文章编号:1004-0609(2014)08-2145-07
离子交换吸附富集红土镍矿浸出液中的镍
杨成武1, 2,廖亚龙1,彭志强1
(1. 昆明理工大学 冶金与能源工程学院,昆明 650093;
2. 云南锡业集团公司 元江镍业有限责任公司,元江 653308)
摘 要:
摘 要:研究高镁铁质红土镍矿硫酸浸出液中镍的高效提取方法。通过在d 150 mm×1800 mm PVC柱中填充12 L CN27离子交换树脂,对高镁铁质红土镍矿硫酸浸出液进行动态吸附。研究初始液pH、Ni2+和Fe2+的质量浓度、流速、吸附时间等参数对树脂有效吸附量和吸附效率的影响。结果表明:初始液中Ni2+质量浓度2.5 g/L、pH 3~5、流速1.0 L/min、树脂饱和吸附时的有效利用率达85%~93%,树脂吸附Ni2+的最高有效吸附量可达58.0 g/kg;初始液中Ni2+质量浓度2.5 g/L、pH 4.5、流速1.0 L/min时,吸附后液Ni2+质量浓度1.0 mg/L时,树脂吸附Ni2+的有效吸附量可达41.8~42.0 g/kg,富集液中Ni2+的富集倍数达到25以上,镍离子的质量浓度提高到54 g/L以上;初始液中Fe2+的质量浓度增加,树脂对镍的吸附量降低,不仅会导致富集液中Ni2+的质量浓度降低,富集液中Fe2+的质量浓度也会增加。离子交换吸附不但能使低浓度含镍溶液富集到满足镍电积工艺的要求,且能对杂质进行有效分离。
关键词:
中图分类号:TF815 文献标志码:A
Enrichment of nickel ions by ion-exchange adsorption from leaching solution of nickel-bearing laterite
YANG Cheng-wu1, 2, LIAO Ya-long1, PENG Zhi-qiang1
(1. Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;
2. Yuanjiang Nickel Corporation Limited Yunnan Tin Group Corporation Limited, Yuanjiang 653308, China)
Abstract: An efficient method for extracting nickel from leaching solution of nickel-bearing laterite was carried out. A PVC column (d 150 mm×1800 mm) filled with 12 L CN27 ion exchange resins was employed to enrich nickel ions from the sulfuric acid leaching solution of nickel-bearing laterite coexisting with high concentration of magnesium and iron ions. The effects of operational parameters on the valid adsorption quantity and efficiency of resin were studied, such as pH in initial solution, mass concentrations of Ni2+ and Fe2+ and flow velocity, as well as contact time. The results indicate that effective utilization efficiency and adsorption capacity are 85%-93% and 58.0 g/kg, respectively, while the resin becomes saturated under the conditions of Ni2+ initial mass concentration of 2.5 g/L, pH of 4.5, and flow velocity of 1.0 L/min. Moreover, the valid adsorption capacity can reach 41.8-42.0 g/kg when controlling Ni mass concentration of drainage under 1.0 mg/L under the conditions of Ni2+ initial mass concentration of 2.5 g/L, pH of 4.5, and flow velocity of 1.0 L/min, and the obtained solution contains more than 54 g/L Ni2+, which is 25 times more than that in the initial solution. Finally, the nickel adsorption on the resin will decrease when the content of Fe in the initial solution increases, resulting in the lower Ni2+ concentration in the rich solution as well as the Fe concentration increases in the rich solution. The dilute nickel solution can be effectively enriched by ion-exchange adsorption to a much higher concentration that meets the electrowinning process, and also effectively removes the impurities.
Key words: nickel-bearing laterite; hydrometallurgy; ion exchange; low nickel concentration enrichment
随着镍矿资源品位的日趋下降,以浸出—净化—电积为主要单元过程的湿法提取镍的工艺引起广泛重视。因采用常压浸出时,矿石中的铁、钙和镁等脉石成分往往会进入浸出液中,造成后续的净化过程复杂、效率低,还原性气氛常压酸浸[1-3]、高压酸浸[4]、氯化浸出[5-6],或者还原焙烧—氨浸[7]等手段常被用于红土镍矿的浸出。然而,还原性气氛常压酸浸过程中酸耗巨大,且镍钴的提取率不高[8]。高压酸浸尽管能够有效限制铁的浸出,有利后续的净化和回收,但是高压酸浸要求设备在较高温度下有良好的耐腐蚀性能和密封性能,设备投资偏高。还原焙烧—氨浸虽然能降低脉石成分进入浸出液,但也存在流程长和氨的挥发损失及对操作环境的不良影响等缺陷。
离子交换吸附富集镍的过程是利用离子交换树脂将低浓度溶液中的镍离子交换到树脂上,再经过解吸,从而达到镍离子富集和分离的目的。ZAINOL等[9]采用亚胺基乙酸基螯合树脂吸附红土镍矿高压酸浸矿浆的镍和钴,研究了树脂骨架结构、粒度、交联度等对吸附性能的影响。FRANCO等[10]研究了强酸型阳离子交换树脂Amberlit IR-120在Ni2+-Na+、Zn2+-Na+二元系及Ni2+- Zn2+-Na+三元金属体系中的吸附行为。SHAIDAN等[11]研究了固定床Lewatit S1467树脂吸附废水中Ni2+。BORBA等[12-13]研究了固定床中Amberlit IR-120树脂在Cu2+-Na+, Zn2+-Na+二元金属体系中交换动力学模型,并用于预测固定床中Cu2+-Zn2+-Na+三元系的交换行为。LI等[14]研究了亚胺基乙酸螯合树脂在单一金属离子体系及二元金属体系中吸附Cu2+、Pd2+和Cd2+的行为。JING等[15]研究了 N,N′(二羧已基)二硫氨基甲酸螯合树脂在水溶液中吸附Cu2+、Pd2+和Ni2+二价金属离子的行为。LIN等[16]研究了Amberlite IRC-748螯合树脂交换水溶液中Cu2+和Ni2+。这些研究中涉及的金属离子溶液几乎都是采用化学试剂配制的模拟溶液,而关于真实红土镍矿浸出液的吸附研究鲜见报道,已有的研究中涉及多种离子共存时皆采用化学沉淀法除去部分金属离子后,再进行离子交换树脂吸附。
高镁铁质红土镍矿中镍的含量低、氧化镁等脉石成分高,浸出液中镍金属质量浓度低、成分复杂,低浓度镍的富集与分离研究成为高镁铁质红土镍矿湿法提取工艺的关键。本文作者在自制的d 150 mm× 1800mm PVC柱中填充12 L强酸型阳离子交换树脂CN27,在连续固定床中吸附、富集高镁铁质红土镍矿常压下硫酸浸出液中镍离子,研究初始液pH、Ni2+和Fe2+的质量浓度、流速、吸附时间等参数对树脂有效吸附量、吸附效率的影响,探索离子交换树脂处理高镁铁质红土镍矿的可行性和吸附富集过程中的影响规律。
1 实验
1.1 实验装置及主要试剂
1) 实验装置
吸附柱为自制的PVC柱(d 150 mm×1800 mm), 实验装置见图1所示。
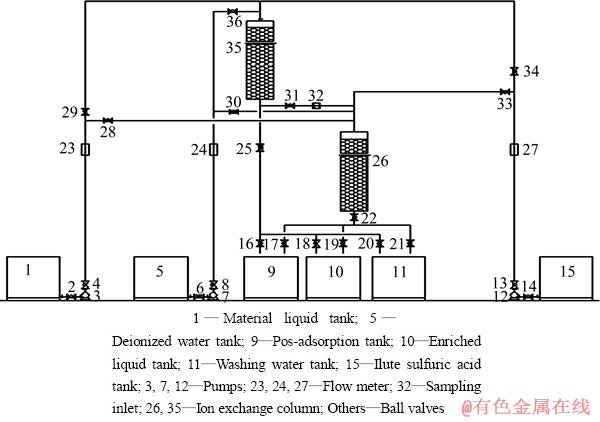
图1 离子交换吸附富集镍实验装置
Fig. 1 Experimental apparatus of enrichment of Ni by ion-exchange adsorption
吸附过程。含镍溶液调节pH值后,控制一定流速下用泵从储槽送入离子交换柱顶部,经过树脂吸附区,溶液中的金属离子被树脂吸附,吸附后液从交换柱底部的出口外排至储槽,当外排液中的镍含量达到1 mg/L时,关闭阀门,打开阀门使吸附后液进入另一离子交换柱,当取样口溶液镍离子浓度接近原液浓度时,关闭交换柱阀门,打开阀门让原液直接进入离子交换柱。用泵将去离子水以一定的流速送入树脂柱顶部,洗涤饱和后的树脂,洗涤液排入储槽。
脱附过程。用泵将稀硫酸送入离子交换柱的顶部解吸,解吸液从交换柱底部的出液口排到富集液储槽。
树脂再生过程。酸洗脱附后,用泵将10%的氢氧化钠溶液送入交换柱再生,出口溶液pH值显碱性时进行下一周期实验。
2) 主要原料和试剂
研究中使用的主要原料和试剂有高镁铁质红土镍矿硫酸浸出液、氢氧化钠(AR)、硫酸镍(AR)、硫酸亚铁(AR)、硫酸(AR)。高镁铁质红土镍矿浸出液成分见表1。
表1 高镁铁质红土镍矿浸出液的化学成分
Table 1 Chemical composition of leaching solution of high magnesium ferruginous laterite nickel ore

1.2 分析检测方法
溶液中镍、铁、铝、钴、镁的含量用原子吸收分光光度计法,镍的测定采用丁二酮肟分光光度法,钴的测定采用EDTA滴定法。
2 结果与讨论
2.1 pH的影响
CN27树脂的理论吸附Ni2+的容量为73.3 g/kg。树脂吸附容量愈大,则吸附金属离子的能力也就越大,但只有进入富集液中的金属离子的量才是有效的回收量,以树脂有效利用率表示:
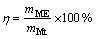 (1)
(1)
式中: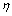 为有效利用率;mME为洗脱至富集液中金属量;mMt为理论吸附金属量。
为有效利用率;mME为洗脱至富集液中金属量;mMt为理论吸附金属量。
不改变浸出液中其他元素成分,仅加入硫酸或氢氧化钠调节溶液的pH值,于流速1.0 L/min下通过树脂,吸附后液中Ni的质量浓度达到进液值时,停止进料,并用2倍树脂体积的去离子水洗涤树脂,然后用2/3树脂体积的15%(质量分数)稀硫酸洗脱树脂,测定不同pH值条件下富集液中金属离子质量体积浓度,计算树脂的有效吸附容量及有效利用率。树脂有效利用率和树脂对不同金属离子的有效吸附量见图2和3。
不改变浸出液中其他元素成分,仅仅加入硫酸或者氢氧化钠调节溶液的pH值,于流速1.0 L/min下通过树脂,进液180 min时停止进液,待无吸附后液流出后,用2倍树脂体积的去离子水洗涤树脂,然后用2/3树脂体积的15%稀硫酸洗脱树脂,测定不同pH值条件下富集液中金属离子质量体积浓度,计算离子交换树脂吸附得到的富集液中镍钴的回收率,富集液中金属离子的浓度及镍钴回收率见表2。

图2 饱和吸附时pH对树脂有效吸附利用率的影响
Fig. 2 Effect of pH on valid adsorption efficiency of resin at saturated adsorption
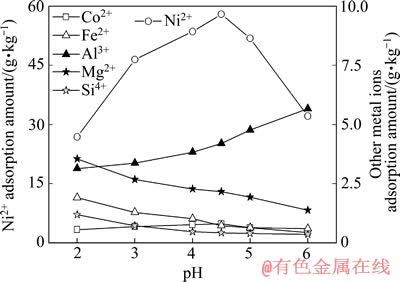
图3 饱和吸附时pH对树脂吸附金属量的影响
Fig. 3 Effect of pH on valid adsorption amount of metal ions at saturated adsorption
表2 pH对富集液成分和镍回收率的影响
Table 2 Effect of pH on concentration of enriched solution and recovery of nickel

从图2和3可以看出:pH为2时,树脂吸附容量的有效利用率为78%,pH为6时,有效利用率仅为70%;pH为3~5时,树脂吸附容量的有效利用率都在85%以上;pH为4.5时,不但吸附量和吸附利用率皆为最大,且Ni2+的吸附量与树脂的理论吸附量的比率(以下称为选择性)也大,Ni2+和Co2+的选择性分别达到79.0%和1.1%,此时树脂对镍和钴的吸附量分别为58.0和0.8 g/kg, 而对其他金属离子的吸附量之和仅为2.6 g/kg。可见,初始液的pH对树脂的有效吸附量、有效利用率和Ni2+的选择性影响大,这主要缘于CN27树脂属于强酸型阳离子交换树脂,相当于一元酸,转型及交换过程与溶液中的金属离子发生如下反应:


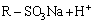 (2)
(2)
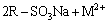

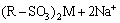 (3)
(3)
反应(2)和反应(3)的平衡常数K2,K3分别可表示为
 (4)
(4)
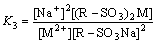 (5)
(5)
可见平衡常数K2、K3与 H+的浓度、金属离子(Na+、M2+)在溶液及树脂上的浓度有关。pH较低时,溶液中H+的浓度高,交换过程中Ni2+存在与H+的竞争,交换树脂表面离子过多的质子化作用会阻碍Ni2+与树脂上活性功能团的结合,即低pH不利于交换反应的进行;pH较高时,溶液中Na+浓度增加,也存在Ni2+与Na+的竞争吸附,离子交换过程中总是交换具有较大亲合力的离子,从而不利于Ni2+的吸附[17]。
2.2 树脂接触时间对Ni2+吸附量的影响
加入氢氧化钠调节浸出液pH为4.5,在流速1.0 L/min下通过离子交换柱,测定前30、60、90、120、150、180、210及240 min流出液中Ni离子质量体积浓度,结果见图4。
从图4可以看出,随吸附时间的延长,吸附后液中的镍含量逐渐升高,吸附180 min时吸附后液中Ni2+为的质量浓度0.91 mg/L,超过180 min后吸附后液中Ni2+的质量浓度急剧升高。为保证吸附后液中Ni2+质量浓度能达到1.0 mg/L的排放标准,确定180 min的吸附时间为树脂穿透点的时间。
2.3 流速对吸附效果的影响
取以氢氧化钠调节pH为4.5的高镁铁质红土镍硫酸浸出液5份,每份体积180 L,用流量计调节进入离子交换柱的溶液流速分别为0.50、1.0、1.5、2.0和2.5 L/min,进液完成且交换柱的出口无溶液流出后,首先用2倍树脂体积的去离子水洗涤,然后用2/3树脂体积的15%(质量分数)稀硫酸洗脱树脂,测定得到的富集液的成分,考察不同流速下对树脂吸附效果的影响,结果见图5。
由图5可知:料液流速为0.5和1.0 L/min的吸附效果比料液流速为1.5、2.0及2.5 L/min时的好,此时富集液中镍离子的浓度最高,树脂对镍离子的有效吸附量达到41.8~42.0 g/kg。这主要是由于料液流速慢时能保证料液与树脂接触充分,离子交换反应时间增长,吸附反应进行完全。相反,料液流速过快,则溶液中的金属离子与树脂上的离子还来不及交换完全,便流出树脂吸附区,从而容易造成过早穿漏。
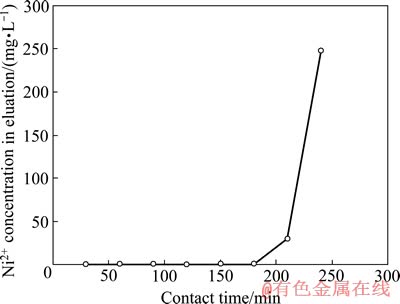
图4 接触时间对CN27交换树脂吸附曲线的影响
Fig. 4 Effect of contact time on adsorption curves of CN27 ion exchange resins
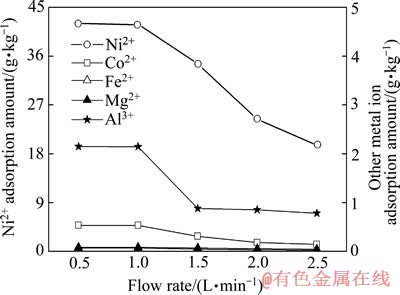
图5 流速对树脂吸附金属量的影响
Fig. 5 Effect of flow rate on metals adsorption amount of resin
2.4 解吸液浓度对解吸效果的影响
调节浸出液pH为4.5,在流速为1.0 L/min流过吸附树脂柱,进液180 min时停止进液,待无吸附后液流出后,先用2倍树脂体积的去离子水洗涤,然后用2/3倍树脂体积、不同稀硫酸质量浓度的解吸液于流速1.0 L/min下洗脱树脂,解吸液中H2SO4质量浓度分别为5%、10%、15%、20%和25%时,得到的富集液成分分布如图6所示。
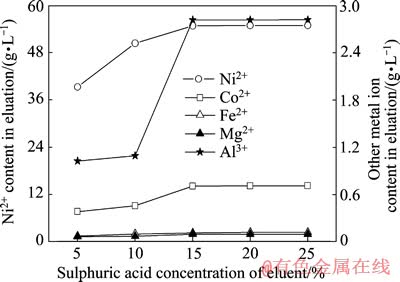
图6 洗脱液硫酸浓度对富集液中镍浓度的影响
Fig. 6 Effect of sulfuric acid concentration of eluent on Ni2+ concentration in enriched solution
由图6可以得出:随着解吸液中酸的质量浓度增加,金属离子的解吸越彻底,富集液中镍离子浓度增高。解吸液中酸的浓度达到15%时,富集液中的镍浓度达到54.80 g/L。解吸液酸度再增加,富集液中镍的浓度没有太大的变化,说明树脂中吸附的镍离子基本解吸完全,解吸液硫酸的最佳浓度为15%。对于非极性或弱极性树脂,洗脱剂极性越小,洗脱能力越强,极性树脂则用极性较强的溶剂能更好的分离,洗脱能力还与被洗脱物质在洗脱液中的溶解度有关,溶解度大的洗脱能力也强。
2.5 溶液中金属离子浓度的影响
2.5.1 Ni2+质量浓度的影响
通过向原液中补加硫酸镍,调节溶液中Ni2+质量浓度分别为2.5、5.0、10.0、15.0和20.0 g/L,加入氢氧化钠调节pH为4.5后,进液180 min时停止进液,待无吸附后液流出后。用2倍树脂体积的去离子水洗涤后,再用2/3倍树脂体积15% H2SO4解吸液于流速为1.0 L/min下洗脱树脂,测定得到的富集液的成分,考察镍离子浓度对树脂吸附效率的影响,其结果如图7所示。
由图7可看出,控制原液中杂质金属离子的含量相同,镍的浓度在2.5~20 g/L间变化时,树脂吸附Ni2+的能力变化不大,树脂对镍的有效吸附量为42.0~43.4 g/kg,镍的吸附量差别不显著,树脂对Co2+、Fe2+和Mg2+的吸附能力基本不变。但原液中Ni2+增大时,富集液中Al3+的量有所下降,说明溶液中Ni2+的浓度增加能有效限制对Al3+吸附,提高进入交换柱的溶液中的镍可以减低富集液中的Al离子浓度。树脂吸附金属离子的行为属于Langmuir型单分子层吸附,当Ni2+浓度增大时,树脂的吸附曲线逐渐趋于平缓,饱和吸附容量不因溶液中金属离子浓度增加而增加。
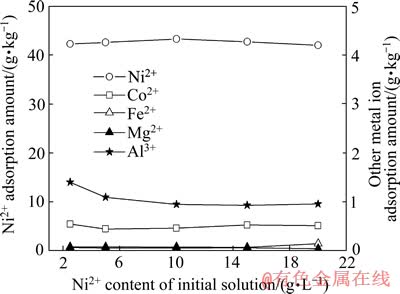
图7 原液中镍浓度对吸附量的影响
Fig. 7 Effect of Ni2+ concentration of initial solution on adsorption amount
2.5.2 Fe2+质量浓度的影响
取高镁铁质红土镍的硫酸浸出液加入氢氧化钠进行除铁,调节Fe2+ 质量浓度值分别为2.5、3.0、4.0、5.0、10.0 g/L,然后加入硫酸调节溶液的pH为4.5,并维持溶液中的其他元素的含量不变,于1.0 L/min的流速流过交换树脂,进液180 min时停止进液,待无吸附后液流出后,用2倍树脂体积的去离子水洗涤,再用2/3倍树脂体积的15%H2SO4解吸液于流速为1.0 L/min下洗脱树脂,测定得到的富集液的成分,考察初始液中铁浓度对树脂吸附的影响,结果如图8所示。
由图8可看出,Fe2+的质量浓度大于Ni2+的质量浓度后,树脂对Fe2+的吸附能力随着原料液中Fe2+含量增加而增大,镍的吸附量相应减少,Co2+、Mg2+和Al3+的吸附量变化不大。因此,要保证树脂对Ni2+的吸附效率,提高富集液中Ni2+含量,需控制原料液中Fe2+含量越低越好,Fe2+的含量最大不能超过Ni2+含量,否则,会导致富集液中Fe2+含量高和降低Ni2+的富集倍数,也会加大了后期除铁等杂质的处理成本。

图8 原液中铁离子浓度对吸附量的影响
Fig. 8 Effect of Fe2+ concentration of initial solution on adsorption amount
树脂与金属离子进行交换反应时,不同金属离子所能产生交换程度和趋势不同,金属离子是否容易交换到树脂上去,这取决于树脂上功能基团与金属离子间作用力和结合力的大小。作用力包括静电效应、溶胀压的作用、共价键的形成、极化效应等。溶液中金属离子与树脂中相应的离子间的交换过程是一个可逆过程,多种金属离子共存时,离子交换势的大小与离子交换树脂的选择性有关,与离子的水合半径及在溶液中的浓度等因素有关。离子交换树脂吸附溶液金属离子的能力和顺序与离子的电荷数目即离子价态有关,电荷数高的离子优先吸附。在常温稀溶液中,离子的化合价越高,就越易被交换。相同价态时,水合半径小的离子易于被交换。
Ni2+、Co2+的水合半径比Mg2+、Fe2+的水合半径小,因此,采用强酸型树脂CN27能将红土镍矿浸出液中的Ni2+和Co2+同溶液中的Mg2+、Fe2+和Al3+分离。但是,溶液中的Fe2+等会对镍的吸附有影响,当溶液中Fe2+的质量体积浓度大于Ni2+的时,树脂对Ni2+的吸附能力下降。
3 结论
1) CN27阳离子交换树脂在pH 3~5、流速为1.0 L/min时,吸附高镁铁质红土镍矿硫酸浸出液的饱和有效吸附容量利用率在85%以上,最高可达93%,对镍回收的有效吸附容量最高可达58.0 g/kg。
2) CN27阳离子交换树脂在pH 4.5、流速为1.0 L/min时,吸附后液的Ni2+、Co2+质量浓度<1 mg/L时,树脂对镍回收的有效吸附容量最高可达41.8~ 42.0 g/kg,富集液中Ni2+的质量浓度可达54 g/L以上,Ni的富集倍数在25以上时,浸出液中的镍98.64%~ 99.12%进入到富集液中。
3) 树脂对溶液中金属离子吸附由易至难的顺序为Ni2+、Fe2+、Mg2+,但为保证Ni的富集浓度,需控制溶液中Fe2+的质量体积浓度不超过Ni2+的。
4) 尽管高镁铁质红土镍矿的硫酸浸出液含镍离子浓度低,Mg2+、Fe2+和Al3+杂质浓度高,采用离子交换树脂处理,控制适当参数,能使镍与杂质有效分离。该富集和分离低浓度溶液中镍的工艺同常压硫酸浸出过程结合,将在高镁铁质红土镍矿的处理中显现良好的应用前景。
REFERENCES
[1] DAS G K, DE LANGE J A B. Reductive atmospheric acid leaching of West Australian smectitic nickel laterite in the presence of sulphur dioxide and copper(Ⅱ)[J]. Hydrometallurgy, 2011, 105: 264-269.
[2] LUO W, FENG Q, OU L, ZHANG G, CHEN Y. Kinetics of saprolitic laterite leaching by sulphuric acid at atmospheric pressure[J]. Minerals Engineering, 2010, 23: 458-462.
[3] LIU K, CHEN Q Y, HU H P. Comparative leaching of minerals by sulphuric acid in a Chinese ferruginous nickel laterite ore[J]. Hydrometallurgy, 2009, 98: 281-286.
[4] LIU K, CHEN Q Y, HU H P, YIN Z L, WU B K. Pressure acid leaching of a Chinese laterite ore containing mainly magnemite and magnetite[J]. Hydrometallurgy, 2010, 104: 32-38.
[5] FAN C L, ZHAI X J, FU Y, CHANG Y F, LI B C, ZHANG T A. Extraction of nickel and cobalt from reduced limonitic laterite using a selective chlorination-water leaching process[J]. Hydrometallurgy, 2010, 105: 191-194.
[6] LIU W R, LI X H, HU Q Y, WANG Z X,GU K Z, LI J H, ZHANG L X. Pretreatment study on chloridizing segregation and magnetic separation of low-grade nickel laterites[J]. Transactions of Nonferrous Metal Society of China, 2010, 20(1): 82-86.
[7] GUO X Y, LI D, PARK K H, TIAN Q H, WU Z. Leaching behavior of metals from a limonitic nickel laterite using a sulfation roasting leaching process[J]. Hydrometallurgy, 2009, 99: 144-150.
[8] MCDONALD R G, WHITTINGTON B I. Atmospheric acid leaching of nickel laterites review. Part Ⅰ. Sulphuric acid technologies[J]. Hydrometallurgy, 2008, 91: 35-55.
[9] ZAINOL Z, NICOL M J. Comparative study of chelating ion exchange resins for the recovery of nickel and cobalt from laterite leach tailings[J]. Hydrometallurgy, 2009, 96: 283-287.
[10] FRANCO P E, VEIT M T, BORBA C E,  G C, FAGUNDES-KLEN M R, BERGAMASCO R, SILVA E A, SUZAKI P Y R. Nickel(Ⅱ) and zinc(Ⅱ) removal using Amberlite IR-120 resin: Ion exchange equilibrium and kinetics[J]. Chemical Engineering Journal, 2013, 221: 426-435.
G C, FAGUNDES-KLEN M R, BERGAMASCO R, SILVA E A, SUZAKI P Y R. Nickel(Ⅱ) and zinc(Ⅱ) removal using Amberlite IR-120 resin: Ion exchange equilibrium and kinetics[J]. Chemical Engineering Journal, 2013, 221: 426-435.
[11] SHAIDAN N H, ELDEMERDASH U, AWAD S. Removal of Ni(II) ions from aqueous solutions using fixed-bed ion exchange column technique[J]. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43: 40-45.
[12] BORBA C E, SANTOS G H F, SILVA E A. Mathematical modeling of a ternary Cu-Zn-Na ion exchange system in a fixed-bed column using Amberlite IR 120[J]. Chemical Engineering Journal, 2012, 189/190: 49-56.
[13] BORBA C E, SILVA E A, SPOHRA S, SANTOS G H F, GUIRARDELLO R. Application of the mass action law to describe ion exchange equilibrium in a fixed-bed column[J]. Chemical Engineering Journal, 2011, 172: 312-320.
[14] LI L J, LIU F Q, JING X S, LING P P, LI A M. Displacement mechanism of binary competitive adsorption for aqueous divalent metal ions onto a novel IDA-chelating resin: Isotherm and kinetic modeling[J]. Water Research, 2011, 45: 1177-1188.
[15] JING X S, LIU F Q, YANG X, LING P P, LI L J, LONG C, LI A M.Adsorption performances and mechanisms of the newly synthesized N,N′-di(carboxymethyl) dithiocarbamate chelating resin toward divalent heavy metal ions from aqueous media[J]. Journal of Hazardous Materials, 2009, 167: 589-596.
[16] LIN L C, LI J K, JUANG R S. Removal of Cu(Ⅱ) and Ni(Ⅱ) from aqueous solutions using batch and fixed-bed ion exchange processes[J]. Desalination, 2008, 225: 249-259.
[17] KUMAR S. Removal of nickel(Ⅱ) from aqueous solution by Ceralite IR 120 cationic exchange resins[J]. J Eng Sci Technol, 2010, 5(2): 232-237.
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(21266011);校企预研基金资助项目(4201252011)
收稿日期:2013-01-20;修订日期:2013-09-15
通信作者:廖亚龙,副教授,博士;电话:0871-65198154;E-mail: liaoylsy@163.com


