锰锌铁氧体废料的浸出工艺
彭长宏1,李景芬1,李基森2
( 中南大学 冶金科学与工程学院,湖南 长沙,410083;
2. 广东风华高新科技股份有限公司,广东 肇庆,526020)
摘 要:
摘 要:以锰锌铁氧体废磁芯粉料为原料,研究硫酸浸出过程的工艺条件,分析浸出过程的动力学机理。实验结果表明,在液固比为3?1,搅拌速度为300 r/min的条件下,锰锌铁氧体废磁芯粉料硫酸浸出过程的最佳工艺条件是:硫酸用量为其理论量的1.15倍,反应温度为95~100 ℃,反应时间为4.5 h。在此优化条件下,4次综合实验的Fe, Mn和Zn平均浸出率分别为98.83%, 98.80%和98.82%;锰锌铁氧体废磁芯粉料的硫酸浸出过程在动力学上属收缩核模型,受化学反应的控制,反应活化能为85.6 kJ/mol。
关键词:
中图分类号:O642.4;TQ136.1 文献标识码:A 文章编号:1672-7207(2009)01-0019-06
Leaching process of waste Mn-Zn ferrites powder
PENG Chang-hong1, LI Jing-fen1, LI Ji-sen2
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Guangdong Fenghua Hi-tech Co. Ltd., Zhaoqing 526020, China)
Abstract: Using waste Mn-Zn magnetic core powders as the raw material, the leaching conditions of sulfuric acid were studied and the leaching kinetics mechanism was also analyzed. The results show that when liquid-solid ratio is 3?1 and the stirring speed is 300 r/min, the optimal leaching conditions can be determined by single factor experimental method and the optimal leaching conditions are as follows: The content of sulfuric acid is 1.15 times of its theoretical content, reaction temperature is 95-100 ℃ and leaching time is 4.5 h. Under above optimal conditions, four times comprehensive experiments were carried out and the average leaching rates of main metals of Fe, Mn and Zn are 98.83%, 98.80% and 98.82%, respectively. The leaching process with activation energy of 85.6 kJ/mol can be descried by the shrinking core model and controlled by chemical reaction.
Key words: waste Mn-Zn ferrite magnetic core powder; sulfuric acid; leaching; kineticS
锰锌铁氧体材料是现代电子工业及信息产业的基础功能材料。随着通讯、计算机和网络等电子信息技术的迅猛发展,锰锌铁氧体的市场需求量以年均20%的速度增长[1]。在锰锌铁氧体磁芯的制备过程中,难以避免地产生10%~20%的废料(含废器件或抛光料)。2005年国内锰锌铁氧体产量为20~30万t/a,按15%的废料产生量计算,原料损失3.0~4.5万t/a。原材料价格按12 000元/t计算,损失3.6~4.5亿元/a。目前,国内外对锰锌铁氧体废料的处理技术有烧结填埋或闲置堆存或出售给模具公司作配料,不能实现废料的高价值利用。目前,锰锌铁氧体的制备方法有陶瓷法、湿化学法[2-5]和直接法。直接法技术结合湿法冶金、无机化工和磁性材料等学科理论,由矿物原料直接制备锰锌铁氧体材料[6]。该技术已用于共沉淀粉500 t/a工业试验,制备出性能指标与PC30铁氧体的相同[7]。但是,由于矿物原料成分复杂,目前未见采用直接法制备高性能铁氧体的研究报道。鉴于锰锌铁氧体产品中杂质成分含量低,以锰锌铁氧体废料为原料,有望制备高性能锰锌铁氧体材料。但是,锰锌铁氧体尖晶石结构非常稳定,实现锰锌铁氧体废料中各有价成分的有效溶出,是锰锌铁氧体废料制备高性能锰锌铁氧体的前提和基础。为此,本文作者在热力学分析的基础上,研究锰锌铁氧体废粉料硫酸浸出过程的工艺条件,探索浸出过程的动力学机理。
1 实验基本原理
1.1 反应原理
锰锌铁氧体废磁芯粉料浸出过程的基本反应为:
![]()
在Fe,Mn和Zn 3种主成分进入浸出液的同时,Si,Ca,Mg,Al,Pb,Ni和Cr等杂质元素也进入溶液中。
1.2 热力学分析
在此反应过程中无电子迁移,仅消耗H+的化学反应,可表达为[8]:

其中:T为热力学温度;?rGT为反应在T时的吉布斯自由能变化值;![]() 为物质在T时的标准摩尔吉布斯自由能;R为摩尔气体常数; aA,aB和
为物质在T时的标准摩尔吉布斯自由能;R为摩尔气体常数; aA,aB和![]() 分别为反应平衡时A,B和H+的活度。
分别为反应平衡时A,B和H+的活度。
当反应处于平衡状态时,?rGT=0,则有:

以ZnO·Fe2O3为例,进行反应式(1)所需酸度的相关计算。
依据文献[9]可查出在100 ℃时的有关热力学数据,有:
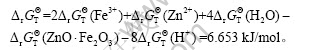
根据式(5),可以计算在100 ℃时,溶解ZnO·Fe2O3所需酸度:
![]()
即:c(H+)=1.412 mol/L。
同理,可计算出溶解MnO·Fe2O3和Fe3O4所需的![]() 值分别为-0.38和0.043,换算成浸出剂所需的酸度,分别为2.415和0.905 mol/L。
值分别为-0.38和0.043,换算成浸出剂所需的酸度,分别为2.415和0.905 mol/L。
![]() 在热力学上是用来衡量反应(2)的酸浸出难易程度,
在热力学上是用来衡量反应(2)的酸浸出难易程度,![]() 越大,酸浸出越易,锰锌铁氧体废料中各组分溶出先后顺序是Fe3O4,ZnO·Fe2O3和MnO·Fe2O3。即当c(H+)≥2.415 mol/L时,可以实现锰锌铁氧体废料中Fe,Mn和Zn 3种成分的有效溶出;当0.905≤c(H+)≤2.415 mol/L时,只能实现部分成分的溶出。
越大,酸浸出越易,锰锌铁氧体废料中各组分溶出先后顺序是Fe3O4,ZnO·Fe2O3和MnO·Fe2O3。即当c(H+)≥2.415 mol/L时,可以实现锰锌铁氧体废料中Fe,Mn和Zn 3种成分的有效溶出;当0.905≤c(H+)≤2.415 mol/L时,只能实现部分成分的溶出。
2 实 验
2.1 原材料、试剂及仪器
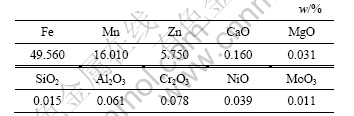
a. 实验原料:锰锌铁氧体废磁芯粉料,取自浙江横店集团东磁股份有限公司,其化学成分见表1。
表1 锰锌铁氧体废磁芯粉料(WMZF)的化学成分
Table 1 Chemical composition of waste Mn ferrite powder
b. 实验试剂:浓硫酸(工业纯,17.73 mol/L,产自株洲冶炼厂);蒸馏水(25 ℃,电导率为10 k?·m,自制)。
c. 实验仪器:JHS-1/90电子恒速搅拌器(杭州仪表电机厂制造);1 000 W数字控温万用电炉(DK-98Ⅱ型,天津市泰斯特仪器有限公司制造)。
2.2 实验方法
固定液固比为3?1,搅拌速度为300 r/min,采用单因素实验方法,分别考察硫酸用量、反应温度和反应时间等对锰锌铁氧体废磁芯粉料中Fe,Mn和Zn浸出率的影响规律。工艺条件实验研究的规模为100 g/次,综合条件实验研究的规模为1 kg/次,实验完毕过滤,量取浸出液体积,测定浸出液中主金属Fe,Mn和Zn的含量,计算主金属的浸出率。反应在500 mL或5 L的三口烧瓶中进行,工艺条件实验采用磁力搅拌,综合实验采用机械搅拌。
2.3 分析检测
Mn2+采用硫酸亚铁铵滴定法检测,以过硫酸铵作氧化剂;Zn2+采用EDTA滴定法,并辅以萃取法检测;Fe3+采用重铬酸钾滴定法检测。
3 结果与讨论
3.1 浸出过程工艺条件研究
3.1.1 硫酸用量对Fe,Mn和Zn浸出率的影响
固定液固比为3?1,搅拌速度为300 r/min,反应时间为3.0 h,温度为90 ℃,考察硫酸用量对锰锌铁氧体废磁芯粉料中Fe, Mn和Zn浸出率的影响规律,浸出过程有关结果见表2。以浓硫酸实际用量与硫酸理论量的比值即硫酸的过量系数为横坐标,Fe,Mn和Zn的浸出率为纵坐标,绘制硫酸用量与主金属浸出率的关系图,见图1。
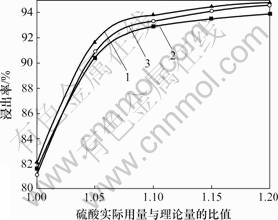
1—Fe; 2—Mn; 3—Zn
图1 Fe, Mn和Zn浸出率与硫酸用量的关系
Fig.1 Relationships between leaching rates of Fe, Mn, Zn and sulfuric acid content
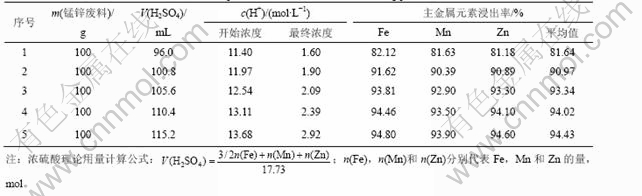
经计算,每100 g锰锌铁氧体废料中Fe,Mn和Zn完全浸出需要浓硫酸的理论量为96 mL。从表2和图1可以看出:
a. 当硫酸用量为理论用量时,反应初始浓度c(H+)=11.40 mol/L,达到锰锌铁氧体中Fe,Mn和Zn溶出所需的酸度,Fe,Mn和Zn都可以有效浸出;随着反应的进行,剩余硫酸量逐渐减少,溶液中c(H+)不断降低,经检测,反应终点的c(H+)=1.60 mol/L,低于ZnO·Fe2O3和MnO·Fe2O3溶出所需的酸度,所以,在此条件下,不能实现Fe,Mn和Zn的完全浸出。
b. 随着浓硫酸用量的增加,溶液中c(H+)增大,主金属的浸出率也随之增大,且浸出液终点c(H+)也逐渐升高。当硫酸实际用量与理论用量之比≥1.15时,反应终点的c(H+)≥2.39 mol/L,接近或达到Fe,Mn和Zn 3种主金属完全溶出所需的酸度,但是,3种主金属最大浸出率为94.46%,而不是100%。产生此现象的原因是:反应过程中的温度控制为90 ℃,低于 100 ℃时3种金属溶出最低c(H+)的热力学计算结果;热力学理论计算时,设定了金属离子活度为1.0,这与实验中各离子的实际浓度也有一定差距;本研究中硫酸理论用量的计算仅以Fe, Mn和Zn 3种主金属为依据,而锰锌铁氧体废料中的少量其他杂质(如CaO,MgO,Al2O3和Cr2O3等)也将消耗一定量的硫酸。
c. 分析图1中3种主金属浸出率随硫酸用量的变化趋势可见,随着硫酸用量的增加,锰锌铁氧体废磁芯粉料中Fe,Mn和Zn的浸出率逐步增大,当硫酸用量为其理论量的1.15倍时,3种主成分的平均浸出率为94.02%;再将硫酸用量提高到其理论量的1.2倍时,Fe,Mn和Zn的平均浸出率为94.43%,仅提高0.41%,据此确定硫酸用量的优化条件为其理论量1.15倍。
3.1.2 反应温度对Fe,Mn和Zn浸出率的影响
固定液固比为3?1,搅拌速度为300 r/min,硫酸用量为其理论量1.15倍和反应时间为3.0 h,考察不同反应温度对锰锌铁氧体废磁芯粉料中Fe,Mn和Zn浸出率的影响规律,结果见图2。
表2 浸出过程实验数据和结果
Table 2 Experimental data and results in leaching process
由图2可看出,Fe,Mn和Zn的浸出率在温度从85 ℃升高到100 ℃时,浸出率提高14%左右,说明反应温度对锰锌铁氧体废磁芯中Fe,Mn和Zn的浸出率影响很大;当反应温度达到100 ℃时,Fe,Mn和Zn的浸出率均不低于98%;但当反应温度为100~105 ℃时,Fe,Mn和Zn的浸出率增加的幅度不大。
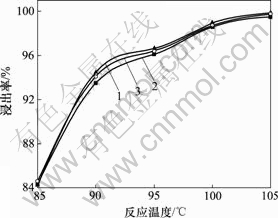
1—Fe; 2—Mn; 3—Zn
图2 Fe, Mn和Zn的浸出率与反应温度的关系
Fig.2 Relationships between leaching rates of Fe, Mn, Zn and reaction temperature
3.1.3 反应时间对Fe,Mn和Zn浸出率的影响
固定液固比为3?1,搅拌速度为300 r/min,反应温度为95~100 ℃,硫酸用量为其理论量的1.15倍,考察反应时间对锰锌铁氧体废磁芯粉料中Fe,Mn和Zn浸出率的影响,结果见图3。
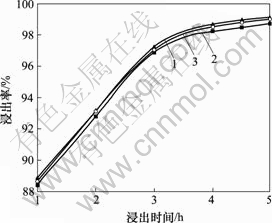
1—Fe; 2—Mn; 3—Zn
图3 Fe, Mn和Zn浸出率与浸出时间的关系
Fig.3 Relationships between leaching rates of Fe, Mn, Zn and reaction time
从图3可知,反应时间对锰锌铁氧体废磁芯粉料中Fe,Mn和Zn 3种主成分的浸出率随浸出时间的延长而增大,当反应时间由1.0 h增加到4.0 h时,这3种主成分的浸出率由88%增大到98%;当反应时间延长到5.0 h时,Fe,Mn和Zn的浸出率都达到99%以上,几乎是完全浸出。但考虑到生产效率,取最优时间为4.5 h。
3.1.4 浸出过程综合条件实验
考虑设备材质和生产效率等因素,确定锰锌铁氧体废料硫酸浸出的优化工艺条件如下:硫酸用量为其理论量1.15倍,反应温度为95~100 ℃,反应时间为4.5 h。在此优化条件下,进行4次综合实验,结果见表3。
表3 浸出液化学成分及Fe, Mn和Zn浸出率
Table 3 Leached solution composition and the leached rate of Fe, Mn and Zn
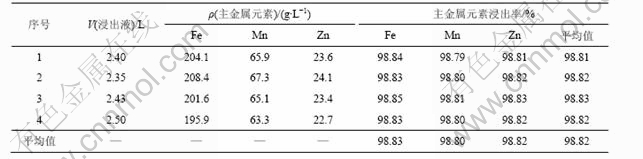
由表3可知,在上述优化工艺条件下,锰锌铁氧体废料中的3种主金属均具有较高的浸出率,Fe,Mn和Zn的浸出率平均值分别为98.83%,98.80%和98.82%,4次综合实验中,主金属的平均浸出率分别为98.83%,98.80%和98.82%,为实现锰锌铁氧体废料的资源化利用提供了依据。
3.2 浸出过程动力学分析
多相反应的速度主要由化学反应或反应物扩散决定。锰锌铁氧体废磁芯粉料的浸出过程就是固相的锰锌铁氧体废磁芯粉料与硫酸溶液所组成的固-液多相反应,主要有2个阶段:反应物之间化学反应和反应产物进入溶液扩散。锰锌铁氧体废磁芯粉料的硫酸浸出速率可能受液膜扩散控制或化学反应控制,但是,究竟是哪个控制步骤为主导,可通过对相关实验结果的分析加以确定。
当固-液多相浸出反应的控制步骤为液膜扩散控制时,搅拌速度对浸出率影响非常大。为此,在反应时间分别为2.0 h和3.0 h,温度为95~100 ℃及硫酸用量为其理论量的1.10倍时,研究搅拌速度对锰锌铁氧体废磁芯粉料硫酸浸出过程中主金属总浸出率的影响规律,结果见图4。
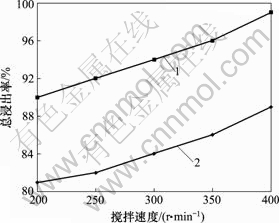
1—3 h; 2—2 h
图4 搅拌速度与总浸出率的关系
Fig.4 Relationships between average leaching rate of main metals and stirring speed
依据湿法冶金动力学原理[10],提高搅拌强度,扩散控制反应的浸出率可提高40%~70%。分析图4可知,当搅拌速度由200 r/min提高到400 r/min时,总浸出率分别提高6%(反应时间为2.0 h)和9%(反应时间为3.0 h),只体现出一般固相在液相中充分分散所产生的浸出率提高的效果。据此,判断锰锌铁氧体废磁芯粉料硫酸浸出反应的控制步骤不是液膜扩散控制。
当化学反应为控制步骤,且没有生成新固相时,该反应的动力学模型可用收缩核模型描述,符合下列速度方程[11]:

上述模型的使用条件是:c必须恒定不变。但在实验过程中,硫酸用量并未远远超过其理论量,随着反应进行,c不断减小。为消除浓度c的影响,李洪桂等[12]对式(6)进行了修订:

由于锰锌铁氧体废磁芯粉料硫酸浸出反应属于一级反应,故式(7)变为:
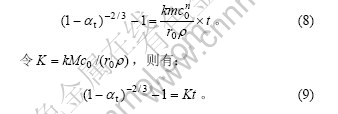
可见,受化学反应控制的浸出率与反应时间呈比例关系,根据时间对浸出率影响的实验结果,按![]() 对时间t作图,结果见图5。
对时间t作图,结果见图5。
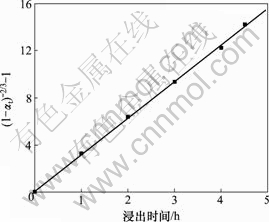
图5 ![]() 与t的关系
与t的关系
Fig.5 Relationship between ![]() and leaching time
and leaching time
结合图2和图3,可绘制出速率常数对数lg k与反应温度1/T的关系曲线,见图6。从图6可见,lg k与1/T呈线性关系,依据阿伦尼乌斯方程:
![]()
得出锰锌铁氧体废料硫酸浸出反应的活化能为85.6 kJ/mol,大于41.8 kJ/mol,符合化学反应控制理论的反应特征。式(10)中:E为反应活化能;A为指前因子;k为速率常数;R为摩尔气体常数;T为热力学温度。

图6 速率常数对数lg k与1/T的关系
Fig.6 Relationship between lg k and 1/T
所以,本研究中影响锰锌铁氧体废磁芯粉料浸出率的主要因素有反应温度、反应时间和浓硫酸用量。这一理论推断与本文的实验结果相吻合。
4 结 论
a. 硫酸浸出锰锌铁氧体废磁芯粉料的最佳工艺条件如下:硫酸用量为其理论量1.15倍,反应温度为95~100 ℃,反应时间为4.5 h。在此优化条件下,3种主金属Fe,Mn和Zn的平均浸出率分别为98.83%,98.80%和98.82%。
b. 锰锌铁氧体废磁芯粉料的硫酸浸出过程符合液-固反应的收缩核模型,浸出速率受浸出剂浓度、温度和时间的影响,为化学反应步骤控制,反应的活化能为85.6 kJ/mol。
参考文献:
[1] 戴志云, 徐辉宇. 锰锌软磁铁氧体料粉市场的现状及发展趋势[J]. 磁性材料及器件, 2006, 37(5): 15-17.
DAI Zhi-yun, XU Hui-yu. The current status and development trend of Mn-Zn soft ferrite powder market[J]. Journal of Magnetic Materials and Devices, 2006, 37(5): 15-17.
[2] 胡少明, 王 军, 任俊峰, 等. 高磁导率低损耗锰锌铁氧体的生产[J]. 电子工艺技术, 2005, 26(5): 289-291.
HU Shao-ming, WANG Jun, REN Jun-feng, et al. Production of high permeability and low attrition Mn-Zn ferrite[J]. Electronics Process Technology, 2005, 26(5): 289-291.
[3] Keluska S H. High permeability of low loss Mn-Zn ferrite obtained by sintering nanoparticle Mn-Zn ferrite[J]. Journal of Magnetism and Magnetic Materials, 2006, 305(2): 296-303.
[4] Etsuo O. Development of low loss Mn-Zn ferrites[J]. Journal of the Japan Society of Powder and Powder Metallurgy, 1996, 43(12): 1386-1392.
[5] Ott G. Recent developments of Mn-Zn ferrites for high permeability applications[J]. Journal of Magnetism and Magnetic Materials, 2003, 254/255: 535-537.
[6] 唐谟堂, 杨声海, 彭长宏, 等. 矿物共沉法制取低功耗软磁铁氧体扩大试验研究[J]. 磁性材料及器件, 2004, 34(6): 23-26.
TANG Mo-tang, YANG Sheng-hai, PENG Chang-hong, et al. The enlarged experiment study on low-power loss soft ferrite made by coprecipitation[J]. Journal of Magnetic Materials and Devices, 2004, 34(6): 23-26.
[7] 彭长宏, 陈艺锋, 唐谟堂. 直接法制备铁锰锌共沉淀粉的工业试验[J]. 湿法冶金, 2007, 26(1): 30-39.
PENG Chang-hong, CHEN Yi-feng, TANG Mo-tang. Industrial experiment of Fe-Mn-Zn co-precipitation powders prepared by direct method[J]. Hydrometallurgy of China, 2007, 26(1): 30-39.
[8] 马玉天, 龚竹青, 武 俊, 等. 从高铅碲渣中浸出碲的热力学分析及实验[J]. 中南大学学报: 自然科学版, 2006, 37(3): 498-504.
MA Yu-tian, GONG Zhu-qing, WU Jun. Thermodynamic analysis and experimental studies of leaching lead-rich tellurium slag[J]. Journal of Central South University: Science and Technology, 2006, 37(3): 498-504.
[9] 杨显万, 何蔼平, 袁宝州. 高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983: 10-148.
YANG Xian-wan, HE Ai-ping, YUAN Bao-zhou. The calculates handbook of high temperature aqueous solution thermodynamics data[M]. Beijing: Metallurgical Industry Press, 1983: 10-148.
[10] 胡天觉, 曾光明, 袁兴中. 湿法炼锌废渣中硫脲浸出银的动力学[J]. 中国有色金属学报, 2001, 11(5): 933-937.
HU Tian-jue, ZENG Guang-min, YUAN Xing-zhong. Leaching kinetics of silver extracted by thiourea from residue in hydrometallurgy of zinc[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(5): 933-937.
[11] 杨显万, 邱定潘. 湿法冶金[M]. 北京: 冶金工业出版社, 1998: 169-174.
YANG Xian-wan, QIU Ding-pan. Hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1998: 169-174.
[12] 李洪桂. 湿法冶金学[M]. 长沙: 中南大学出版社, 2002: 83-85.
LI Hong-gui. Hydrometallurgy[M]. Changsha: Central South University Press, 2002: 83-85.
收稿日期:2008-02-05;修回日期:2008-04-28
基金项目:国家高技术研究发展计划(863)项目(2006AA06Z373);广东省—教育部产学研专项基金资助项目(2006D904032);中国博士后科研基金资助项目(20060400884);广东省科技计划项目(2008A080403007)
通信作者:彭长宏(1966-),男,湖南长沙人,博士,从事直接法制备锰锌铁氧体功能材料及新型离子液体合成与应用研究;电话:13467609637;E-mail: peng9013@163.com


