文章编号: 1004-0609(2005)08-1300-05
Li1.05Ni0.05Mn1.9O4正极材料脱锂过程中的结构变化
师绍纯, 曹高劭, 涂 健, 赵新兵, 涂江平
(浙江大学 材料科学与工程系, 杭州 310027)
摘 要: 与未掺杂的尖晶石LiMn2O4进行比较, 用固相混合合成法制得的结晶良好的尖晶石Li1.05Ni0.05Mn1.9O4正极材料在室温和55℃下的循环性能都能得到较大改善, 首次放电容量在室温和55℃分别保持理论容量的92.6%和91.5%。 在常温条件下, 以0.5C充放电倍率循环50次, 容量保持为首次放电容量的95.3%。 采用非原位X射线衍射的方法对不同脱锂状态的Lix[Li0.05Ni0.05Mn1.9]O4 (0.1〈x〈1)试样进行了结构分析。 结果表明: Li、 Ni的协同掺杂明显减小了晶格参数的变化, 稳定了试样的结构及改善了电池循环性能。
关键词: 锂离子电池; 正极材料; Li1.05Ni0.05Mn1.9O4; 非原位X射线衍射; 晶格参数 中图分类号: TM911
文献标识码: A
Structure change of Li1.05Ni0.05Mn1.9O4
cathode material during Li extraction
SHI Shao-chun, CAO Gao-shao, TU Jian, ZHAO Xin-bing, TU Jiang-ping
(Department of Materials Science and Engineering,Zhejiang University, Hangzhou 310027, China) Abstract: Li1.05Ni0.05Mn1.9O4 cathode material with spinel structure was synthesized after solid-state mixing. Compared with spinel LiMn2O4, the cyclic stability of Li1.05Ni0.05Mn1.9O4 was improved both at room temperature and 55℃. The first discharge capacities of Li1.05Ni0.05Mn1.9O4 are 92.6% and 91.5% of the theoretical capacity at room temperature and 55℃. After 50 cycles with 0.5C charging-discharging rate at room temperature, the capacity is still 95.3% of the first discharging capacity. Ex-situ X-ray diffraction(XRD) was used to analyze the structures of different Li extraction states of Lix[Li0.05Ni0.05Mn1.9]O4 (0.1〈x〈1). The results indicate that adding Li and Ni ions into LiMn2O4-based compound restrains the change of lattice parameter, stabilizes the structure of the sample and improves the cyclic performance.
Key words: lithium-ion battery; cathode material; Li1.05Ni0.05Mn1.9O4; ex-situ X-ray diffraction; lattice parameter
尖晶石LiMn2O4正极材料以其丰富的自然存储量、 低成本和环保等方面的优越性成为锂离子电池中最具发展前途的材料之一[1, 2]。 尤其随着动力电池的发展, 需要安全性能好, 成本低, 制作工艺简单的正极材料。 在这些方面, 尖晶石LiMn2O4相对于广泛用于小型电器方面的LiCoO2有着明显的优势, 但是尖晶石LiMn2O4较差的循环性能以及高温性能成为制约其商业化发展的最大障碍。
尖晶石LiMn2O4的容量衰退机理大致可以分为两个方面: 1) 在充电/放电过程中, 随着Li的脱出和嵌入, Mn3+产生Jahn-Teller效应影响[3]; 2) Mn在电解液中的溶解(尤其是高温溶解)造成电池容量损失更为严重[4]。 也有一种观点认为在锂的脱嵌过程中存在单相-两相-单相的变化过程(0.4〈x〈1, LixMn2O4), 从而导致了尖晶石结构的崩溃[4]。 为此, 一系列抑制容量衰减的方法被采用, 其中非常有效方法是引入其他一些阳离子(如Co、 Ni、 Li、 Mg、 Al等)占据Mn的位置[5-9], 这种方法掺杂的离子稳定了尖晶石结构的晶格畸变或抑制了Jahn-Teller效应的影响。 很多报导[10, 11]发现, 即使掺杂很微量的其他离子, 尖晶石相的LiMyMn2-yO4(y〈0.2)比未掺杂的材料表现出明显优越的循环性能。 研究结果表明, 掺杂量较大(y>0.2)时, 4V的电位平台逐渐消失, 而逐渐产生了3V或者5V的电位平台[12, 13]。
本文作者采用微量Li、 Ni离子协同掺杂的方法制备了Li1.05Ni0.05Mn1.9O4, 对制得的材料进行X射线衍射结构表征以及SEM微观表面分析, 同时进行电化学吸放锂性能测试, 对不同充电状态的Lix[Li0.05Ni0.05Mn1.9]O4 (0.1〈x〈1)进行非原位X射线衍射(XRD)结构分析。
1 实验
将Li2CO3(99.6%, 质量分数), 电解二氧化锰(EMD) (92%, 质量分数)与NiO(99.9%, 质量分数)按一定的化学计量比配比并研磨混匀后, 于箱式炉中400℃时保温4h, 然后升温到750℃保温20h, 制成化学计量的LiMn2O4与Li1.05Ni0.05Mn1.9O4。 把制得的活性材料与乙炔黑和聚偏二氟乙烯(PVDF)按活性材料、 乙炔黑、 聚偏二氟乙烯(PVDF)的质量比为75∶15∶10混合后, 以N-甲基吡咯烷酮为溶剂涂覆在铝箔上制成工作电极。 对电极为金属锂片, 电解液为1mol/L LiPF6/碳酸乙烯酯(EC)与二甲基碳酸酯(DMC) (体积比为1∶1), 隔膜为聚丙烯膜Celgard2400, 在充满氩气的手套箱中组装成CR 2025型纽扣电池。 电化学性能测试实验均在美国Arbin公司的BT2000电池测试仪上进行, 充、 放电倍率为0.5C, 充、 放电电压范围为3.3~4.35V。 所有高于室温的电化学测试均在恒温水浴槽中进行, 误差为±1℃。
对不同电池分别进行充电, 将制得的不同脱锂状态的正极材料进行非原位X射线衍射分析。 实验仪器采用Rigaku-D/MAX-2550PC型转靶X射线多晶衍射仪(CuKα, λ=1.5406, Ni滤波片, 管流为20mA, 管压为40kV)对试样进行分析, 扫描范围为10°~ 75°, 扫描速度为10(°)/min。 用0.1C的电流倍率进行缓慢充电两个循环。 按脱锂的速率与时间的乘积计算出材料中的实际充电容量。 通过对充电时间的控制得到不同脱锂状态的正极材料(0.1〈x〈1, Lix[Li0.05Ni0.05Mn1.9]O4), 充电完成之后, 将电极片在充满氩气保护的手套箱中取出然后做X射线衍射分析。
2 结果与讨论
2.1 Li、 Ni离子掺杂后的结构特征
Li、 Ni离子等比例掺杂和未掺杂的LiMn2O4正极材料的X射线衍射谱如图1所示。 尖晶石LiMn2O4正极材料属于Fd3m空间群, O占据32e位置, 构成立方密堆积, Mn占据16d位置, Li占据8a位置。 从图1可看出, 掺杂后没有出现杂相的衍射峰, 产物仍然呈完整的尖晶石结构。

图1 Li1.05Ni0.05Mn1.9O4与LiMn2O4的X射线衍射谱
Fig.1 XRD patterns of Li1.05Ni0.05Mn1.9O4(a)and LiMn2O4(b)
图2所示为LiMn2O4和Li1.05Ni0.05Mn1.9O4的SEM像。 从图2可看出, Li、 Ni离子掺杂使两者形貌具有明显的不同。 LiMn2O4的颗粒比较细小、 均匀, 外形比较规则, Li1.05Ni0.05Mn1.9O4的颗粒分布不是很均匀, 产生了一些比较大的颗粒, 颗粒的外形也不像LiMn2O4颗粒那么规则。 这些较大的颗粒能够减小Li1.05Ni0.05Mn1.9O4正极材料的比表面积, 从而减小与电解液的直接接触面积, 对提高材料的循环性能有一定的作用。

图2 Li1.05Ni0.05Mn1.9O4(a)与LiMn2O4(b)的SEM像
Fig.2 SEM images of Li1.05Ni0.05Mn1.9O4(a)and LiMn2O4(b)
2.2 充电过程中的结构变化
在充电的过程中, 锂的脱出总是伴随着晶格参数和结构的变化, 有时甚至形成其他更为稳定的相,相, 造成容量的不可逆衰减。 为了研究经过掺杂后尖晶石Li1.05Ni0.05Mn1.9O4正极材料在循环过程中的结构变化特征, 本文作者对充电过程中不同脱锂状态的正极材料进行了非原位X射线衍射表征。 由于实验采用的是恒流充电, Li的脱出量与时间成正比, Lix[Li0.05Ni0.05Mn1.9]O4中的x值通过充电时间和充电电流来确定:
x=(C-tI)/C(1)
式中 C为试样的可逆储锂量; t充电时间; I为充电电流。
试样的可逆储锂量即Lix[Li0.05Ni0.05Mn1.9]O4试样中x=1时的可逆储锂量, 测试结果如图3所示。 从图3中可看出, 在锂脱出过程中, Lix[Li0.05-Ni0.05Mn1.9]O4衍射峰的峰位向高角度移动, 这在(531)峰表现尤为明显。 由布拉格公式及立方晶系的面间距计算公式2d sinθ=nλ可知高角度的衍射峰变化比低角度明显。 本文作者选择在高角度衍射强度较大的(440)峰进行局部放大以观察其随锂的脱出的微细变化, 结果如图4所示。 从图4可以看出, 随着锂的脱出, 峰形产生明显宽化, 强度有所降低, 但是在此过程中, 衍射峰并没有产生分裂, 也就是说没有产生其他相。 由于活性材料涂覆在铝箔上, 因此(222)峰以及(440)峰的右侧均出现了基底Al的衍射峰。 随着锂的脱出, (440)峰向高角度移动逐渐与其迭加。 而对于LiMn2O4, 相关报导[4, 14]发现在脱锂后期(0.1〈x〈0.4), 会有一个两相共存的过程, 这种从单相到两相共存再到单相的变化恶化了LiMn2O4循环性能。 对比不同脱锂深度的X射线衍射谱[14]发现, 通过Li、 Ni的协同掺杂, 可以抑制这种相的变化, 稳定了循环过程中的晶格结构。
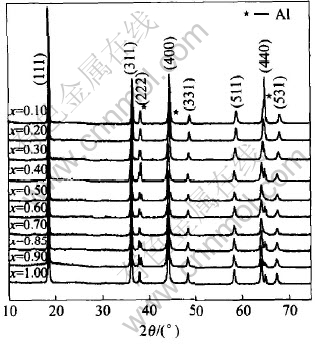
图3 Lix[Li0.05Ni0.05Mn1.9]O4非原位X射线衍射谱
Fig.3 Ex-situ XRD patterns of Lix[Li0.05Ni0.05Mn1.9]O4(0.1〈x〈1)
为了进一步研究掺杂后晶格在充放电过程中的变化特征, 做了晶格参数a随锂脱出的变化曲线图, 并与未掺杂的LiMn2O4晶格参数[4]变化特征做了对比, 结果如图5所示。 由图5可看出, Li1.05-Ni0.05Mn1.9O4和LiMn2O4的晶格参数随锂的脱出具有相似的变化, 但Li1.05Ni0.05Mn1.9O4的晶格参数的变化范围大大减小, 未掺杂的LiMn2O4随锂的脱出, 晶格参数a从0.8247nm逐渐减小到0.8055nm, 缩小了2.33%, 晶胞体积变化6.8%。 经过Li、 Ni离子协同掺杂后, 在脱锂过程中, 晶格参数从0.8205nm逐渐减小到0.8126nm, 缩小了0.96%, 体积变化只有2.9%。 当0.4〈x〈1时, Li1.05Ni0.05Mn1.9O4晶格参数a的变化比较平缓, 从0.8205nm降至0.8184nm, 仅占总变化的26.58%, 说明在这个阶段, 随锂的脱出, 晶格没有产生明显的变化。 在这个范围内, 峰位的移动不是非常明显, 这与Xia等报导的LiMn2O4在低电位范围内(0.5〈x〈1.0)和室温下容量几乎不衰减相一致[4, 8]。 当x〈0.40时, 晶格参数的变化相对非常显著, 晶格参数从0.8184nm很快降至0.8126nm, 占总变化的73.42%。 从图4中还可看出, 峰位的移动非常明显, 但是从x为0.40, 0.30和0.20峰形看出, (440)峰仍然非常平滑, 没有产生分裂。 当x=0.10时, (440)峰与Al峰重迭。 从以上总的变化过程来看, 可以说明没有新相在锂的脱出过程中产生。 而对于未掺杂的LiMn2O4, 可以看出, 当0.40〈x〈1时, 晶格参数的变化非常大, 相对来说, 掺杂后的晶格参数变化要小的多。 这说明Li、 Ni离子的加入能明显减小充电前期(0.4〈x〈1)的晶格参数变化, 稳定材料的结构, 抑制新相的产生。

图4 脱锂过程中(440)特征峰的变化曲线
Fig.4 Curves of (440) peak change during Li extraction

图5 脱锂过程中Li1.05Ni0.05Mn1.9O4与LiMn2O4晶格参数的变化
Fig.5 Lattice parameter change of Li1.05Ni0.05Mn1.9O4 and LiMn2O4 during Li extraction Li1.05Ni0.05Mn1.9O4
晶格中的镍离子呈+2价[5, 15], 其离子半径为0.072nm, 大于Mn3+的半径(0.065nm)和Mn4+的半径(0.055nm), Li+、 Ni2+离子的加入使试样中离子的价态分布变为Li8a[Mn3+1-5yMn4+1+3yLi+yNi2+y]16dO4, 锰的平均价态升高, Mn4+离子含量增加, 而且Li+的半径(0.060nm)小于Mn3+的, 实事上掺杂的后晶格参数略微有所减小。 Li离子脱出时, 晶格参数减小, 体积收缩, 而Li、 Ni离子的协同掺杂降低了晶格参数的大小无疑会抑制充放电过程中晶胞体积的变化, 稳定了材料的结构, 从而提高其循环性能。
2.3 电化学性能
图6所示为锂镍协同掺杂后与未掺杂尖晶石LiMn2O4的循环寿命曲线。 对于尖晶石锰酸锂, 其4V左右的容量取决于Mn3+的数目[16]。
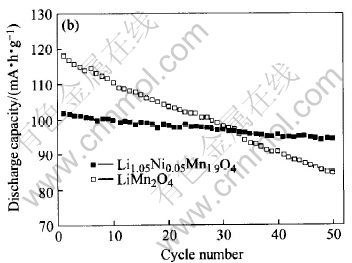
图6 Li1.05Ni0.05Mn1.9O4与LiMn2O4在室温和55℃下的循环性能
Fig.6 Cycle capicities of Li1.05Ni0.05Mn1.9O4 and LiMn2O4 at room temperature(a) and 55℃(b) Li[Mn3+1-5yMn4+1+3yLi+yNi2+y]O4→Li5y[Mn4+2-2yLi+yNi2+yO4+
(1-5y)Li++(1-5y)e(2)
随着Li、 Ni离子的掺入, 试样中的活性离子Mn3+减少为原来的1-5y, 因此试样的理论容量减少为148(1-5y)mA·h/g。
经过Li、 Ni离子协同掺杂Li1.05Ni0.05Mn1.9O4的理论容量降为111mA·h/g, 首次放电容量在常温和55℃分别保持理论容量的92.6%和91.5%。 从图中还可看出, 尖晶石LiMn2O4的循环性能很差, 50次循环后容量下降到原来的87.5%, 55℃时不但首次放电容量有所下降, 且循环的稳定性更差。
掺杂后的Li1.05Ni0.05Mn1.9O4试样无论在室温还是高温下均表现出优良的循环性能。 室温下Li1.05Ni0.05Mn1.9O4试样充放电50次后放电容量为97.98mA·h/g, 为初始放电容量的95.30%, Li、 Ni离子协同掺杂后的初始容量有所降低, 但是尖晶石Li1.05Ni0.05Mn1.9O4在常温和高温下均表现出良好的循环性能。
3 结论
1) 用Li、 Ni离子协同掺杂, 通过固相反应能够制备结晶良好的尖晶石Li1.05Ni0.05Mn1.9O4正极材料, 其循环性能以及高温性能与未掺杂的LiMn2O4进行比较, 得到显著的改善。
2) 通过Li、 Ni的协同掺杂, 不但能够有效地减小充电前期(0.4〈x〈1)晶格参数的变化, 而且能明显减小充电后期(0.1〈x〈0.4)晶格参数的变化, 抑制新相的产生, 从而稳定了充电过程中的材料结构, 改善了材料的循环性能与高温性能。
REFERENCES
[1] Sigala C, Guyomard D, verbaere A, et al. Positive electrode materials with high operating voltage for lithium batteries- LiCryMn2-yO4 (0≤y≤1)[J]. Solid State Iconis, 1995, 81(3-4): 167-170.
[2] Manev V, Banov B, Momchilov A, et al. LiMn2O4 for 4 V lithium-ion batteries[J]. J Power Sources, 1995, 57(1-2): 99-103.
[3] Atsuo Y, Masahiro T, Koichi T, et al. Jahn-Teller instability in spinel Li-Mn-O[J]. J Power Sources, 1999, 81-82: 73-78.
[4] Xia Y Y, Zhou Y H, Yoshio M. Capacity fading on cycling of 4 V Li/LiMn2O4 cells[J]. J Electrochem Soc, 1997, 144(8): 2593-2600.
[5] Li G, Ikuta H, Uchida T. The spinel phases LiMyMn2-yO4(M=Co, Cr, Ni) as the cathode for rechargeable lithium batteries[J]. J Electrochem Soc, 1996, 143(1): 178-183.
[6] Bittihn R, Herr R, Hoge D. The SWING system, a nonaqueous rechargeable carbon/metal oxide cell[J]. J Power Sources, 1993, 43/44(2): 223-231.
[7] Shin Y, Manthiram A. LiMn2O4 cathode doped with excess lithium and synthesized by co-precipitation for Li-ion batteries[J]. J Power Sources, 2003, 115(1): 110-118.
[8] Lee J H, Hong J K, Jang D H, et al. Degradation mechanisms in doped spinels of LiM0.05Mn1.95O4(M=Li, B, Al, Co, and Ni) for Li secondary batteries[J]. J Power Sources, 2000, 89(1): 7-14.
[9] Shiraishi Y, Nakai I, Kimoto K, et al. EELS analysis of electrochemically deintercalated Li1-xMn2O4 and substituted spinels LiMn1.6M0.4O4(M=Co, Cr, Ni)[J]. J Power Sources, 2001, 97-98: 461-464.
[10] Shin Y, Manthiram A. Influence of microstructure on the electrochemical performance of LiMn2-y-zLiyNizO4 spinel cathodes in rechargeable lithium batteries[J]. J Power Sources, 2004, 126(1-2): 169-174.
[11] DU Ke, XIE Jing-ying, WANG Jiu-lin, et al. LiMn2-xCrxO4 spinel prepared by a modified citrate route with combustion[J]. J Power Sources, 2003, 119-121: 130-133.
[12] Amine K, TukamotoH, Yasuda H, et al. A new three-volt spinel Li1+xMn1.5Ni0.5O4 for secondary lithium batteries[J]. J Electrochem Soc, 1996, 143(5): 1607-1613.
[13] Ein-Eli, Howard W F Jr, Lu S H, et al. LiMn2-x- CuxO4 spinels (0.1≤x≤0.5): a new class of 5 V cathode materials for Li batteries[J]. J Electrochem Soc, 1998, 145(4): 1238-1244.
[14] 徐仲榆, 苏玉长, 王要武. 锂锰氧材料在充放电过程中的结构变化[J]. 电池, 2000, 30(3): 101-104.
XU Zhong-yu, SU Yu-chang, WANG Yao-wu. The change of the microstructure of the spinel LiMn2O4 during charging-discharging[J]. Battery Bimonthly, 2000, 30(3): 101-104.
[15] Amine K, Tukamoto H, Yasuda H, et al. Preparation and electrochemical investigation of batteries[J]. J Power Sources, 1997, 68(2): 604-608.
[16] Yanko M, Todorov H Y, Yoshio M. Determination of theoretical capacity of metal ion-doped LiMn2O4 as the positive electrode in Li-ion batteries[J]. J Power Sources, 1999, 77: 198-201.
基金项目: 国家自然科学基金资助项目(50201014)
收稿日期: 2005-01-26;
修订日期: 2005-04-26
作者简介: 师绍纯(1979-), 男, 硕士研究生.
通讯作者: 曹高劭, 副教授; 电话: 0571-87951881; 传真: 0571-87951403; E-mail: gscao@zju.edu.cn
(编辑 李艳红)


