文章编号:1004-0609(2013)10-2970-07
黄铁矿对砷黄铁矿生物浸出的影响
方 芳1, 2, 3,钟 宏1, 3,江放明1, 3,罗忠银2,孙晓伟2,许凯扬2
(1. 中南大学 化学化工学院,长沙 410083;
2. 长沙理工大学 化学与生物工程学院,长沙 410114;
3. 中南大学 有色金属资源化学教育部重点实验室,长沙 410083)
摘 要:
为探明黄铁矿在砷黄铁矿生物浸出过程中的作用与影响,选择纯黄铁矿和砷黄铁矿组成的矿浆浸出体系,考察黄铁矿和砷黄铁矿质量比以及黄铁矿粒度对体系中砷的浸出率以及砷的氧化状态的影响。结果表明:砷的浸出率随黄铁矿与砷黄铁矿质量比的增加而升高,随黄铁矿粒度的增加而减少。当黄铁矿的粒度小于74 μm、黄铁矿与砷黄铁矿质量比为10:2时,砷的最高浸出率为97.7%,比不添加黄铁矿时砷的浸出率提高了约43.18%。且黄铁矿可以加速As(Ⅲ)转化为As(Ⅴ),降低矿浆对细菌的毒害,使生物浸出体系细菌密度提高、pH下降、氧化还原电位φh升高并与砷黄铁矿形成原电池效应,从而促进砷黄铁矿的浸出。
关键词:
中图分类号:TF802.1 文献标志码:A
Effect of pyrite on bioleaching of arsenopyrite
FANG Fang1, 2, 3, ZHONG Hong1, 3, JIANG Fang-ming1, 3, LUO Zhong-yin2, SUN Xiao-wei2, XU Kai-yang2
(1. College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. College of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha 410114, China;
3. Key Laboratory of Resources Chemical of Nonferrous Metals, Ministry of Education, Central South University, Changsha 410083, China)
Abstract: In order to clarify the function of pyrite in arsenopyrite bioleaching, pure pyrite and arsenopyrite were used to prepare a pulp system for studying the effect of the pyrite-to-arsenopyrite mass ratio and particles size of pyrite on the leaching rate and oxidation state of arsenic. The results show that the leaching rate of arsenic increases with increasing the mass fraction of pyrite and decreases with increasing the particle size of pyrite. When the mass ratio of pyrite to arsenopyrite is 10:2 and the particles size of pyrite is less than 74 μm, the highest leaching rate of arsenic is 97.7%, which is about 43.18 % higher than that of the arsenopyrite bioleaching without pyrite. The pyrite can accelerate the transform of As(Ⅲ) to As(Ⅴ), which reduces the toxicity of pulp and makes the bioleaching system have higher bacterial density, lower pH, higher oxidation-reduction potential, and generates galvanic effect with arsenopyrite. Therefore, the bioleaching efficiency of arsenopyrite can be promoted by adding pyrite.
Key words: pyrite; arsenopyrite; Acidithiobacillus ferrooxidans; bioleaching; galvanic effect
在已探明的黄金地质储量中,近一半的矿石属于毒砂(砷黄铁矿)-黄铁矿型难处理金矿。这类矿石的金主要以显微金、次显微金或晶格金的形式包裹在砷黄铁矿中,氰化前必须进行氧化预处理脱砷[1-7]。近年来,细菌预处理方法因其成本低、对环境友好、操作简单而倍受关注[8-10]。细菌浸出硫化矿物的过程中,不同的矿物被细菌氧化的速度是不同的,在黄铁矿-砷黄铁矿浸出体系,砷黄铁矿总是被优先浸出[11-13],且研究发现,在大部分砷黄铁矿被氧化而大部分黄铁矿未被氧化时就可以使金暴露出来,最终提高了氰化工艺中金的回收率[1, 3, 7, 14-15]。硫化矿生物浸出过程的本质是电化学腐蚀溶解过程,它们氧化的速率在很大程度上取决于它们的氧化还原电位[15-16]。因此,在黄铁矿-砷黄铁矿浸出体系,砷黄铁矿由于其氧化还原电位比黄铁矿的低而作为原电池的阳极溶解,黄铁矿则作为原电池的阴极得到保护。除了原电池效应,黄铁矿对浸出体系细菌的繁殖、细菌的活性、对浸出体系溶液的化学特征是否也有影响,这.些影响对砷黄铁矿的浸出是有利还是有害,目前还没有相关研究。为此,本文作者在这方面做了一些基础工作,研究黄铁矿对砷黄铁矿生物浸出体系细菌密度、pH、氧化还原电位φh的影响,并且考察黄铁矿与砷黄铁矿质量比以及黄铁矿粒度对砷的浸出率以及氧化状态的影响,这些研究结果有助于了解细菌对砷黄铁矿浸出的机理,对寻求加速砷黄铁矿溶解的可能途径、调控细菌浸出过程和优化浸出工艺都具有重要的指导意义和应用价值。
1 实验
1.1 试验矿样
试验用黄铁矿和砷黄铁矿均购自国土资源部长沙矿产资源监督检测中心,矿物依次经过手工挑选—稀盐酸浸泡—去离子水清洗—瓷球磨细磨—磁选除去磁性矿物,其中砷黄铁矿采用瓷球磨细磨至粒径<74 μm,黄铁矿细磨以后还要筛分为<43、43~74、74~100 μm 3种粒级,放入干燥器中备用。黄铁矿和砷黄铁矿纯度都比较高,黄铁矿含Fe 43.25%、S 49.61%,砷黄铁矿含Fe 32.46%、S 18.30%、As 42.56%(质量分数)。
1.2 菌种及培养基
使用的嗜酸氧化亚铁硫杆菌由本实验室从国内某高砷金矿酸性矿坑水分离纯化、驯化、诱变得到,命名为NSJ209-2,其最佳培养条件如下:pH 2.0,温度30 ℃,转速180 r/min,采用9K培养基,配方如下:FeSO4·7H2O (44.7 g/L),(NH4)2SO4(3.0 g/L),KCl (0.1 g/L),K2HPO4(0.50 g/L),MgSO4·7H2O (0.50 g/L),Ca(NO3)2 (0.01 g/L),用体积比1:1的H2SO4调节pH为2.0。将基础无机盐培养液(无硫酸亚铁的9K培养基)于121 ℃灭菌20 min,能源物质硫酸亚铁经微孔滤膜(d 0.22 μm)真空抽滤除菌之后混合使用。实验菌种制备方法如下:将菌种恒温培养至对数生长期,对菌液进行离心,在5 000 r/min 下离心20 min,去上清液得到固体,用pH=2.0预先灭过菌的硫酸溶液对沉淀进行洗涤和重悬浮,然后再离心去上清液,如此反复操作3次,以得到纯的细胞悬浮液,在生物显微镜下进行计数,调整细菌浓度。
1.3 实验仪器与设备
ZQ2Y-HC高精度振荡培养箱(上海知楚仪器有限公司生产),AL104分析天平(瑞士梅特勒-托利多集团生产),PHSJ-4A pH计(上海雷磁仪器厂生产),CX31生物显微镜(奥林巴斯集团生产),BPC-150F 型生化培养箱(上海一恒科学仪器有限公司生产),SW-CJ-10超净工作台(苏州净化设备有限公司生产),YXQ-LS-30S1立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂生产),SQJ1-XB-K-25血细胞计数板(Midwest-G),U-2910型紫外可见分光光度计(Hitachi)。
1.4 实验方法
准确称取粒径<74 μm的砷黄铁矿矿粉2 g置于容量为250 mL的摇瓶,根据需要加入不同粒度和不同质量的黄铁矿,加入50 mL pH=2.0的9K无铁培养基预浸24 h,然后接种10 mL对数生长期的细菌(细菌浓度为1.0×108 mL-1)并补加培养基定容至100 mL,用体积比1:1的硫酸调节pH后放入摇床,在温度30 ℃,转速180 r/min的空气浴恒温摇床内振荡浸出,浸出过程蒸发掉的水分用蒸馏水补充,取样消耗的液体用9K无铁培养基补充,每隔24 h检测浸出体系中的pH、氧化还原电位φh、细菌的密度、As(Ⅲ)和总砷(为As(Ⅲ)和As(Ⅴ)之和)的浓度并计算砷的浸出率。
1.5 分析方法
细菌密度采用血球计数板在显微镜下直接计数,pH采用上海精科雷磁仪器厂生产的PHSJ-4A型便携式酸度计测量,氧化还原电位φh用公式φh=φm+240 mV换算(φh为相对于标准氢电极的电位;φm为用甘汞电极(参比电极)和金属铂电极(指示电极)所测的电位,饱和甘汞电极在30 ℃时的标准电位值为240 mV)。总砷含量采用新银盐法测定,三价砷采用溴酸钾滴定法,As(Ⅴ)采用总砷与As(Ⅲ)之差计算。
2 结果与讨论
2.1 黄铁矿对砷黄铁矿生物浸出体系pH和氧化还原电位φh的影响
硫化矿生物浸出体系pH的变化由其浸出过程的化学反应所决定。在黄铁矿-砷黄铁矿生物浸出体系,硫和砷的氧化浸出以及黄钾铁矾沉淀的形成都是产酸反应,会使体系的pH下降,但溶液中Fe2+在细菌的作用下氧化成Fe3+是一个耗酸反应,会使体系的pH升高,这些化学反应共同决定体系的pH变化趋势。图1所示为不同黄铁矿与砷黄铁矿质量比时pH和φh随时间变化。从图1(a)可以看出,在浸矿初期,体系的pH呈上升趋势,这是因为在浸矿初期,细菌对浸矿环境的适应有一停滞期,在停滞期内,细菌密度低,产酸反应和耗酸反应都很弱,但由于矿物中含有一部分碱性物质会溶解释放到溶液中,致使体系的pH升高。随着浸矿时间的延长,细菌密度迅速增加,矿物浸出速度加快,这时产酸反应和耗酸反应都增强,但总体上生成的H+要多于消耗的H+,所以pH逐渐下降。从图1(a)还可以看出,加入的黄铁矿质量比越高,在浸矿初期,体系的pH越高,在浸矿后期,pH下降越显著,当黄铁矿与砷黄铁矿的质量比大于4:2时,浸矿后期的pH几乎直线下降。
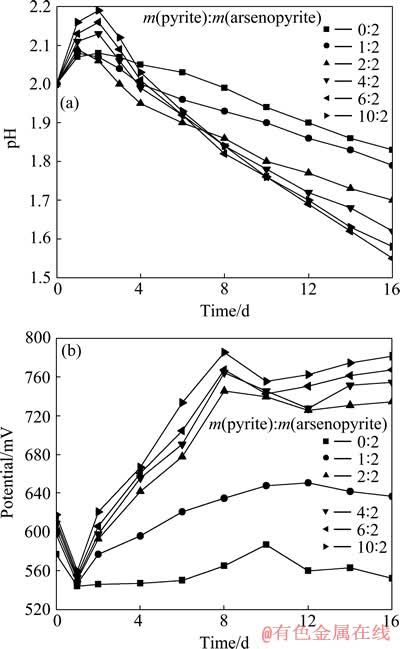
图1 不同黄铁矿与砷黄铁矿质量比时pH和φh随时间变化曲线
Fig. 1 Changing curves of pH (a) and φh (b) with leaching time at different mass ratios of pyrite to arsenopyrite
硫化矿生物浸出体系的氧化还原电位φh主要受x(Fe3+)/x(Fe2+)的影响,溶液中的电位不仅能反映细菌生长活性而且还能反映矿样的氧化情况。体系电位升高主要是由于细菌的生长需要能量,促使溶液中Fe2+氧化成Fe3+或者直接从矿物中浸出Fe3+,从而维持体系的高电位,浸出过程电位下降主要因为Fe3+氧化硫化矿时被还原为Fe2+,使得x(Fe3+)/x(Fe2+)下降。从图1(b)可以看出,刚接种时,浸出体系的氧化还原电位φh都较高,但浸出一天后都急剧下降,这是由于接种液中含有一定量的Fe3+,它与矿物发生还原反应而迅速消耗。从第三天开始,加入了黄铁矿的浸出体系,细菌已经适应了环境,细菌密度随之升高,溶液中的Fe2+在细菌的作用下氧化成Fe3+,因此,氧化还原电位φh迅速增大,而纯砷黄铁矿浸出体系,由于细菌的停滞期更长,氧化还原电位φh到第6天才慢慢升高。从图1(b)还可以看出,在浸矿后期,浸出体系的氧化还原电位有所波动,这可能与溶液中三价砷的浓度变化有关,三价砷的毒性很强,对细菌具有强烈的抑制作用,致使细菌的密度和活性降低,但无论在浸矿前期还是后期,添加黄铁矿后溶液的电位一直大于未添加黄铁矿时的电位,并且电位升高得更快。
2.2 黄铁矿对砷黄铁矿生物浸出体系细菌密度的影响
浸出液中细菌的密度是衡量浸矿细菌生物活性的一个重要指标。黄铁矿-砷黄铁矿生物浸出体系的细菌密度随时间变化趋势如图3所示。从图3可以看出,在浸出的初始阶段,纯砷黄铁矿生物浸出体系溶液中细菌密度并没有明显的变化,说明大部分细菌以游离菌的形式存在于溶液中,只有少数细菌被吸附到砷黄铁矿表面上。纯砷黄铁矿生物浸出体系细菌生长的停滞期较长,停滞期后细菌密度增加速度也较慢,到第10天,细菌浓度达到最大值,最终维持在1.0×107 mL-1左右。但加入黄铁矿后,在浸出初期,溶液中的游离菌浓度明显减少,其数量级从1.0×107 mL-1变为1.0×106 mL-1,表明加入溶液中的细菌大部分被吸附到黄铁矿表面,细菌生长的停滞期也明显缩短,浸出到第8天,细菌密度就达到最大值1.0×108 mL-1左右,比未加黄铁矿体系的细菌密度高10倍左右。从图2还可以看出,在浸矿后期,浸出体系的细菌密度有所波动,这可能与溶液中三价砷的浓度变化有关,三价砷浓度增加细菌密度下降,三价砷浓度下降细菌密度升高,同时,溶液中五价砷的浓度对细菌密度也有一定的影响。因此,可以得出以下结论:在砷黄铁矿生物浸出体系加入黄铁矿可以使体系pH下降、氧化还原电位φh升高、细菌密度提高,这些都有利于砷黄铁矿生物浸出速度的提高。
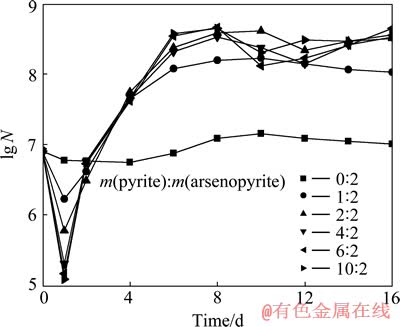
图2 不同黄铁矿与砷黄铁矿质量比时细菌密度随时间变化曲线
Fig. 2 Changing curves of bacterial density with leaching time at different mass ratios of pyrite to arsenopyrite
2.3 黄铁矿对砷浸出率的影响
图3所示为不同黄铁矿与砷黄铁矿质量比下砷的浸出率及砷的浸出率随时间变化曲线。由图3可知,砷的浸出率随黄铁矿和砷黄铁矿质量比的增加而升高,在黄铁矿与砷黄铁矿的质量比10:2时,砷的浸出率为97.7%,比不添加黄铁矿时砷的浸出率提高了约43.18%。这是因为砷黄铁矿的生物浸出以间接机理为主,而黄铁矿的生物浸出以直接机理为主, 加入的黄铁矿可以直接提供细菌生长所需的铁和硫等营养物质,所以,体系中细菌的密度更高,细菌活性更强,Fe3+的浓度也更高,从而强化砷黄铁矿的间接氧化作用,砷的浸出速度加快。另外,由于砷黄铁矿和黄铁矿产生原电池效应并发生了原电池反应,砷黄铁矿由于其氧化还原电位比黄铁矿低而作为原电池的阳极溶解,导致砷黄铁矿氧化分解速度加快。而且在纯砷黄铁矿细菌氧化过程中, 在浸出后期会产生大量的黄钾铁矾沉淀, 沉淀覆盖到砷黄铁矿表面上隔绝了它与环境的接触, 最终也会影响它的脱砷效果。
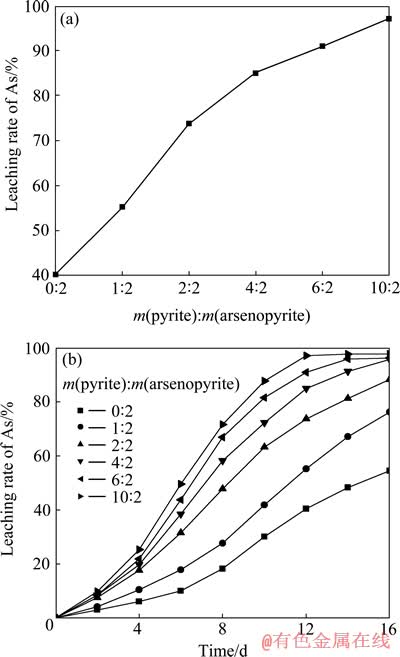
图3 不同黄铁矿与砷黄铁矿质量比下砷的浸出率(12 d)及砷的浸出率随时间变化曲线
Fig. 3 Leaching rate of As at different mass ratios of pyrite to arsenopyrite(12 d) (a) and changing curves of leaching rate of As with leaching time at different mass ratios of pyrite to arsenopyrite (b)
2.4 黄铁矿对浸出过程As(Ⅲ)、As(Ⅴ)浓度的影响
砷黄铁矿生物浸出过程中,As的价态变化为[AsS]2-→As(Ⅲ)→As(Ⅴ)[12],并最终以As(Ⅲ)或As(Ⅴ)或以两者氧化物的混合形态存在于浸出液中。由于As(Ⅲ)对细菌的抑制能力远大于As(Ⅴ),因此,生物浸出过程加快As(Ⅲ)氧化成As(Ⅴ)是生物预处理含砷金精矿研究的重要课题[17]。图4所示为不同黄铁矿与砷黄铁矿质量比时As(Ⅲ)和As(Ⅴ)浓度随时间变化曲线。从图4可以看出,未添加黄铁矿时,砷黄铁矿在整个氧化过程中,砷以As(Ⅲ)为主,说明细菌和Fe3+氧化As(Ⅲ)的速度非常缓慢。当加入黄铁矿以后,在浸出的初始阶段,砷仍然以As(Ⅲ)为主,但在浸出后期,As(Ⅲ)浓度越来越小,As(Ⅴ)浓度越来越高,说明黄铁矿是决定生物浸出中砷氧化状态的主要因素,细菌和Fe3+与黄铁矿共同作用,可以将As(Ⅲ)迅速氧化为As(Ⅴ)。从图4还可以看出,黄铁矿和砷黄铁矿质量比越高,As(Ⅲ)转化成As(Ⅴ)的速度越快,最终浸出液中As(Ⅲ)浓度也越低。
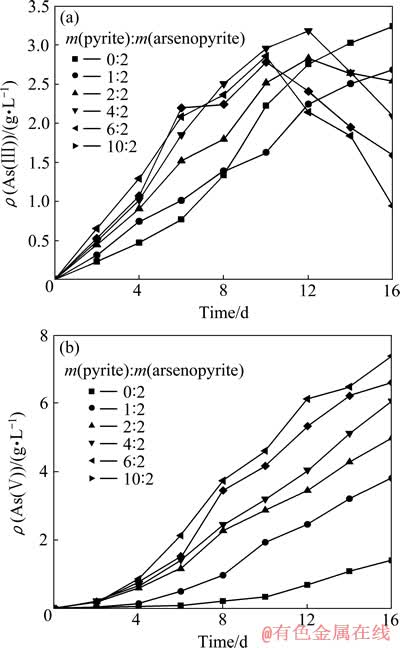
图4 不同黄铁矿与砷黄铁矿质量比下As(Ⅲ)和As(Ⅴ)浓度随时间变化曲线
Fig. 4 Changing curves of As(Ⅲ)(a) and As(Ⅴ)(b) concentration with leaching time at different mass ratios of pyrite to arsenopyrite
2.5 黄铁矿粒度对砷浸出率的影响
在黄铁矿与砷黄铁矿质量比为10:2的条件下,不同粒度的黄铁矿对砷的浸出率的影响结果如图5所示。从图5可以看出,随着黄铁矿粒度的减小,砷的浸出率逐步增大,在黄铁矿粒度<43 μm时,砷的浸出效果最佳,其浸出初期以及最终浸出率均高于其他粒级。这是因为硫化矿的生物浸出是一个多相复杂反应,这些反应一般在相界面上进行,因此界面的几何形状对于反应的速度有重要的影响,黄铁矿粒度越小,单位质量的表面积就越大,矿物溶解的速度也就越快。图6所示为不同粒度组成下浸出体系的pH和氧化还原电位φh随时间变化曲线。由图6(a)可看出,黄铁矿粒度越细浸出体系的pH下降速度越快,且pH随浸出时间的增加均呈先升高后降低的趋势。从图6(b)可以看出,3种粒度的氧化还原电位φh变化趋势较相似,氧化还原电位φh随黄铁矿粒度的减少而升高,在浸出前期随浸出时间的增加而升高,在浸出后期随浸出时间的增加先降后升。因此,体系的pH和氧化还原电位φh间接地反映了矿物的浸出情况,pH下降越快,氧化还原电位值越高,矿物的浸出速度就越快。
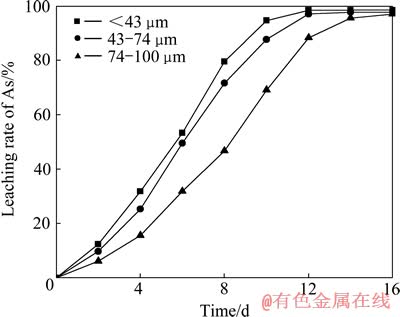
图5 不同黄铁矿粒度下砷的浸出率随时间变化曲线
Fig. 5 Changing curves of leaching rate of As with leaching time at different particle sizes of pyrite
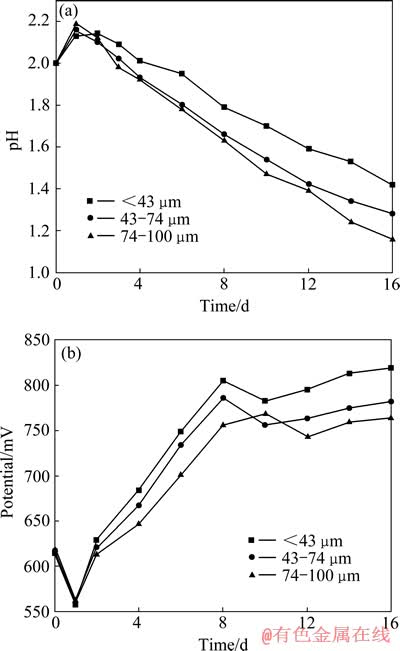
图6 不同黄铁矿粒度下pH和φh随时间变化曲线
Fig. 6 Changing curves of pH(a) and φh(b) with leaching time at different particle sizes of pyrite
2.6 黄铁矿强化砷黄铁矿生物浸出的机理分析
1) 黄铁矿强化了砷黄铁矿生物浸出体系细菌的直接氧化作用。黄铁矿能直接提供细菌生长繁殖所需要的能源物质铁和硫,使得浸出体系细菌的密度比纯砷黄铁矿浸出体系更高。同时,加入黄铁矿后,浸出体系氧化还原电位φh更高,浸出过程中pH下降更快。因此,能减少黄钾铁矾沉淀的生成,而纯砷黄铁矿浸出体系, 在浸出后期会产生大量的黄钾铁矾沉淀, 沉淀覆盖到砷黄铁矿表面上隔绝了它与环境的接触, 最终影响了它的浸出效果。另外,细菌和Fe3+与黄铁矿共同作用,加速了As(Ⅲ)向As(Ⅴ)转变, 降低砷离子对细菌的毒性, 从而强化砷黄铁矿的浸出。
2) 黄铁矿强化了砷黄铁矿生物浸出体系细菌的间接氧化作用。因为砷黄铁矿的生物浸出以间接机理为主[10, 15],浸出过程中只有极少数的细菌被吸附在矿物表面,浸出速度慢。而黄铁矿的生物浸出以直接机理为主[10, 15],加入黄铁矿以后,大量细菌被吸附到黄铁矿表面,细菌繁殖速度快,氧化活性强,细菌直接氧化黄铁矿产生大量的Fe3+释放到溶液中,Fe3+与砷黄铁矿发生反应被还原成Fe2+,产生的Fe2+又在细菌的作用下被氧化为Fe3+,依次循环,大大强化砷黄铁矿的浸出。
3) 黄铁矿与砷黄铁矿产生原电池效应并发生原电池反应,加快了砷黄铁矿的浸出。在所有的硫化矿中,黄铁矿的氧化还原电位是最高的而砷黄铁矿的氧化还原电位是最低的,当它们处在同一个电解质溶液中时就会组成原电池并发生原电池反应,在细菌存在的条件下,原电池反应更加剧烈[16]。因此,电位相对低的砷黄铁矿充当阳极, 发生失去电子的氧化反应, 不断地被腐蚀溶解。
3 结论
1) 黄铁矿强化了砷黄铁矿生物浸出体系细菌的直接氧化作用和间接氧化作用,而且黄铁矿能提高砷黄铁矿生物浸出体系的细菌密度,使体系的pH下降、氧化还原电位φh升高,还能减少浸出过程黄钾铁矾沉淀的生成,从而提高砷黄铁矿的浸出速度和浸出率。
2) 黄铁矿与砷黄铁矿产生原电池效应并发生了原电池反应,导致作为阳极的砷黄铁矿氧化分解速度加快。
3) 黄铁矿是决定砷黄铁矿生物浸出过程砷的氧化状态的主要因素,尽管Fe3+是强氧化剂,但不能直接将As(Ⅲ)氧化成As(Ⅴ),而需与黄铁矿和细菌共同作用才能氧化成As(Ⅲ)。
4) 砷的浸出率随黄铁矿和砷黄铁矿质量比的增加而升高,随黄铁矿粒度的减少而增加。当黄铁矿的粒度小于74 μm、黄铁矿与砷黄铁矿质量比为10:2时,砷的最高浸出率为97.7%,比不添加黄铁矿时砷的浸出率提高了约43.18%。
REFERENCES
[1] 杨洪英, 范 金, 崔日成, 巩恩普. 难处理高砷金矿的细菌氧化-提金研究[J]. 贵金属, 2009, 30(3): 1-3.
YANG Hong-ying, FAN Jin, CUI Ri-cheng, GONG En-pu. Study on bacterial oxidation-extraction gold of refractory gold ore[J]. Precious Metals, 2009, 30(3): 1-3.
[2] 杨丽丽, 杨洪英, 范有静, 王大文. 难处理金矿石细菌氧化的影响因素研究[J]. 贵金属, 2007, 28(1): 58-62.
YANG Lili, YANG Hong-ying, FAN You-jing, WANG Da-wen. Study on influencing factors of bacterial oxidation of refractory gold ores[J]. Precious Metals, 2007, 28(1): 58-61.
[3] 杨 玮, 覃文庆, 刘瑞强, 任允超. 高砷难处理金精矿细菌氧化-氰化提金[J]. 中国有色金属学报, 2011, 21(5): 1151-1158.
YANG Wei, QIN Wen-qing, LIU Rui-qiang, REN Yun-chao. Extraction of Au from high arsenic refractory gold concentrate by bacterial oxidation-cyanidation[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1151-1158.
[4] 罗志雄, 张广积, 方兆珩. 采用中温菌和常温菌浸出含砷金精矿[J]. 中国有色金属报, 2007, 17(8): 1342-1347.
LUO Zhi-xiong, ZHANG Guang-ji, FANG Zhao-heng. Bioleaching arsenic-containing gold concentrates with MLY and At.f[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(8): 1342-1347.
[5] 杨松荣, 邱冠周, 胡岳华, 谢纪元. 含砷难处理金矿石生物氧化工艺及其应用[M]. 北京: 冶金工业出版社, 2006: 93.
YANG Song-rong, QIU Guan-zhou, HU Yue-hua, XIE Ji-yuan. The biological oxidation technology and application of refractory gold ores containing arsenic[M]. Beijing: Metallurgical Industry Press, 2006: 93.
[6] MARQUEZ M, GASPAR J, BESSLER K E. Process mineralogy of bacterial oxidized gold ore in Sao Bento Mine(Brasil)[J]. Hydrometallurgy, 2006, 83(1/4): 114-123.
[7] 杨洪英, 巩恩普, 訾建威, 杨 立. 嗜热菌对高砷金精矿氧 化-氰化提金试验研究[J]. 东北大学学报: 自然科学版, 2006, 27(4): 426-429.
YANG Hong-ying, GONG En-pu, ZI Jian-wei, YANG Li. Experimental investigation on gold recovery from high As concentration through bio-oxidation/cyanidation with thermophilic bacteria[J]. Journal of Northeastern University: Natural Science, 2006, 27(4): 426-429.
[8] 杨均流, 温建康, 陈勃伟, 刘兴宇. 黄铁矿强化生物浸出低品位磷矿[J]. 北京科技大学学报, 2010, 32(9): 1113-1118.
YANG Jun-liu, WEN Jian-kang, CHEN Bo-wei, LIU Xing-yu. Pyrite enhancing bioleaching of low-grade phosphorite ore[J]. Journal of University of Science and Technology Beijing, 2010, 32(9): 1113-1118.
[9] 莫晓兰, 林 海, 傅开彬, 徐承焱. 黄铁矿促进黄铜矿微生物浸出影响因素[J]. 北京科技大学学报, 2012, 34(7): 761-768.
MO Xiao-lan, LIN Hai, FU Kai-bin, XU Cheng-yan. Influence factors of pyrite promotion on the bioleaching of chalcopyrite[J]. Journal of University of Science and Technology Beijing, 2012, 34(7): 761-768.
[10] LANGHANS D, LORD A, LAMPSHIRE D. Biooxidation of an arsenic-bearing refractory gold ore[J]. Minerals Engineering, 1995, 8(2): 147-158.
[11] 金世斌, 马金瑞, 郝福来. 金精矿生物氧化过程中砷的氧化行为初探[J]. 黄金, 2009, 30(8): 41-43.
JIN Shi-bin, MA Jin-rui, HAO Fu-lai. Preliminary discussion on the arsenic oxidization behavior in gold concentrate biologic oxidization process[J]. Gold, 2009, 30(8): 41-43.
[12] 杨洪英, 杨 立, 魏绪钧. 氧化亚铁硫杆菌(SH-T)氧化毒砂的机理[J]. 中国有色金属报, 2001, 11(2): 323-327.
YANG Hong-ying, YANG Li, WEI Xu-jun. Mechanism on biooxidation of arsenopyrite with Thiobacillus ferrooxidans strain SH-T[J]. The Chinese Journal of Nonferrous Metals, 2001, 21(2): 323-327.
[13] ARRASCUE M L, NIEKERK J V. Biooxidation of arsenopyrite concentrate using BIOX process: Industrial experience in Tamboraque, Peru[J]. Hydrometallurgy, 2006, 83(1/4): 90-96.
[14] JIANG Tao, LI Qian, YANG Yong-bin, LI Guan-zhou, QIU Guan-zhou. Bio-oxidation of arsenopyrite[J]. Transaction of Nonferrous Metals Society of China, 2008, 18(6): 1433-1438.
[15] 崔日成, 杨洪英, 张谷平, 马玉蕊. 毒砂型高砷金精矿的细菌氧化[J]. 化工学报, 2008, 59(12): 3090-3094.
CUI Ri-cheng, YANG Hong-ying, ZHANG Gu-ping, MA Yu-rui. Biooxidation of high arsenic gold concentrate with arsenopyrite type[J]. Journal of Chemical Industry and Engineering, 2008, 59(12): 3090-3094.
[16] 李宏煦, 邱冠周, 胡岳华, 王淀佐. 原电池效应对混合硫化矿细菌浸出的影响[J]. 中国有色金属学报, 2003, 13(5): 1283-1285.
LI Hong-xu, QIU Guan-zhou, HU Yue-hua, WANG Dian-zuo. Galvanic effect on mixed sulfide bioleaching[J]. The Chinese Journal of Nonferrous Metal Society, 2003, 13(5): 1283-1285.
[17] WIERTZ J V, MATEO M, ESCOBAR B. Mechanism of pyritecatalysis of As(Ⅲ) oxidation in bioleaching solutions at 30 ℃ and 70 ℃[J]. Hydrometallurgy, 2006, 83(1/4): 35-39.
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51104024);湖南省自然科学基金资助项目(10JJ6019);湖南省教育厅资助项目(10C0399);湖南省科技厅资助项目(2013SK3141)
收稿日期:2012-11-09;修订日期:2013-06-26
通信作者:钟 宏,教授,博士;电话:0731-88830654;E-mail: zhongh@mail.csu.edu.cn
摘 要:为探明黄铁矿在砷黄铁矿生物浸出过程中的作用与影响,选择纯黄铁矿和砷黄铁矿组成的矿浆浸出体系,考察黄铁矿和砷黄铁矿质量比以及黄铁矿粒度对体系中砷的浸出率以及砷的氧化状态的影响。结果表明:砷的浸出率随黄铁矿与砷黄铁矿质量比的增加而升高,随黄铁矿粒度的增加而减少。当黄铁矿的粒度小于74 μm、黄铁矿与砷黄铁矿质量比为10:2时,砷的最高浸出率为97.7%,比不添加黄铁矿时砷的浸出率提高了约43.18%。且黄铁矿可以加速As(Ⅲ)转化为As(Ⅴ),降低矿浆对细菌的毒害,使生物浸出体系细菌密度提高、pH下降、氧化还原电位φh升高并与砷黄铁矿形成原电池效应,从而促进砷黄铁矿的浸出。
[1] 杨洪英, 范 金, 崔日成, 巩恩普. 难处理高砷金矿的细菌氧化-提金研究[J]. 贵金属, 2009, 30(3): 1-3.
[2] 杨丽丽, 杨洪英, 范有静, 王大文. 难处理金矿石细菌氧化的影响因素研究[J]. 贵金属, 2007, 28(1): 58-62.
[3] 杨 玮, 覃文庆, 刘瑞强, 任允超. 高砷难处理金精矿细菌氧化-氰化提金[J]. 中国有色金属学报, 2011, 21(5): 1151-1158.
[4] 罗志雄, 张广积, 方兆珩. 采用中温菌和常温菌浸出含砷金精矿[J]. 中国有色金属报, 2007, 17(8): 1342-1347.
[5] 杨松荣, 邱冠周, 胡岳华, 谢纪元. 含砷难处理金矿石生物氧化工艺及其应用[M]. 北京: 冶金工业出版社, 2006: 93.
[7] 杨洪英, 巩恩普, 訾建威, 杨 立. 嗜热菌对高砷金精矿氧 化-氰化提金试验研究[J]. 东北大学学报: 自然科学版, 2006, 27(4): 426-429.
[8] 杨均流, 温建康, 陈勃伟, 刘兴宇. 黄铁矿强化生物浸出低品位磷矿[J]. 北京科技大学学报, 2010, 32(9): 1113-1118.
[9] 莫晓兰, 林 海, 傅开彬, 徐承焱. 黄铁矿促进黄铜矿微生物浸出影响因素[J]. 北京科技大学学报, 2012, 34(7): 761-768.
[11] 金世斌, 马金瑞, 郝福来. 金精矿生物氧化过程中砷的氧化行为初探[J]. 黄金, 2009, 30(8): 41-43.
[12] 杨洪英, 杨 立, 魏绪钧. 氧化亚铁硫杆菌(SH-T)氧化毒砂的机理[J]. 中国有色金属报, 2001, 11(2): 323-327.
[15] 崔日成, 杨洪英, 张谷平, 马玉蕊. 毒砂型高砷金精矿的细菌氧化[J]. 化工学报, 2008, 59(12): 3090-3094.
[16] 李宏煦, 邱冠周, 胡岳华, 王淀佐. 原电池效应对混合硫化矿细菌浸出的影响[J]. 中国有色金属学报, 2003, 13(5): 1283-1285.


