文章编号:1004-0609(2016)-12-2676-10
冶炼烟气洗涤污酸废水气液硫化除锌
蒋国民1, 2,彭 兵1, 2,王海棠1, 2,柴立元1, 2,王庆伟1, 2,王云燕1, 2,史美清1, 2
(1. 中南大学 冶金与环境学院,长沙 410083;
2. 中南大学 国家重金属污染防治工程技术研究中心,长沙 410083)
摘 要:
采用气液硫化法对模拟含锌污酸废水进行处理,考察pH值、H2S气体分压、反应温度、反应时间、Zn2+初始浓度等条件对Zn2+去除效果的影响。在单因素实验的基础上进行五因素五水平的正交实验,并对采用该工艺处理冶炼烟气洗涤污酸废水效果进行验证。研究Zn2+硫化分离的热力学,及其气液反应动力学过程,并对锌沉渣进行分析与表征。结果表明:在最佳工艺条件为模拟溶液初始pH值3、反应时间80 min、温度35 ℃、H2S气体的体积分数为30%、Zn2+初始浓度100 mg/L时,Zn2+脱除率为99.54%,沉渣主要物相为ZnS,锌的质量分数达63.84%;实际污酸废水锌浓度为569和216.7 mg/L时,去除率分别达到99.79%和99.49%。
关键词:
中图分类号:X703 文献标志码:A
有色金属冶炼过程中产生的SO2烟气中常夹杂铅、锌、砷等重金属粉尘。烟气制硫酸前需采用湿法除尘,因此,在空塔、填料塔、动力波以及电除雾过程中会产生大量的烟气洗涤污酸废水[1]。铅锌冶炼产生的污酸废水中含有高浓度的铅和锌[2]。铜、镍、黄金冶炼产生的污酸废水中,也含有少量锌。锌是维持机体正常生长发育、新陈代谢的重要物质,被誉为“生命之花”。但是,锌离子也是一种累积性毒物,具有持久性、毒性大、污染严重等特点,一旦进入环境后不能被生物降解,并最终在生物体内积累,破坏生物体正常生理代谢活动,危害人体健康[7-9]。
含锌污酸废水的处理方法有化学沉淀法[10]、吸附法[11-12]、电絮凝法[13-14]、离子交换法、膜分离法[15]和萃取法[16-17]等。目前,国内外污酸废水处理技术以化学沉淀法和硫化法[18]为主。化学沉淀法处理后的渣量大,且这些废渣含有砷、铜、铅等元素,属于危险废物,会引发二次污染,后续处理成本很高,且污酸中原有的有价资源没有得到回收利用[19]。硫化法由于渣量较小、沉淀稳定、难于返溶、不易造成二次污染,得到了国内外学者的高度重视。在硫化法沉淀分离原理和机理研究方面,FUKUTA等[20-23]利用不同金属硫化物溶度积的差异,通过改变溶液pH值实现了Cu-Zn-Ni以及Sn-Zn废水体系的选择性沉淀;LUTHER等[24]通过分析体系中Zn(H2O)62+、Zn4S64-以及Zn3S3之间的转化规律,研究了硫化锌的沉淀机理;在硫化法工艺条件的研究中,GROOTSCHOLTEN等[25]通过实验及模拟评估得到了硫化锌沉淀影响因素及反应参数;ESPOSITO等[26]采用硫化法处理废水可将水中的锌浓度从3 g/L降低到0.07 mg/L,并研究了硫化锌沉淀粒径对去除效率的影响。但现有研究通常采用Na2S、NaHS、FeS、CaS直接作为硫化剂,硫化剂利用率低,且引入钠、钙等离子,增加了系统盐分,造成后续废水处理回用的困难。本研究中的工艺采用气液硫化技术,硫化物的利用率高,可接近理论值,相比传统的硫化技术硫化物的用量节省20%以上,且硫化渣的减少量可达30%以上,大大降低危废处理成本,节约运行费用。气液硫化在密闭系统内进行,无硫化氢的二次污染。同时,由于采用硫化氢硫化,避免大量的钠离子进入污酸,降低了污酸的盐分,便于后续废水的处理与回用。
本文作者采用H2S气液硫化处理模拟含锌污酸废水及实际污酸废水,探究了其最佳工艺操作条件,分析了锌离子硫化分离的热力学,研究了其气液反应动力学过程,实现了污酸废水中锌离子的高效去除。同时,使锌在沉渣中得到富集,有利于锌的回收与资源化,为污酸废水中锌的去除与回收研究提供了重要参考。
1 实验
1.1 实验流程
本实验中所采用的废水为配置的模拟废水和来自内蒙古与福建两家冶炼企业的实际废水。采用H2S气体处理含锌废水实验装置示意图如图1所示。试验时采用FeS与HCl反应制取H2S气体,再由排水法收集。先关闭二通阀,将储气罐用饱和H2S溶液充满,并用石蜡密封。再将三口瓶中生成的H2S气体充入储气罐中,打开二通阀,储气罐中的液体就会被压入储液罐内;打开氮气钢瓶,将钢瓶压力表调节至指定压力,通入到储气罐中,即得到一定体积分数的H2S气体。试验时控制一定的温度和溶液pH值,打开阀门12、14、15,关闭阀门13、16,将H2S气体通入到反应器进行循环,配制好的模拟硫酸锌废水则通过蠕动泵(600 r/min)输送到反应器中进行循环。反应一定时间后,关闭阀门12、14、15,打开阀门13、16,通入氮气吹扫反应器10 min,排除未反应的H2S后,停止通氮气,通过蠕动泵将水样取出。加入2 mL絮凝剂PAM使沉淀絮凝,从而加速渣水分离,再通过0.2 μm的膜过滤,滤液经过0.1 mol/L HNO3酸化后,保存在4 ℃以下,滤渣保存待分析。本实验中采用的硫化剂H2S有毒,实验过程中需严格保证反应器的气密性,反应前后氮气(N2)吹扫,将未反应的H2S气体排出,并用碱液吸收,防止引发二次污染。同时,本实验在通风橱中进行,防止H2S泄露造成实验人员伤害。
1.2 分析与检测
溶液化学成分采用电感耦合等离子体发射光谱仪(ICP) (iCAP7000)分析;采用扫描电镜分析沉渣的表面形貌(仪器型号为JSM-6360LV)进行分析;沉渣组分 X射线能谱分析仪器型号为EDX-Genesis进行分析;沉渣的物相采用日本理学TTR Ⅲ型X射线衍射仪分析。
2 结果与分析
2.1 各因素对Zn2+去除效果的影响
2.1.1 pH值对Zn2+去除效果的影响
实验中Zn2+初始浓度为500 mg/L,储气罐中配制H2S气体的体积分数为20%,反应温度为25 ℃,采用HCl溶液调节体系pH值分别为1、2、3、4和5,反应时间1 h,其结果见图2。对于含锌废水,当pH值低于3时,溶液中Zn2+并没有得到较大程度的净化;pH=1和pH=2时,锌的去除率分别为5.73%和41.76%;当pH值超过3时,锌的去除率明显增加,达到98%以上;之后,随着pH值的增加,溶液中残留的Zn2+浓度基本保持不变。可见,在酸性条件下采用H2S气体处理含锌废水的最佳pH值取4。
2.1.2 硫化氢分压对Zn2+去除效果的影响
H2S气体作为重金属离子硫化的重要反应物,其体积分数的大小在很大程度上影响了溶液中Zn2+的去除效果。实验时Zn2+的初始浓度控制在500 mg/L,温度为25 ℃,pH值控制在4.0,控制H2S气体的体积分数分别为10%、20%、30%、40%和50%,反应时间1 h,溶液中Zn2+的去除率见图3。由图3中可以看出,H2S气体的体积分数对Zn2+的去除率影响不是特别大。当H2S气体的体积分数逐渐增加时,溶液中Zn2+的去除率也逐渐升高,当H2S的体积分数达到20%以上时,Zn2+去除率基本保持平衡。因此,综合经济成本可控制H2S的最佳体积分数为20%。

图1 含锌废水处理工艺实验装置示意图
Fig. 1 Schematic diagram of experimental apparatus for zinc-containing wastewater treatment

图2 pH值对锌脱除率的影响
Fig.2 Effect of pH value on removal rate of Zn2+

图3 H2S分压对锌去除率的影响
Fig. 3 Effect of volume fraction of H2S partial pressure on removal rate of Zn2+
2.1.3 反应温度对Zn2+去除效果的影响
控制pH值为4、H2S分压为20%,在25~65 ℃的温度范围内进行实验,探究反应温度对Zn2+去除率的影响,其结果见图4。由图4可看出,随着温度的升高,Zn2+的去除率出现了小幅度的增长,当温度达到65 ℃时,部分沉淀出现了反溶现象,去除率开始下降。总体来讲,反应温度对锌去除效果影响不大,废水在室温下即能达到很好的处理效果。
2.1.4 反应时间对Zn2+去除效果的影响
反应时间对锌去除效果的影响如图5所示。由图5可看出,开始反应至20 min,Zn2+的去除率迅速升高,达到97%;随着时间的延长,溶液中Zn2+的去除率呈缓慢上升趋势,50 min时,效果最佳,其去除率为98.62%,之后,溶液中的Zn2+浓度基本保持平衡,约为6.92 mg/L。

图4 反应温度对Zn2+去除率的影响
Fig. 4 Effect of reaction temperature on removal rate of Zn2+
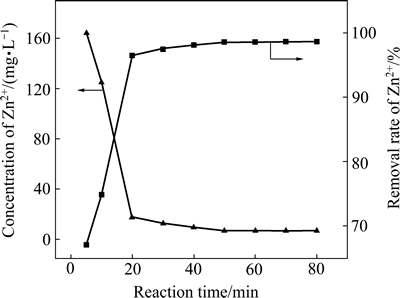
图5 反应时间对锌去除率的影响
Fig. 5 Effect of reaction time on removal rate of Zn2+

图6 初始Zn2+浓度对Zn2+去除率的影响
Fig. 6 Effect of initial concentrations of Zn2+ on removal rate of Zn2+
2.1.5 初始浓度对Zn2+去除效果的影响
当Zn2+的初始浓度改变时,会对其去除效果带来明显影响。如图6所示,可见H2S气体对低浓度(浓度低于1 g/L)的Zn2+溶液去除效果较好,去除率保持在99%左右。当初始浓度增加到1 g/L以上时,其去除率降至70%左右。Zn2+浓度升高,离子间距减小,随着反应进行,生成的沉渣明显会有所增加,这些沉淀分散到溶液中,使H2S气体与ZnSO4溶液的接触面积大幅减小,严重阻碍了气液硫化反应的进行,从而降低了溶液中锌的沉淀能力。另一方面,Zn2+浓度的升高加速了H2S气体由气相进入液相的扩散速度,气相中H2S气体的分压降低,根据式(1)可判断出溶液中Zn2+的平衡浓度增加,脱除效果变差。
H2S+Zn2+→ZnS↓+2H+ (1)
 (2)
(2)
2.1.6 五因素五水平正交试验
1) 正交试验设计
根据单因素试验的结果,选择pH值、反应时间、反应温度、体积分数及Zn2+浓度作为主要影响因素,每个因素取5个水平,设计五因素五水平正交试验,不考虑因素间的交互作用,应选用L25(55)安排试验,共进行25次试验,对正交试验结果进行极差分析,以分析同一因素不同水平对试验结果的影响情况,并确定最佳方案。正交试验除锌结果如表1所示。
1) 由表1中的极差计算结果可知:比较各因素的极差值R,在影响锌去除效果的5个因素中,pH值是最主要的影响因素。其他因素对脱锌的影响程度由大到小依次为H2S气体的体积分数、锌溶液的初始浓度、温度和反应时间。
2) 比较25次的试验结果得出,11号、15号、19号及22号试验条件处理效果都较好,Zn2+去除率高达99%以上,从运行成本及操作条件方面考虑,确定最佳试验条件为A3B5C2D4E1。
2.1.7 冶炼烟气洗涤污酸实际废水除锌效果
根据单因素实验及正交实验所获得的最优除锌条件,对来自内蒙古(原水样A)和福建(原水样B)的两个冶炼企业实际废水水样进行气液强化硫化除锌研究,先通过硫化预处理去除水样中铜砷等其他重金属,保留高浓度的含锌废水作为实验水样,其原水水质、预处理后水质及硫化除锌后出水水质结果如表2所列。
由表2可以看出,经预处理后含高浓度锌元素的实际废水,气液硫化除锌分别可达到99.79%和99.49%的去除率,证明该工艺对冶炼烟气洗涤污酸实际废水的除锌效果显著。
2.2 机理分析
2.2.1 废水中Zn2+分离的热力学分析
从正交试验极差分析结果可以看出,最佳脱锌工艺参数为:Zn2+的初始浓度为100 mg/L,溶液pH值为3,反应时间为80 min,温度为35 ℃,H2S气体的体积分数为30%,此条件下Zn2+的脱除率高达99.54%。此时溶液中Zn2+的残余浓度为0.46 mg/L,即7.08 μmol/L。
由式(3)可求得S2-的平衡浓度,即
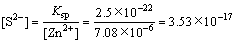 mol/L (3)
mol/L (3)
对于H2S,
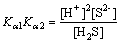 (4)
(4)
式中: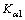 、
、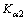 分别为H2S的一级、二级电离常数。
分别为H2S的一级、二级电离常数。
结合式(3)及式(4),得到式(5):
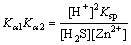 (5)
(5)
当反应达到平衡时,体系中的Zn2+离子不能再与S2-结合生成ZnS沉淀,溶液中的H2S气体基本趋于饱和,其浓度为0.1 mol/L。
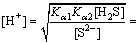

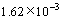 mol/L (6)
mol/L (6)
由此,可得溶液中的pH值:
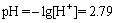 (7)
(7)
式(7)表明,只要溶液pH值达到2.79时,溶液中的Zn2+就可以几乎全部转化为ZnS沉淀。理论计算结果与试验最佳pH值(pH=3)基本一致。
2.2.2 气液反应动力学分析
Zn2+在溶液中与H2S气体发生连续接触气液反应,采用稳态近似法分析其动力学过程。
表1 正交设计试验结果
Table 1 Orthogonal experiment results
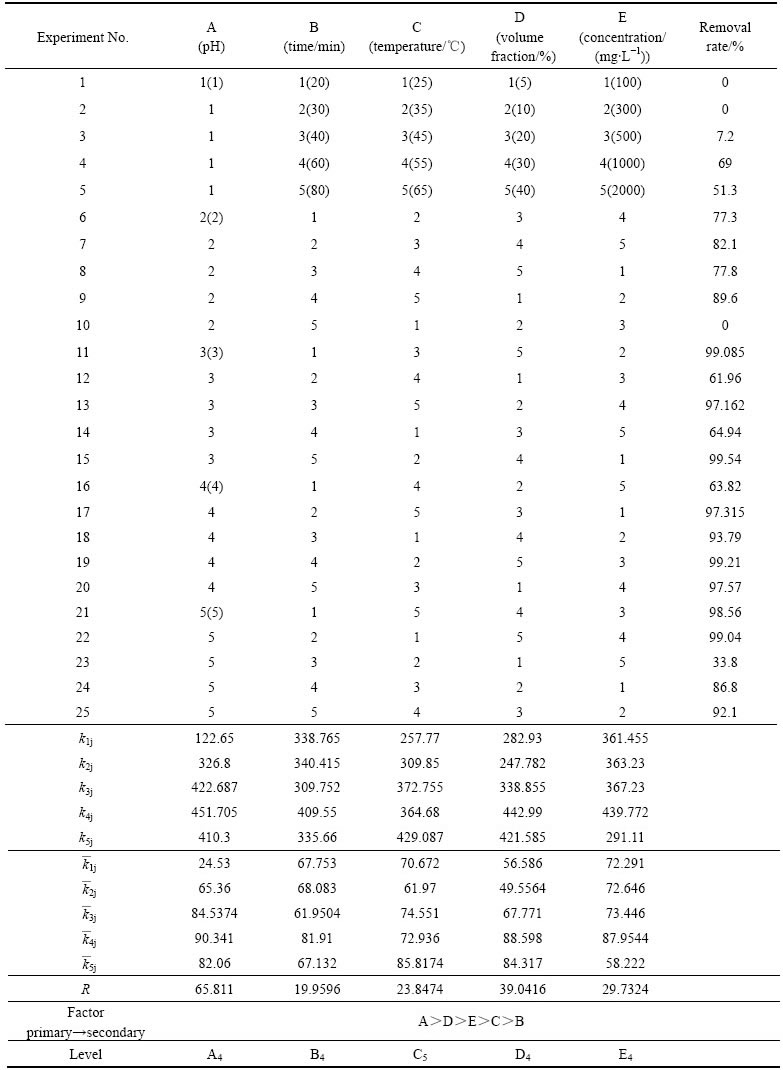
表2 冶炼污酸废水除锌效果
Table 2 Removal rate of zinc of smelting acidic wastewater
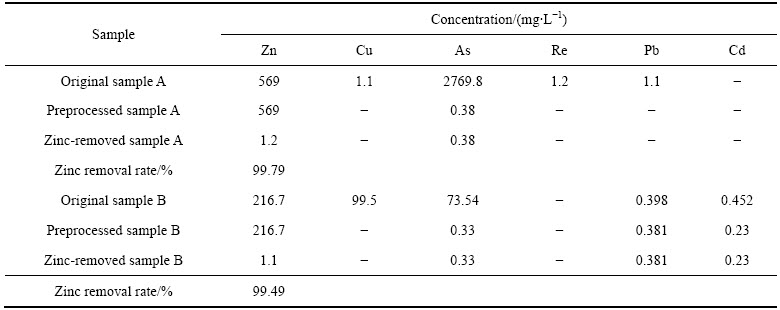
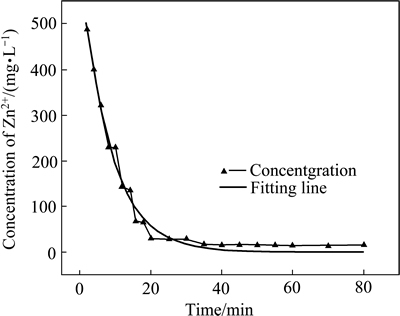
图7 Zn2+残余浓度随反应时间的变化规律
Fig. 7 Varying pattern of Zn2+ remaining concentration with reaction time
脱锌反应为准一级动力学反应。于是有
 (8)
(8)
在25 ℃条件下,调节溶液pH为4.0,锌初始浓度为500 mg/L,向溶液中通入体积分数为20%的H2S气体,溶液中残余Zn2+浓度随时间变化规律如图7所示。
对所得曲线进行指数模拟,模拟方程与式(8)基本一致:
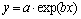 (9)
(9)
结果如下:a=633.55402,b=-0.11931。相关系数R2=0.98619。可见,该反应为准一级动力学,反应速率常数k=0.11931 s-1。根据准一级动力学反应的特性可知,为了获得较快的反应速率,可以提高初始浓度。根据式(8)和(9),可计算除锌反应的半衰期和反应达到90%时所需要的时间,对实际废水除锌工艺的反应时间判定具有指导意义。
2.2.3 锌沉渣分析与表征
1) 锌沉渣的表面形貌分析(SEM)
将反应得到的沉渣进行电镜扫描,其表面形貌如图8所示。沉渣为白色晶体物质,结合能谱分析可判断出其成分为ZnS。另外,该晶体颗粒粒径极小,为亚微米数量级。放大3000倍及10000倍后的照片表明,大量ZnS颗粒团聚絮凝成致密、较规则的圆球状。从电镜图分析可知,硫化法生成的硫化锌沉淀粒径极小,沉降与过滤性能较差,不利于该工艺的推广应用,需要通过调节搅拌速率、加入絮凝剂或加入硫化锌晶种诱导其细小颗粒的晶核成长等方法,获得大颗粒的硫化锌渣以便于后续的沉降过滤操作。
2) 锌沉渣的能谱分析(EDX)
为定性分析锌渣中各种元素组成,对残渣进行能谱分析。其结果见图9。从图9中可以看出,沉渣中仅含有S和Zn两种元素,由两种元素的质量分数可以计算出其Zn和S摩尔比为0.869,近似为1,可见残渣主要成分为ZnS。同时,沉渣中锌的质量分数达63.84%。该品位的硫化锌渣可直接作为锌精矿返回火法冶炼系统,回收锌元素,实现资源的再生。
3) 锌沉渣的XRD物相

图8 锌沉渣的SEM像
Fig. 8 SEM images of zinc precipitate

图9 锌沉渣的SEM像及EDX能谱分析图
Fig. 9 SEM image(a) and EDX spectrum(b) of zinc precipitate
对不同H2S气体体积分数、反应温度、锌初始浓度试验后得到的沉渣进行X射线衍射分析,结果如图10所示。由分析结果可知,反应条件虽然改变,但净化得到的沉渣中的主要成分均为ZnS晶体[27],其结果与EDX得到的结论相吻合,且净化率高的条件下(H2S气体体积分数为40%,温度45 ℃,锌初始浓度为100 mg/L)得到的沉渣XRD峰值相对较高,可见其结晶度相对较高。
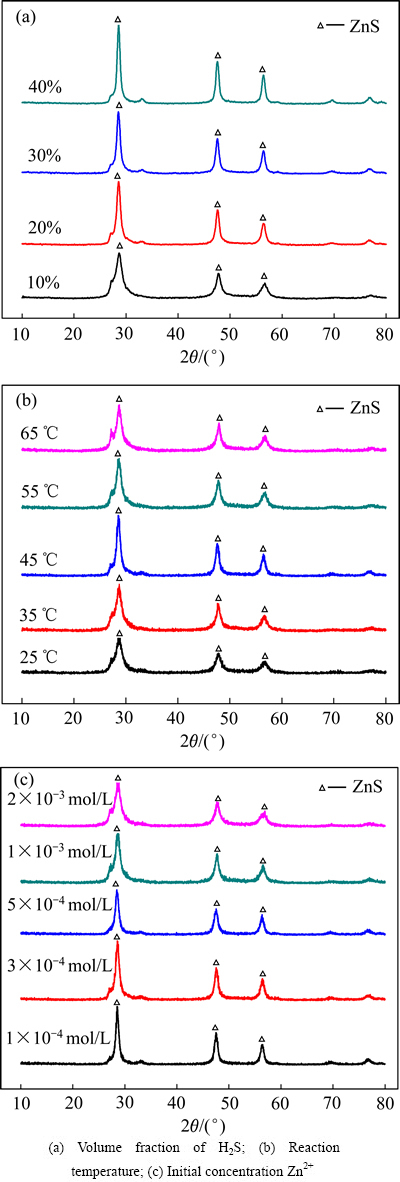
图10 不同条件下得到锌沉渣的XRD谱
Fig. 10 XRD patterns of zinc precipitations at different conditions
3 结论
1) H2S气液强化硫化除去污酸废水中的锌工艺简单,处理效果好,且实现了锌的回收与资源化。最佳工艺条件如下:溶液pH值为3、反应时间为80 min、温度为35 ℃、H2S气体的体积分数为30%、模拟废水初始浓度为100 mg/L时,Zn2+脱除率为99.54%;实际废水Zn2+浓度为569 mg/L和216.7 mg/L时,锌去除率分别达到99.79%和99.49%。
2) 废水中Zn2+分离的热力学计算表明溶液pH值达到2.79时,溶液中的Zn2+几乎全部转化为ZnS沉淀。理论计算结果与试验最佳pH值一致。
3) 溶液反应动力学研究表明Zn2+的硫化为准一级动力学反应,反应速率常数k=0.11931 s-1。
4) 锌沉渣的SEM、EDS、XRD分析表明,锌沉渣为白色晶体物质,颗粒为亚微米数量级,团聚絮凝成致密、较规则的圆球状,成分为ZnS。沉渣中锌的质量分数达63.84%,实现了Zn2+的富集,有利于锌的回收利用。
REFERENCES
[1] 梅 婷. 污酸废水的处理[J]. 湖南有色金属, 2015, 31(1): 68-70.
MEI Ting. Treatment of waste acid water[J]. Hunan Nonferrous Metals, 2015, 31(1): 68-70.
[2] 王庆伟. 铅锌冶炼烟气洗涤含汞污酸生物制剂法处理新工艺研究[D]. 长沙: 中南大学,2011.
WANG Qing-wei. New technology for treatment of mercury- containing acidic wastewater from gas washing process in lead and zinc smelting by biologies[D]. Changsha: Central South University, 2011.
[3] 刘玉强, 刘世和. 镍冶炼烟气制酸的酸性废水减排及再利用[J]. 硫酸工业, 2008(1): 28-32.
LIU Yu-qiang, LIU Shi-he. Reduction and recycle of acidic waste water from sulpheric acid plant based on nickel smelting off-gas[J]. Sulpheric Acid Industry, 2008(1): 28-32.
[4] 郭智生, 黄卫华. 有色冶炼烟气制酸技术的现状及发展趋势[J]. 硫酸工业, 2007(2): 13-21.
GUO Zhi-sheng, HUANG Wei-hua. Present situation development prospect of metallurgy acid production technologies[J]. Sulpheric Acid Industry, 2007(2): 13-21.
[5] 陈南洋. 我国有色冶炼低浓度二氧化硫烟气制酸技术进展[J]. 硫酸工业, 2005, 2(2): 15-18.
CHEN Nan-yang. Technical progress in China’s sulpheric acid production with low-SO2 metallurgy gases[J]. Sulpheric Acid Industry, 2005, 2(2): 15-18.
[6] 琚成新, 宫玉川, 张 斌. 钼精矿焙烧烟气制酸工艺探索[J]. 中国钼业, 2008, 32(2): 5-8.
JU Cheng-xin, GONG Yu-chuan, ZHANG Bin. The exploration of gas producing acid technics in the process of molybdenum concentrate roasting[J]. China Molybdenum Industry, 2008, 32(2): 5-8.
[7] 李二平, 闵小波, 舒余德, 杨少辉, 柴立元. 内聚营养源SRB污泥固定化处理含锌及硫酸根废水[J]. 中南大学学报(自然科学版), 2011, 42(6): 1522-1527.
LI Er-ping, MIN Xiao-bo, SHU Yu-de, YANG Shao-hui, CHAI Li-yuan. Treatment of wastewater containing zinc and sulfate ion in immobilized beads of SRB sludge with inner cohesive carbon source[J]. Journal of Central South University (Science and Technology), 2011, 42(6): 1522-1527.
[8] 张秀兰, 栗印环, 张明歌, 赵华敏. 酸和微波改性沸石对锌离子的吸附及动力学研究[J]. 矿产综合利用, 2015(1): 69-72.
ZHANG Xiu-lan, LI Yin-huan, ZHANG Ming-ge, ZHAO Hua-min. Study on kinetics and adsorption onto zeolite modified by microwave and HCl[J]. Multipurpose Utilization of Mineral Resources, 2015(1): 69-72.
[9] 王亚飞, 傅海燕, 黄国和, 柴 天, 高攀峰, 许鹏成, 王进羽. 固定化小球藻与活性污泥的共生系统处理含锌废水[J]. 环境工程学报, 2014, 8(4): 1379-1384.
WANG Ya-fei, FU Hai-yan, HUANG Guo-he, CHAI Tian, GAO Pan-feng, XU Peng-cheng, WANG Jin-yu. Treatment of zinc-containing wastewater by immobilized Chlorella-activated sludge symbiotic system[J]. Chinese Journal of Environmental Engineering, 2014, 8(4): 1379-1384.
[10] GHOSH P, SAMANTA A N, RAY S. Reduction of COD and removal of Zn2+ from rayon industry wastewater by combined electro-Fenton treatment and chemical precipitation[J]. Desalination, 2011, 266(1): 213-217.
[11] HAFSHEJANI L D, NASAB S B, GHOLAMI R M, MORADZADEHA M, IZADPANAHA Z, HAFSHEJANIC S B, BHATNAGAR A. Removal of zinc and lead from aqueous solution by nanostructured cedar leaf ash as biosorbent[J]. Journal of Molecular Liquids, 2015, 211: 448-456.
[12] JIA Chun-yun, WEI De-zhou, LIU Wen-gang, HAN Cong, GAO Shu-ling, WANG Yu-juan. Selective adsorption of bacteria on sulfide minerals surface[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(5): 1247-1252.
[13] DERMENTZIS K, CHRISTOFORIDIS A, VALSAMIDOU E. Removal of nickel, copper, zinc and chromium from synthetic and industrial wastewater by electrocoagulation[J]. International Journal of Environmental Sciences, 2011, 1(5): 697-710.
[14] AL AJI B, YAVUZ Y, KOPARAL A S. Electrocoagulation of heavy metals containing model wastewater using monopolar iron electrodes[J]. Separation and Purification Technology, 2012, 86: 248-254.
[15] FU Feng-lian, WANG Qi. Removal of heavy metal ions from wastewaters: a review[J]. Journal of Environmental Management, 2011, 92(3): 407-418.
[16] HU Jiu-gang, CHEN Qi-yuan, HU Hui-ping, YIN Zhou-lan. Synergistic extraction of zinc from ammoniacal solutions using β-diketone mixed with CYANEX923 or LIX84I[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(5): 1217-1223.
[17] QING Wen-qing, LAN Zhuo-yue, LI Wei-zhong, QIU Guan-zhou. Selective extraction of zinc from sulfate leach solution of zinc ore[J]. Transactions of Nonferrous Metals Society of China, 2003, 13(6): 1435-1439.
[18] ZOU Lian-hua, XUE Yu-lan. Sulfide precipitation flotation for treatment of acidic mine waste water[J]. Transactions of Nonferrous Metals Society of China, 2000, 10(S1): s106-s109.
[19] 马小乐, 高 飞. 浅谈有色冶炼厂污酸及酸性废水处理的新工艺和新技术[J]. 有色冶金节能, 2014, 30(2): 42-45.
MA Xiao-le, GAO Fei. Discussion on new process and technique for waste acid and acid waste water treatment in nonferrous smelter[J]. Energy Saving of Non-Ferrous, 2014, 30(2): 42-45.
[20] TOKUDA H, KUCHAR D, MIHARA N, KUBOTA M, MATSUDA H, FUKUTA T. Study on reaction kinetics and selective precipitation of Cu, Zn, Ni and Sn with H2S in single-metal and multi-metal systems[J]. Chemosphere, 2008, 9(73): 1448-1452.
[21] KONDO H, FUJITA T, KUCHAR D, FUKUTA T, MATSUDA H, KUBOTA M, YAGISHITA K. Separation of metal sulfides from plating wastewater containing Cu, Zn and Ni by selective sulfuration with hydrogen sulfide[J]. Journal of the Surface Finishing Society of Japan, 2006, 57(12): 901-906.
[22] FUKUTA T, KOJIMA Y, HITOKI M, SETO F, YAGISHITA K. Sulfuration behaviors of Cu, Zn and Ni in electroplating wastewater and filtration characteristics of produced metal sulfides[J]. Journal of the Surface Finishing Society of Japan, 2006, 57(1): 77-83.
[23] FUKUTA T, MATSUDA H, KOJIMA Y, SETO F, YAGISHITA K. Selective separation of Cu, Zn and Ni by sulfuration of electroplating wastewater[J]. Journal of the Surface Finishing Society of Japan, 2005, 56(10): 607-611.
[24] LUTHER III G W, THEBERGE S, RICKARD D T. Evidence for aqueous clusters as intermediates during zinc sulfide formation[J]. Geochimica et Cosmochimica Acta, 1999, 63(19/20): 3159-3169.
[25] GROOTSCHOLTEN T, KEESMAN K, LENS P. Modelling and on-line estimation of zinc sulphide precipitation in a continuously stirred tank reactor[J]. Separation and Purification Technology, 2008, 63: 654-660.
[26] ESPOSITO G, VEEKEN A, WEIJMA J, LENS P N L. Use of biogenic sulfide for ZnS precipitation[J]. Separation and Purification Technology, 2006, 51: 31-39.
[27] MU Wang-zhong, ZHANG Ting-an, LIU Yan, GU Yan, DOU Zhi-he,  Guo-zhi, BAO Li, ZHANG Wei-guang. E-pH diagram of ZnS-H2O system during high pressure leaching of zinc sulfide[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(10): 2012-2019.
Guo-zhi, BAO Li, ZHANG Wei-guang. E-pH diagram of ZnS-H2O system during high pressure leaching of zinc sulfide[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(10): 2012-2019.
Technique, thermodynamics and kinetics of zinc removal from acidic wastewater via gas-liquid sulfidation reaction
JIANG Guo-min1, 2, PENG Bin1, 2, CHAI Li-yuan1, 2, WANG Qing-wei1, 2, WANG Yun-yan1, 2, SHI Mei-qing1, 2
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
2. Chinese National Engineering Research Center for Control and Treatment of Heavy Metal Pollution, Central South University, Changsha 410083, China)
Abstract: Sulfide precipitation via gas-liquid reaction was used to treat the simulated acidic wastewater containing zinc ion. The effects of pH value, H2S volume fraction, temperature, reaction time, initial concentration of Zn2+ on the removal rate of zinc were investigated. The orthogonal experiments with five factors and five levels were designed based on the results of single factor experiments, which was applied to the treatment of acidic wastewater generated from smelting flue gas washing. The thermodynamic of Zn2+ sulfidation and kinetics of gas-liquid reaction were studied. And then, the sediments were analyzed and characterized. The results show that the optimum operation conditions are as follows pH value of 3, the time for reaction of 80 min, the temperature controlled at 25℃, H2S volume fraction of 30%, and the initial concentration of Zn2+ of 100 mg/L. The removal rate of Zn2+ can reach 99.54% under the optimum operation condition. The sediments mainly consists of ZnS with zinc content of 63.84%. When concentrations of Zn2+ in acidic wastewater are 569 and 216.7 mg/L, the removal rates of Zn2+ are 99.79% and 99.49%, respectively.
Key words: acidic wastewater; zinc removal; gas-liquid sulfidation; thermodynamic
Foundation item: Projects(51304251, 51504299) supported by the National Natural Science Foundation of China; Project(201509050) supported by Special Program on Environmental Protection for Public Welfare, China
Received date: 2016-01-04; Accepted date: 2016-06-28
Corresponding author: CHAI Li-yuan; Tel: +86-731-88836921; Fax: +86-731-88710171; E-mail: liyuan.chai@ yahoo.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51304251,51504299);国家公益性行业科研专项(201509050)
收稿日期:2016-01-04;修订日期:2016-06-28
通信作者:柴立元,教授,博士;电话:0731-88836921;传真:0731-88710171;E-mail: liyuan.chai@yahoo.com
摘 要:采用气液硫化法对模拟含锌污酸废水进行处理,考察pH值、H2S气体分压、反应温度、反应时间、Zn2+初始浓度等条件对Zn2+去除效果的影响。在单因素实验的基础上进行五因素五水平的正交实验,并对采用该工艺处理冶炼烟气洗涤污酸废水效果进行验证。研究Zn2+硫化分离的热力学,及其气液反应动力学过程,并对锌沉渣进行分析与表征。结果表明:在最佳工艺条件为模拟溶液初始pH值3、反应时间80 min、温度35 ℃、H2S气体的体积分数为30%、Zn2+初始浓度100 mg/L时,Zn2+脱除率为99.54%,沉渣主要物相为ZnS,锌的质量分数达63.84%;实际污酸废水锌浓度为569和216.7 mg/L时,去除率分别达到99.79%和99.49%。
[1] 梅 婷. 污酸废水的处理[J]. 湖南有色金属, 2015, 31(1): 68-70.
MEI Ting. Treatment of waste acid water[J]. Hunan Nonferrous Metals, 2015, 31(1): 68-70.
[2] 王庆伟. 铅锌冶炼烟气洗涤含汞污酸生物制剂法处理新工艺研究[D]. 长沙: 中南大学,2011.
[3] 刘玉强, 刘世和. 镍冶炼烟气制酸的酸性废水减排及再利用[J]. 硫酸工业, 2008(1): 28-32.
[4] 郭智生, 黄卫华. 有色冶炼烟气制酸技术的现状及发展趋势[J]. 硫酸工业, 2007(2): 13-21.
[5] 陈南洋. 我国有色冶炼低浓度二氧化硫烟气制酸技术进展[J]. 硫酸工业, 2005, 2(2): 15-18.
[6] 琚成新, 宫玉川, 张 斌. 钼精矿焙烧烟气制酸工艺探索[J]. 中国钼业, 2008, 32(2): 5-8.
[7] 李二平, 闵小波, 舒余德, 杨少辉, 柴立元. 内聚营养源SRB污泥固定化处理含锌及硫酸根废水[J]. 中南大学学报(自然科学版), 2011, 42(6): 1522-1527.
[8] 张秀兰, 栗印环, 张明歌, 赵华敏. 酸和微波改性沸石对锌离子的吸附及动力学研究[J]. 矿产综合利用, 2015(1): 69-72.
[9] 王亚飞, 傅海燕, 黄国和, 柴 天, 高攀峰, 许鹏成, 王进羽. 固定化小球藻与活性污泥的共生系统处理含锌废水[J]. 环境工程学报, 2014, 8(4): 1379-1384.
[19] 马小乐, 高 飞. 浅谈有色冶炼厂污酸及酸性废水处理的新工艺和新技术[J]. 有色冶金节能, 2014, 30(2): 42-45.


