文章编号:1004-0609(2015)08-2218-08
难处理含硫金精矿生物预氧化方法的强化工艺
刘新星1, 2,王国华1, 2,谢建平1, 2,李寿朋1, 2,郭玉洁1, 2,潘昊旻1, 2
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 生物冶金教育部重点实验室,长沙410083)
摘 要:
难处理含硫金精矿的生物预氧化方法前景广阔,但是由于生物预氧化反应速度慢、氧化周期长等因素的存在,严重影响该法在实际应用中的推广。因此,研究生物预氧化技术的强化方法已成为推动该技术发展的关键因素。为达到强化目的,总结了3个方面的强化策略:首先,分析了微生物群落的组成优化,通过组合氧化能力更强的微生物群落来达到强化目的;其次,控制溶液的化学条件,以保证微生物的代谢和功能发挥;最后,对预氧化工艺进行改进,构建更高效的生化反应条件。通过这些方法,难处理含硫金精矿生物预氧化效果可望得到有效强化。
关键词:
生物预氧化;难处理含硫金精矿;微生物群落;化学条件控制;两步氧化法;
中图分类号:Q939 文献标志码:A
Approaches to intensify bio-oxidation of refractory gold-bearing sulfide concentrates
LIU Xin-xing1, 2, WANG Guo-hua1, 2, XIE Jian-ping1, 2, LI Shou-peng1, 2, GUO Yu-jie1, 2, PAN Hao-min1, 2
(1. School of Mineral Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Biological Metallurgy, Ministry of Education, Central South University, Changsha 410083, China)
Abstract: Growing demand of gold makes it essential to recover gold from refractory gold-bearing sulfide concentrates. Bio-oxidation method of refractory gold-bearing concentrates is a promising technology, but the widely utilization of bio-oxidation in the gold pre-treatment industry is limited by the low reaction rate and long oxidation cycle. Therefore, the intensifying approaches become the key factor to improve this technology. To achieve the intensification goal, three strategies were summarized in this work. Firstly, optimization of the microbial community was analyzed with the purpose of constructing more promising mixed cultures. Secondly, the chemical conditions were controlled to enhance the metabolism and function of the microorganisms. Thirdly, new processing approaches were improved to create more favorable conditions for biological and chemical reactions. When the bio-oxidation process is subjected to these strengthening strategies, the bio-oxidation efficiency will be elevated significantly.
Key words: bio-oxidation; refractory gold-bearing sulfide concentrate; microbial community; chemical condition control; two-step oxidation approach
在难处理含硫金精矿中,金的粒度较小,呈显微状和次显微状,主要以包裹体形式赋存于硫化矿物(黄铁矿和毒砂)中,硫化物的包裹阻挡了氰化物与金的接触,因此,采用常规的氰化法直接处理金的浸出率很低[1-4]。为了消除或者减少硫化物的阻碍作用,金精矿的预氧化得以兴起,研究大多集中在加压氧化、化学氧化、焙烧和生物氧化等工艺上[5-6]。焙烧法技术成熟,脱硫效果较好,但是在焙烧过程中会产生SO2,造成环境污染。而加压氧化与化学氧化具有氧化效果好,无污染的优点,但是该方法对反应器要求较高,操作条件严格,因此具有投资大、生产成本高的缺点。与其他氧化方法相比,生物预氧化具有费用低、环境友好、金回收率高等优点[7-10],成为世界各国研究和应用的热点。1986年,全球首个生物预氧化厂在南非Fairview矿投产,而后生物预氧化技术在澳大利亚、巴西、加纳、中国、乌兹别克斯坦、俄罗斯等国家相继投入使用,其技术前景广阔[11]。
但是,与其他氧化方法相比,生物预氧化周期较长,一般需要4~6 d的时间[12],而且长时间的搅拌和充气能耗较大,严重影响了该法的实际应用,截至2013年世界黄金总产量中只有5%是生物预氧化工艺生产的[13]。随着易处理金矿的贫化,现在全球约2/3以上金矿属于含硫难处理金矿[11, 14-15],充分利用生物预氧化的优势处理这部分矿石,提高生物预氧化速率、缩短预氧化周期,将极大推进黄金行业的发展。
生物氧化提金技术利用微生物将金精矿中的载金硫化物氧化分解,使包裹金暴露出来,易于金的氰化浸出,从而提高了提金率。微生物是预氧化过程的主要参与者,保证混合菌的高效代谢活性对提高金精矿预氧化效率有重大意义[11, 13]。生物预氧化体系由微生物、金精矿、溶液三相组成,含硫金精矿生物预氧化强化方法的研究应从以下3个方面展开:1) 高效混合菌的构建。在生物预氧化过程中,通过多种微生物的协同作用才能高效地完成物质的转化,同时,增强单类种群的代谢活性,从而提高生物氧化效率[16]。2) 溶液化学条件控制。金精矿的预氧化是一个复杂的过程,微生物代谢活性会受到酸度、温度、溶氧、矿浆浓度等因素的影响。通过对反应体系的溶液条件进行控制,可以保证微生物在最佳代谢条件下发挥其活性[17]。3) 优化生物氧化工艺。合适的生物氧化工艺可以节约操作成本,并且为微生物的代谢活性及化学反应提供最适宜的条件[18]。
近年来,环境保护与黄金产业的矛盾日趋尖锐,生物预氧化成为解决这一矛盾的关键技术。因此,非常有必要对该技术的研究进展进行系统的分析与总结。本文作者从微生物代谢活性的角度对生物预氧化的强化方法进行归类总结。在综合考虑预氧化体系的多方面影响因素的基础上,介绍优化微生物群落组成、溶液化学条件和生产工艺等强化手段的研究情况。最后探讨生物预氧化技术的发展方向。
1 生物预氧化原理
生物预氧化是一个复杂的过程,在预氧化体系中化学反应、生物氧化、原电池反应同时进行。该过程利用微生物的代谢活性把溶液中的Fe2+氧化为Fe3+,把元素硫或者其他的还原性硫化物氧化为硫酸,反应方程式如式(1)和(2)所示:
4Fe2++O2+4H+→4Fe3++2H2O (1)
2S0+3O2+2H2O→4H++2SO42- (2)
通过微生物氧化作用产生的Fe3+和H+作用于硫化矿的共价键,导致硫化物的分解,释放出Fe2+,接着又被微生物氧化为Fe3+,这样就构成了一个氧化还原的浸出循环体系,促使预氧化反应的持续进行。
2 生物预氧化强化方法
2.1 微生物群落组成优化
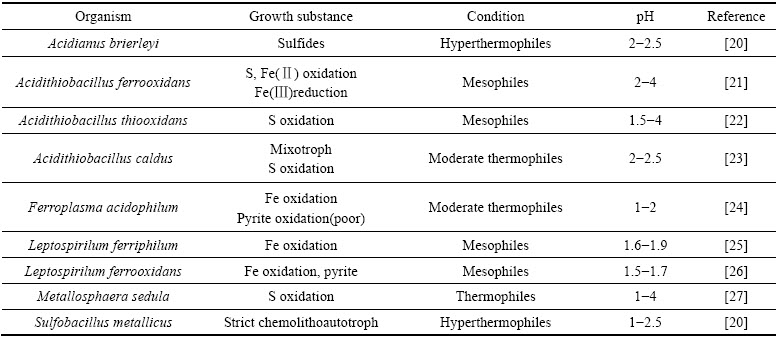
微生物是生物预氧化过程的主要参与者,优良混合菌的筛选与构建是生物预氧化工业化应用的关键。浸矿微生物种类繁多,生物预氧化过程中常用的嗜酸微生物如表1所列。按照营养类型可划分为自养菌与异养菌,其中自养菌又分为铁氧化菌与硫氧化菌;按照微生物的来源可以分为土著菌与外来菌;充分利用各种微生物的代谢活性,可以完成单类种群不能完成的物质转化,同时增强各自的代谢活性,进而提高预氧化效率[19]。根据微生物的代谢活性构建高效的浸矿混合菌来提高预氧化效率一直是预氧化研究的热点。
2.1.1 亚铁氧化菌与硫氧化菌的协同
生物预氧化过程中最主要的微生物是亚铁氧化菌及硫氧化菌,它们通过氧化Fe2+和S0获得能量。亚铁氧化菌把Fe2+氧化为Fe3+,Fe3+在酸性氧化体系中作为强氧化剂氧化多种硫化矿。硫氧化菌则与预氧化过程中产生的单质硫或者还原性硫化物发生反应,从而减少氰化浸出时氰化物的消耗,降低生产成本。
实验研究表明混合菌的氧化效率要高于单一纯菌。中等高温混合菌(Leptospirilum ferriphilum, Acidithiobacillus caldus, Acidithiobacillus ferrooxidans)对黄铁矿的氧化速度远远高于纯菌的,说明通过亚铁氧化菌与硫氧化菌的协同作用可以极大提高生物预氧化速率[16]。通过分子生物学方法对高速运作的BIOX氧化槽中微生物组成进行分析,发现在室温条件下主要微生物组成为Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans和Leptospirilum ferrooxidans;当氧化槽的温度升高到42~45 ℃,主要微生物组成为Acidithiobacillus caldus和Leptospirilum ferriphilum。这些结果都说明高效运行的生物预氧化体系中都有亚铁氧化菌与硫氧化菌的协同作用。
表1 生物预氧化过程中的主要铁硫代谢微生物
Table 1 Iron and sulfur oxidizing microorganisms used in bio-oxidation process
2.1.2 自养菌与异养菌的协同作用
自养菌与异养菌的协同作用主要体现在消除代谢物的抑制作用及提高相关基因的表达水平方面。预氧化体系中微生物包括异养菌、兼性异养菌、自养菌,通过自养菌与异养菌的相互影响及促进可以有效提高金精矿的氧化效率。一方面,由于浮选药剂的存在及微生物代谢产物的积累和自身的衰亡,都会产生较多的有机物,从而抑制自养菌的活性,降低预氧化效果,异养菌(如Alicyclobacillus spp., Ferroplasma spp., Ferrimicrobium acidiphilum等)的加入则可以有效降低氧化体系的有机物浓度,提高自养菌的活性[28-29]。另一方面,硫代硫酸盐是黄铁矿氧化过程中的中间产物,对异养菌Acidiphilium cryptum有抑制作用,Acidithiobacillus ferrooxidans可以有效氧化各种形态硫,可以减轻硫代硫酸盐对异养菌Acidiphilium cryptum的影响。
从转录水平看,异养菌的存在还可以提高自养菌某些基因的表达量,进而提高主要浸矿菌的代谢活性。在异养菌Acidiphilium acidophilum对自养菌Acidithiobacillus ferrooxidans的共培养体系中,自养菌Acidithiobacillus ferrooxidans的指数生长期延长2 d,细菌浓度比纯培养时提高5倍。通过基因表达分析发现,在共培养体系中异养菌Acidiphilium acidophilum激活了自养菌Acidithiobacillus ferrooxidans的铁氧化与CO2固定基因,因此,极大促进了Acidithiobacillus ferrooxidans代谢活性[30]。
2.1.3 土著菌群与外来菌群的协同作用
为了获取高效氧化微生物菌群,土著菌群与外来人工搭配菌群的效果也日益引起人们的关注。土著菌群由于长期驯化,更具适应性。而人工搭配菌群则是人们按照生物预氧化的原理构建,可以更好地进行群落组成调控。比较两种混合菌的氧化效果发现,通过逐步驯化,人工搭配菌群的氧化效果逐步提高。但是,人工搭配菌群的生物预氧化效果还是不如土著菌群 的[31]。高效预氧化微生物的标准是微生物在氧化体系中能够保持高效的亚铁及硫化物的代谢活性,只有经过长期的驯化,微生物才能适应预氧化过程中的不利条件,充分发挥其代谢活性,最终达到较好的氧化效果。
鉴于人工搭配菌群的不足之处,有人研究了在土著菌群的基础上加入外来菌种对生物氧化的影响[32]。当Acidithiobacillus thiooxidans A01加入到原先土著混合菌群中时,生物预氧化效果提高了10.7%。功能基因分析表明,当A01加入到该氧化体系中使硫氧化菌(Acidiphilium caldus)的硫氧化相关基因表达下调,而亚铁氧化菌(如Leptospirilum ferriphilum)的铁氧化基因表达量上调。另外,外来菌种的加入使得新菌群的铁、硫氧化基因表达总量上调,提高了黄铁矿的氧化效果。在土著菌群中加入外来菌种可能是一项有提高生物预氧化速度的有效方法,该方法既利用了土著菌群的高度适应性,同时,也通过外来菌种的加入弥补了原先混合菌代谢功能的不足。
2.2 溶液化学条件优化
为了维持微生物的代谢与活性,必须考虑生物预氧化过程中溶液化学条件对微生物的影响。预氧化体系的pH、CO2与有机物的浓度必须足够才能维持微生物的高效代谢活性。
2.2.1 pH的调控
难处理含硫金精矿中的主要硫化物为黄铁矿与毒砂,金被包裹在这些硫化物中。黄铁矿与毒砂的生物预氧化是一个产酸的过程[33],如式(3)和(4)所示:
FeS2+Fe2(SO4)3+3O2+2H2O→3FeSO4+2H2SO4 (3)
2FeAsS+Fe2(O4)3+6O2+4H2O→4FeSO4+H2SO4+2H3AsO4 (4)
在生物预氧化体系中,由于酸的产生及积累导致溶液pH下降,微生物的活性受到影响[34]。为了保持溶液的适宜酸度,生石灰或者石灰石常常作为中和试剂加入到预氧化体系中。
众所周知,如果氧化体系的pH维持在合适的范围可以提高生物预氧化效率。有研究表明,生石灰或者石灰岩的消耗在生物预氧化的成本投入中已跃居第二位[35]。利用工业生产的副产品如钢渣、电弧炉灰等作为中和试剂的替代品取得了较好的效果[35-36]。
然而,酸度的调节范围不能单纯以微生物生长的最佳酸度作为参考,在生物预氧化过程中溶液酸度对铁钒等沉淀的影响也是会对预氧化效果产生影响。QIN等[37]研究发现,尽管Sulfobacillus thermosulfidooxidans与Acidithiobacillus caldus混合菌的最佳生长酸度为1.5~1.6,但是进行含砷金精矿的生物预氧化时,溶液pH控制在1.0~1.2时,可以有效减少沉淀的生成,同时保持微生物的活性,因此更有利于预氧化的进行。
2.2.2 溶液CO2浓度的调控
为了保证生物预氧化过程的顺利进行,微生物必须获得足够的营养物质。溶液中CO2的溶解量是难处理含硫金精矿生物预氧化过程中一项重要指标[38]。作为生物生长的炭源,CO2在空气中的浓度只有0.03%(体积分数),远小于O2的浓度(21%)。尽管CO2在水中的溶解度要高于O2的,但是如果按照O2的需求量供给空气,微生物对CO2的需求将远远不足,微生物的代谢及功能将会受到抑制。增加充气量或者提高CO2的浓度都可以增加CO2的供给[39-40],但是提高CO2在通入气体中的浓度更加经济可行。这是因为当溶解氧的浓度达到其溶解度的50%时,O2的供给将足够微生物代谢使用。当通气量过大、溶解氧的浓度过高时,还有可能对微生物的生长产生抑制效应[40]。
由于金精矿碳酸盐含量的差异,不同金精矿需要通入的CO2的浓度也不尽相同。ACEVEDO等[38]指出当CO2的浓度增加到4%(体积分数)时,Acidithiobacillus ferrooxidans的比生长速率及铁、铜、砷的浸出都会增加。而GERICKE等[40]的研究发现,当CO2的浓度增加到0.25%(体积分数)时,炭源的抑制作用就会消除。如果金精矿中碳酸盐的含量超过2%,酸浸产生的CO2就可以满足微生物的炭源需求,在通气过程中只需考虑氧气的含量即可。如果没有碳酸盐类物质存在,可以选择碳酸盐类物质作为中和试剂,满足全部或者部分的CO2需求[34]。
2.2.3 有机营养物浓度的调控
大部分的中等高温微生物是混合营养型微生物,这些微生物需要利用有机碳作为其生长代谢所需炭 源[41]。单纯利用微生物自身的CO2固定酶系统不能满足这些微生物的代谢需求。因此,在预氧化体系中添加酵母提取物才能维持微生物的高效代谢。
MURAVYOV等[42]添加0.2%(质量分数)的酵母提取物到生物预氧化体系中,金精矿中黄铁矿和毒砂的氧化率可以分别从62%与92%提高到73.5%与95.1%,相应地,金的提取率也从71.7%提高到77.9%。由于单纯利用硫氧化微生物不能有效溶解黄铁矿与毒砂矿物,因此,提高亚铁氧化微生物的活性在黄铁矿与毒砂的分解过程意义重大。当酵母提取物加入到生物预氧化体系中,混合营养型亚铁氧化微生物的数量有所增加,Acidiplasma sp.成为预氧化体系中的主要微生物。由于亚铁氧化微生物的数量,最终预氧化体系的氧化效果得到增强。其他学者通过实验也得到了类似的结论[41, 43]。值得注意的是,有机物应当微量添加,以满足主要混合营养微生物的代谢需求即可,过多的有机物会对预氧化体系中的一些主要微生物的代谢活性产生抑制,影响预氧化的进行。
2.3 预氧化工艺优化
生物预氧化的强化,除了在不改变氧化工艺的前提下优化微生物群落组成、控制氧化体系化学环境之外,还可以进行强化的途径是改变生物预氧化工艺。近年来,两步氧化法等新工艺被应用于生物预氧化中。
2.3.1 中等高温-高温混合菌两步氧化法
在生物预氧化体系中,除了常用的中温菌及中等高温菌,极端嗜热微生物具有以下优点受到越来越多地关注[8, 44-45]:
1) 极度嗜热微生物的最适宜生长温度较高(65~80 ℃),因此,可以提高Fe3+对金精矿的化学浸出速度。
2) 高温操作条件降低冷却水的成本,提高经济效益。
3) 在高温条件下,硫化矿的氧化更加彻底,金的回收率提高。
4) 氧化渣中硫化物含量降低,氰化过程中产生的硫氰酸盐减少,氰化试剂消耗降低。
高温条件下,低溶氧率、高蒸发量以及极度嗜热微生物对剪切力的低耐受性都限制了其在工业方面的应用[46]。
为了充分利用高温菌的氧化特点,同时消除高温菌在预氧化过程中的不利因素,LINDSTROM等[47]提出了一种连续的两步法。在第一阶段,利用中等高温混合菌氧化金精矿,这样金精矿中的砷含量就会下降,同时,溶液中的三价砷也会被氧化剂氧化为五价砷。对于微生物而言,五价砷的毒性要小于三价砷,这样砷的毒性在第一阶段就会减少。除此之外,氧化体系中的矿浆浓度在经过第一阶段作用后也会下降,减小剪切力,溶液的传质效果也会得到改善。在第二阶段,预氧化体系利用极端嗜热菌Sulfobacillus metallicus作为氧化微生物。连续两步法作用后进行氰化浸出,氰化试剂的消耗明显降低,从原先的9.84 kg/t下降到1.98 kg/t。
现在的生物预氧化体系采用了连续搅拌氧化槽氧化难处理含硫金精矿,氧化体系溶液中Fe3+可以保持较高浓度(有的甚至达到50 g/L)。在如此高浓度的Fe3+溶液中,大部分的三价砷可以氧化为五价砷,只要操作得当,砷的毒性就可以大幅度降低。但是在高温条件下(>65 ℃),O2与CO2的溶解度下降,当矿浆浓度较高时,气体的传质会受到影响,微生物生长所需的O2与CO2的供给会受到影响。通过连续两步法的第一阶段,氧化体系处理的矿浆浓度下降,这可能成为未来利用极端嗜热混合菌的一种可行方法。
2.3.2 化学-生物两步氧化法
根据阿伦尼乌斯公式可知,提高温度可以提高酸性条件下硫化矿物与Fe3+反应的速率。在高温氧化环境下,只需几小时处理,金精矿即可达到很好的氧化效果[48]。但是该工艺条件苛刻、能耗高等缺点都制约了其发展。为了兼顾高温反应的高反应速度及生物氧化的低能耗、易操作的优点,FOMCHENKO等[49]提出了一种两步氧化法去强化生物预氧化过程。其中第一阶段为化学氧化阶段,利用微生物氧化产生的Fe3+溶液在高温条件下(80 ℃左右)氧化去除一部分容易氧化的硫化矿,然后第一步反应产生的氧化渣进入到生物预氧化的第二阶段,在微生物的作用下(39 ℃左右)Fe3+再次生成,同时,硫化物也最终被氧化。在两步法中,由于化学反应与生物反应分开进行,可以保证两种反应都可以在各自的最佳条件下进行,从而提高氧化速率。
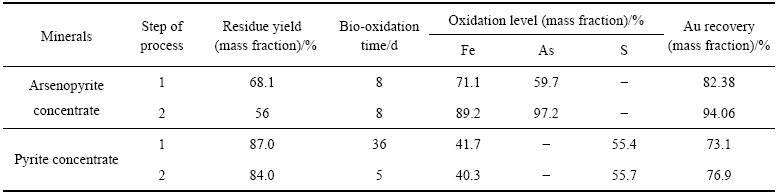
FOMCHENKO等[49]比较了两种浮选金精矿(黄铁矿载金与毒砂载金金精矿)的常规预氧化与两步法的氧化效果。其中黄铁矿载金金精矿矿物组成为黄铁矿30%(质量分数),元素组成为Fe 15.06%,Ss 14.89%,金含量为22.77 g/t;毒砂载金金精矿(80%矿物粒度小于0.044 mm)矿物组成为磁黄铁矿与毒砂含量超过75%,石英和碳酸盐为主要的非金属矿物,元素组成为Fe 27.0%,As 8.21%,Ss 20.32%,金含量为108 g/t,反应都在2 L反应器中进行,且装液量为1 L。生物氧化阶段微生物为Sulfobacillus spp.,Leptospirillum spp.,Ferroplasma acidiphilum。两种载金金精矿首先在反应器中(440 r/min,60 ℃)进行酸浸以去除金精矿所含的碳酸盐,酸浸过程中维持溶液pH为1.5~1.6,矿浆浓度为17%,酸浸过程持续20 h。待酸浸结束后,取浸渣与高铁溶液混合配成20%矿浆在高温条件下(440 r/min,80 ℃)进行化学氧化,该过程中溶液pH维持在1.15~1.35,待溶液铁离子降为3~5 g/L时,结束化学氧化。生物氧化阶段在连续搅拌器中进行,pH维持在1.45~1.9,通气量为4 L/min,矿浆浓度为17%,搅拌速度为440 r/min,氧化时间及效果如表2所示。经过两步氧化法两种金精矿的氧化速率及金的回收率都有了较大的提高,毒砂载金金精矿的铁砷氧化率由原先的71.1%与59.7%提高到89.2%与97.2%,金回收率也由原先的82.38%提高到94.06%。黄铁矿载金金精矿的氧化率,仅仅通过5 d氧化就可以达到以前36 d氧化的效果。
表2 一步反应与两步氧化法处理毒砂与黄铁矿金精矿氧化渣分析
Table 2 Analysis of precipitate obtained by one- and two-stage bio-oxidation of arsenopyrite and pyrite concentrates
3 结语
强化难处理含硫金精矿生物预氧化过程对生物冶金工业的发展至关重要。目前,通过优化微生物群落结构、化学条件及氧化工艺对氧化速率的提高取得了一定的进展。但是仍有一些问题需要深入研究。
1) 协同作用机理的完善。通过混合菌群的协同作用可以高效完成物质的转化,促进混合菌群的代谢活动,提高生物预氧化速率。然而,协同作用中涉及的功能基因调控、微生物对矿物的溶解及吸附、外来菌种加入微生物群落活性的影响等都不完善。结合分子生物学、宏基因组学、蛋白质组学和矿物分析方法对预氧化过程中的微生物群落组成、微生物群落变化及微生物与矿物之间的相互作用进行研究,进一步揭示微生物的协同作用及其增效机制,将是未来强化方法研究的一个重要方向。
2) 具有针对性的高效微生物群落的构建。由于不同混合菌代谢活性的差异,其最适宜处理的金精矿也不尽相同。有研究者发现嗜中温混合菌处理高砷高矿浆浓度的金精矿效果最好,而极端嗜热混合菌处理低砷低矿浆浓度的金精矿效果最好。根据金精矿的组成有针对性地构建高效混合菌可以极大地提高氧化效果,但是这方面的研究还远远不够。
3) 进一步探索新的氧化工艺。新的氧化工艺的开发一直是研究的重点。近几十年来,研究者提出BIOX、BACOX、BIONORD等工艺,而对化学生物联合法,中、高温混合菌联合法等方法研究较少。因此,需要进一步研究各种方法的优缺点,利用不同方法的优势提高生物氧化效率。
综上所述,尽管生物预氧化工艺经过世界各国学者的努力取得了长足的发展,但是提高氧化速率仍然是该技术发展的瓶颈之一,要想更有效地利用该工艺,需要对该工艺做更多更深入的探讨。
REFERENCES
[1] CANALES C, ACEVEDO F, GENTINA J C. Laboratory-scale continuous bio-oxidation of a gold concentrate of high pyrite and enargite content[J]. Process Biochemistry, 2002, 37(10): 1051-1055.
[2] 李绍英, 王海霞, 孙春宝, 赵留成, 阎志强. 碘化物对金精矿碘化浸出过程的影响[J]. 中国有色金属学报, 2013, 23(5): 1434-1439.
LI Shao-ying, WANG Hai-xia, SUN Chun-bao, ZHAO Liu-cheng, YAN Zhi-qiang. Effects of different iodides on gold concentrates leaching process in iodine-iodide solution[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1434-1439.
[3] 方 芳, 钟 宏, 江放明, 罗忠银, 孙晓伟, 许凯扬. 黄铁矿对砷黄铁矿生物浸出的影响[J]. 中国有色金属学报, 2013, 23(10): 2970-2976.
FANG Fang, ZHONG Hong, JIANG Fang-ming, LUO Zhong-yin, SUN Xiao-wei, XU Kai-yang. Effect of pyrite on bioleaching of arsenopyrite[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2970-2976.
[4] 袁喜振, 李绍英, 孙春宝, 王海霞, 赵留成, 李根壮, 郭林中. 浮选金精矿和难浸含铜金矿的碘化浸金[J]. 中国有色金属学报, 2014, 24(12): 3123-3128.
YUAN Xi-zhen, LI Shao-ying, SUN Chun-bao, WANG Hai-xia, ZHAO Liu-cheng, LI Gen-zhuang, GUO Lin-zhong. Gold extraction from gold concentrate and copper-bearing refractory gold ore by iodine-iodide solution[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(12): 3123-3128.
[5] GERICKE M, NEALE J, van STADEN P. A Mintek perspective of the past 25 years in minerals bioleaching[J]. J SAIMM, 2009, 109: 567-585.
[6] RAWLINGS D E, DEW D, du PLESSIS C. Biomineralization of metal-containing ores and concentrates[J]. Trends in Biotechnology, 2003, 21(1): 38-44.
[7] BRIERLEY C. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 324-328.
[8] CIFTCI H, AKCIL A. Effect of biooxidation conditions on cyanide consumption and gold recovery from a refractory gold concentrate[J]. Hydrometallurgy, 2010, 104(2): 142-149.
[9] MA S, LUO W, MO W, SU X, LIU P, YANG J. Removal of arsenic and sulfur from a refractory gold concentrate by microwave heating[J]. Minerals Engineering, 2010, 23(1): 61-63.
[10] 富 瑶, 杨洪英, 崔日成, 范有静, 王 承. 细菌胞外聚合层在氧化含砷金精矿生物氧化过程中的作用[J]. 中国有色金属学报, 2010, 20(10): 2057-2062.
FU Yao, YANG Hong-ying, CUI Ri-cheng, FAN You-jing, WANG Cheng. Role of extracellular polymers of bacteria during arsenic-bearing gold concentrate biooxidation process[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(10): 2057-2062.
[11] VERA M, SCHIPPERS A, SAND W. Progress in bioleaching: Fundamentals and mechanisms of bacterial metal sulfide oxidation-part A[J]. Appl Microbiol Biotechnol, 2013, 97(17): 7529-7541.
[12] RAWLINGS D E, DEW D, du PLESSIS C. Biomineralization of metal-containing ores and concentrates[J]. Trends in Biotechnology, 2003, 21(1): 38-44.
[13] BRIERLEY C L, BRIERLEY J A. Progress in bioleaching: part B: Applications of microbial processes by the minerals industries[J]. Applied Microbiology and Biotechnology, 2013, 97(17): 7543-7552.
[14] 吴俊子, 曾伟民, 王玉光, 仉丽娟, 万利利, 周洪波. 搅拌槽反应器中中度嗜热浸矿菌预处理含砷金矿[J]. 过程工程学报, 2013, 13(3): 494-499.
WU Jun-zi, ZENG Wei-min, WANG Yu-guang, ZHANG Li-juan, WAN Li-li, ZHOU Hong-bo. Pretreatment of refractory gold ore by a moderate thermophilic consortium in stirred tank reactor[J]. The Chinese Journal of Process Engineering, 2013, 13(3): 494-499.
[15] 徐祥彬, 张 勇, 郑艳平. 生物氧化-氰化提金工艺设计及生产实践[J]. 黄金, 2012, 33(12): 44-46.
XU Xiang-bin, ZHANG Yong, ZHENG Yan-ping. Design and practice of bio-oxidation-cyanidation gold extraction process[J]. Gold, 2012, 33(12): 44-46.
[16] OKIBE N, JOHNSON D B. Biooxidation of pyrite by defined mixed cultures of moderately thermophilic acidophiles in pH-controlled bioreactors: Significance of microbial interactions[J]. Biotechnol Bioeng, 2004, 87(5): 574-583.
[17] BRIERLEY C. How will biomining be applied in future?[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1302-1310.
[18] ASTUDILLO C, ACEVEDO F. Adaptation of Sulfolobus metallicus to high pulp densities in the biooxidation of a flotation gold concentrate[J]. Hydrometallurgy, 2008, 92(1): 11-15.
[19] 余润兰, 石丽娟, 周 丹, 邱冠周, 曾伟民. 生物浸出过程中微生物协同作用机制的研究进展[J]. 中国有色金属学报, 2013, 23(10): 3006-3014.
YU Run lan, SHI Li juan, ZHOU Dan, QIU Guan zhou, ZENG Wei min. Research development of microorganism synergy mechanisms during bioleaching[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 3006-3014.
[20] STOTT M, SUTTON D, WATLING H, FRANZMANN P. Comparative leaching of chalcopyrite by selected acidophilic bacteria and archaea[J]. Geomicrobiology Journal, 2003, 20(3): 215-230.
[21] PENG H, YANG Y, LI X, QIU G, LIU X, HUANG J, HU Y. Structure analysis of 16S rDNA sequences from strains of Acidithiobacillus ferrooxidans[J]. Journal of Biochemistry and Molecular Biology, 2006, 39(2): 178-182.
[22] ZHOU Q G, BO F, BO Z H, XI L, JIAN G, FEI L F, HUA C X. Isolation of a strain of Acidithiobacillus caldus and its role in bioleaching of chalcopyrite[J]. World Journal of Microbiology and Biotechnology, 2007, 23(9): 1217-1225.
[23] ZHOU H B, LIU X, FU B, QIU G Z, HUO Q, ZENG W M, LIU J S, CHEN X H. Isolation and characterization of Acidithiobacillus caldus from several typical environments in China[J]. Journal of Central South University of Technology, 2007, 14: 163-169.
[24] ZHANG R B, WEI M M, JI H G, CHEN X H, QIU G Z, ZHOU H B. Application of real-time PCR to monitor population dynamics of defined mixed cultures of moderate thermophiles involved in bioleaching of chalcopyrite[J]. Applied Microbiology and Biotechnology, 2009, 81(6): 1161-1168.
[25] GAO J, ZHANG C G, WU X L, WANG H H, QIU G Z. Isolation and identification of a strain of Leptospirillum ferriphilum from an extreme acid mine drainage site[J]. Annals of Microbiology, 2007, 57(2): 171-176.
[26] SAND W, ROHDE K, SOBOTKE B, ZENNECK C. Evaluation of Leptospirillum ferrooxidans for leaching[J]. Applied and Environmental Microbiology, 1992, 58(1): 85-92.
[27] STOTT M, WATLING H, FRANZMANN P, SUTTON D. The role of iron-hydroxy precipitates in the passivation of chalcopyrite during bioleaching[J]. Minerals Engineering, 2000, 13(10): 1117-1127.
[28] d'HUGUES P, JOULIAN C, SPOLAORE P, MICHEL C, GARRIDO F, MORIN D. Continuous bioleaching of a pyrite concentrate in stirred reactors: Population dynamics and exopolysaccharide production vs. bioleaching performance[J]. Hydrometallurgy, 2008, 94(1): 34-41.
[29] HAO C, WANG L, DONG H, ZHANG H. Succession of acidophilic bacterial community during bio-oxidation of refractory gold-containing sulfides[J]. Geomicrobiology Journal, 2010, 27(8): 683-691.
[30] LIU H W, YIN H Q, DAI Y X, DAI Z M, LIU Y, LI Q, JIANG H D, LIU X D. The co-culture of Acidithiobacillus ferrooxidans and Acidiphilium acidophilum enhances the growth, iron oxidation, and CO2 fixation[J]. Arch Microbiol, 2011, 193(12): 857-866.
[31] BRYAN C G, JOULIAN C, SPOLAORE P, EL ACHBOUNI H, CHALLAN-BELVAL S, MORIN D, d’HUGUES P. The efficiency of indigenous and designed consortia in bioleaching stirred tank reactors[J]. Minerals Engineering, 2011, 24(11): 1149-1156.
[32] LIU Y, YIN H, ZENG W, LIANG Y, LIU Y, BABA N, QIU G, SHEN L, FU X, LIU X. The effect of the introduction of exogenous strain Acidithiobacillus thiooxidans A01 on functional gene expression, structure and function of indigenous consortium during pyrite bioleaching[J]. Bioresource Technology, 2011, 102(17): 8092-8098.
[33] 杨 玮, 覃文庆, 刘瑞强, 任允超. 高砷难处理金精矿细菌氧 化-氰化提金[J]. 中国有色金属学报, 2011, 21(5): 1151-1158.
YANG Wei, QIN Wen-qing, LIU Rui-qiang, REN Yun-chao. Extraction of Au from high arsenic refractory gold concentrate by bacterial oxidation-cyanidation[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1151-1158.
[34] TSAPLINA I, ZHURAVLEVA A, GRIGOR’EVA N, BELYI A, PIVOVAROVA T, BULAEV A, MELAMUD V, KONDRAT’EVA T. Biooxidation of a gold-containing sulfide concentrate in relation to changes in physical and chemical conditions[J]. Microbiology, 2012, 81(3): 288-298.
[35] GAHAN C S, SUNDKVIST J E,  . Use of mesalime and electric arc furnace (EAF) dust as neutralising agents in biooxidation and their effects on gold recovery in subsequent cyanidation[J]. Minerals Engineering, 2010, 23(9): 731-738.
. Use of mesalime and electric arc furnace (EAF) dust as neutralising agents in biooxidation and their effects on gold recovery in subsequent cyanidation[J]. Minerals Engineering, 2010, 23(9): 731-738.
[36] GAHAN C S, SUNDKVIST J E, ENGSTR M F,  . Utilisation of steel slags as neutralising agents in biooxidation of a refractory gold concentrate and their influence on the subsequent cyanidation[J]. Resources, Conservation and Recycling, 2011, 55(5): 541-547.
. Utilisation of steel slags as neutralising agents in biooxidation of a refractory gold concentrate and their influence on the subsequent cyanidation[J]. Resources, Conservation and Recycling, 2011, 55(5): 541-547.
[37] QIN W, LIU K, DIAO M, WANG J, ZHANG Y, YANG C, JIAO F. Oxidation of arsenite (As(Ⅲ)) by ferric iron in the presence of pyrite and a mixed moderately thermophilic culture[J]. Hydrometallurgy, 2013, 137: 53-59.
[38] ACEVEDO F, GENTINA J, GARC A N. CO2 supply in the biooxidation of an enargite-pyrite gold concentrate[J]. Biotechnology Letters, 1998, 20(3): 257-259.
[39] ASTUDILLO C, ACEVEDO F. Effect of CO2 air enrichment in the biooxidation of a refractory gold concentrate by Sulfolobus metallicus adapted to high pulp densities[J]. Hydrometallurgy, 2009, 97(1): 94-97.
[40] GERICKE M, PINCHES A, van ROOYEN J. Bioleaching of a chalcopyrite concentrate using an extremely thermophilic culture[J]. International Journal of Mineral Processing, 2001, 62(1): 243-255.
[41] ASTON J E, APEL W A, LEE B D, PEYTON B M. Growth effects and assimilation of organic acids in chemostat and batch cultures of Acidithiobacillus caldus[J]. World Journal of Microbiology and Biotechnology, 2011, 27(1): 153-161.
[42] MURAVYOV M I, BULAEV A G. Two-step oxidation of a refractory gold-bearing sulfidic concentrate and the effect of organic nutrients on its biooxidation[J]. Minerals Engineering, 2013, 45: 108-114.
[43] LI Q, TIAN Y, FU X, YIN H, ZHOU Z, LIANG Y, QIU G, LIU J, LIU H, LIANG Y. The community dynamics of major bioleaching microorganisms during chalcopyrite leaching under the effect of organics[J]. Current Microbiology, 2011, 63(2): 164-172.
[44] LIU H C, XIA J L, NIE Z Y, PENG A A, MA C Y, ZHENG L, ZHAO Y D. Comparative study of sulfur utilization and speciation transformation of two elemental sulfur species by thermoacidophilic Archaea Acidianus manzaensis YN-25[J]. Process Biochemistry, 2013, 48(12): 1855-1860.
[45] 刘 凯, 刁梦雪, 杨 宇, 覃文庆, 吴学玲. 混合高温菌浸出黄铜矿及浸出过程中微生物群落的演替[J]. 中国有色金属学报, 2010, 20(2): 346-353.
LIU Kai, DIAO Meng-xue, YANG Yu, QIN Wen-qing, WU Xue-ling. Bioleaching of chalcopyrite concentrate using mixed thermophilic culture and succession of microbial community during leaching process[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(2): 346-353.
[46] AHMADI A, SCHAFFIE M, PETERSEN J, SCHIPPERS A, RANJBAR M. Conventional and electrochemical bioleaching of chalcopyrite concentrates by moderately thermophilic bacteria at high pulp density[J]. Hydrometallurgy, 2011, 106(1): 84-92.
[47] LINDSTROM E B, SANDSTR M A, SUNDKVIST J E. A sequential two-step process using moderately and extremely thermophilic cultures for biooxidation of refractory gold concentrates[J]. Hydrometallurgy, 2003, 71(1): 21-30.
[48] LI Q, LI D, QIAN F. Pre-oxidation of high-sulfur and high-arsenic refractory gold concentrate by ozone and ferric ions in acidic media[J]. Hydrometallurgy, 2009, 97(1): 61-66.
[49] FOMCHENKO N V, MURAVYOV M I, KONDRAT'EVA T F. Two-stage bacterial–chemical oxidation of refractory gold-bearing sulfidic concentrates[J]. Hydrometallurgy, 2010, 101(1): 28-34.
(编辑 王 超)
基金项目:国家重点基础研究发展计划资助项目(2010CB630901);国家自然科学基金国际合作重大项目(51320105006)
收稿日期:2014-09-22;修订日期:2015-05-19
通信作者:刘新星,教授,博士;电话:0731-88716592;Email:xxlcsu@163.com
摘 要:难处理含硫金精矿的生物预氧化方法前景广阔,但是由于生物预氧化反应速度慢、氧化周期长等因素的存在,严重影响该法在实际应用中的推广。因此,研究生物预氧化技术的强化方法已成为推动该技术发展的关键因素。为达到强化目的,总结了3个方面的强化策略:首先,分析了微生物群落的组成优化,通过组合氧化能力更强的微生物群落来达到强化目的;其次,控制溶液的化学条件,以保证微生物的代谢和功能发挥;最后,对预氧化工艺进行改进,构建更高效的生化反应条件。通过这些方法,难处理含硫金精矿生物预氧化效果可望得到有效强化。
[2] 李绍英, 王海霞, 孙春宝, 赵留成, 阎志强. 碘化物对金精矿碘化浸出过程的影响[J]. 中国有色金属学报, 2013, 23(5): 1434-1439.
[3] 方 芳, 钟 宏, 江放明, 罗忠银, 孙晓伟, 许凯扬. 黄铁矿对砷黄铁矿生物浸出的影响[J]. 中国有色金属学报, 2013, 23(10): 2970-2976.
[4] 袁喜振, 李绍英, 孙春宝, 王海霞, 赵留成, 李根壮, 郭林中. 浮选金精矿和难浸含铜金矿的碘化浸金[J]. 中国有色金属学报, 2014, 24(12): 3123-3128.
[7] BRIERLEY C. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 324-328.
[10] 富 瑶, 杨洪英, 崔日成, 范有静, 王 承. 细菌胞外聚合层在氧化含砷金精矿生物氧化过程中的作用[J]. 中国有色金属学报, 2010, 20(10): 2057-2062.
[14] 吴俊子, 曾伟民, 王玉光, 仉丽娟, 万利利, 周洪波. 搅拌槽反应器中中度嗜热浸矿菌预处理含砷金矿[J]. 过程工程学报, 2013, 13(3): 494-499.
[15] 徐祥彬, 张 勇, 郑艳平. 生物氧化-氰化提金工艺设计及生产实践[J]. 黄金, 2012, 33(12): 44-46.
[19] 余润兰, 石丽娟, 周 丹, 邱冠周, 曾伟民. 生物浸出过程中微生物协同作用机制的研究进展[J]. 中国有色金属学报, 2013, 23(10): 3006-3014.
[33] 杨 玮, 覃文庆, 刘瑞强, 任允超. 高砷难处理金精矿细菌氧 化-氰化提金[J]. 中国有色金属学报, 2011, 21(5): 1151-1158.
[45] 刘 凯, 刁梦雪, 杨 宇, 覃文庆, 吴学玲. 混合高温菌浸出黄铜矿及浸出过程中微生物群落的演替[J]. 中国有色金属学报, 2010, 20(2): 346-353.


