无氧及微氧下H2S与PH3在改性分子筛上的等温吸附
蒋明,宁平,王重华,徐浩东,周键,覃扬颂
(昆明理工大学 环境科学与工程学院,云南 昆明,650500)
摘 要:
sub>4溶液浸渍改性的13X分子筛作为吸附剂,在20~60 ℃的温度范围内,无氧或微氧(O2体积分数为1%)条件下,对H2S和PH3的混合气体的吸附特性进行实验研究。研究结果表明:在无氧条件下,H2S与PH3的吸附过程均以物理吸附为主;在微氧条件下,H2S的吸附过程与前者相同,而PH3的吸附过程则为化学吸附所主导,其等量吸附热随着吸附量的增加而减小,由Clausius-Clapeyron方程计算出的等量吸附热为33.33~51.01 kJ/mol。
关键词:
中图分类号:X511 文献标志码:A 文章编号:1672-7207(2013)02-0854-08
Isothermal adsorption of H2S and PH3 on modified molecular sieve in oxygen-free or micro-oxygen ambience
JIANG Ming, NING Ping, WANG Zhonghua, XU Haodong, ZHOU Jian, QIN Yangsong
(Faculty of Environmental Science and Engineering, Kunming University of Science and Technology,Kunming 650500, China)
Abstract: Using 13X molecular sieve modified by CuSO4 impregnation method as adsorbent, the adsorption characteristics of H2S and PH3 mixture were experimentally studied at 20-60 ℃, in oxygen-free or micro-oxygen (1%, volume fraction) ambience. The results show that in the absence of oxygen, the adsorption process of H2S and PH3 is mainly physisorption, and with trace oxygen the adsorption process of H2S is the same as the former. However, that of PH3 is mainly chemisorption, the isosteric heat of adsorption decreases with the increase of adsorption capacity, the isosteric heat of adsorption is 33.33-51.01 kJ/mol calculated by Clausius-Clapeyron equation.
Key words: H2S; PH3; modified molecular sieve; adsorption; isotherm; adsorption heat
一碳化工是替代石油合成路线制备基本有机化工原料、燃料和其他重要化学品的有效途径。目前我国典型有毒有害工业废气如黄磷尾气、密闭电石炉尾气等都富含高浓度CO,是重要的一碳化工原料气,但影响其羰基合成的主要杂质H2S和PH3的存在却极大的限制了CO的提纯和净化[1-3]。以活性炭为脱硫剂净化脱除H2S是一种常用而行之有效的方法[4-5],浸渍某些金属化合物或碱,可以显著增强活性炭的催化活性,既可以降低反应的温度,又可以极大提高吸附容量[6-8]。酸改性NaY型分子筛对H2S和其他硫化物具有极强的吸附催化作用[9-10],也是脱硫最有效的催化剂之一。Li等[11]研究发现以Cu,Zn和Mn改性ZSM-5型和Y型分子筛对PH3有较优的吸附性能,其中Cu改性时,吸附效率可达99%以上。目前,国内外对H2S和PH3气体的联合净化脱除鲜有报道,本课题组前期研究结果表明酸、碱和过渡金属盐类浸渍改性活性炭能同时有效的净化脱除H2S和PH3,其净化剂筛选、影响因素、吸附模型、反应机理、中试试验等相关问题已得到具体阐述[1-3, 12-15]。其中,在净化过程中起到催化氧化作用所补充的微量O2是影响吸附净化的关键,但其存在又会对工业净化及合成带来较大的安全隐患。因此,如何使净化系统的O2含量达到较低的安全范围内或在根本无氧的状态下也能达到与有氧时相当的净化脱除效果,这是现阶段及今后研究的重点及难点。本文作者采用浸渍法改性13X分子筛制备吸附剂联合吸附净化H2S和PH3,比较了在微氧和无氧条件下改性吸附剂对H2S和PH3的吸附脱除效果,从吸附容量、吸附等温线和吸附热方面对相关问题进行研究,探索富含高浓度CO工业尾气的预处理和深度净化的安全性和最佳途径,开发优良的选择性吸附剂。
1 实验
1.1 材料
(1) 材料。13X型分子筛(购自国药集团化学试剂有限公司),其结构参数为:钠X,球状,颗粒粒度(3~5 mm)≥97.0%,堆积密度≥0.65 g/mL,抗压强度≥75.0,水吸附量(50%RH)≥26.0%;其余化学药品均为国产分析纯试剂;H2S和PH3混合气体钢瓶气(钢瓶气有6种浓度,气体中均含H2S和PH3 各0.25,0.60,0.75,1.50,2.20和3.00 g/m3,其余气体为N2平衡,购自大连大特气体有限公司)。
(2) 吸附剂。将13X分子筛在400 ℃下活化3 h,然后将其研磨为粒径0.5 mm的颗粒,并用100 mL浓度为0.1 mol/L的CuSO4溶液浸渍24 h,再在110 ℃下干燥12 h,最后在300 ℃下焙烧6 h即得所用吸附剂。
1.2 实验流程及方法
吸附净化实验流程参见文献[14]。先将含H2S和PH3的钢瓶混合气以0.3 L/min的流量与空气经混合器进行混合,然后混合气体进入气体预热装置后进入吸附床层单元,吸附反应在一个不锈钢圆柱体反应器中进行,柱内装有10 g上述吸附剂,反应在20~60 ℃温度下、氧体积分数为1%的条件下进行,尾气经硫酸铜吸收处理后排放。当净化后气体质量浓度为净化前的10%(即ρt/ρ0=10%)时可视为穿透,通过各条件下H2S和PH3的穿透曲线并按式(1)即可计算各自的吸附容 量[13-14];实验氧含量变化通过改变泵入的空气量确定,计算见式(2),净化前后的H2S和PH3气体浓度采用湖北省化学研究院生产的HC-6微量硫、磷气相色谱仪测定。
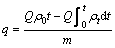 (1)
(1)
式中:qt为吸附容量,mg/g;Q为气体流量,m3/min;t为吸附时间,min;ρ0为吸附柱进口气体质量浓度,mg/m3;ρt为吸附柱出口气体质量浓度,mg/m3;m为吸附剂质量,g。
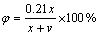 (2)
(2)
式中:φ为实验中氧含量(体积分数),%;x为泵入空气量,m3/min;v为混合钢瓶气体流量,m3/min。
1.3 吸附等温线的测定
采用计算法绘制吸附等温线。首先准确称量吸附剂2 g并装入上述装置的吸附柱中,并分别用6种含不同浓度H2S和PH3的钢瓶混合气进行吸附反应。同一个吸附剂样品先在最低的进口气体浓度下吸附饱和(1 h之内混合气体在吸附前后的浓度几乎相等时可视为吸附饱和),在温度不变的条件下不更换吸附柱中的吸附剂,仅增加进口气体浓度,仍然继续作饱和,以此类推,不断增加实验用气体浓度,直到浓度最高的气体吸附饱和为止;最后,相同温度下以进样气体质量浓度ρ0为横坐标,不同浓度下的饱和吸附容量Q为纵坐标,即可绘制出吸附等温线。
1.4 吸附等温线的拟合
采用弗伦得里希(Freundlich)吸附等温方程进行吸附等温线的拟合,该方程应用广泛,可用于物理吸附,也可用于化学吸附。该方程的基本形式为:
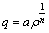 (3)
(3)
式中:q为污染气体在吸附剂上的吸附容量,kg/kg;ρ为污染气体的平衡质量浓度,kg/m3;a和n为方程参数,由曲线拟合求取。在式(3)的等号两边同时取对数,可得下式:
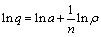 (4)
(4)
以ln q为纵坐标,ln ρ为横坐标,即可绘制出直线形式的吸附等温线,由该等温线可以计算出n和 ln a,为之后进行等量吸附热的计算提供数据。
1.5 等量吸附热的计算
等量吸附热的大小在一定程度上可判断吸附的类型,故通过Clausius-Clapeyron[16]方程可计算出气体在不同温度下吸附平衡时的等量吸附热△H。吸附时吸热,△H为正,反之为负。
 (5)
(5)
式中:△H为等量吸附热,kJ/mol;R为摩尔气体常数,R=8.314 J/(mol·K);T为热力学温度,K;ρ为污染气体的平衡质量浓度,kg/m3。在固定吸附量q的情况下,对式(5)两边同时对T积分,可得:
 (6)
(6)
式中:K为积分常数项。由式(6)可知:在相同的吸附容量q下,ln ρ与1/T呈线性关系,将此直线称为吸附等量线,又由式(4)得ln ρ=n(ln q-ln a),故由吸附等量线的斜率△H/R可得到等量吸附热△H。
2 结果与讨论
由于实际工业尾气富含高浓度CO,一旦容器和管道中进入空气,当氧含量达到2.5%以上时即可形成爆炸性气体,故在生产过程中氧含量必须控制在1.5%以下或者保持绝对无氧,通过前期研究,氧含量为1%左右净化效果可达到最佳,既能达到安全的控制范围,又能提供足够的氧便于吸附剂与杂质气体进行催化氧化反应[1, 12, 14]。而吸附反应过程中反应温度也是影响净化效率的关键因素之一,故本实验主要讨论无氧和1%的氧含量条件下吸附剂对H2S和PH3气体吸附性能的影响,其他影响因素不再赘述。又由于CuSO4和MgSO4等水合硫酸盐都具有相似的一水化合物结构,在高温成型的过程中,该盐类担载分子筛、SiO2等载体上能表现出优异的选择性和酸催化活性[17-18],对气态污染物有较强的吸附作用,故本实验选择了CuSO4作为浸渍剂。
2.1 无氧条件下吸附温度的影响
图1所示为无氧时不同温度下的穿透曲线。由图1可知:无氧条件下,吸附温度越低改性分子筛吸附剂对H2S和PH3气体吸附越强,说明低温有利于吸附净化的进行,尤其20 ℃时吸附剂对H2S的净化效率比PH3高,而吸附剂穿透曲线破点后斜率的增加也反映出吸附剂上吸附速率的增加。
图2所示为通过将不同浓度H2S与PH3达到吸附饱和,并根据平衡数据绘制的不同温度下的吸附等温线。由图2可知:对于2种气体其平衡吸附量随温度的升高而降低,说明无氧条件下H2S和PH3与吸附剂表面发生了放热过程,这与活性炭纤维或分子筛单一净化PH3的报道相一致[19-20]。高温时(60 ℃)H2S与PH3饱和吸附容量相差不大,但在低温范围时(20 ℃和40 ℃) H2S的饱和吸附容量都比PH3大,其在最佳温度20 ℃、平衡浓度为3.0 g/m3时H2S与PH3的吸附容量分别为41.22 mg/g和24.98 mg/g,说明改性分子筛吸附剂在该条件下对H2S分子的吸附作用明显优于对PH3的吸附作用,但要说明该吸附是物理吸附或化学吸附,还是2种吸附都同时存在,则需结合吸附热进行进一步研究。

图1 无氧时不同温度下的穿透曲线
Fig.1 Breakthrough curves for different adsorption temperature in oxygen-free
2.2 无氧条件下H2S的等量吸附热
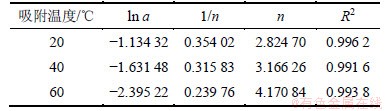
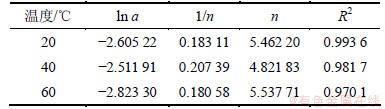
由于用Langmuir等温方程描述等温吸附平衡过程时,以吸附剂表面均匀作为假设前提,且吸附热△H与吸附量q或表面覆盖度θ无关,但实际情况并非如此。在制备吸附剂时,其表面不可能是充分均匀,且前期研究也表明[19-21]:单一PH3气体在不同吸附剂上的等温吸附热常常会随着吸附量q的增加而变化。因此,这里采用应用范围更为广泛的Freundlich等温方程进行拟合。图3所示是根据Freundlich等温方程绘制出的无氧条件下H2S吸附等温线的拟合回线,其拟合数据见表1。由图3和表1可知:拟合回线的斜率1/n在0.1~0.5之间,表明吸附较容易进行[21],若1/n超过2,表明该吸附较难进行。
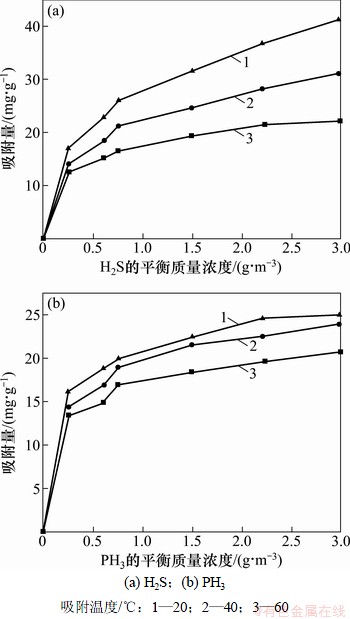
图2 无氧时气体吸附等温线
Fig.2 Adsorption isotherms in oxygen-free
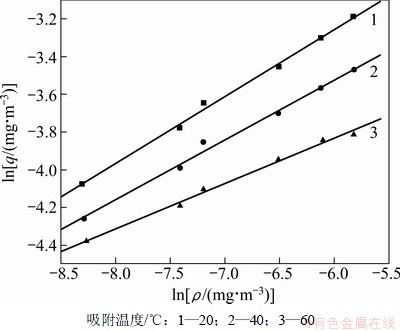
图3 无氧时H2S吸附等温线拟合回线
Fig.3 Isothermal equation regression curves of H2S in oxygen-free
表1 无氧条件下H2S吸附等温线的拟合参数
Table 1 Parameters of Freundlich fitting of H2S in oxygen-free
由图2(a)可知:不同温度下H2S在改性分子筛上的平衡吸附量在10~40 mg/g之间,故分别选取10,15,20,25,30,35和40 mg/g这7个吸附容量按式(6)做吸附等量线,结果见图4,通过吸附等量线得到的参数并由Clausius-Clapeyron方程计算的等量吸附热见表2。由计算结果可知:在无氧条件下,H2S在分子筛上的吸附热△H<0,说明是一个放热过程,并且随着吸附量的增加,等量吸附热呈上升的趋势,这与理论上吸附热随吸附量的增加而降低的结论不同。

图4 无氧时H2S吸附等量线
Fig.4 Adsorption isostere of H2S in oxygen-free
表2 无氧条件下H2S吸附等量线的拟合参数
Table 2 H2S fitting parameter of adsorption isostere and isosteric heat of adsorption in oxygen-free

其可能的原因是:13X 分子筛具有均匀排列的孔道和尺寸固定的孔径,在较低吸附量时,气体分子吸附于均匀排列的孔道表面,此时气体分子间相互作用力较小使得吸附热值较小;当吸附量增大时,气体分子逐渐在孔道内重叠和填充,分子间的相互作用力逐渐增强,导致吸附热增加[22-23],但总体来说,吸附热的绝对值不大(40 kJ/mol左右),说明H2S在改性分子筛上的整个吸附过程是以物理吸附为主。
2.3 无氧条件下PH3的等量吸附热
无氧时PH3吸附等温线的拟合回线及其拟合数据分别见图5和表3。不同温度下吸附等温方程参数1/n仍在0.1~0.5之间,且与H2S相比,1/n都有所减小,表明PH3的吸附仍较易进行。
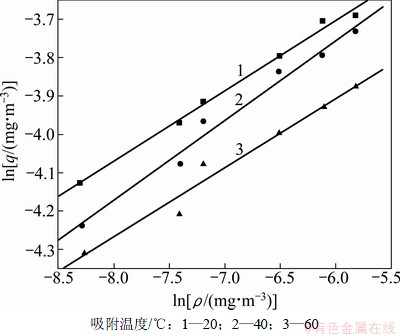
图5 无氧时PH3吸附等温线拟合回线
Fig.5 Isothermal equation regression curves of PH3 in oxygen-free
表3 无氧条件下PH3吸附等温线的拟合参数
Table 3 Parameters of Freundlich fitting of PH3 in oxygen-free
同时在图2(b)中,不同温度下PH3在改性分子筛上的平衡吸附量在10~25 mg/g之间,因此,也分别选取10,15,20和25 mg/g的吸附容量做吸附等量线,见图6。吸附等量线的拟合参数和计算等量吸附热结果见表4。由表4可知:无氧条件下,PH3在改性分子筛上的吸附情况与H2S相似,都是明显的放热过程,吸附热△H的绝对值始终保持在20 kJ/mol左右,鉴于化学吸附热通常为40~800 kJ/mol,因此PH3在20~60 ℃温度范围内的吸附属于典型的物理吸附,PH3分子吸附在分子筛微孔表面上后,位能下降,放出了物理吸附热△H,故温度越低越有利其吸附,这与图2(b)所示的吸附等温线的描述是相一致的。
表4 无氧条件下PH3吸附等量线的拟合参数
Table 4 PH3 fitting parameter of adsorption isostere and isosteric heat of adsorption in oxygen-free
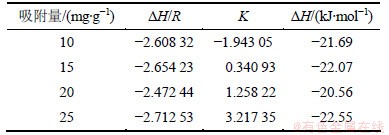
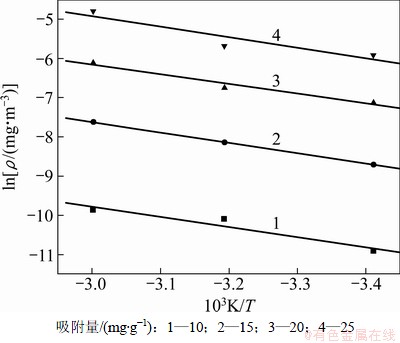
图6 无氧时PH3吸附等量线
Fig.6 Adsorption isostere of PH3 in oxygen-free
2.4 微氧条件下吸附温度的影响
图7所示为氧含量1%时气体的吸附等温线。由于在实验中补充了1%的氧气,对气流中的H2S和PH3气体浓度起到了一定的稀释作用,故通过理论计算和气相色谱测定相结合的方法对气流中的H2S和PH3气体浓度进行了测定,测定后从原来均含H2S和PH3 各0.25,0.60,0.75,1.50,2.20和3.00 g/m3的浓度变为此时均含H2S和PH3 各0.237,0.570,0.715,1.430,2.095和2.855 g/m3,所以,图7所示的吸附等温线是根据补充了1%的氧气后新气流所含有H2S和PH3的浓度而绘制的。由图7可知:改性分子筛吸附剂在微氧情况下对H2S的吸附性能与无氧时是一致的,均是低温有利于气体的吸附,吸附过程受放热所控制,说明分子筛该条件下对H2S的吸附可能仍以物理吸附为主。而对于PH3气体,在微氧条件下分子筛对其的吸附性能与无氧时发生了较大变化,无氧时,温度越低吸附剂对PH3的吸附性能越强,但低温段(20 ℃和40 ℃)时温度对PH3饱和吸附容量的影响已不明显;微氧时,温度的升高使分子筛对PH3的吸附性能逐渐增强,且温度范围对PH3饱和吸附容量有明显的影响,很可能是氧的参与使PH3与分子筛表面活性中心发生了化学反应,形成了作用力强的吸附化学键。由吸附等温线还可以看出,微氧条件下相同温度时吸附剂对H2S的饱和吸附容量总是大于无氧条件时的,很可能是混合气体因O2的加入导致气体总流量的增大,有利于消除吸附剂表面的外扩散阻力,便于混合气流进入吸附剂内部,增加了气体的吸附量。与H2S的吸附不同,PH3的吸附则可能是有氧时依靠化学吸附为主的吸附方式增加了气体的吸附量,但其吸附类别仍需从吸附热进行进一步判定,其在60 ℃的最佳温度、进气浓度为2.855 g/m3时饱和吸附容量为25.96 mg/g。
2.5 微氧条件下H2S的等量吸附热
在计算等量吸附热时,吸附等温线的拟合过程与无氧条件下相一致,故计算与拟合过程不再赘述。由图7(a)可知:不同温度下H2S在改性分子筛上的平衡吸附量约在15~50 mg/g之间,故分别选取15,20,25,30,35,40,45和50 mg/g共8个饱和吸附容量计算吸附等量线,见图8。吸附等量线的拟合参数和等量吸附热的计算结果见表5。由表5可知:吸附热△H<0,说明该条件下的吸附为放热过程,等量吸附热随着吸附量的增加而增加,在吸附量<40 mg/g时,其吸附热△H<40 kJ/mol,虽然在吸附量>40 mg/g时,△H的绝对值超过了40 kJ/mol,但超过的量并不大,这很可能是由于实验计算误差所致。故微氧条件下H2S在改性分子筛上表现为物理吸附为主的吸附过程。

图7 1%氧含量时气体吸附等温线
Fig.7 Adsorption isotherms in 1% oxygen
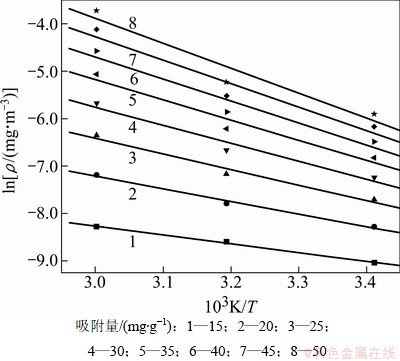
图8 微氧时H2S吸附等量线
Fig.8 Adsorption isostere of H2S in 1% oxygen
表5 微氧条件下H2S吸附等量线的拟合参数
Table 5 H2S fitting parameter of adsorption isostere and isosteric heat of adsorption in 1% oxygen
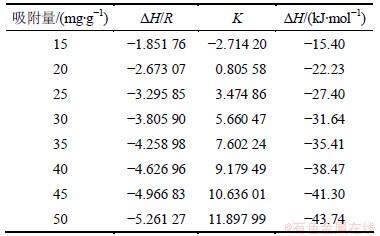
2.6 微氧条件下PH3的等量吸附热
图9所示是PH3吸附量分别为5,10,15,20和25 mg/g时的吸附等量线。等量线的拟合参数和等量吸附热的计算结果见表6。
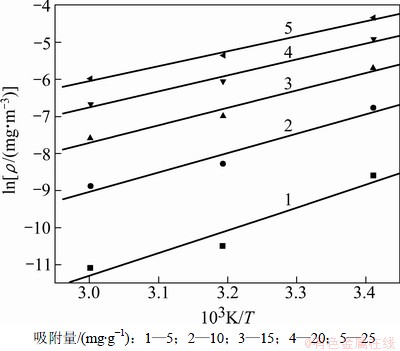
图9 微氧时PH3吸附等量线
Fig.9 Adsorption isostere of PH3 in 1% oxygen
表6 微氧条件下PH3吸附等量线的拟合参数
Table 6 PH3 fitting parameter of adsorption isostere and isosteric heat of adsorption in 1% oxygen
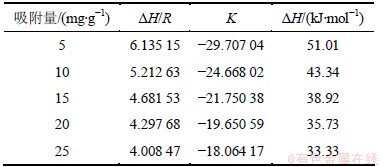
由表6可知:吸附热△H为正值,与前面的结论相反,说明此时的吸附过程绝不是单一的物理吸附或是以物理吸附为主的吸附过程。从吸附量与吸附热的关系上来看,吸附热随着吸附量的增加而减小,这种变化趋势表明改性分子筛表面能量的分布不均。在PH3吸附的初期,改性分子筛上的活性位在有氧的条件下与PH3吸附结合,此时吸附热较大;随着吸附量的增加,吸附剂表面的活性位被吸附质逐渐覆盖或填充占据,吸附转移到活性较差的吸附位,导致吸附热降低,活化能增大。吸附热表现为吸热,说明吸附质分子的脱附能大于吸附质分子与吸附剂表面成键的生成能。从表6还可以看出:吸附热△H的绝对值在吸附初期时>40 kJ/mol,到吸附中后期(吸附量>15 mg/g) 时逐渐降至40 kJ/mol以下,鉴于化学吸附热的通常判定标准为40~800 kJ/mol,说明PH3在此时的吸附可能不是单一的化学吸附,而是物理吸附和化学吸附共存而最终表现为化学吸附为主的吸附过程。另外,由于化学吸附是多相催化过程中的重要环节之一,因此,不能排除PH3在微氧气分下发生气-固相催化氧化反应的可能性。
3 结论
(1) 在温度为20~60 ℃,无氧或微氧(O2体积分数为1%)的条件下,改性分子筛对H2S和PH3都具有较优的吸附净化性能。无氧时,吸附温度越低越有利于H2S和PH3气体的吸附;微氧时,吸附温度对H2S的影响与无氧时相同,但对PH3的影响与无氧时相反。
(2) 无氧气氛下,H2S和PH3在改性分子筛上发生的均是放热的物理吸附过程,同等条件下H2S的平衡吸附量较PH3的大;微氧气氛下,H2S在改性分子筛上的吸附与无氧时一致,但PH3发生的却是吸热的化学吸附为主的吸附过程,其等量吸附热为33.33~51.01 kJ/mol, 且等量吸附热随吸附量的增加而减小。
参考文献:
[1] MA Liping, NING Ping, ZHANG Yuanyuan, et al. Experimental and modeling of fixed-bed reactor for yellow phosphorous tail gas purification over impregnated activated carbon[J]. Chemical Engineering Journal, 2008, 137(3): 471-479.
[2] WANG Zhonghua, JIANG Ming, NING Ping, et al. Thermodynamic modeling and gaseous pollution prediction of the yellow phosphorus production[J]. Industrial & Engineering Chemistry Research, 2011, 50(21): 12194-12202.
[3] YI Honghong, YU Qiongfen, TANG Xiaolong, et al. Phosphine adsorption removal from yellow phosphorus tail gas over CuO-ZnO-La2O3/activated carbon[J]. Industrial & Engineering Chemistry Research, 2011, 50(7): 3960-3965.
[4] Danh N T, Bandosz T J. Activated carbons with metal containing bentonite binders as adsorbents of hydrogen sulfide[J]. Carbon, 2005, 43(2): 359-367.
[5] Bandosz T J. Effect of pore structure and surface chemistry of virgin activated carbons on removal of hydrogen sulfide[J]. Carbon, 1999, 37(3): 483-491.
[6] Alexeeva O K, Klebanov Y D, Safonova A M, et al. Preparation of adsorption-catalytic and protective coatings on carbon fibers used for hydrogen purification[J]. International Journal of Hydrogen Energy, 1999, 24(2): 241-246.
[7] Tsai J H, Jeng F T, Chang H L. Removal of H2S from exhaust gas by use of alkaline activated carbon[J]. Adsorption, 2001, 7(8): 357-366.
[8] Yan R, Chin T, Ng Y L, et al. Influence of surface properties on the mechanism of H2S removal by alkaline activated carbons[J]. Environmental Science & Technology, 2004, 38(1): 316-323.
[9] Yang R T, Hernandez-Maldonado A J, Yang F H. Desulfurization of transportation fuels with zeolites under ambient conditions[J]. Science, 2003, 301(4): 79-81.
[10] Mauge F, Sahibed-Dine A, Caillard M, et al. Modification of the acidic properties of NaY zeolite by H2S adsorption—An infrared study[J]. Journal of Catalysis, 2002, 207(2): 353-360.
[11] Li W C, Bai H , Hsu J N, et al. Metal loaded zeolite adsorbents for phosphine removal[J]. Industrial & Engineering Chemistry Research, 2008, 47(5): 1501-1505.
[12] 徐浩东, 宁平, 蒋明, 等. 净化PH3和H2S气体改性炭的制备与表征[J]. 环境科学学报, 2008, 28(7): 1365-1369.
XU Haodong, NING Ping, JIANG Ming, et al. Preparation and characterization of modified activated carbon for purification of PH3 and H2S[J]. Acta Scientiae Circumstantiae, 2008, 28(7): 1365-1369.
[13] NING Ping, WANG Xiangyu, Bart H J, et al. Removal of phosphorus and sulfur from yellow phosphorus off-gas by metal-modified activated carbon[J]. Journal of Cleaner Production, 2011, 19(13): 1547-1552.
[14] WANG Xueqian, NING Ping, SHI Yan, et al. Adsorption of low concentration phosphine in yellow phosphorus off-gas by impregnated activated carbon[J]. Journal of Hazardous Materials, 2009, 171(1/2/3): 588-593.
[15] WANG Xueqian, NING Ping, CHEN Wei. Studies on purification of yellow phosphorus off-gas by combined washing, catalytic oxidation, and desulphurization at a pilot scale[J]. Separation and Purification Technology, 2011, 80(3): 519-525.
[16] Pan H, Ritter J A, Balbuena P B. Examination of the approximations used in determining the isosteric heat of adsorption from the Clausius-Clapeyron equation[J]. Langmuir, 1998, 14(21): 6323-6327.
[17] Wang Y, Akaishi M, Yamaoka S. Diamond formation from graphite in the presence of anhydrous and hydrous magnesium sulfate at high pressures and high temperatures[J]. Diamond and Related Materials, 1999, 8(1): 73-77.
[18] Moghaddam F M, Bardajee G R, Oskui A A. A mild and chemoselective dithioacetalization of aldehydes in the presence of anhydrous copper (II) sulfate[J]. Phosphorus Sulfur and Silicon and the Related Elements, 2006, 181(6): 1445-1450.
[19] 余琼粉, 易红宏, 唐晓龙, 等. 磷化氢在改性活性炭纤维上的吸附等温过程[J]. 中南大学学报: 自然科学版, 2010, 41(1): 381-386.
YU Qiongfen, YI Honghong, TANG Xiaolong, et al. Adsorption isotherm of phosphine onto CoCl2-modified activated carbon fiber[J]. Journal of Central South University: Science and Technology, 2010, 41(1): 381-386.
[20] YU Qiongfen, TANG Xiaolong, YI Honghong, et al. Equilibrium and heat of adsorption of phosphine on CaCl2-modified molecular sieve[J]. Asia-Pacific Journal of Chemical Engineering, 2009, 4(5): 612-617.
[21] 王学谦, 宁平. 浸渍活性炭吸附低浓度PH3动力学[J]. 中南大学学报: 自然科学版, 2011, 42(7): 2162-2166.
WANG Xueqian, NING Ping. Kinetics of low concentration PH3 adsorption on impregnatedly activated carbon[J]. Journal of Central South University: Science and Technology, 2011, 42(7): 2162-2166.
[22] 段林海, 蒋施, 孙兆林, 等. 环戊烷在 Silicalite-1上吸附的热力学研究[J]. 石油化工高等学校学报, 2003, 16(3): 6-14.
DUAN Linhai, JIANG Shi, SUN Zhaolin, et al. The thermodynamic study on the adsorption for cyclopentane in Silicalite-1[J]. Journal of Petrochemical Universities, 2003, 16(3): 6-14.
[23] 邓华, 易红宏, 唐晓龙, 等. 燃煤烟气在13X分子筛上的吸附行为与热力学分析[J]. 中南大学学报: 自然科学版, 2012, 43(1): 401-406.
DENG Hua, YI Honghong, TANG Xiaolong, et al. Equilibrium isotherms and thermodynamics for flue gas on 13X zeolite[J]. Journal of Central South University: Science and Technology, 2012, 43(1): 401-406.
(编辑 杨幼平)
收稿日期:2012-02-23;修回日期:2012-06-03
基金项目:国家高技术研究发展计划(“863”计划)项目(2008AA062602);云南省自然科学基金资助项目(14051184);昆明理工大学分析测试基金资助项目(2010136)
通信作者:宁平(1958-),男,山西太原人,博士,教授,博士生导师,从事环境污染控制与化工过程数值模拟研究;电话:0871-5186313;E-mail:ningping58@126.com
摘要:以经CuSO4溶液浸渍改性的13X分子筛作为吸附剂,在20~60 ℃的温度范围内,无氧或微氧(O2体积分数为1%)条件下,对H2S和PH3的混合气体的吸附特性进行实验研究。研究结果表明:在无氧条件下,H2S与PH3的吸附过程均以物理吸附为主;在微氧条件下,H2S的吸附过程与前者相同,而PH3的吸附过程则为化学吸附所主导,其等量吸附热随着吸附量的增加而减小,由Clausius-Clapeyron方程计算出的等量吸附热为33.33~51.01 kJ/mol。
[12] 徐浩东, 宁平, 蒋明, 等. 净化PH3和H2S气体改性炭的制备与表征[J]. 环境科学学报, 2008, 28(7): 1365-1369.
[19] 余琼粉, 易红宏, 唐晓龙, 等. 磷化氢在改性活性炭纤维上的吸附等温过程[J]. 中南大学学报: 自然科学版, 2010, 41(1): 381-386.
[21] 王学谦, 宁平. 浸渍活性炭吸附低浓度PH3动力学[J]. 中南大学学报: 自然科学版, 2011, 42(7): 2162-2166.
[22] 段林海, 蒋施, 孙兆林, 等. 环戊烷在 Silicalite-1上吸附的热力学研究[J]. 石油化工高等学校学报, 2003, 16(3): 6-14.
[23] 邓华, 易红宏, 唐晓龙, 等. 燃煤烟气在13X分子筛上的吸附行为与热力学分析[J]. 中南大学学报: 自然科学版, 2012, 43(1): 401-406.


