Na2CO3-CO2-H2O体系处理铬渣的热力学分析
刘伟,李斌,周秋生,齐天贵,彭志宏,刘桂华,李小斌
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:采用Na2CO3-CO2-H2O体系处理铬渣,分析该体系的反应热力学,并通过实验研究不同浸出剂对铬渣中 Cr(Ⅵ)浸出的影响。研究结果表明:在75 ℃,当6.6<pH<10.8且c(CO32-)>1.55×10-6 mol/L时,体系处于碳酸钙的稳定区,铬酸钙、水榴石、水铝钙石及钙铁石可被分解而释放出其中的Cr(Ⅵ),而水滑石难以被分解;在温度为80 ℃,碳酸钠质量浓度为120 g/L,液固比为15,CO2体积分数为5%,时间为24 h的条件下处理铬渣,得到的渣经湿磨后再用此体系二次浸出,最终铬渣中Cr(Ⅵ)的质量分数降至0.13%,Cr(Ⅵ)的浸出率达到85%;毒性实验浸出液中Cr(Ⅵ)和总Cr质量浓度分别为1.21 mg/L和1.51 mg/L,均远低于HJ/T 301—2007中规定的限值,符合一般工业固体废物填埋的标准;含Cr(Ⅵ)的主要物相钙铁石、水铝钙石的质量分数明显降低且没有铬酸钙生成,这与热力学分析结果基本一致。
关键词:
中图分类号:X705 文献标志码:A 文章编号:1672-7207(2011)05-1209-06
Thermodynamic analysis of chromite ore processing residue treatment in Na2CO3-CO2-H2O system
LIU Wei, LI Bin, ZHOU Qiu-sheng, QI Tian-gui, PENG Zhi-hong, LIU Gui-hua, LI Xiao-bin
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: A new system of Na2CO3-CO2-H2O was employed to leach Cr(Ⅵ) in the chromite ore processing residue (COPR). The thermodynamic analysis was carried out and the effect of various leaching reagents on Cr(Ⅵ) leaching was studied. The results show that the system is in the stability region of CaCO3 at 75 ℃ with pH in 6.6-10.8 and the CO32- concentration above 1.55×10-6 mol/L, and thus CaCrO4, hydrogarnet, hydrocalumite and brownmillerite may be decomposed, resulting in the release of Cr(Ⅵ), while hydrotalcite can hardly be decomposed. The content of Cr(Ⅵ) in COPR treated by Na2CO3-CO2-H2O leaching followed by wet-grinding and then leaching, and the leaching efficiency of Cr(Ⅵ) in COPR can reach 0.13% and 85% respectively under the optimal conditions of 80 ℃, liquid-solid ratio of 15, CO2 concentration in the mixture of CO2 and air of 5%, Na2CO3 mass concentration of 120 g/L and leaching time of 24 h. The Cr(Ⅵ) and total Cr mass concentrations in the leachate of toxicity characteristic leaching procedure of the COPR treated under the above optimal conditions are 1.21 mg/L and 1.51 mg/L respectively, far below the regulatory limit and meeting the landfill standard for common industrial solid waste in HJ/T 301—2007. The contents of brownmillerite and hydrocalumite regarded as the main Cr(Ⅵ)-bearing phases reduce obviously and there are no apparent diffraction peaks of CaCrO4, approximately in agreement with the thermodynamic calculation.
Key words: chromite ore processing residue (COPR); Cr(Ⅵ); leaching; thermodynamics
铬渣(COPR)是铬铁矿经高温焙烧、用水浸取铬酸钠后得到的废渣。传统有钙焙烧工艺产生的铬渣含有0.5%~2.0%(质量分数)的Cr(Ⅵ),被列为危险废物[1]。目前,铬渣处理仍然以堆存为主,而铬渣堆存有2个方面的问题:一是铬渣中Cr(Ⅵ)随雨水源源不断地浸出;二是铬渣的体积膨胀无法控制[2]。因此,对铬渣进行解毒与综合利用势在必行。将铬渣中的Cr(Ⅵ)转移至液相,主要有水化法[3]、酸溶法[4]和碱溶法[4]。水化法是用水作浸出剂,利用铁铝酸钙等的水化特性,将铬渣中的水溶性和少部分酸溶性Cr(Ⅵ)转移到溶液中。由于Cr(Ⅵ)浸出不彻底,Geelhoed等[5]否定了用此法来解毒铬渣。而酸溶法是用硫酸等强酸破坏铬渣中含Cr(Ⅵ)物质的结构,从而将渣中Cr(Ⅵ)转移到液相中。由于铬渣具有很强的pH缓冲能力,将其pH由12.0调至7.5所需酸量较大,导致其解毒成本较高[5]。考虑到铬渣中含有大量的碱性物质,以碱性体系处理铬渣应该更加合理。景学森等[6]对铬渣中Cr(Ⅵ)在不同盐溶液中的浸出效果进行了比较,发现Na2CO3溶液的浸出效果最好,Cr(Ⅵ)浸出率可达77%;陈振林等[7]用CO2处理铬渣,在常温常压下于水中处理3 h,渣中Cr(Ⅵ)的浸出率也可达65%。目前,单独用CO2或Na2CO3处理铬渣均无法实现铬渣解毒,且其解毒机理不清楚。为此,本文作者对采用Na2CO3-CO2-H2O体系处理铬渣进行热力学计算和分析,并在此基础上进行实验研究,以便寻找一种强化铬渣中含Cr(Ⅵ)的钙镁复杂化合物分解的方法,开发铬渣解毒新技术。
1 实验
1.1 实验原料
实验所用铬渣取自某铬渣堆场,其主要化学成分(质量分数)见表1。将铬渣在50 ℃时烘干12 h,然后,磨细至过75 μm筛作为实验原料。所用碳酸钠为化学纯,二氧化碳为工业纯。
表1 铬渣的主要化学组成
Table 1 Chemical composition of COPR %

1.2 实验步骤
将一定量铬渣置于直径×长度为35 mm×315 mm的玻璃管中,按液固比为15加入设定浓度的碳酸钠溶液(浓度以Na2O计),混合均匀后在恒温水浴槽中保温一段时间,达到预定温度后,从溶液底部通入二氧化碳与空气的混合气体(CO2体积分数为5%)并开始反应计时。在反应过程中气体流量维持在0.1 m3/h左右,以保证反应物料的搅拌效果不受影响。反应结束后,进行固液分离并测定滤液的pH,将处理后的铬渣充分洗涤后烘干、称质量,最后分析渣中Cr(Ⅵ)的含量并计算铬渣中Cr(Ⅵ)的浸出率。
1.3 分析方法
渣中Cr(Ⅵ)的含量依据GB 5085.3—2007《危险废物鉴别标准:浸出毒性鉴别》中《附录T:固体废物—六价铬分析的样品前处理—碱消解法》和GB/T 15555.4—1995《固体废物:六价铬的测定—二苯碳酰二肼分光光度法》进行测定;溶液的pH用酸度计(PHS-25C Precision)测定;渣的物相组成采用X线衍射仪(D/MAX-RA)进行分析。
2 结果与讨论
2.1 热力学计算与分析
2.1.1 铬渣中Cr(Ⅵ)的存在形式
铬渣的物相组成极其复杂,国内外学者综合运用XRD(X线衍射),FT-IR(红外),SEM-EDX(扫描电镜-能谱)和XRF(X线荧光)对铬渣中Cr(Ⅵ)的存在形式进行了研究[8-11],主要结果见表2。物相中四水铬酸钠呈水溶性,铬酸钙呈微溶性,而其他几种物质都是呈难溶性。
2.1.2 热力学参数及计算
由表2可知:钙钒石中Cr(Ⅵ)的含量极少。故在此未对其进行热力学分析,而主要对水榴石、水铝钙石、水滑石及钙铁石在Na2CO3-CO2-H2O体系中的反应行为进行热力学分析。
体系中相关离子及部分化合物的热力学参数可直接从文献[12-13]查得,如表3所示。而Ca4Al2Fe2O10的热力学参数根据文献[13]求得:298 K时的吉布斯自由能![]() 为-5.172 70 MJ/mol,348 K时的吉布斯自由能
为-5.172 70 MJ/mol,348 K时的吉布斯自由能![]() 为-5.195 41 MJ/mol;CaCrO4的热力学参数根据文献[14-15]求得:
为-5.195 41 MJ/mol;CaCrO4的热力学参数根据文献[14-15]求得:![]() 为-1.403 96 MJ/mol,
为-1.403 96 MJ/mol,![]() 为 -1.412 20 MJ/mol;Mg6Al2(CO3)(OH)16·4H2O的热力学参数根据文献[16]及表3求得:
为 -1.412 20 MJ/mol;Mg6Al2(CO3)(OH)16·4H2O的热力学参数根据文献[16]及表3求得:![]() 为-8.454 55 MJ/mol,
为-8.454 55 MJ/mol,![]() 为-8.289 02 MJ/mol。
为-8.289 02 MJ/mol。
铬渣处理过程中可能发生的化学反应见表4。根据公式![]() 或
或![]()
![]() 计算各化学反应在298 K和348 K时的标准吉布斯自由能变化
计算各化学反应在298 K和348 K时的标准吉布斯自由能变化![]() ,计算所用热力学参数为表3和上述根据文献计算所得热力学参数。然后,由等温方程式
,计算所用热力学参数为表3和上述根据文献计算所得热力学参数。然后,由等温方程式![]()
![]() 得出各化学反应的标准平衡常数
得出各化学反应的标准平衡常数![]() ,进而求出反应在温度T下达到平衡时ln c(CO32-)与ln c(OH-)的关系式。推导浓度时均以溶液中离子浓度代替活度进行计算,并且设溶液中c(Al(OH)4-)=0.1 mol/L,c(CrO42-)= 0.01 mol/L。最后,根据不同温度下溶液中c(H+)与c(OH-)之间的关系,得到各化学反应达到平衡时的 lg c(CO32-)-pH关系式,计算结果见表4。
,进而求出反应在温度T下达到平衡时ln c(CO32-)与ln c(OH-)的关系式。推导浓度时均以溶液中离子浓度代替活度进行计算,并且设溶液中c(Al(OH)4-)=0.1 mol/L,c(CrO42-)= 0.01 mol/L。最后,根据不同温度下溶液中c(H+)与c(OH-)之间的关系,得到各化学反应达到平衡时的 lg c(CO32-)-pH关系式,计算结果见表4。
2.1.3 热力学平衡图的绘制及其分析
由于在酸性条件下CO32-会转变为H2CO3,研究CO32-对含Cr(Ⅵ)物质的分解作用没有意义,因此,只讨论体系在弱酸性到碱性条件下(6<pH<14)铬渣中各物质的反应行为,并且在此条件下CrO42-转变为Cr2O72-的程度很弱,可以忽略CrO42-浓度变化对热力学计算的影响。在Na2CO3-CO2-H2O处理体系中,由于CO32-参与分解反应并生成OH-,导致CO32-浓度下降和碱度上升。但是,通入的CO2气体通过溶解反应CO2+H2O=H2CO3及中和反应2OH-+H2CO3= CO32-+2H2O,可以维持CO32-的浓度稳定并调节体系
的pH。为了便于分析,在此没有考虑CO2气体分压对各物质分解的影响。
由表4中lg c(CO32-)-pH关系式(1)~(5)绘制出 25 ℃时水榴石在Na2CO3-CO2-H2O体系中的热力学平衡图,同样可绘制出75 ℃时的热力学平衡图,将两图叠加得到图1。依此方法,可由表4中关系式绘制水铝钙石、水滑石和钙铁石在Na2CO3-CO2-H2O体系中的热力学平衡图,分别如图2~4所示。
由图1可知:在75 ℃下且6.6<pH<10.8时,体系中存在水榴石的稳定区且不会有CaCrO4生成;当体系的pH满足此条件并且c(CO32-)>3.16×10-7 mol/L时,水榴石将被分解而转变为CaCO3且稳定存在。另外,从图1中不同温度下平衡线的走向可以看出:降低温度后CaCO3的稳定区有所扩大,说明降低温度有利于水榴石的分解。图2中各平衡线的走向与图1中的相似,在75 ℃且6.6<pH<12.2,c(CO32-)>2×10-4 mol/L时,体系处于CaCO3的稳定区,水铝钙石可被分解而转变为CaCO3且稳定存在。但从图3
表2 铬渣中Cr(Ⅵ)的存在形式
Table 2 Existing forms of Cr(Ⅵ) in COPR
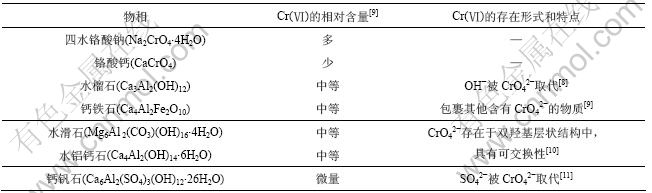
表3 体系中相关物质的热力学参数
Table 3 Thermodynamic data of related substances in system
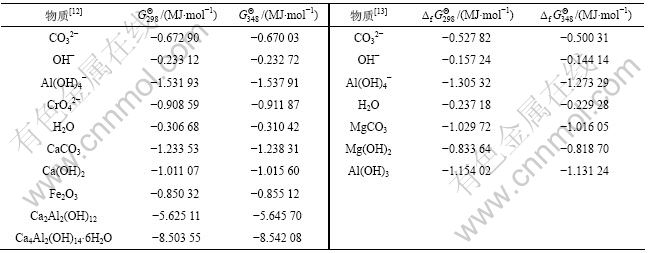
表4 铬渣在Na2CO3-CO2-H2O体系中可能发生的化学反应及lg c(CO32-)-pH关系式(25 ℃时)
Table 4 Possible chemical reactions of COPR in Na2CO3-CO2-H2O system and lg c(CO32-)-pH relationships
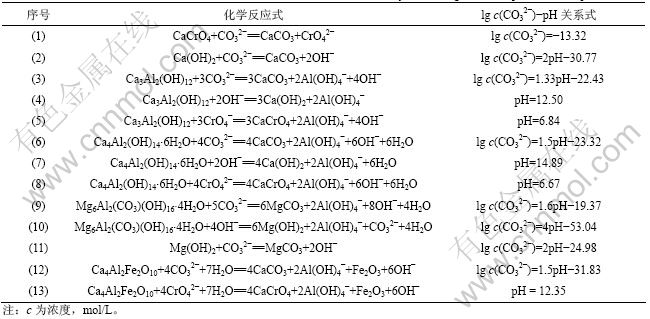
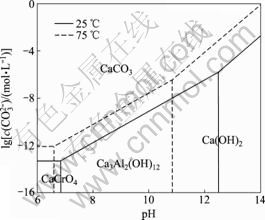
图1 水榴石在Na2CO3-CO2-H2O体系中的热力学平衡图
Fig.1 Thermodynamic equilibrium diagram of hydrogarnet in Na2CO3-CO2-H2O system
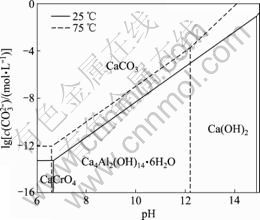
图2 水铝钙石在Na2CO3-CO2-H2O体系中的热力学平衡图
Fig.2 Thermodynamic equilibrium diagram of hydrocalumite in Na2CO3-CO2-H2O system
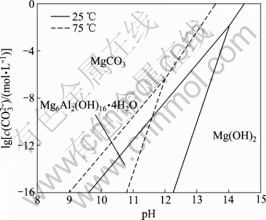
图3 水滑石在Na2CO3-CO2-H2O体系中的热力学平衡图
Fig.3 Thermodynamic equilibrium diagram of hydrotalcite in Na2CO3-CO2-H2O system
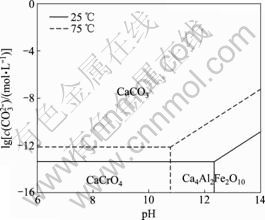
图4 钙铁石在Na2CO3-CO2-H2O体系中的热力学平衡图
Fig.4 Thermodynamic equilibrium diagram of brownmillerite in Na2CO3-CO2-H2O system
可以看出:在75 ℃时,将水滑石分解而转变为MgCO3所需CO32-的浓度很高,需要满足c(CO32-)>6.3 mol/L,这实际上说明CO32-不能分解水滑石。然而,当体系中pH>12时,水滑石可以被OH-分解而转变为Mg(OH)2稳定存在,且升高温度有利于水滑石的分解。从钙铁石的热力学平衡图(图4)可知:75 ℃时钙铁石的稳定区很小,仅在pH>10.8时稳定;当体系满足pH<10.8并且c(CO32-)>8.13×10-13 mol/L时,钙铁石将被分解而转变为CaCO3,且其分解趋势很大。
上述分析表明:采用Na2CO3-CO2-H2O体系处理铬渣以强化其中含Cr(Ⅵ)的钙镁化合物的分解在热力学上是可行的。在75 ℃,6.6<pH<10.8,且c(CO32-)>1.55×10-6 mol/L时,铬酸钙、水榴石、水铝钙石及钙铁石可被分解而转变为CaCO3,但水滑石难以被分解。
2.2 铬渣处理实验结果
为考察不同pH及CO32-浓度的浸出剂处理铬渣的效果,分别用H2O,CO2-H2O,Na2CO3-H2O及Na2CO3-CO2-H2O 4种不同浸出剂处理铬渣。实验条件如下:反应温度为80 ℃,碳酸钠质量浓度为120 g/L(以Na2O计),反应时间为6 h,液固比为15。实验结果如图5所示。
测得铬渣用浸出剂A~D处理后的溶液pH分别为11.18,8.15,12.20和9.74。从图5可以看出:用A~D这4种浸出剂处理铬渣,处理后渣中Cr(Ⅵ)的含量依次降低;H2O的处理效果最差,处理后渣中Cr(VI)的质量分数由原铬渣中的1.16%(见表1)降至0.78%;Na2CO3-CO2-H2O的处理效果最好,处理后渣中Cr(Ⅵ)的含量降至0.17%。对H2O处理渣、Na2CO3-CO2-H2O处理渣及原铬渣进行XRD分析,结果如图6所示。
从图6(a)可以看出:原铬渣中存在水榴石、水铝钙石、水滑石及钙铁石这4种含Cr(Ⅵ)的物质。铬渣用水处理后这些物质的衍射峰没有明显变化(见图6(b))。这说明当反应体系中不存在CO32-时,这些物质不发生反应或者反应速度很慢[17]。然而,图6(c)中物质的衍射峰与图6(b)中的相比有明显变化,这表明在Na2CO3-CO2-H2O体系中铬渣中各物质发生了显著的化学反应;CaCO3的衍射峰明显增强,钙铁石和Ca(OH)2的衍射峰明显减弱,水铝钙石的衍射峰彻底消失,且未见CaCrO4生成,这与热力学分析结果一致。另外,Mg(OH)2的衍射峰明显减弱,水滑石的衍射峰略微增强,这与体系处于水滑石的稳定区(见图3)从而Mg(OH)2转变为水滑石相符合。然而,水榴石的衍射峰无明显变化,其原因可能是其被原铬渣中的钙铁石等包裹[9],或者被新生成的CaCO3包裹,从而阻碍反应进行。

图5 浸出剂对处理后渣中Cr(Ⅵ)含量的影响
Fig.5 Effects of leaching reagents on mass fraction of Cr(Ⅵ) in treated COPR
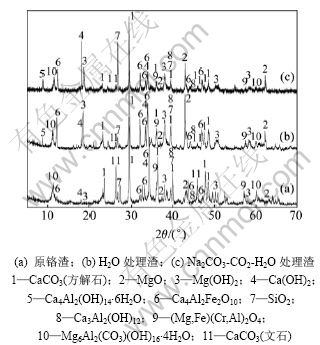
图6 原铬渣和经不同浸出剂处理后渣的XRD图
Fig.6 XRD patterns of untreated COPR and COPR treated with different leaching reagents
在其他实验条件一定的情况下,将铬渣在Na2CO3-CO2-H2O体系中处理24 h以使反应进行得更加彻底。为了消除反应生成的沉淀对铬渣中Cr(Ⅵ)形成包裹所造成的影响,将处理后的铬渣用水湿磨,然后,用此体系进行二次处理,测得二次处理铬渣中Cr(Ⅵ)的含量降至0.13%,铬渣中Cr(Ⅵ)的浸出率达到85%。采用HJ/T 299—2007《固体废物浸出毒性浸出方法:硫酸硝酸法》对处理后的铬渣进行毒性实验,毒性浸出液中Cr(Ⅵ)和总Cr质量浓度分别为1.21 mg/L和1.51 mg/L,均远低于HJ/T 301—2007《铬渣污染治理环境保护技术规范》中规定的限值。因此,可将处理后的铬渣送入一般工业固体废物填埋场进行填埋。
3 结论
(1) 在75 ℃,Na2CO3-CO2-H2O体系满足6.6< pH<10.8并且c(CO32-)>1.55×10-6 mol/L时,铬渣中含Cr(Ⅵ)的物质铬酸钙、水榴石、水铝钙石及钙铁石将被分解而转变为CaCO3,且降低温度有利于这些物质的分解;水滑石难以被CO32-分解,但在75 ℃且当体系中pH>12时可被OH-分解为Mg(OH)2。
(2) 在温度为80 ℃,液固比为15,Na2CO3质量浓度为120 g/L,CO2体积分数为5%的条件下,采用Na2CO3-CO2-H2O体系处理铬渣24 h,再对处理后的铬渣进行湿磨处理并且二次浸出,最终处理铬渣中Cr(Ⅵ)的质量分数降至0.13%,其毒性浸出液中Cr(Ⅵ)和总Cr的质量浓度分别为1.21 mg/L和1.51 mg/L,符合一般工业固体废物填埋的标准。
参考文献:
[1] 丁翼. 铬化合物生产与应用[M]. 北京: 化学工业出版社, 2003: 272.
DING Yi. Chromium compounds production and applications [M]. Beijing: Chemical Industry Press, 2003: 272.
[2] Dermatas D, Chrysochoou M, Moon D H, et al. Ettringite induced heave in chromite ore processing residue (COPR) upon ferrous sulfate treatment[J]. Environmental Science & Technology, 2006, 40(18): 5786-5792.
[3] 黄双双, 黄源伟. 42万t铬渣综合治理的研究及其环评要点[J]. 企业技术开发, 2008, 27(2): 9-12.
HUANG Shuang-shuang, HUANG Yuan-wei. Study on the comprehensive treatment of 420 000 t chromic residue and the outline of environmental impact review[J]. Technological Development of Enterprise, 2008, 27(2): 9-12.
[4] 景学森, 蔡木林, 杨亚提. 铬渣处理处置技术研究进展[J]. 环境技术, 2006, 24(3): 33-36.
JING Xue-sen, CAI Mu-lin, YANG Ya-ti. Current development on technologies of chromite ore processing residue treatment and disposal[J]. Environmental Technology, 2006, 24(3): 33-36.
[5] Geelhoed J S, Meeussen J C L, Hillier S, et al. Identification and geochemical modeling of processes controlling leaching of Cr(Ⅵ) and other major elements from chromite ore processing residue[J]. Geochimica et Cosmochimica Acta, 2002, 66(22): 3927-3942.
[6] 景学森, 杨亚提, 蔡木林. 铬渣中Cr(Ⅵ)在盐溶液中的浸出机理[J]. 西北农林科技大学学报: 自然科学版, 2007, 35(8): 151-154.
JING Xue-sen, YANG Ya-ti, CAI Mu-lin. Study on leaching mechanism of hexavalent chromium leaching from chromium residue in salt solutions[J]. Journal of Northwest Agriculture & Forestry University: Science and Technology, 2007, 35(8): 151-154.
[7] 陈振林, 黄志强. 二氧化碳常温浸提法回收铬渣中铬的研究[J]. 无机盐工业, 2006, 38(8): 42-44.
CHEN Zhen-lin, HUANG Zhi-qiang. Study on the recovery of Cr(Ⅵ) from chrome residue by extracting with carbon dioxide at normal temperature[J]. Inorganic Chemicals Industry, 2006, 38(8): 42-44.
[8] Hillier S, Lumsdon D G, Brydson R, et al. Hydrogarnet: A host phase for Cr(Ⅵ) in chromite ore processing residue (COPR) and other high pH wastes[J]. Environmental Science & Technology, 2007, 41(6): 1921-1927.
[9] Hillier S, Roe M J, Geelhoed J S, et al. Role of quantitative mineralogical analysis in the investigation of sites contaminated by chromite ore processing residue[J]. Science of the Total Environment, 2003, 308(1/3): 195-210.
[10] Chrysochoou M, Dermatas D. Application of the rietveld method to assess chromium(Ⅵ) speciation in chromite ore processing residue[J]. Journal of Hazardous Materials, 2007, 141(2): 370-377.
[11] Palmer C D. Precipitates in a Cr(Ⅵ)-contaminated concrete[J]. Environmental Science & Technology, 2000, 34(19): 4185-4192.
[12] 杨显万, 和蔼平, 袁宝州. 高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983: 20-352.
YANG Xian-wan, HE Ai-ping, YUAN Bao-zhou. The handbook of high temperature aqueous solution thermodynamic data[M]. Beijing: Metallurgical Industry Press, 1983: 20-352.
[13] 李永芳. 氧化铝生产热力学数据库的研究与开发[D]. 长沙: 中南大学冶金科学与工程学院, 2001: 15-40.
LI Yong-fang. Research on thermodynamic data for alumina production[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2001: 15-40.
[14] Lee Y M, Nassaralla C L. Heat capacities of calcium chromate and calcium chromite[J]. Thermochimica Acta, 2001, 371(1/2): 1-5.
[15] WANG Tian-gui, LI Zuo-hu. Some thermodynamic properties of calcium chromate[J]. Journal of Chemical and Engineering Data, 2004, 49(5): 1300-1302.
[16] Allada R K, Navrotsky A, Berbeco H T, et al. Thermochemistry and aqueous solubilities of hydrotalcite-like solids[J]. Science, 2002, 296(26): 721-723.
[17] 盛灿文, 柴立元, 王云燕, 等. 铬渣中六价铬水浸动力学研究[J]. 安全与环境工程, 2006, 13(3): 40-44.
SHENG Can-wen, CHAI Li-yuan, WANG Yun-yan, et al. Study on leaching kinetics of Cr(Ⅵ) from chromium-containing slag[J]. Safety and Environmental Engineering, 2006, 13(3): 40-44.
收稿日期:2010-06-10;修回日期:2010-08-28
基金项目:湖南省科技重大专项项目(2009FJ1009)
通信作者:周秋生(1972-),男,湖南涟源人,博士,副教授,从事碱法冶金的研究;电话:0731-88830453;E-mail: qszhou@csu.edu.cn
[1] 丁翼. 铬化合物生产与应用[M]. 北京: 化学工业出版社, 2003: 272.
[3] 黄双双, 黄源伟. 42万t铬渣综合治理的研究及其环评要点[J]. 企业技术开发, 2008, 27(2): 9-12.
[4] 景学森, 蔡木林, 杨亚提. 铬渣处理处置技术研究进展[J]. 环境技术, 2006, 24(3): 33-36.
[6] 景学森, 杨亚提, 蔡木林. 铬渣中Cr(Ⅵ)在盐溶液中的浸出机理[J]. 西北农林科技大学学报: 自然科学版, 2007, 35(8): 151-154.
[7] 陈振林, 黄志强. 二氧化碳常温浸提法回收铬渣中铬的研究[J]. 无机盐工业, 2006, 38(8): 42-44.
[17] 盛灿文, 柴立元, 王云燕, 等. 铬渣中六价铬水浸动力学研究[J]. 安全与环境工程, 2006, 13(3): 40-44.


