文章编号:1004-0609(2010)07-1418-06
硝酸氧化浸出难冶炼高砷钴矿
郑雅杰1,滕 浩1,闫海泉2
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 白银有色金属公司,白银 730900)
摘 要:
在100 g钴矿加入39 mL浓硫酸、浸出温度80 ℃、浸出时间2 h、液固比2?1时,采用常规的硫酸浸出,钴浸出率仅为16.86%;当100 g钴矿中加入42.5 mL浓硫酸、在焙烧温度630 ℃、焙烧时间1.5 h的焙烧条件下,采用硫酸化焙烧后硫酸浸出,钴浸出率达到67.48%;在100 g钴矿中加入39 mL浓硫酸和56 mL浓硝酸、浸出温度60 ℃、浸出时间4 h、液固比为3?1时,采用硝酸氧化下硫酸浸出,钴浸出率为96.35%。
关键词:
中图分类号:TF803.21 文献标志码:A
Nitric acid oxidation leaching of cobalt from refractory high-arsenic cobalt ores
ZHENG Ya-jie1, TENG Hao1, YAN Hai-quan2
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Baiyin Nonferrous Metals Company, Baiyin 730900, China)
Abstract: The leaching rate of Co is only 16.86% under condition of 39 mL sulfuric acid in 100 g cobalt ores, reaction time 2 h, reaction temperature 80 ℃, the ratio of liquid to solid 2?1 when high-arsenic cobalt ores was leached by sulfuric acid solution. The leaching rate of Co reaches 67.48% when 100 g cobalt ores was contacted with 42.5 mL sulfuric acid and roasted at 630 ℃ for 1.5 h, and then the obtained calcine is leached in sulfuric acid solution. In the process of nitric acid oxidation leaching with sulfuric acid, the leaching rate of Co is 96.35% when the nitric acid and sulfuric acid addition volume are 56 mL and 39 mL in 100 g cobalt ores, reaction time is 4 h, reaction temperature is 60 ℃, the ratio of liquid to solid is 3?1.
Key words: high-arsenic cobalt ores; oxidation leaching; sulfuric acid; nitric acid
钴作为重要的战略金属,由于其具有优良的物理、化学和力学性能,是各种特殊钢、耐热合金、抗腐蚀合金、磁性合金、硬质合金、催化剂及电池等生产的重要原料[1-3],广泛用于航空航天、电机电器、机械、化工、陶瓷和电池工业等领域[4-5]。我国钴资源缺乏,单一的钴矿储量仅2%左右,多数以共生元素的形式存在于镍、铜、铁等矿脉当中[6-7]。在自然界中,钴的赋存状态主要以独立钴矿物形式存在、以类质同像或包裹体形式存在和以吸附形式存在[8]。目前,生产钴的原料分为两大类:一类是各种含钴矿物原料,如钴土矿、钴硫精矿、硫化铜镍矿渣、砷钴矿、锌冶炼钴渣、黄铁矿及深海锰结核等[9-12];另一类是在生产和使用中产生的含钴废料,如各种含钴合金废料、含钴废催化剂及含钴废二次电池材料等[13-14]。由于各种钴原料的成分及含量差异,钴的提取方法较多,综合起来可以归为两类:一类是火法-湿法联合流程,即钴原料经火法预处理,使钴初步富集,然后通过湿法提取;另一类是全湿法流程,即钴原料经湿法浸出、脱除杂质制备纯净钴溶液和制备得到钴及其化合 物[15-16]。本研究针对青海某高砷钴矿的特点,通过比较传统工艺和硝酸氧化下硫酸浸出试验研究,确定处理该钴矿方法—硝酸氧化下硫酸浸出工艺,为难冶炼钴矿的利用提供一条可行途径。
1 实验
实验原料为青海某地高砷钴矿,其成分分析如表1所列,钴的物相分析如表2所列,其XRD谱如图1所示,扫描电镜和能谱分析结果分别如图2和表3所示。
由表1和2可知,原料中钴含量(质量分数)为1.62%,并含有大量的铁和砷,其含量分别为33.35%、23.26%,原料中的钴主要以类质同象形态存在,其含量为1.3%,0.3%钴存在于硅酸盐中,仅有极少量的钴
表1 高砷钴矿的成分
Table 1 Chemical components of high-arsenic cobalt ores (mass fraction, %)
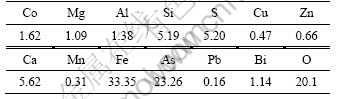
表2 高砷钴矿中钴的物相分析
Table 2 Analysis results of Co phase in high-arsenic cobalt ores

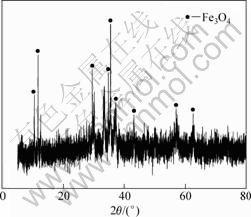
图1 高砷钴矿的XRD谱
Fig.1 XRD pattern of high-arsenic cobalt ores

图2 高砷钴矿的SEM像
Fig.2 SEM image of high-arsenic cobalt ores
表3 图2中a和b点的能谱扫描元素分析结果
Table 3 EDS analysis results of points a and b in Fig.2
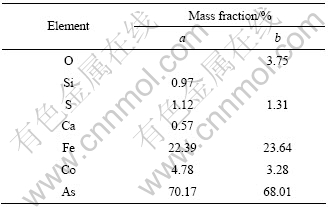
以氧化矿形态存在。由图1可知,原料中存在Fe3O4。由图2和表3可知,原料中的钴与铁、砷相伴生在一起。因此,原料为难处理高砷钴矿。
将一定浓度的硝酸和硫酸溶液配置后倒入容量为1 L的三颈瓶中,启动搅拌,加入称量好的钴矿,在电热套中加热至所需温度,反应一定时间后过滤并分析。其工艺流程如图3所示。
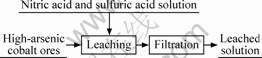
图3 硝酸氧化硫酸浸出高砷钴矿工艺流程示意图
Fig.3 Flow sheet of high-arsenic cobalt ores leached by nitric acid oxidation in sulfuric acid solution
采用原子吸收分光光度计分析溶液中钴,用X荧光分析(XRF)测定固体产物成分,用ICP分析溶液成分及含量。
通常钴矿提钴采用硫酸浸出及硫酸化焙烧后硫酸浸出工艺。
采用硫酸直接浸出,取100 g钴矿,当浸出温度为80 ℃、浸出时间为2 h、液固比为2?1时,硫酸用量对钴浸出率的影响如图4所示。由图4可知,当硫酸用量为19.5 mL时,钴浸出率为13.98%;增加硫酸用量,硫酸浓度增大,钴浸出率也随之增大;当硫酸用量为39 mL时,钴浸出率达到最大,为16.86%;继续增大硫酸用量,钴浸出率反而降低。矿石中的钴主要与铁以类质同象的形式存在,并存在氧化钴,在硫酸作用下,发生如下反应:
(Fe,Co)3O4+H+→Co2++Fe3++H2O (1)
CoO+2H+→Co2++H2O (2)
当易于与硫酸反应的钴被浸出后,继续增加硫酸用量,不能破坏其它含钴矿物结构,而其中的钴不能被浸出。因此,钴浸出率较低。
采用硫酸化焙烧后硫酸浸出工艺,在100 g钴矿中加入42.5 mL浓硫酸、焙烧时间为1.5 h条件下焙烧,焙砂在直接硫酸浸出的适宜条件下浸出,焙烧温度对钴浸出率的影响如图5所示。由图5可知,随着焙烧温度的升高,钴浸出率明显增加;当焙烧温度达到630 ℃,钴浸出率达到67.48%,继续升高焙烧温度,钴浸出率基本保持不变。焙烧过程中主要发生如下反应:
(Fe,Co)AsS+O2→Co3O4+Fe2O3+As2O3+SO2↑ (3)
CoO+O2→Co2O3 (4)
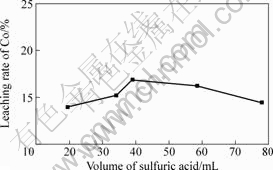
图4 硫酸用量对钴浸出率的影响
Fig.4 Effect of volume of sulfuric acid on leaching rate of Co
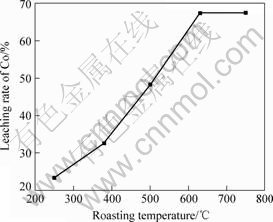
图5 焙烧温度对钴浸出率的影响
Fig.5 Effect of roasting temperature on leaching rate of Co
CoO+O2→Co3O4 (5)
Co2O3+H2SO4→CoSO4+H2O (6)
Co3O4+H2SO4→CoSO4+H2O (7)
Fe3O4+O2→Fe2O3 (8)
矿石焙烧后,其中与铁以同质类象存在的钴矿发生分解,最终生成硫酸钴。因此,焙烧有利于钴的提取。
实验表明:钴矿经过氧化焙烧后,含钴矿石发生分解,钴浸出率明显提高。因此,采用硫酸溶液浸取钴,加入硝酸使含钴矿石在溶液中发生分解,以利于钴的浸出。
2.2.1 硝酸用量对钴浸出率的影响
取100 g钴精矿,当浸出温度为80 ℃、浸出时间为6 h、液固比为3?1、硫酸用量为39 mL时,硝酸用量对钴浸出率的影响如图6所示。
由图6可知:随着硝酸用量的增加,钴浸出率明显提高,当硝酸用量由34 mL增加到56.5 mL时,钴浸出率由75.6%增加到93.3%;随着铁浸出率的增加,钴的浸出率也随着增加,说明矿石中铁与钴以类质同象形式存在,浸出过程中主要发生以下反应:
(Fe,Co)AsS+H++NO3-→
Fe3++Co2++AsO43-+SO32-+NO↑+H2O (9)
FeS2+H++NO3-→
Fe3++NO↑+SO42-+H2O (10)
(Fe,Co)3O4+H++NO3-→
Co2++Fe3++NO↑+H2O (11)
CoO+H+→Co2++H2O (12)
NO+O2+H2O→HNO3 (13)
当硝酸用量较低时,随着硝酸用量的增加,反应速率增加,钴的浸出率也随之增大;当硝酸用量超过 56.5 mL时,继续增加硝酸用量,钴浸出率随硝酸用量变化不大。因此,选取硝酸的最佳用量为 56.5 mL。
2.2.2 浸出时间对钴浸出率的影响
其它条件不变,硝酸用量为56.5 mL,浸出时间对钴浸出率的影响如图7所示。由图7可知:随着浸出时间的增加,钴浸出率随之提高,当浸出时间由1 h延长至4 h,钴浸出率从90.3%增加到93.51%;继续延长浸出时间,钴浸出率增加不明显,而铁浸出率明显增加,后续除铁过程将增加成本。因此,选用最佳浸出时间为4 h。
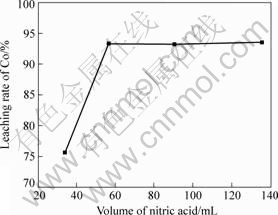
图6 硫酸用量对钴浸出率的影响
Fig.6 Effect of volume of nitric acid on leaching rate of Co
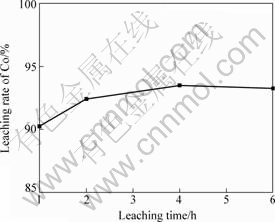
图7 浸出时间对钴浸出率的影响
Fig.7 Effect of leaching time on leaching rate of Co
2.2.3 浸出温度对钴浸出率的影响
其它条件不变,当反应时间为4 h时,浸出温度对钴浸出率影响如图8所示。
由图8可知:随着浸出温度升高,钴浸出率提高;当浸出温度为80 ℃时,钴浸出率达到93.51%。温度升高对化学反应速率具有促进作用,所以钴浸出率随着温度的升高而增大;当浸出温度超过80 ℃,由于硝酸的沸点为83 ℃;继续升高温度,硝酸易挥发,降低了硝酸的浓度,使溶液氧化性和酸性降低。因此,钴浸出率减小。
浸出温度为60 ℃,钴浸出率为92.8%,与80 ℃时的相差不大,但能量消耗低。因此,选择最佳的浸出温度为60 ℃。
2.2.4 液固比对钴浸出率的影响
其它条件不变,当浸出温度为60 ℃,液固比对钴浸出率的影响如9所示。由图9可知:随着液固比的增大,钴浸出率先增大后减小;增大液固比,反应物
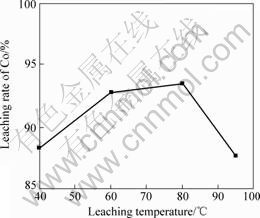
图8 浸出温度对钴浸出率的影响
Fig.8 Effect of leaching temperature on leaching rate of Co
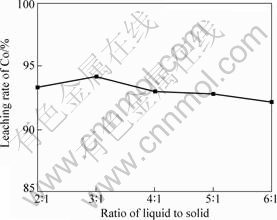
图9 液固比对钴浸出率的影响
Fig.9 Effect of ratio of liquid to solid on leaching rate of Co
的混合更加均匀,钴浸出率增大,当液固比为3?1时,钴浸出率最大,达到94.18%;继续增大液固比时,溶液中硫酸和硝酸的浓度降低,浓度梯度降低,反应物和生成物的扩散速率减慢,所以钴浸出率有所下降。因此,选择最佳的液固比为3?1。
取2.5 kg高砷钴矿﹑0.85 L硫酸和1.41 L硝酸,在浸出温度为60 ℃﹑浸出时间为4 h﹑液固比为3?1条件下进行放大实验。反应后过滤,浸出液主要成分及浸出率如表3所列,浸出渣的主要成分如表4所列,其XRD谱如图10所示。
表3 浸出液主要成分及浸出率
Table 3 Main chemical components of leaching solution and leaching rate

表4 浸出渣主要成分
Table 4 Main chemical components of leaching residue (mass fraction, %)
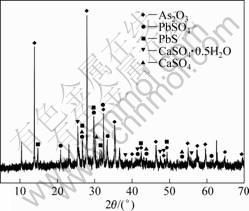
图10 浸出渣的XRD谱
Fig.10 XRD pattern of leaching residue
由表3和4可知,采用硝酸氧化硫酸浸出钴精矿,可以将精矿中钴、铁和砷等有价元素浸出,钴浸出率达到96.35%,铁和砷浸出率分别为56.20%和44.14%。由图10可知,浸出渣主要物相为As2O3、PbSO4、PbS和CaSO4。
3 结论
1) 实验原料为难冶高砷钴矿,化学分析其中铁、砷和钴含量分别为33.20%、18.78%和1.49%。钴主要以类质同象形式存在于砷和铁的化合物中。
2) 采用硫酸浸出,在100 g钴矿中加入39 mL浓硫酸、浸出温度为80 ℃、浸出时间为2 h、液固比为2?1时,钴浸出率为16.86%;采用硫酸化焙烧后硫酸浸出,在焙烧温度为630 ℃、100 g钴矿加入42.5 mL浓硫酸、焙烧时间为1.5 h的焙烧条件下,钴浸出率达到67.48%。
3) 采用硝酸氧化硫酸浸出钴矿时,钴浸出率随硝酸用量的增大和浸出时间的延长而增大,随浸出温度和液固比的增大先增大后减小,其浸出的适宜条件为:100 g钴矿中加入39 mL浓硫酸和56 mL浓硝酸、浸出时间为4 h、浸出温度为60 ℃、液固比为3?1,Co浸出率达到96.35%。
4) 钴矿经硝酸氧化硫酸浸出,残渣主要成分为As2O3、PbSO4、PbS和CaSO4。
REFERENCES
[1] MATJIE R H, MDLELENI M M, SCURRELL M S. Extraction of cobalt(Ⅱ)from an ammonium nitrate-containing leach liquor by an ammonium salt of di(2-ethylhexyl)phosphoric acid[J]. Minerals Engineering, 2003, 16(10): 1013-1017.
[2] SADANANDAM R, FONSECA M F, SRIKANT K, SHARMA A K, TANGRI S K, SURI A K. Recovery of high purity cobalt from spent ammonia cracker catalyst[J]. Hydrometallurgy, 2005, 77(3/4): 247-251.
[3] SWAIN B, JEONG J, LEE J C, LEE G H. Development of process flow sheet for recovery of high pure cobalt from sulfate leach liquor of lithium ion battery industry waste:A mathematical model correlation to predict optimum operational conditions[J]. Separation and Purification Technology, 2008, 63(2): 360-369.
[4] KARGL-SIMARD C, HUANG J H, ALFANTAZI A M. Electrical conductivity and density of CoSO4/H2SO4 solution the range of modern cobalt electrowinning electrolytes[J]. Minerals Engineering, 2003,16(6): 529-535.
[5] JANDOVA J, VU H, DVORAK P. Treatment of sulphate leach liquors to recover cobalt from waste dusts generated by the glass industry[J]. Hydrometallurgy, 2005, 77(1/2): 67-73.
[6] SHARMA I G, PAMELA ALEX, BIDAYE A C, SURI A K. Electrowinning of cobalt from sulphate solutions[J]. Hydrometallurgy, 2005, 80(1/2): 132-138.
[7] 张义忠, 谢 刚, 李荣兴, 杨 棣. 从铜钴尾矿中提钴的浸出实验研究[J]. 中国稀土学报, 2008, 26: 132-137.
ZHANG Yi-zhong, XIE gang, LI Rong-xing, YANG Di. Study on leaching of cobalt in coppertailings materials[J]. Journal of Chinese Rare Earth Society, 2008, 26: 132-137.
[8] 丰成友, 张德全, 党兴彦. 中国钴资源及其开发利用概况[J]. 矿床地质, 2004, 23(1): 93-100.
FENG Cheng-you, ZHANG De-quan, DANG Xing-yan. Cobalt resources of china and their exploitation and utilization[J]. Mineral Deposits, 2004, 23(1): 93-100.
[9] SADANANDAM R, FONSECA M F, SRIKANT K, SHARMA A K, TANGRI S K, SURI A K. Production of high purity cobalt oxalate from spent ammonia cracker catalyst[J]. Hydrometallurgy, 2008,91 (1/4): 28-34.
[10] 侯慧芬. 从各种含钴原料中提取电解钴[J]. 上海有色金属, 2001, 22(3): 132-137.
HOU Hui-fen. Extraction of cobalt by electrolysis from various kinds of cobalt-containing raw materials [J]. Shanghai Nonferrous Metals, 2001, 22(3): 132-137.
[11] 曹异生. 钴工业现状及发展前景[J].中国金属通报, 2006(1): 6-9.
CAO Yi-sheng. Present status and future prospects of cobalt industry [J]. China Metal Bulletin, 2006(1): 6-9.
[12] 兰玮锋, 米玺学. 从氧化钴矿石中提取钴的试验研究[J]. 湿法冶金, 2008, 27(4): 230-233.
LAN Wei-feng, MI Xi-xue. Extraction of cobalt from cobalt oxide ore[J]. Hydrometallurgy of China, 2008, 27(4): 230-233.
[13] 谢福标. 含钴废料回收工艺述评[J]. 矿冶, 2003, 12(1): 63-66.
XIE Fu-biao. Review on recovery technology of cobaltiferous waste materials[J]. Mining and Metallurgy, 2009, 27(2): 16-18.
[14] 李安国, 廖春发, 饶先发. 从含钴废料中回收钴的研究进展[J].中国资源综合利用, 2009, 27(2): 16-18.
LI An-guo, LIAO Chun-fa, RAO Xian-fa. Study on recovery of cobalt from cobalt-containing wastes [J]. China Resources Comprehensive Utilization, 2009, 27(2): 16-18.
[15] 杨遇春. 再生钴的生产现状和开发前景[J]. 中国资源综合利用, 2001(9): 16-22.
YANG Yu-chun. Cobalt separation technologies and their application to scrap treatment[J]. China Resources Comprehensive Utilization, 2001(9): 16-22.
[16] 刘三平, 王海北, 蒋开喜, 王玉芳. 钴提取分离技术分析与应用[J]. 有色金属, 2004, 56(2): 73-76.
LIU San-ping, WANG Hai-bei, JIANG Kai-xi, WANG Yu-fang. Cobalt separation technologies and their application to scrap treatment[J]. Nonferrous Metals, 2004, 56(2): 73-76.
(编辑 李艳红)
基金项目:广东省教育部产学研重大资助项目(2008A090300016)
收稿日期:2009-09-18;修订日期:2009-12-11
通信作者:郑雅杰,教授,博士;电话:0731-88836285;E-mail:zzyyjj01@yahoo.com.cn


