主因子分析方法在确定地下水石油烃生物降解过程中的应用
吕航,刘明遥,苏小四,林广宇
(吉林大学 地下水资源与环境教育部重点实验室,吉林 长春,130026)
摘 要:
污染场地地下水生物降解作用机制,通过主因子分析方法对场地三期水化学监测数据进行研究,将各变量归纳为5个主因子,因子1主要由Ca2+,Mg2+,K+和Cl-构成,与矿物溶解反应关系密切,因子2~5与石油烃污染物(总油)、生物降解产物(HCO3-等)、电子受体(SO42-等)和水化学环境指标(pH等)等相关性较强,表征了石油烃生物降解作用(以有氧呼吸、硫酸盐还原和硝酸盐还原为主)对水化学环境的影响,上述指标在空间上的变化规律也进一步验证了反应的发生。同时,代表微生物降解作用的主因子得分系数在场地污染源和污染晕上游位置为正值,其他位置均为负值,表明该位置地下水主要受微生物降解作用的控制,而矿物溶解作用则主要影响了污染晕下游和边缘位置的水化学条件。采用主因子分析方法可以更进一步分析解释监测数据,为识别微生物降解作用的发生和确定主要的氧化还原过程提供一种有效的手段。
关键词:
中图分类号:P641.3;X523 文献标志码:A 文章编号:1672-7207(2013)08-3552-09
Determination of biogeochemical processes in oil-contaminated aquifer using principal component analysis
L Hang, LIU Mingyao, SU Xiaosi, LIN Guangyu
Hang, LIU Mingyao, SU Xiaosi, LIN Guangyu
(Key Laboratory of Groundwater Resources and Environment, Ministry of Education,Jilin University, Changchun 130026, China)
Abstract: Three rounds of monitoring data were used to analyze the most important governing processes and their space distribution by principal component analysis. Five factors explaining most of the variability were extracted. Factor 1 is highly correlated with Mg2+, Ca2+, K+ and Cl-, which can be interpreted as the mineral dissolution factor. Factors 2-5 are all correlated with the petroleum hydrocarbons contaminants, degradation products (HCO3-), electron acceptors (such as SO42-) and indicators of environmental conditions (pH), indicating the occurrence of biodegradation processes, especially sulfate reduction, aerobic respiration and nitrate reduction, and the space distribution of the indicators above also confirms the reaction. On the other hand, the scores of Factor 2, which represent the biodegradation process, are positive in the core and upgradient of the contaminated plume and negative in the downgradient, which further confirm that from the core and upgradient of the contaminated plume to the the downgradient, the impact of biodegradation weakens and mineral dissolution strengthens. The principal component analysis can further explain the monitoring data, and it is a useful tool to study the biodegradation processes and identify the dominant terminal electron-accepting process in contaminated aquifers.
Key words: groundwater; petroleum hydrocarbons contamination; biodegradation; principal component analysis
近年来,因石油泄漏造成的水土污染已成为威胁饮用水安全的普遍问题[1]。石油烃中含多种具有致癌、致畸和致突变性的化学物质,对人类健康构成了直接威胁[2]。因此,如何经济、快速、有效地去除地下水中石油类污染物,确保地下水供水安全已成为各国环境学者研究的热点。在地下水修复的众多方法中,基于污染场地自身理化、生物条件和污染物自然衰减能力进行有监测控制的自然衰减修复技术因其具有不产生次生污染物、对生态环境和土地使用的干扰程度较小、修复费用远远低于其他修复技术等特点而备受关注[3]。但该技术对区域地下水和土壤环境的自然衰减能力有较高要求,因此选择该技术修复野外污染场地前需要针对场地具体情况进行可行性分析[4]。根据污染物的衰减机理,只有生物降解作用可以通过破坏污染物的结构而将其去除。因此,生物降解作用是地下水中石油烃自然衰减修复技术研究的重点,对于评价自然衰减技术的可行性和适宜性尤为关键。石油类污染物进入地下水环境后,增高了地下水中有机碳含量,地下水土中微生物会在石油烃的驯化下逐渐适应受污染环境,使得其数量有所增加[4],这些微生物利用O2、NO3-、铁锰氧化物、SO42-等作为电子受体[5],将石油烃类有机物转化为CO2和H2O等无机物,同时将电子受体还原为低价态化合物[6]。在上述反应过程中,地下水中污染物、代谢产物和电子受体(SO42-和NO3-等)等水化学指标含量会发生相应的变化,因此通过对地下水水化学的时空分布特征和演化规律的分析可以识别石油烃生物降解作用和水岩作用的发生及各反应过程的分布范围[5-9]。上述研究过程需要对大量数据进行分析,而pH、氧化还原电位、溶解氧等地球化学参数可能同时受到多种物理、化学、生物过程的影响[10],因此对上述数据进行分析的过程中需要通过确定各类数据之间的关系来识别控制各参数的反应机制,该过程可以通过对监测数据进行主因子分析的方法来解 决[11]。主因子分析方法首先由Spearman在1901年提出。它通过将大量数据归类为少数几个因子并解释数据的变异性来揭示潜在的数据结构和变量之间的关系。该方法在地球化学数据中的应用包括描述潜在地下水污染[12]、识别水文地球化学过程[13-15]、识别地下水污染区域等[16]。本研究的污染场地由于油井套外返水和原油泄漏事故使浅层地下水遭到石油烃污染,严重影响了当地居民的地下水用水安全,亟需选取适当的修复方法对该地区地下水进行治理。2009年1月对前期建立的监测网络中的浅层观测井进行了重点采样分析工作,初步证明了微生物降解作用的存在[17]。但前期建立的监测网络缺少污染源等位置的监测控制点,且只针对一期监测数据进行研究。本研究在前期工作基础上,通过补充布设污染源区等位置的监测孔,并采用主因子分析方法对三期水化学监测数据进行分析,确定控制场地地下水化学环境的主要反应过程,从而验证生物降解作用的存在,为评价MNA技术在污染场地地下水石油烃污染修复过程中的可行性提供科学依据。
1 材料和方法
1.1 污染场地概况
研究区位于已有30余年开发历史的某油田采区。该地区属中温带大陆性季风气候,年均降雨量为435.9 mm,年蒸发量为1 694 mm,平均气温约为4.7 ℃,污染场地面积约为9 000 m2,地势平坦,自东南向西北方向倾斜,主要为河谷冲积平原一级阶地以及周围的冲洪积高平原微波状岗地。
地下水主要赋存于第四系松散岩类孔隙、上第三系碎屑岩类裂隙孔隙以及白垩系裂隙孔隙含水层中,其中第四系全新统承压含水层是该地区的主要供水层。图1所示为场地水文地质剖面图,从图1可以看出:该污染场地的浅部地层岩性和厚度相对稳定,含水层由上至下岩性依次为黄褐色细纱、粉砂和砂砾,颗粒逐渐变粗,厚度约为20 m。含水层上部有一层连续的约2 m厚的黏土层构成的隔水层,下部的淤泥质黏土层构成了该含水层的底板。场地这种水文地质结构使得浅层承压含水层构成了一个较为封闭的环境,与大气降水和空气的接触较少,同时地表污染物也很难透过上部的黏土层进入浅层承压地下水中。场地地下水的主要补给来源为微波岗地地下水侧向径流补给,排泄方式主要以侧向径流和人工开采为主。地下水位观测资料显示,污染场地地下水流方向为从东南至西北方向,地下水位埋深约为3.5 m,常年水位较稳定,平均水力坡度为17‰,如图2所示。
根据污染场地的包气带介质TPH(total petroleum hydrocarbon,总石油烃)含量分层取样分析结果,油井套外返水直接穿透含水层造成了该污染场地浅层地下水石油烃污染。地下水中TPH含量监测结果表明:各监测井中地下水均受到了不同程度的污染。监测期间各监测井TPH质量浓度随时间的变化曲线如图3所示,由图3可知:TPH质量浓度基本稳定,空间上地下水中TPH污染晕呈北西-东南方向分布,与地下水流方向近于一致,污染晕的纵向中心轴长约为95 m,横向最大宽度为62 m,总面积约为3 600 m2。在废弃油井附近,地下水的污染程度最高。沿地下水流方向,污染晕质量浓度从大到小呈梯度变化,至场地南端Z10-Z9-Z11断面TPH质量浓度降至0.05 mg/L左右,污染晕轴部大体位于观测孔Z1-1,Z7,Z16和Z9所构成的直线上,轴两侧TPH质量浓度逐渐降低[17]。
1.2 样品采集和测试
污染场地监测网络由20口监测井构成,2009年5月初步建立了11口监测井,其中Z1-1,Z7,Z16和Z9构成了污染晕的纵向监测断面,同时Z6,Z7,Z8和Z19,Z20,Z21以及Z9,Z10,Z11分别构成了污染晕的3个横向监测断面。Z19,Z20和Z22同时用于了解污染晕在横向上的迁移范围。考虑到缺少污染源区监测井,而且前期建立的Z16,Z19和Z20孔钻孔深度大于其他监测井,本研究于2010年7月补充建立了9口监测井,其中:Z23位于污染场地废弃油井附近,为污染源区监测井,Z27,Z28和Z29分别位于Z19,Z20和Z16附近,但井深与其他监测井统一。另外,E1,E2和E3为场地后期强化MNA技术的研发所建。

图1 污染场地Ⅰ-Ⅰ′剖面水文地质剖面图[17]
Fig. 1 Hydrogeological cross section sketch ofⅠ-Ⅰ′[17]

图2 污染场地地下水流场和TPH污染晕空间分布图
Fig. 2 Map of groundwater flow regime and plume of TPH contaminated groundwater

图3 监测井TPH质量浓度随时间变化曲线[17]
Fig. 3 Temporal variation of groundwater TPH concentration[17]
分别于2009年11月、2010年1月和8月对污染场地进行了采样分析,主要测试指标包括地下水中有机和无机化学组分(K+,Na+,Ca2+,Mg2+,SO42-,Cl-,HCO3-,NO3-,NO2-,NH4+,CO32-,PO43-,总铁锰和硫化物等)以及主要物化参数(pH,Eh和DO等)。
采用螺旋钻对不同深度土壤样品进行分层采集。当到达目标层位时,快速采集钻头尖部的土壤样品,并且将土壤样品不留顶空地放入60 mL棕色广口瓶中密封保存。采集地下水样之前先对地下水井洗井,洗井过程抽出地下水体积约为井管内水体积的3~5倍,同时连续测试pH、温度、电导率和氧化还原电位(Eh)等指标,上述指标稳定后开始取样。
土样和地下水中的TPH采用红外分光测油仪(JDS-108U+,吉林北光分析仪器厂,中国)测定;地下水中挥发、半挥发组分全扫描和质量浓度采用气-质联机(GC6890-MS5973,美国)测定;K+,Na+,Ca2+,Mg2+,总Fe和总Mn质量浓度利用原子吸收光谱仪(Perkin Elmer AAnalyst 700,美国)测定;NH4+,NO3-,NO2-和Fe2+质量浓度利用紫外分光光度计(瓦里安CARY50,美国)测定;地下水总碱度和游离CO2采用酸碱指示剂滴定法测试,HCO3-由酚酞指示剂滴定,SO42-质量浓度采用乙二胺四乙酸二钠-钡容量法测定,硫化物通过碘量法测试,Cl-质量浓度利用硝酸根滴定测试。
1.3 主因子分析
综合利用2009年11月、2010年1月和2010年8月3期数据,选取主要阴阳离子(K+,Na+,Ca2+,Mg2+,Cl-,SO42-,HCO3-和NO3-),金属离子(Fe2+和总Mn),主要理化指标(pH,Eh和溶解氧、电导率)以及总石油烃(TPH)等指标作为初始变量,通过主因子分析的方法从上述指标提取出主因子,并结合各主因子对应的监测指标的实际意义确定控制场地地下水环境的主要反应机制,根据场地各个位置主因子得分的高低,讨论主要反应机制在空间上的强弱分布。上述主因子分析过程借助SPSS软件的因子分析功能来计算完成。
2 分析与讨论
2.1 因子分析可行性分析
通过对研究区3期共49个地下水化学样本点进行因子分析获得各变量的相关矩阵见表1。从表1可以看出:多个变量之间的相关系数较大,说明这些变量之间存在着较为显著的相关性,进而也说明了有进行因子分析提取出主要因子的必要。
表1 场地地下水水化学因子相关矩阵
Table 1 Correlation among groundwater chemistry measurement data of studied site
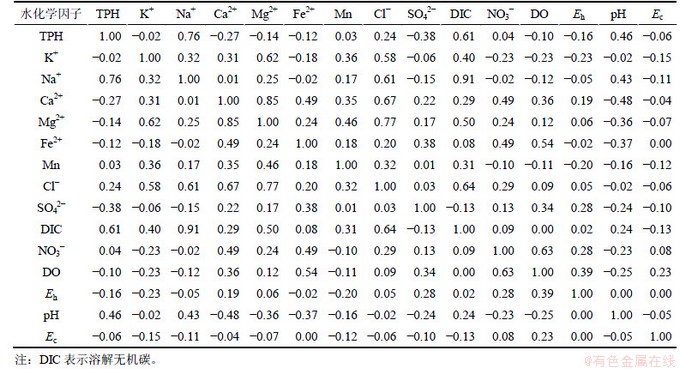
同时,KMO检验取值为0.551,由于一般KMO统计量在0.5以上结果可以接受,因此本次研究中的KMO取值符合要求;另外,Bartlett球形检验统计量的Sig=0(<0.01),由此否定相关矩阵为单位阵的零假设,再次验证了研究区数据进行因子分析的可行性。
2.2 主因子的提取
通过计算得到的场地地下水水化学因子相关矩阵的特征值和累计方差贡献率如表2所示,从表2可以看出:前5个因子的特征值均大于1,且它们的累计方差贡献率达到了78.986%,即可以反映总体样本78.986%的水化学信息量,因此选取这5个因子作为主因子进行分析。
2.3 主因子分析
将研究区地下水化学成分的因子载荷矩阵(表3),通过方差旋转,得到了每个主因子载荷分配更清晰的的因子载荷矩阵(表4)。因子载荷是变量与公共因子的相关系数,对一个变量来说,载荷绝对值较大的因子与它的关系更为密切,更能代表这个变量。由此,对各主因子的意义及其合理性分析如下:
第一主因子F1的方差贡献率为27.35%,主要由Ca2+,Mg2+,K+和Cl-构成。相关研究将上述指标解释为矿物溶解作用[18-21],本研究的污染场地含水介质富含碱性长石、方解石等,随着CO2溶于地下水,促进了上述矿物的风化溶解,增大了地下水中Ca2+和K+含量;另外,场地含水介质富含黏土矿物(表5),因此地下水中阳离子可能与含水介质表面吸附的阳离子发生阳离子交替吸附作用,改变了上述指标在地下水的分布,场地地下水和含水介质各自Na+和Ca2+质量浓度相关关系图如图4和5所示,从图4和5可以看出:地下水和含水介质中二离子均呈较明显的负相关关系,说明了阳离子交替吸附作用的发生。因此主因子F1表征了矿物溶解和阳离子交替吸附作用对地下水化学成分的影响。
表2 场地地下水水化学因子相关矩阵的特征值和累计方差贡献率
Table 2 Eigenvalues of factors extracted through principal component analysis and proportion of variance explained by factors
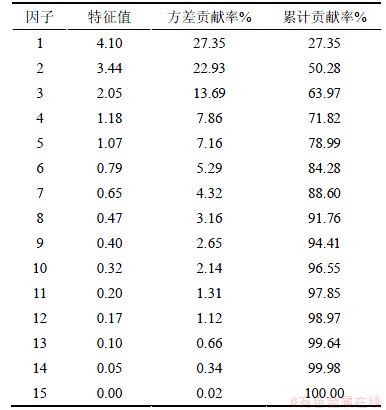
表3 场地地下水水化学指标因子载荷矩阵
Table 3 Factor matrix of studied site

表4 场地地下水水化学指标方差极大旋转因子矩阵
Table 4 Rotated factor pattern of five extracted factors after varimax rotation

表5 污染场地含水层介质X线矿物衍射分析结果
Table 5 Petrographic analysis of aquifer solids by X-ray diffraction
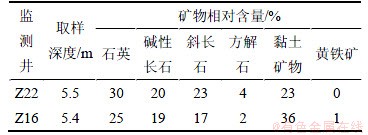
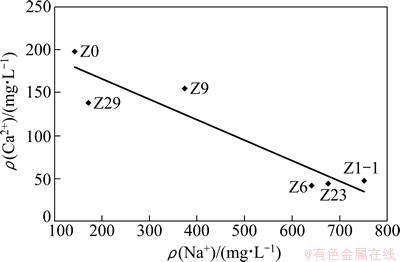
图4 场地污染晕轴线监测井地下水Na+-Ca2+关系图
Fig. 4 Ca2+ plotted versus Na+ for groundwater along contaminate plume

图5 场地污染晕轴线监测井含水介质Na+-Ca2+关系图
Fig. 5 Ca2+ plotted versus Na+ for aquifer medium along contaminate plume
第二主因子F2的方差贡献率为22.93%,主要由TPH,Na+,HCO3-和pH组成。污染场地地下水pH均在7.0~7.5的范围内,因此HCO3-是溶解无机碳(DIC)的主要形态,地下水中DIC含量是评价CO2生成和发生生物降解作用的定性指标参数,石油烃微生物降解作用会产生CO2,溶于水后使地下水中的DIC含量增大:
CO2+H2O→H2CO3 (1)
H2CO3→HCO3-+H+ (2)
图6所示为场地地下水水化学组分纵向变化曲线,由图6(a)可以看出:污染场地DIC含量由污染源向下游随着TPH含量的逐渐降低呈减少的趋势,说明很可能发生了石油烃微生物降解作用,所以污染源附近由于总油含量高,生物降解作用产生CO2相对较多,溶于水后使DIC含量增高更明显,而在污染较轻的地区相对较低。同时,场地地下水中碱度相对于Ca2+浓度明显较高,相关研究中也将其解释为石油烃降解过程引起的[5, 22]。
污染场地地下水中Na+主要来源于碱性长石等矿物的溶解,当地下水中发生石油烃生物降解作用时,产生的CO2溶于水后可能促进其溶解,从而增大地下水中Na+含量。
地下水pH对于无机碳在各种形态间分配有显著的影响,而地下水中无机碳含量的变化也会造成pH的改变。当污染场地发生石油烃生物降解作用时,产生的CO2溶于水会降低地下水的pH。图6所示为随着TPH和DIC含量逐渐升高,pH呈现出增大的趋势,说明污染源和污染晕上游由于石油烃生物降解作用产生的CO2较多,对pH影响较大。
综合以上各成分分析,主因子F2表征了石油烃生物降解作用对地下水环境的影响。
第三主因子F3的方差贡献率为13.69%,主要由NO3-,溶解氧和Fe2+构成。Lovley等[23]认为前两者属于生物降解反应中的电子受体,而Fe2+为Fe3+作为电子受体参与微生物降解反应的产物也说明了该反应过程发生的可能性,相关研究中将上述指标解释为硝酸盐还原、有氧呼吸和铁还原过程[11, 23],三者参与石油烃生物降解的反应可表示为:
CH2+O2→CO2+H2O (3)
5CH2+4NO3-→2N2+4HCO3-+CO2+3H2O (4)
CH2+7CO2+4Fe(OH)3→Fe2++8HCO3-+3H2O (5)
根据式(3)~(5),在污染源附近由于石油烃含量高,使得溶解氧和NO3-等电子受体被消耗更多,而在下游地区,随着总石油烃含量的减少,所消耗的各种电子受体量也相应减少,因此从污染源向下游电子受体浓度应呈逐渐上升的趋势。图6(b)和6(d)所显示的DO和NO3-的变化趋势验证了二者作为电子受体参与了生物降解反应。
第四主因子F4的方差贡献率为7.86%,主要由氧化还原电位(Eh)构成,它作为指示水体氧化还原条件的最直接的指标,在污染越严重的区域由于消耗了大量电子受体,使得环境更趋于还原环境,Eh越低,相反污染较轻的环境Eh越高,偏于氧化环境。从图6(c)可以看出:各监测井Eh均小于0,且总体上呈现由污染源向下游逐渐升高的趋势。

图6 场地地下水水化学组分纵向变化
Fig. 6 Variations of major ions concentration in groundwater flow direction
第五主因子F5的方差贡献率为7.16%,主要由SO42-组成,与F3类似,也反映了污染场地可利用的电子受体[18, 24]。SO42-作为电子受体的反应可表示为:
2CH2+SO42-→H2S+2HCO3- (6)
从图6(f)可以看出:SO42-含量随着远离污染源,总石油烃含量的减少呈逐渐升高的趋势,说明在污染源附近由于利用SO42-作为电子受体的微生物降解更为显著,消耗了更多的SO42-,向下游反应的影响逐渐减弱。
综合以上分析,F2~F5主因子都与石油烃的微生物降解作用有关,因此,控制污染场地地下水化学条件的主要因素可以总结为矿物溶解过程和阳离子交替吸附作用(F1)以及石油烃微生物降解作用(F2~F5)。且F2~F5的方差贡献率总和达到了51.64%,高于F1的27.35%,说明微生物降解作用的影响更为明显。
2.4 主因子得分系数解释
根据上述分析,选取方差贡献率相对最高的F2代表微生物降解作用,通过分析分布于场地内各个位置的观测孔F2因子得分的高低,讨论污染场地石油烃微生物降解反应程度在空间上的强弱分布。由于组成F2主因子的各成分的因子载荷均为正值,所以若各观测孔F2得分越高,则说明微生物降解作用越强,相反则越弱。由图7可以看出:污染场地内Z23,E1,E2,E3,Z1-1,Z6,Z7和Z8孔的F2因子得分为正值,其他各点均为负值,说明前一部分点所在位置地下水中石油烃的微生物降解作用影响较强,而后一部分受该作用影响则相对较弱,相应地以矿物溶解过程(F1)为地下水化学性质的主要控制因素。对比污染场地TPH含量和观测井分布位置(见图1),前一部分点都位于场地污染源和污染晕上游,总石油烃污染物含量较高,促使微生物降解反应更强烈,而后部分点则对应于污染晕下游和边缘位置,由于总石油烃含量较少,微生物降解作用较弱,处于接近未污染的背景环境,验证了分析的合理性。

图7 各监测井F2因子得分系数分布图
Fig. 7 Variability of Factor 2 scores of monitor wells
3 结论
(1) 主因子分析方法将15个监测变量归纳为5个主因子,因子1主要由Ca2+,Mg2+,K+和Cl-构成,与矿物溶解反应关系密切;因子2~5由石油烃污染物、生物降解产物、电子受体和水化学环境指标等组成,表征了石油烃生物降解作用(以有氧呼吸、硫酸盐还原和硝酸盐还原为主)对水化学环境的影响,同时,上述指标空间上的变化规律也进一步验证了反应的发生。
(2) 代表微生物降解作用的主因子得分系数在空间上表现出分带性,根据得分系数确定微生物降解作用主要发生于场地污染源和污染晕上游位置,而矿物溶解作用则主要影响了污染晕下游和边缘位置的水化学条件。
(3) 通过对污染场地水化学数据的分析,确定了微生物降解作用的存在,从反应机理上验证了自然衰减修复技术在该场地修复中的可行性,同时,主因子分析过程识别出场地具体的生物降解过程为有氧呼吸、硫酸盐还原和硝酸盐还原,也为强化自然衰减技术应用中选择何种电子受体向地下水环境投注提供了依据。
(4) 通过对水化学数据的分析确定了场地生物降解等过程的存在,但水化学数据的分析可能具有多解性,进一步研究可以考虑补充对地下水中同位素样品和微生物样品等的分析,为污染场地水化学环境形成机制的研究提供更多依据。
参考文献:
[1] US National Research Council. In situ bioremediation-when does it work?[M]. Washington DC: National Academy Press, 1993:12.
[2] Lesage S, Hao X, Kent S N. Distinguishing natural hydrocarbons from anthropogenic contamination in groundwater[J]. Ground Water, 1997, 35(1): 149-160.
[3] Kuchovsky T, Sracek O. Natural attenuation of chlorinated solvents: A comparative study[J]. Environ Geology, 2007, 53: 147–157.
[4] Anderson R T, Lovley D R. Ecology and biogeochemistry of in situ groundwater bioremediation[J]. Advances in Microbial Ecology, 1997, 15: 289-350.
[5] Borden R C, Gomez C A, Becker M T. Geochemical indicators of intrinsic Bioremediation[J]. Ground Water, 1995, 33(2): 180-189.
[6] 董军. 垃圾淋滤液在地下环境中的氧化还原分带及污染物的降解机理研究[D]. 长春: 吉林大学环境与资源学院, 2006: 36.
DONG Jun. Study of landfill leachate redox zones and degradation mechanisms of pollutants in the subsurface environment[D]. Changchun: Jilin University. College of Environment and Resources, 2006: 36.
[7] Fang J, Barcelona M J, Krishnamurthy R V, et al. Stable carbon isotope biogeochemistry of a shallow sand aquifer contaminated with fuel hydrocarbons[J]. Applied Geochemistry, 2000, 15: 157-169.
[8] Hunkeler D, Hǒhener P, Bernasconi S, et al. Engineered in situ bioremediation of a petroleum hydrocarbon contaminated aquifer: Assessment of mineralization based on alkalinity, inorganic carbon and stable isotope balances[J]. Journal of Contaminant Hydrology, 1999, 37: 201-233.
[9] Pradeep K A, Robert E H. Monitoring in situ biodegradation of hydrocarbons by using stable carbon isotopes[J]. Environmental Science and Technology, 1991, 25: 1178-1180.
[10] Hunt R J, Krabbenhoft D P, Anderson M P, et al. Assessing hydrogeochemical heterogeneity in natural and constructed wetlands[J]. Biogeochemistry, 1997, 39: 271-293.
[11] Susan E B, Jennifer T M, Isabelle M C, et al. Determination of dominant biogechemical processes in a contaminated aquiger wetland system using multivariate statistical analysis[J]. Journal of Environmental Quality, 2008, 37: 0-46.
[12] Maths S E, Rasmussen T C. Combining multivariate statistical analysis with geographic information systems mapping: A tool for delineating groundwater contamination[J]. Hydrogeology Journal, 2006, 14: 1493-1507.
[13] FAN Wei, YANG Yuesuo, DU Xinqiang, et al. Finger-printing biodegradation of petroleum contamination in shallow groundwater and soil system using hydro-bio-geochemical markers and modelling support[J]. Water, Air, and Soil Pollution, 2011, 220: 253-263.
[14] Liu C W, Lin K H, Kuo Y M. Application of factor analysis in the assessment of groundwater quality in a blackfoot disease area in Taiwan[J]. Sci Total Environ, 2003, 313: 77-89.
[15] Kumar M, Ramanathan A, Rao M S, et al. Identification and evaluation of hydrogeochemical processes in the groundwater environment of Delhi, India[J]. Environmental Geology, 2006, 50: 1025-1039.
[16] Suk H, Lee K K. Characterization of a groundwater hydrochemical system through multivariate analysis: Clustering into groundwater zones[J]. Ground Water, 1999, 37(3): 358-366.
[17] 苏小四, 吕航, 张文静, 等. 某石油污染场地地下水石油烃生物降解的13C、34S同位素证据[J]. 吉林大学学报: 地球科学版, 2011, 41(3): 847-854.
SU Xiaosi, L Hang, ZHANG Wenjing, et al. 13C and 34S isotope evidence for biodegradation of a petroleum hydrocarbon contaminated aquifer in the northeast of China[J]. Journal of Jilin University: Earth Science Edition, 2011, 41(3): 847-854.
Hang, ZHANG Wenjing, et al. 13C and 34S isotope evidence for biodegradation of a petroleum hydrocarbon contaminated aquifer in the northeast of China[J]. Journal of Jilin University: Earth Science Edition, 2011, 41(3): 847-854.
[18] Lee J Y, Cheon J Y, Lee K K, et al. Statistical evaluation of geochemical parameter distribution in a ground water system contaminated with petroleum hydrocarbons[J]. Journal of Environmental Quality, 2001, 35(5): 1548-1563.
[19] Puckett L J, Bricker O P. Factors controlling the major ion chemistry of streams in the Blue Ridge and Valley and Ridge physiographic provinces of Virginia and Maryland[J]. Hydrological Processes, 1992, 6(1): 79-98.
[20] Schot P P, van der Waal J. Human impact on regional groundwater composition through intervention in natural flow patterns and changes in land use[J]. Journal of Hydrology, 1992, 134: 297-313.
[21] Wayland K G, Long D T, Hyndman D W, et al. Identifying relationships between baseflow geochemistry and land use with synoptic sampling and r-mode factor analysis[J]. Journal of Environmental Quality, 2003, 32(1): 180-190.
[22] Basberg L, Banks D,  O M. Redox processes in groundwater impacted by landfill leachate[J]. Aquatic Geochemistry, 1998, 4(2): 253-272.
O M. Redox processes in groundwater impacted by landfill leachate[J]. Aquatic Geochemistry, 1998, 4(2): 253-272.
[23] Lovley D R, Phillips E J P, Lonergan D J. Enzymatic versus nonenzymatic mechanisms for Fe(III) reduction in aquatic sediments[J]. Environmental Science and Technology, 1991, 25(6): 1062-1067.
[24] Báez-Cazull S E, McGuire J T, Cozzarelli I M, et al. Centimeter-scale characterization of biogeochemical gradients at a wetland-aquifer interface using capillary electrophoresis[J]. Applied Geochemisty, 2007, 22(12): 2664-2683.
(编辑 何运斌)
收稿日期:2012-12-29;修回日期:2013-01-22
基金项目:中国地调局地质调查项目(1212011220981);国家自然科学基金资助项目(41203050);吉林省自然科学基金资助项目(201215023)
通信作者:苏小四(1971-),男,安徽巢湖人,博士,教授,从事同位素水文地球化学和地下水资源评价与管理研究;电话:13664430603;E-mail:suxiaosi@jlu.edu.cn
摘要:为揭示某石油烃污染场地地下水生物降解作用机制,通过主因子分析方法对场地三期水化学监测数据进行研究,将各变量归纳为5个主因子,因子1主要由Ca2+,Mg2+,K+和Cl-构成,与矿物溶解反应关系密切,因子2~5与石油烃污染物(总油)、生物降解产物(HCO3-等)、电子受体(SO42-等)和水化学环境指标(pH等)等相关性较强,表征了石油烃生物降解作用(以有氧呼吸、硫酸盐还原和硝酸盐还原为主)对水化学环境的影响,上述指标在空间上的变化规律也进一步验证了反应的发生。同时,代表微生物降解作用的主因子得分系数在场地污染源和污染晕上游位置为正值,其他位置均为负值,表明该位置地下水主要受微生物降解作用的控制,而矿物溶解作用则主要影响了污染晕下游和边缘位置的水化学条件。采用主因子分析方法可以更进一步分析解释监测数据,为识别微生物降解作用的发生和确定主要的氧化还原过程提供一种有效的手段。


