文章编号:1004-0609(2013)06-1694-07
黄铜矿生物浸出过程中Fe(Ⅱ)和Fe(Ⅲ)的行为
马鹏程,杨洪英,佟琳琳,韩战旗,宋 言
(东北大学 材料与冶金学院,沈阳 110819)
摘 要:
采用Fe(Ⅱ)和Fe(Ⅲ)对黄铜矿进行生物浸出,主要研究浸出过程中体系的pH值、铁离子浓度、细菌吸附率及铜浸出率变化规律。结果表明:介质中Fe(Ⅲ)含量不同,生成黄钾铁矾的形态不同。在Fe(Ⅲ)生物浸出体系中,絮状的黄钾铁矾逐渐生成并全部覆盖在黄铜矿表面,阻碍黄铜矿的浸出过程。在Fe(Ⅱ)生物浸出体系中,生成皮壳状、结核状的黄钾铁矾分散于浸出液中,不覆盖在黄铜矿表面,对黄铜矿的浸出没有阻碍作用。
关键词:
中图分类号:TF111.3 文献标志码:A
Behaviour of Fe(Ⅱ) and Fe(Ⅲ) in chalcopyrite bioleaching process
MA Peng-cheng, YANG Hong-ying, TONG Lin-lin, HAN Zhan-qi, SONG Yan
(School of Materials Science and Metallurgy, Northeastern University, Shenyang 110819, China)
Abstract: The chalcopyrite was bioleached using ferrous and ferric solution. The variations of main experimental parameters including the pH value, ferrous and ferric concentration, bacterial adsorption rate and copper leaching efficiency in the leaching solution were investigated. The results show that the ferric concentration can affect the morphologies of jarosite. As the flocculent jarosite gradually forms in the ferric bioleaching solution, the floccule jarosite forms and cover on the chalcopyrite surface, which prevents the leaching process. In the ferrous bioleaching solution, the crustose and nodulated jarosite is generated and dispersed in the solution, which cannot prevent the sequential dissolution of the chalcopyrite.
Key words: chalcopyrite; jarosite; bioleaching; bacterial adsorption; hydrolysis
黄铜矿是重要的铜矿资源,约占世界铜矿资源的70%,也是开采最多的铜矿物。从黄铜矿中提炼铜的传统方法是火法冶炼,其具有生产效率高、铜回收率高等优点,但生产过程中产生大量SO2烟气严重污染环境。因此,SO2非发型的湿法提铜技术逐渐受到重视并快速发展,在硫酸盐、氯化盐、氨、硝酸和细菌等浸出体系中均已实现提铜[1]。在众多的湿法提铜技术中,生物冶金技术因生产成本低、环境污染小等优点已成为全球性研究热点,目前已成功地应用在含砷难浸金矿和次生硫化铜矿的冶炼过程中。然而,对于黄铜矿的生物冶金技术存在浸出速度慢、浸出率低等技术瓶颈。归因于两方面:一方面是黄铜矿具有较高的晶格能,在生物浸出过程中较难被氧化;另一方面是在浸出过程中矿石表面生成不溶性产物而“钝化”, 阻碍了细菌、反应物以及产物之间的相互作用,导致铜的浸出速率慢、浸出率低[2-4]。关于黄铜矿在浸出过程中表面钝化的原因,目前学界有几种观点:PARKER等[5]认为在浸出过程中生成的黄钾铁矾沉淀层对黄铜矿的浸出有重要影响;DUTRIZAC [6]认为浸出过程中副产物硫层是导致黄铜矿钝化的原因;GHAHREMANINEZHAD等[7]认为,由于黄铜矿表面铁的优先浸出而在表面形成富铜的多硫代物层阻碍了铜和铁的扩散溶解。杨洪英等[3]研究表明:黄铜矿在细菌作用下表面依次生成了Cu1-xFe1-yS2(x<y)、单质S0、Fe(Ⅲ)–氧化物、Fe(Ⅲ)—O—OH和黄钾铁矾。多硫代物层和单质S0层都是中间产物,黄钾铁矾是稳定的最终产物。尽管研究的结论有差异,但目前被普遍接受的观点是在黄铜矿的浸出过程中生成的黄钾铁矾沉淀对浸出有阻碍作用。
黄铜矿生物浸出过程中黄钾铁矾的生成与浸出溶液中Fe(Ⅲ)浓度和pH值关系密切。在浸出液中同时存在Fe(Ⅱ)和Fe(Ⅲ),其中Fe(Ⅲ)是重要的氧化剂[8-10],细菌的作用是在胞外聚合层(EPS层)中将Fe(Ⅱ)氧化为Fe(Ⅲ),并将Fe(Ⅲ)和H+积聚于矿物/水的接触面以促进矿物分解[11-13]。在胞外聚合层中的铁离子既可是Fe(Ⅱ),也可是Fe(Ⅲ),显然,只有当胞外聚合层中Fe(Ⅲ)占优势时,矿物表面吸附的细菌才有可能氧化硫化矿。胞外聚合层中n(Fe(Ⅲ))/n(Fe(Ⅱ))取决于浸出溶液中的n(Fe(Ⅲ))/n(Fe(Ⅱ)),而胞外聚合层的大比表面积和丰富的表面电荷又可为Fe(Ⅲ)水解提供结晶的形核中心,促进Fe(Ⅲ)水解生成黄钾铁矾。因此,本文作者分别用Fe(Ⅱ)和Fe(Ⅲ)对黄铜矿进行生物浸出,研究浸出过程中体系的pH值、铁离子浓度、细菌吸附率等变化规律,探讨黄铜矿生物浸出过程中铁的水解行为及黄钾铁矾的生成机制。
1 实验
1.1 菌种
实验所采用的细菌为东北大学生物冶金实验室自行筛选并长期驯化的Acidithiobacillus ferrooxidans, Thiobacillus thiooxidans和Leptospirillum ferrooxidans混合菌,该菌以Fe2+和S为能源,在pH为1.0~2.5、温度为25~50 ℃条件下自养。
1.2 实验矿样
实验用黄铜矿购自中国地质博物馆,经手工挑选后破碎、细磨。磨矿粒度小于74 μm的占93%,浮选分离后在Leica MZ6体视显微镜下挑选出纯净的黄铜矿矿粒供实验研究。矿样的元素分析如表1所列,扫描电镜和EDS能谱分析如图1所示。矿石表面Cu、Fe、S的元素摩尔比为1:1.01:2.34,较接近黄铜矿的理论值。
表1 矿样的主元素分析结果
Table 1 Main elementary analytical results of ore sample
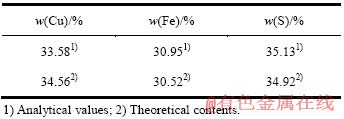
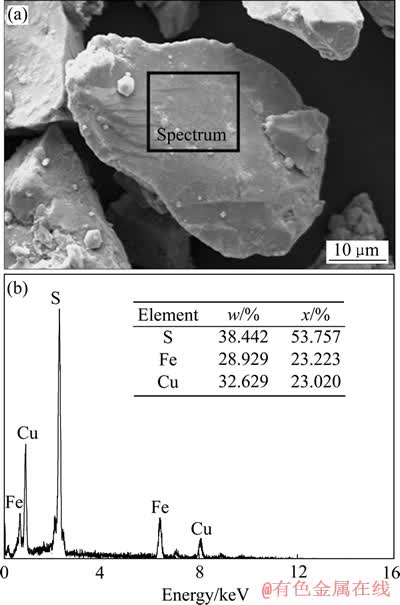
图1 矿样SEM像和EDS谱
Fig. 1 SEM image(a) and EDS spectrum(b) of ore sample
1.3 实验方法
菌液在9K培养基中活化后,含9 g/L Fe(Ⅲ)离子,细菌密度为3.2×108 cell/mL,取200 mL置于500 mL摇瓶。另取200 mL菌液置于离心管中,经10 000 r/min常温离心10 min,使细菌离心到离心管底部,用pH值为1.4的稀硫酸清洗3次后转移菌体到装有200 mL 9K培养基的500 mL摇瓶中,此体系含9 g/L的Fe(Ⅱ)离子。分别向两摇瓶中加入1.2节中所述矿石6 g。用体积比为1:1的硫酸将两摇瓶的pH值调至1.4。重复上述操作,再各作两个平行样品,以供不同时期取样。将上述6个摇瓶放入温度为44 ℃、转速为170 r/min的恒温振荡培养箱中进行浸铜实验。
1.4 分析方法
浸矿实验中用雷磁PHS-2F型pH计跟踪摇瓶中矿浆的pH值变化情况;在Leica DM2500生物显微镜下用XB-K-25型血球计数板直接计数矿浆中游离的细菌数量,矿石上吸附的细菌数用茚三酮比色法测定[14]。浸出液中Fe(Ⅱ)浓度用重铬酸钾滴定法测定,铜和总铁浓度用美国伯明斯顿公司SF2A370MC型原子吸收分光光度计测定。用日本岛津公司SSX-550扫描电子显微镜和电子散射谱仪EDS分析不同浸出时期浸出渣的表观形貌和成分。
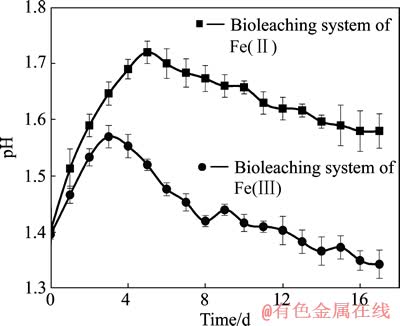
图2 矿浆的pH值随浸出时间的变化
Fig. 2 Change of pH value of pulp with bioleaching time
2 结果与讨论
2.1 pH值
生物浸出黄铜矿过程中矿浆的pH值直接影响体系中细菌活性和Fe(Ⅲ)的水解。图2所示为浸出液的pH值随浸出时间的变化曲线。由图2可知,无论Fe(Ⅲ)还是Fe(Ⅱ)生物浸出体系的pH值均先升高后下降。这是因为黄铜矿的生物浸出过程耗酸,如反应(1)和(2)。浸出过程分为两步,首先是Fe(Ⅲ)氧化黄铜矿,这里的Fe(Ⅲ)来源可分为两部分,一部分是游离在溶液中的Fe(Ⅲ),另一部分是吸附在黄铜矿表面的细菌胞外聚合层中的Fe(Ⅲ);其次是前一过程所生成的Fe(Ⅱ)在细菌的细胞内被氧化成Fe(Ⅲ),消耗浸出液中的H+,溶液pH值升高。此后,元素硫的氧化和Fe(Ⅲ)的水解过程是产酸反应(式(3)~(7)),且产酸反应对pH的影响超过了细菌对Fe(Ⅱ)的氧化反应,溶液pH值开始下降。对于Fe(Ⅲ)生物浸出体系由于Fe(Ⅲ)与SO42-的络合作用,浸出开始前溶液中含有大量的FeSO4+、Fe(SO4)2-、FeHSO42+络离子及铁的水解产物FeOH2+、Fe(OH)2+、Fe2(OH)24+。当浸出开始后,随着黄铜矿的氧化,细菌不断将Fe(Ⅱ)氧化成Fe(Ⅲ),持续消耗H+,溶液pH值升高,Fe(Ⅲ)的水解反应得到促进,释放出的H+进入溶液。而Fe(Ⅱ)生物浸出体系中因初始无Fe(Ⅲ),细菌优先利用溶液中Fe(Ⅱ)离子作为能源,消耗溶液中的H+(反应2)[15]。当溶液中有足够数量的Fe(Ⅲ)时,浸出反应(1)才能持续进行[16]。因此,Fe(Ⅱ)生物浸出体系pH值升高的幅度大于Fe(Ⅲ)生物浸出体系的。
CuFeS2+4Fe3+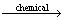 Cu2++5Fe2++2S0 (1)
Cu2++5Fe2++2S0 (1)
4Fe2++4H++O2 4Fe3++2H2O (2)
4Fe3++2H2O (2)
2S0+3O2+2H2O 2H2SO4 (3)
2H2SO4 (3)
Fe3++nH2O
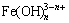 +nH+ (n=1, 2) (4)
+nH+ (n=1, 2) (4)
2Fe(OH)2+ 
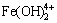 (5)
(5)
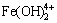 +4H2O→2Fe(OH)3+4H+ (6)
+4H2O→2Fe(OH)3+4H+ (6)
3Fe(OH)3+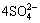 +3Fe3++3H2O+2M+→2MFe3(SO4)2(OH6)+3H+ (M=K+,
+3Fe3++3H2O+2M+→2MFe3(SO4)2(OH6)+3H+ (M=K+,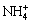 , H3O+) (7)
, H3O+) (7)
2.2 Fe(Ⅲ)和Fe(Ⅱ)
黄铜矿生物浸出过程溶液中Fe(Ⅲ)的含量及供给速率与黄钾铁矾的生成关系密切[17-19]。图3所示为浸出液中Fe离子浓度随时间的变化。图中总Fe的理论含量是根据黄铜矿的分解率计算得到的。如图3所示,当浸出开始后,在Fe(Ⅲ)生物浸出体系中,Fe(Ⅲ)氧化黄铜矿后被还原为Fe(Ⅱ)与黄铜矿溶解所释放出的Fe(Ⅱ)一起进入溶液,浸出液中Fe(Ⅱ)浓度增加。浸出第3 d,Fe(Ⅱ)浓度达到8.573 g/L,总铁浓度为9.768 g/L。此后Fe(Ⅱ)浓度迅速减小,表明细菌已进入对数生长期,浸出液中Fe(Ⅲ)的生成速率大于消耗速率,Fe(Ⅲ)浓度快速增大。黄铜矿不断的被氧化,浸出液中总Fe浓度持续增大,浸出到第9 d时,溶液中的总Fe浓度开始下降。原因可能是Fe(Ⅲ)生物浸出体系中铁的羟基化多聚物Fe(OH)n(3-n)+ (n=1, 2)在浸出开始后,吸附在矿物表面造成最初溶液中总Fe浓度与理论总Fe浓度相差较大。此后,由于氧化反应(式(1))不断地进行,体系中Fe(Ⅲ)浓度减小。吸附在矿石表面的Fe(OH)n(3-n)+ (n=1, 2)逐步分解(式(4)),释放出Fe(Ⅲ)与黄铜矿氧化释放出的Fe(Ⅱ)一起进入溶液,溶液中总Fe浓度上升。浸出3 d后,细菌进入对数生长期,Fe(Ⅲ)的生成速率大于氧化反应(1)的消耗速率,浸出液中Fe(Ⅲ)浓度迅速增大。矿石表面吸附的未分解的Fe(OH)n(3-n)+ (n=1, 2)发生迅速、杂化的聚合和堆积,生成Fe(OH)3胶体相(见式(5)~(6)),Fe(OH)3不稳定与浸出液中的K+、Na+、NH4+结合在黄铜矿表面生成铁矾类物质(式(7))[20],浸出液中总Fe浓度逐渐减小。对于Fe(Ⅱ)生物浸出体系,因为初始无Fe(Ⅲ) (见图3(b)),细菌将Fe(Ⅱ)氧化成Fe(Ⅲ)后即与黄铜矿反应而被消耗,体系中Fe(Ⅲ)离子浓度较小,发生水解反应的程度也相对较低。因此,在浸出初期(0~5 d),浸出液中总Fe浓度与理论值相差不大,但随浸出时间延长,体系的pH值逐渐升高。浸出7 d后,溶液中的总Fe浓度开始明显小于理论总Fe浓度。表明溶液中的Fe(Ⅲ)已开始水解,同时溶液中Fe(Ⅲ)浓度增长速率较慢,溶液中高OH-与Fe浓度比对Fe的羟基化多聚物的生成起促进作用,铁水解生成的羟基化多聚物在浸出过程中充分的聚合成高聚合度的阳离子后逐渐成核、聚集、生长,最终生成黄钾铁矾从溶液中析出。
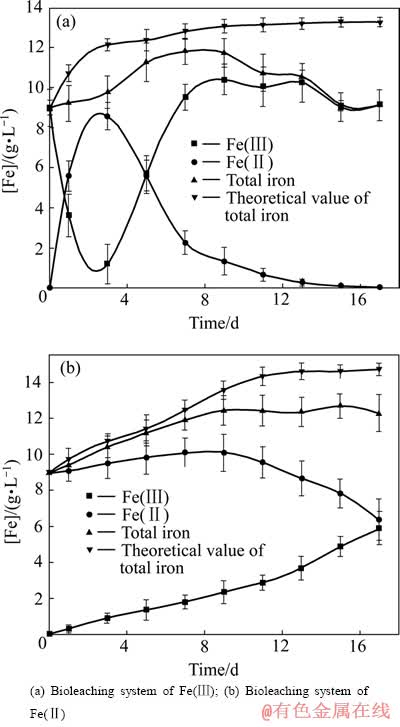
图3 Fe离子浓度随浸出时间变化图
Fig. 3 Change of iron concentration with bioleaching time
2.3 溶蚀与钝化
对于Fe(Ⅲ)生物浸出过程,黄铜矿的表面形态随浸出时间延长而变化(见图4)。当浸出3 d时,黄铜矿表面出现椭圆形溶蚀坑、裂痕和细小结晶相(图4(a));当浸出第8 d时,黄铜矿表面的溶蚀坑增多,呈蜂窝状,裂痕加深并扩大,矿物表面有明显溶蚀痕迹(图4(b)),有絮状的黄钾铁矾附着在矿石表面。可能是吸附在矿石表面上细菌的细胞壁和胞外聚合层为Fe(Ⅲ)的水解产物提供的离子吸附和矿物成核中心。此时细菌处于对数生长期,生命活动旺盛,分泌的多糖等代谢产物使矿物颗粒和细胞间的吸附作用加强,从而导致生成的黄钾铁矾发生团聚,自形程度较低,呈絮状、纤维状附着在矿物表面。当浸出结束时,黄钾铁矾已全部覆盖矿石表面(见图4(c)和(d))。
图5所示为Fe(Ⅱ)生物浸出不同时间黄铜矿表面形态图。当浸出到3 d时,黄铜矿石表面出现凹坑状溶蚀坑,未见黄钾铁矾沉淀生成(图5(a))。当浸出到8 d时,黄铜矿表面氧化严重,呈现出高低不平的凹坑和棱台,伴有黄钾铁矾沉淀的生成。在成矾过程中,溶液中Fe(Ⅲ)浓度增长缓慢,有利于铁矾的成核、生长,所以生成的黄钾铁矾晶体发育较好,呈皮壳状或结核状之集合体分散在浸出液中,不覆盖在黄铜矿表面上,对黄铜矿的溶解没有阻碍作用(见图5(b)~(d))。
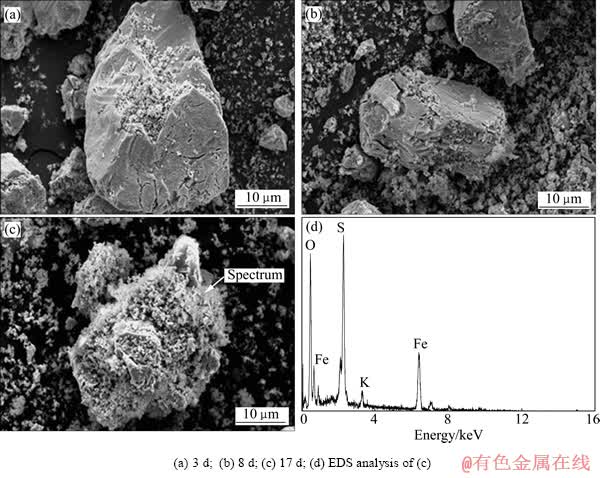
图4 Fe(Ⅲ)生物浸出黄铜矿不同时期SEM谱和EDS像
Fig. 4 SEM images((a), (b), (c)) and EDS spectrum(d) of chalcopyrite in ferric iron bioleaching system at different stages
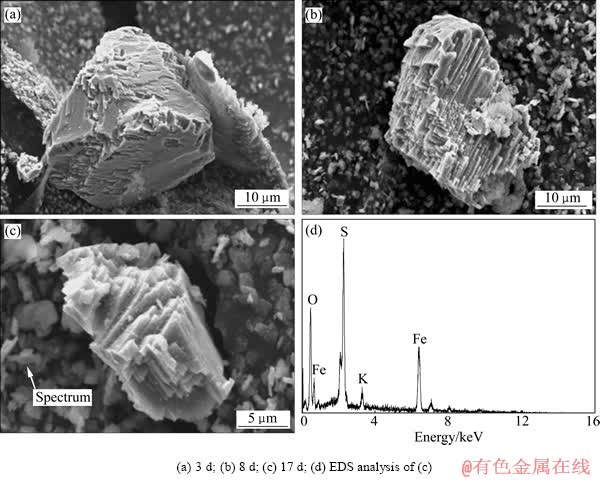
图5 Fe(Ⅱ)生物浸出黄铜矿不同时期的SEM像和EDS谱
Fig. 5 SEM images((a), (b), (c)) and EDS spectrum(d) of chalcopyrite in bioleaching system of Fe(Ⅱ) at different stages
2.4 细菌吸附
黄铜矿生物浸出过程中,细菌在矿物表面的吸附是浸出的必要条件。对于Fe(Ⅲ)生物浸出体系,当浸出开始后,因体系初始无Fe(Ⅱ),细菌由疏水性和静电作用而大量地吸附在黄铜矿表面上(图6(a)),营造出细菌—胞外聚合层—矿物之间的局部微环境[21]。当浸出1d时,在黄铜矿表面上细菌的吸附率达到88.17%(矿石表面吸附的细菌数量与体系中细菌总数之比),铜的浸出率为18.45%。EPS层中Fe(Ⅲ)氧化黄铜矿后在细菌体内再生时消耗H+,使得细菌吸附的黄铜矿表面微区pH值上升,从而引起吸附在该微区处的Fe(OH)n(3-n)+ (n=1, 2)以细菌的细胞壁为中心进行水解结晶,进而形成了最初的沉淀物覆盖在黄铜矿表面,引起细菌吸附率减小。随着黄铜矿不断地氧化,溶液中Fe(Ⅲ)离子持续增多并逐渐水解,以矿石表面最初的沉淀物为中心不断的地生长,最终生成黄钾铁矾类物质覆盖在矿石表面,黄铜矿发生钝化,浸出率不再增长,浸出17 d后,铜的浸出率为46.01%。对于Fe(Ⅱ)生物浸出体系;浸出1 d时,细菌在矿石表面的吸附率和铜浸出率分别为17.22%和7.66%,小于Fe(Ⅲ)生物浸出体系同时期的细菌吸附率和Cu的浸出率(见图6(b))。这是因为在细菌的胞外聚合层中,糠醛酸Fe(Ⅲ)配合物是氧化/还原的媒介物质;在 Fe(Ⅱ)介质中,细菌的胞外聚合层中主要为糠醛酸Fe(Ⅱ)配合物,糠醛酸Fe(Ⅱ)不稳定,Fe(Ⅱ)离子在胞外聚合层中迁移、扩散到细菌的外膜而被细菌的酶系统氧化形成糠醛酸Fe(Ⅲ)配合物,所以当浸出开始时,细菌胞外聚合层中同时存在糠醛酸Fe(Ⅲ)和糠醛酸Fe(Ⅱ)配合物,其中以糠醛酸Fe(Ⅱ)配合物为主,而Fe(Ⅲ)生物浸出体系中细菌的胞外聚合层中主要为糠醛酸Fe(Ⅲ)配合物。因此,在浸出开始时,Fe(Ⅱ)生物浸出体系对矿物的氧化作用相对较弱,Cu的浸出率较Fe(Ⅲ)生物浸出体系低。但浸出液中低浓度的Fe(Ⅲ)离子同时也减缓了Fe(Ⅲ)水解反应发生。随着浸出的进行,Cu的浸出率缓慢增长,浸出17 d后达到61.73%。
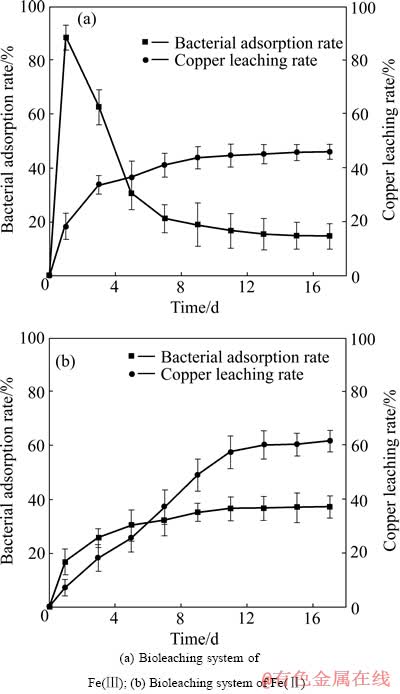
图6 细菌吸附率、铜浸出率随浸出时间变化曲线
Fig. 6 Change curves of bacterial adsorption rate and copper leaching rate with bioleaching time
3 结论
1) 在生物浸出黄铜矿过程中,黄钾铁矾的生成受溶液的pH值、Fe(Ⅲ)离子浓度和Fe(Ⅲ)供给速率影响。对于Fe(Ⅲ)生物浸出体系,由Fe(Ⅲ)离子水解所生成的Fe(OH)3胶体与细菌一起粘附于矿物表面,以细菌的细胞壁为中心结晶出絮状的黄钾铁矾,最终覆盖在黄铜矿表面上,阻碍浸出的进行。
2) Fe(Ⅱ)生物浸出体系中生成皮壳状、结核状的黄钾铁矾分散于浸出液中,不覆盖在黄铜矿表面,对黄铜矿的溶解没有阻碍作用。
3) Fe(Ⅲ)生物浸出体系中,浸出初始阶段细菌大量吸附于矿石表面,浸出1 d后,矿石表面细菌吸附率达到88.17%,Cu的浸出率为18.49%;当黄铜矿表面钝化后,细菌不再继续吸附在矿石表面,黄铜矿表面细菌吸附率逐渐下降。Fe(Ⅱ)生物浸出体系中,浸出1 d后,矿石表面的细菌吸附率为17.22%,Cu的浸出率为4.59%,且增长缓慢,但低浓度的Fe(Ⅲ)同时也避免了水解反应的发生,随着浸出的进行,Cu的浸出率最终达到61.73%。
REFERENCES
[1] 付念新, 岩崎巌, 玉川建雄, 小林翰男. 黄铜矿低温氯化-选择性氧化提取铜过程[J]. 过程工程学报, 2010, 10(6): 1138-1142.
FU Nian-xin, IWASAKI I, TAMAGAWA T, KOBAYASHI M. Extraction process of copper from chalcopyrite concentrate by low-temperature chlorination-selective oxidation[J]. The Chinese Journal of Process Engineering, 2010, 10(6): 1138-1142.
[2] STOTT M B, WATLING H R, FRANZMANN P D, SUTTON D. The role of iron-hydroxy precipitates in the passivation of chalcopyrite during bioleaching[J]. Minerals Engineering, 2000, 13(10/11): 1117-1127.
[3] 杨洪英, 潘颢丹, 佟琳琳, 刘媛媛. 黄铜矿表面生物氧化膜的形成过程[J]. 金属学报, 2012, 48(9): 1145-1152.
YANG Hong-ying, PAN Hao-dan, TONG Lin-lin, LIU Yuan-yuan. Formation process of biological oxide film on chalcopyrite crystal surface[J]. Acta Metallurgica Sinica, 2012. 48(9): 1145-1152.
[4] BRIERLEY C L. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 324-328.
[5] PARKER A, KLAUBER C, KOUGIANOS A, WATLING H R, van BRONSWIJK W. An X-ray photoelectron spectroscopy study of the mechanism of oxidative dissolution of chalcopyrite[J]. Hydrometallurgy, 2003, 71(1/2): 265-276.
[6] DUTRIZAC J E. Elemental sulphur formation during the ferric chloride leaching of chalcopyrite[J]. Hydrometallurgy, 1990, 23(2/3): 153-176.
[7] GHAHREMANINEZHAD A, ASSELIN E, DIXON D G. Electrochemical evaluation of the surface of chalcopyrite during dissolution in sulfuric acid solution[J]. Electrochimica Acta, 2010, 55(18): 5041-5056.
[8] TRIBUTSCH H. Direct versus indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2/3): 177-185.
[9] DEVASIA P, NATARAJAN K A. Adhesion of Acidithiobacillus ferrooxidans to mineral surfaces[J]. International Journal of Mineral Processing, 2010, 94(3/4): 135-139.
[10] HANSFORD G S, VARGAS T. Chemical and electrochemical basis of bioleaching processes[J]. Hydrometallurgy, 2001, 59(2/3): 135-145.
[11] SAND W, GEHRKE T, JOZSA P G, SCHIPPERS A. (Bio)chemistry of bacterial leaching—Direct vs. indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2/3): 159-175.
[12] SAND W, GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(1): 49-56.
[13] YU Run-lan, OU Yang, TAN Jian-xi, WU Fa-deng, SUN Jing, MIAO Lei, ZHONG Dai-li. Effect of EPS on adhesion of Acidithiobacillus ferrooxidans on chalcopyrite and pyrite mineral surfaces[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(2): 407-412.
[14] 潘颢丹, 杨洪英, 陈世栋. 黄铜矿表面生物吸附量的测定条件[J]. 东北大学学报: 自然科学版, 2010, 31(7): 999-1002.
PAN Hao-dan, YANG Hong-ying, CHEN Shi-dong. Conditions for biosorption measuring on chalcopyrite surface[J]. Journal of Northeastern University: Natural Science, 2010, 31(7): 999-1002.
[15] LILOVA K, KARAMANEV D. Direct oxidation of copper sulfide by a biofilm of Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2005, 80(3): 147-154.
[16] VILCAEZ J, SUTO K, INOUE C. Bioleaching of chalcopyrite with thermophiles: Temperature-pH-ORP dependence[J]. International Journal of Mineral Processing, 2008, 88(1/2): 37-44.
[17] BEVILAQUA D, LEITE A L L C, GARCIA O, TUOVINEN O H. Oxidation of chalcopyrite by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans in shake flasks[J]. Process Biochemistry, 2002, 38(4): 587-592.
[18] 柏双友, 梁剑茹, 王 敏, 周立祥. Fe(Ⅲ)供应速率对无定型施氏矿物形成的影响[J]. 矿物学报, 2011, 31(2): 256-262.
BAI Shuang-you, LIANG Jian-ru, WANG Min, ZHOU Li-xiang. Effect of Fe(Ⅲ) supply rate on the formation of amorphous schwertmannite[J]. Acta Mineralogica Sinica, 2011, 31(2): 256-262.
[19] 朱长见, 陆建军, 陆现彩, 王汝成, 李 奇. 氧化亚铁硫杆菌作用下形成的黄钾铁矾的SEM研究[J]. 高校地质学报, 2005, 11(2): 234-238.
ZHU Chang-jian, LU Jian-jun, LU Xian-cai, WANG Ru-cheng, LI Qi. SEM study on jarosite mediated by Thiobacillus ferrooxidans[J]. Geological Journal of China Universities, 2005, 11(2): 234-238.
[20] 谢海云, 刘中华, 周 峨. 高铁离子浓度下氧化亚铁硫杆菌的生长行为[J]. 过程工程学报, 2004, 4(1): 43-46.
XIE Hai-yun, LIU Zhong-hua, ZHOU E. Growth of Thiobacillus ferrooxidan in high concentration ferrous ion culture medium[J]. The Chinese Journal of Process Engineering, 2004, 4(1): 43-46.
[21] WANG Zhao-hui, XIE Xue-hui, LIU Jian-she. Experimental measurements of short-term adsorption of Acidithiobacillus ferrooxidans onto chalcopyrite[J]. Transactions of Nonferrous Metals Society of China, 2012(2): 442-446.
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51174062,51104036);国家高技术研究发展计划资助项目(2012AA061502);国家“十二五”科技支撑计划项目(2012BAE06B05);中央高校基本科研业务费专项基金资助项目(N110602005)
收稿日期:2012-08-06;修订日期:2013-05-02
通信作者:杨洪英,教授,博士;电话:024-83673932;E-mail: yanghy @smm.neu.edu.cn
摘 要:采用Fe(Ⅱ)和Fe(Ⅲ)对黄铜矿进行生物浸出,主要研究浸出过程中体系的pH值、铁离子浓度、细菌吸附率及铜浸出率变化规律。结果表明:介质中Fe(Ⅲ)含量不同,生成黄钾铁矾的形态不同。在Fe(Ⅲ)生物浸出体系中,絮状的黄钾铁矾逐渐生成并全部覆盖在黄铜矿表面,阻碍黄铜矿的浸出过程。在Fe(Ⅱ)生物浸出体系中,生成皮壳状、结核状的黄钾铁矾分散于浸出液中,不覆盖在黄铜矿表面,对黄铜矿的浸出没有阻碍作用。
[1] 付念新, 岩崎巌, 玉川建雄, 小林翰男. 黄铜矿低温氯化-选择性氧化提取铜过程[J]. 过程工程学报, 2010, 10(6): 1138-1142.
[3] 杨洪英, 潘颢丹, 佟琳琳, 刘媛媛. 黄铜矿表面生物氧化膜的形成过程[J]. 金属学报, 2012, 48(9): 1145-1152.
[4] BRIERLEY C L. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 324-328.
[8] TRIBUTSCH H. Direct versus indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2/3): 177-185.
[14] 潘颢丹, 杨洪英, 陈世栋. 黄铜矿表面生物吸附量的测定条件[J]. 东北大学学报: 自然科学版, 2010, 31(7): 999-1002.
[18] 柏双友, 梁剑茹, 王 敏, 周立祥. Fe(Ⅲ)供应速率对无定型施氏矿物形成的影响[J]. 矿物学报, 2011, 31(2): 256-262.
[19] 朱长见, 陆建军, 陆现彩, 王汝成, 李 奇. 氧化亚铁硫杆菌作用下形成的黄钾铁矾的SEM研究[J]. 高校地质学报, 2005, 11(2): 234-238.
[20] 谢海云, 刘中华, 周 峨. 高铁离子浓度下氧化亚铁硫杆菌的生长行为[J]. 过程工程学报, 2004, 4(1): 43-46.


