文章编号:1004-0609(2007)03-0453-06
两株不同铁氧化细菌合成的沉淀差异性分析
高 健1, 2,彭 宏1,李邦梅1,吴学玲1,丁建南1,邱冠周1
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 湖南科技大学 生命科学学院,湘潭410201)
摘 要:
通过ICP-AES、SEM、XRD和FTIR等方法,对不同铁氧化细菌在不同温度条件下所合成的赭黄色高铁沉淀进行了分析。结果表明:无论是嗜铁钩端螺旋菌DY菌株(Leptospirillum ferriphium),还是嗜酸氧化亚铁硫杆菌GF菌株(Acidithiobacillus ferrooxidans)合成的沉淀都是黄钾铁矾和黄铵铁矾的混合物;其中,GF合成的沉淀混合物中黄钾铁矾的含量比DY合成的黄钾铁矾约高出5.53%;而DY合成的沉淀中,黄铵铁矾的含量比GF合成的沉淀中的黄铵铁矾的含量约高出15.24%。
关键词:
黄钾铁矾;黄铵铁矾;嗜铁钩端螺旋菌;嗜酸氧化亚铁硫杆菌;沉淀;
中图分类号:TF646,O657.3 文献标识码:
Discrepant analysis of iron precipitate synthesized by two strains of different iron-oxidizing bacteria
GAO Jian1, 2, PENG Hong1, LI Bang-mei1, WU Xue-ling1, DING Jian-nan1, QIU Guan-zhou1
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. School of Life Science, Hunan University of Science and Technology, Xiangtan 410201, China)
Abstract: The yellow ochre-colored iron precipitates synthesized by two strains of different iron-oxidizing bacteria at different temperatures were analyzed by using ICP-AES, SEM, XRD and FTIR. The results indicate that both the precipitates produced by Leptospirillum ferriphium strain DY and Acidithiobacillus ferrooxidans strain GF are composed of jarosite and ammonium jarosite. However, the content of jarosite in the precipitates synthesized by strain GF is 5.53% higher than that synthesized by strain DY, but the content of ammonium jarosite in the precipitates synthesized by strain DY is 15.24% higher than that synthesized by strain GF.
Key words: jarosite; ammonium jarosite; Leptospirillum ferriphium strain DY; Acidithiobacillus ferrooxidans strain GF; precipitate
不同类型的铁矾矿物(MFe3(SO4)2(OH)6,其中M=K,Na,NH4+,Ag+等)广泛地存在于自然界[1],其中,地球上黄钾铁矾的存在主要是在含有稀硫酸的地下水环境中形成的,例如在矿山排水区域附近,或在富含硫的火山喷孔附近。但最近,火星上黄钾铁矾的发现暗示那里曾经或现在存在生命的可能[2]。由于黄钾铁矾类矿物具有不溶于稀酸的特点,易于沉淀、洗涤和过滤,因此,在一定的温度、酸度以及铵或碱金属离子存在的条件下,可使溶液中的Fe3+形成黄钾铁矾类矿物而沉淀下来,从而除去浸出液的铁[3]。黄钾铁矾类矿物的这种特性,不但可以用来治理矿山及工业废水,以去除其中的S、Fe及As 、Cr、Hg、Pb等有毒或有害的元素,而且还可以应用于冶金工业,如冶锌工业过程中,锌回收之前,往往通过黄钾铁矾的加工预处理以使来自热酸性浸出液中的可溶性铁沉淀下来[4-7]。此外,也由于黄钾铁矾具有遮盖力强、耐候性好、无毒和抗酸等优越的性能而被应用于绘画艺术,如最近发现的古代埃及金字塔的壁画艺术中就应用黄钾铁矾作为颜料[8]。绘画艺术中往往采用天然黄钾铁矾作颜料, 但天然存在的黄钾铁矾往往与黄铁矿的细菌氧化作用密切相关, 如硫杆菌属的嗜酸氧化亚铁硫杆菌[9](Acidithiobacillus ferrooxidans,A.ferrooxidans)与钩端螺旋菌属的嗜铁钩端螺旋菌[10](Leptospirillum ferriphium, L.ferriphium.)等, 它们属于中温、好氧、嗜酸和专性无机化能自养菌, 能通过氧化亚铁、或元素硫、或还原性硫来获得生命活动所需要的能量。虽然已有许多探讨黄钾铁矾类矿物的形成与嗜酸氧化亚铁硫杆菌的关系[11-15],但对以亚铁作为唯一能源的钩端螺旋菌合成黄钾铁矾类矿物的研究,特别是比较不同铁氧化细菌合成铁矾沉淀差异的研究,国内外还未见相关报道。本研究的主要目的就是在实验室条件下,通过比较分析嗜铁钩端螺旋菌DY与嗜酸氧化亚铁硫杆菌GF合成的沉淀差异性,试图为工业生产中选择何种菌种合成黄钾铁矾或黄铵铁矾提供参考。
1 实验
1.1 仪器
实验仪器主要如下:JEOL JEM-1230扫描电子显微镜;美国PS-6型等离子体原子发射光谱仪;NEXUS 670型 FTIR红外光谱仪;D/max2500PC型18 kW转靶X射线衍射仪;上海雷磁PHS-3C型精密pH计。美国TC-436型氮/氧分析仪。
1.2 菌种
Leptospirillum ferriphium strain DY(16S rDNA登录号为Q444291)和Acidithiobacillus ferrooxidans strain GF(16S rDNA登录序列号为DQ062115)由本研究室分离与保藏。电镜下,菌株DY呈螺旋状或弧状,GF呈短杆状(图1)。
1.3 培养基与细菌培养条件
9 K液体的培养基如下:A液(NH4)2SO4 3.0 g/L,MgSO4?7H2O 0.5 g/L,KCl 0.1 g/L,Ca(NO3)2 0.01 g/L,K2HPO4 0.5 g/L,蒸馏水配制700 mL,高压灭菌;B液FeSO4?7H2O 44.2 g/L,蒸馏水配制300 mL,过滤除菌。将A液与B液混合,用5 mol/L的硫酸调节pH至2.0。以上试剂均为国产分析纯。
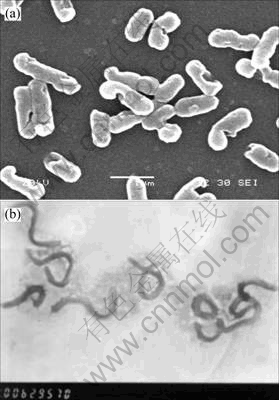
图1 DY和GF的电镜照片
Fig.1 SEM image of strain GF (a) and TEM image of strain DY (b)
在pH2.0、摇床转速180 r/min、温度分别为40 ℃(嗜铁钩端螺旋菌DY的最适生长温度)和30 ℃(嗜酸氧化亚铁硫杆菌GF的最适生长温度)的条件下,用9 K液体培养基分别培养菌株DY和菌株GF。培养时间均为96 h,以确保沉淀大量生成。菌株DY和GF的接种物分别来自上述相同条件下培养48 h的培养物,各自培养物的细胞浓度分别为(4.43±0.33)×107和(1.5±0.1)×108 mL(均为3次计数的平均值)。菌株DY和菌株GF的接种量分别为10%和3%(体积比)。
1.4 沉淀的收集
当细菌生长到对数晚期时,开始收集沉淀。所有沉淀均用0.45 μm滤膜收集。根据文献[14],沉淀用5 mmol/L的硫酸洗涤二次后,自然风干并保存备用。
1.5 沉淀的鉴定
自然风干后的样品用扫描电镜观察样品的表面特征;采用等离子发射光谱(ICP-AES)测定Fe, K, S元素含量;采用TC-436型氮/氧分析仪分析样品中氮的含量;采用傅里叶转换红外光谱仪测定样品的红外光谱,其扫描范围为400~4 000 cm-1;X射线衍射光谱按Ingrid Oborn法[1]测定。
2 结果与分析
由培养基的成分以及铁矾的通用化学式MFe3(SO4)2(OH)6(其中化学式中的M代表K+、Na+、NH4+、Ag+等阳离子)可知,本研究中两种细菌所形成沉淀的Fe与S摩尔比与黄钾铁矾或者黄铵铁矾的理论值基本一致(表1),证实沉淀只能是黄钾铁矾,或黄铵铁矾,或二者的混合物。两种沉淀中钾元素的含量均低于黄钾铁矾的理论值,相差高达71.1%(DY)和65.6%(GF)。由此初步可以判断,本实验条件下,无论是菌株DY,还是菌株GF合成的沉淀并非只存在单一的黄钾铁矾成分;同样,两种沉淀中氮元素的含量与黄铵铁矾的理论值的不一致也表明了无论是菌株DY,还是菌株GF所合成的沉淀也并非只存在单一的黄铵铁矾成分。钾和氮元素的同时存在,表明两种沉淀都是黄钾铁矾和黄铵铁矾的混合物。而且,经初步计算,虽然DY和GF合成的沉淀中黄铵铁矾的含量均高于黄钾铁矾的含量,但GF合成的沉淀中,其黄钾铁矾的含量比DY合成的沉淀中的黄钾铁矾的含量约高出5.53%,而DY合成的沉淀中,其黄铵铁矾的含量比GF合成的沉淀中的黄铵铁矾的含量约高出15.24%。
表1 菌株DY和GF合成的沉淀组成
Table 1 Composition of precipitates synthesized by strain DY and strain GF1)

从SEM分析结果可知,尽管DY 和GF合成的沉淀的晶体形态都呈多面体,且轮廓分明(图2),但由GF合成的沉淀晶体外观比DY合成的晶体外观明显更好。研究表明,影响黄钾铁矾晶体形态的因素是反应过程中Fe3+ 的供应速率和一价阳离子的类型[16]。本实验条件下,由于培养基成分一致,使一价阳离子类型的来源相同。DY和GF在分类学上属于不同的分类阶元,虽然都能以亚铁离子作为各自代谢的能量来源,但GF氧化亚铁离子的速率比DY氧化亚铁离子的速率稍快,因此,造成两种沉淀晶体的形态的差异很可能是由于不同菌种氧化亚铁形成Fe3+的速率的不同所造成的。此外,两种沉淀晶体的外观差异也可能是因为较低温度下,晶体的形成速度比较高温度条件下要缓慢得多。

图2 DY和GF合成的沉淀晶体的扫描电镜照片
Fig.2 SEM micrographs of crystalline precipitate synthesized by DY strain(a) and GF strain(b)
至于DY合成过程中所伴随的细小颗粒,它们不可能是羟基硫酸高铁颗粒,因为根据文献[17],在相同条件下,无定型的羟基硫酸高铁颗粒只能在pH>3.5的情况下生成。因此,在pH=2时,这些细小的颗粒很可能是未成熟的黄钾铁矾或黄铵铁矾晶体的前体。
X射线衍射现象是晶体所产生的独特现象,因此,X射线衍射分析方法是用来鉴别晶体与非晶体的最常用、也是最有效的手段。图3中,在d(A)值分别为3.12(峰a)和3.09(峰b)时,由菌株DY和菌株GF所合成的沉淀的衍射峰强度恰好相反,而且峰a属于黄钾铁矾的典型特征峰,峰b属于黄钾铁矾和黄铵铁矾的共同特征峰,因此,根据这两个衍射峰的相对强弱,可进一步证实由GF合成的沉淀中的黄钾铁矾的相对含量比DY合成的沉淀中的黄钾铁矾的相对含量要高。同时,从表2可知,无论是DY,还是GY既具有标准黄钾铁矾的三强特征峰,又具有标准黄铵铁矾的三强特征峰,因此,进一步证实在本实验条件下,由DY和GF合成的沉淀只能是黄钾铁矾和黄铵铁矾的混合物,从而排除了两株不同种类的铁氧化细菌所合成的沉淀为单一成分的可能性。
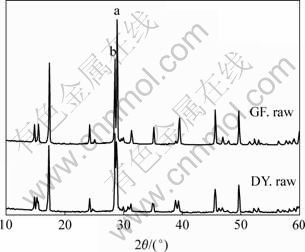
图3 GF和DY形成的沉淀的X射线衍射谱
Fig.3 XRD patterns of precipitate produced by strains GF and DY
表2 实验样品的X射线衍射分析结果
Table 2 XRD analysis results from synthetic samples

沉淀的FTIR光谱见图4,它们与Powers等[18-22]报道的标准样品的光谱非常相似。在波数为2 900~3 700 cm-1区域的强吸收峰很可能归属于OH的伸缩振动。由L.ferriphium DY合成的沉淀在1 635 cm-1处的吸收峰归属于HOH的变形振动,与Powers报道的结果基本一致,而由A.ferrooxidans GF合成的沉淀在相对应的波数处,其吸收峰强度较弱,这很有可能是由于样品中水分含量相对较高的缘故。尽管Powers等认为1 002 cm-1处的吸收峰属于OH的变形振动,但根据Arkhipenko的结论,由A.ferrooxidans GF合成的沉淀在波数为1 196、1 087和1 002 cm-1处所观察到的3个强吸收峰分别归属于![]() 的υ3和υ1振动。同样,由L.ferriphium DY 合成的沉淀在1 192、1 082 cm-1和1 002 cm-1处的吸收峰也属于
的υ3和υ1振动。同样,由L.ferriphium DY 合成的沉淀在1 192、1 082 cm-1和1 002 cm-1处的吸收峰也属于![]() 的υ3和υ1振动。在475~1 000 cm-1之间,也可以观察到几个吸收峰,其中,在627 cm-1的附近和约670 cm-1处的吸收峰可能属于
的υ3和υ1振动。在475~1 000 cm-1之间,也可以观察到几个吸收峰,其中,在627 cm-1的附近和约670 cm-1处的吸收峰可能属于![]() 的υ4振动。无论是在黄钾铁矾还是黄铵铁矾的结构中,由于
的υ4振动。无论是在黄钾铁矾还是黄铵铁矾的结构中,由于![]() 在上述范围的对称性降低,因此,很容易通过FTIR光谱来区别
在上述范围的对称性降低,因此,很容易通过FTIR光谱来区别![]() 的υ4振动[23]。同时,在此处,无法看到
的υ4振动[23]。同时,在此处,无法看到![]() 的υ1和υ2振动,这可能是附近的吸收峰与之相互重叠的结果;根据Powers的报道,推断无论是在508或者507和475 cm-1附近所形成的波峰应该都归属于FeO6八面体的振动峰。另外,根据Schafer等[22],可以判断在1 424和1 430 cm-1处所观察到的吸收峰应归属于
的υ1和υ2振动,这可能是附近的吸收峰与之相互重叠的结果;根据Powers的报道,推断无论是在508或者507和475 cm-1附近所形成的波峰应该都归属于FeO6八面体的振动峰。另外,根据Schafer等[22],可以判断在1 424和1 430 cm-1处所观察到的吸收峰应归属于![]() 的伸缩振动;
的伸缩振动;![]() 吸收峰的存在,进一步证实由L.ferriphium DY和A.ferrooxidans GF合成的沉淀为黄钾铁矾和黄铵铁矾的混合物。
吸收峰的存在,进一步证实由L.ferriphium DY和A.ferrooxidans GF合成的沉淀为黄钾铁矾和黄铵铁矾的混合物。
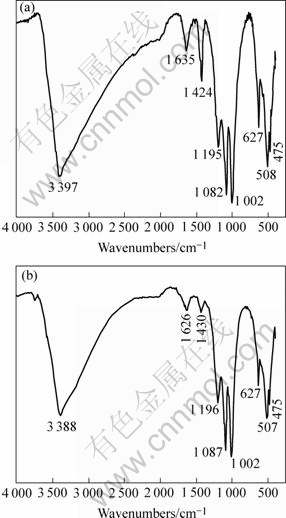
图4 DY和GF合成的沉淀的红外光谱图
Fig.4 Infrared spectra of iron precipitate synthesized by strain DY and strain GF
3 结论
在pH2.0、摇床转速180 r/min、温度分别为40 ℃和30 ℃的条件下,不同铁氧化细菌(L.ferriphium DY和A.ferrooxidans GF)在9 K液体培养基所合成的赭黄色高铁沉淀经ICP-AES,SEM,XRD和FTIR等方法鉴定为黄钾铁矾和黄铵铁矾的混合物,其中,由A.ferrooxidans GF合成的沉淀混合物中其黄钾铁矾的含量比L.ferriphium DY合成的约高出5.53%,而DY合成的沉淀中,其黄铵铁矾的含量比GF合成的沉淀中的黄铵铁矾的含量约高出15.24%。
REFERENCES
[1] Ingrid Oborn, Dan Berggren. Characterization of jarosite- natrojarosite in two Northern Scandinavian soils [J]. Geoderma, 1995, 66: 213-25.
[2] Elwood M E, Madden R J, Bodnar J D. Rimstidt. Jarosite as an indicator of water-limited chemical weathering on Mars [J]. Nature, 2004, 431: 821-823.
[3] 王长秋,马生凤,鲁安怀,等. 黄钾铁矾的形成条件研究及其环境意义[J]. 岩石矿物学杂志, 2005, 24(6): 607-611.
WANG Chang-qiu, MA Sheng-feng, LU An-huai, et al. The formation conditions of jarosite and its environmental signi- ficance[J]. Acta Petrologica et Mineralogica, 2005, 24(6): 607-611.
[4] Arregui V, Gordon A R, Steintveit G. The jarosite process-past and future[A]. Cigan J M, Mackey T S, O’Keefe T J. Lead-Zinc-Tin’80[C]. Warrendale, PA: The Metallurgical Society of AIME , 1979: 97-123.
[5] Dutrizac J E. The physical chemistry of iron precipitation in the zinc industry[A]. Cigan J M, Mackey T S, O’Keefe T J. Lead-Zinc-Tin’80. The Metallurgical Society of AIME[C], Warrendale, PA. 1979: 532-564.
[6] Asokan P, Mohini S, Asolekar S R. Jarosite characteristics and its utilisation potentials [J]. Science of the Total Environment, 2006, 359: 232-243.
[7] 宁顺明,陈志飞. 从黄钾铁矾渣中回收锌铟[J].中国有色金属学报,1997, 7(3):56-58.
NING Shun-ming, CHEN Zhi-fei. Recovery of zinc and indium from jarosite residues[J]. The Chinese Journal of Nonferrous Metals, 1997, 7(3): 56-58.
[8] Ambers J. Raman analysis of pigments from the Egyptian old kingdom [J]. Journal of Raman Spectroscopy, 2003, 35: 768-773.
[9] Kelly D P, Wood A P. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 511-516.
[10] Coram N J, Rawlings D E. Molecular relationship between two groups of the genus Leptospirillum and finding that leptospirillum ferriphilum sp.nov. Dominates South Africa commercial biooxidation tanks that operate at 40 ℃[J]. Applied and Environmental Microbiology, 2002, 68(2): 838-845.
[11] 周顺桂,周立祥,黄焕忠. 黄钾铁矾的生物合成与鉴定[J]. 光谱学与光谱分析,2004, 24(9): 1140-1143.
ZHOU Shun-gui, ZHOU Li-xiang, WONGJonathan W C. Biosynthesis and characterization of jarosite[J]. Spectroscopy and Spectral Analysis, 2004, 24(9): 1140-1143.
[12] 朱长见,陆建军,陆现彩,等. 氧化亚铁硫杆菌作用下形成的黄钾铁矾的SEM研究[J]. 高校地质学报,2005,11(2): 234-238.
ZHU Chang-jian, LU Jian-jun, LU Xian-cai, et al. SEM study on jarosite mediated by Thiobacillus ferrooxidans[J]. Geological Journal of China Universities, 2005, 11(2): 234-238.
[13] Santelli C M, Welch S A, Westrich H R, et a1. The effect of Fe-oxidizing bacteria on Fe-silicate mineral dissolution[J]. Chemical Geology, 2001, 180: 99-115.
[14] WANG Chang-qiu, MA Sheng-feng, LU An-huai, et a1. Experimental study on formation conditions of ammoniojarosite and its environmental significance [J]. Acta Geologica Sinica, 2006, 80(2): 296-301.
[15] Wang H M, Bigham J M, Tuovinen O H. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms[J]. Mater Sci Eng C, 2006, 26: 588-592.
[16] Sasaki K, Konno H. Morphology of jarosite-group compounds precipitated from biologically and chemically oxidized Fe ions[J]. The Canadian Mineralogist, 2000, 38: 45-56.
[17] Akai J, Akai K, Nakano S, et a1. Biologically localized iron ore at Gunma iron mine, Japan [J]. American Mineralogist, 1999, 84: 171-182.
[18] Powers D A, Rossman G R, Schugar H J, et al. Magnetic behavior and infrared spectra of jarosite, basic iron sulfate and their chromate analogs[J]. Journal of Solid State Chemistry, 1975, 13: 1-13.
[19] Tuovinen O H, Carlson L. Jarosite in cultures of iron oxidizing thiobacilli [J]. Geomicrobiololgy Journal, 1979, 1: 205-210.
[20] Lazaroff N, Melanson L, Lewis E, et al. Scanning electron microscopy and infrared spectroscopy of iron sediments formed by thiobacillus ferrooxidans[J]. Geomicrobiololgy Journal, 1985, 4: 231-267.
[21] Baron D, Palmer C D. Solubility of jarosite at 4-35 ℃[J]. Geochimica et Cosmochimica Acta, 1996, 60: 185-195.
[22] Schafer E, Begemann M H, Gudeman C S, et al. The vibrational spectrum of the free ammonium ion NH4+ [J]. Journal of Chemical Physics, 1983, 79: 3159-3160.
[23] Christophe D, Alexandra N. Synthesis, characterization, and thermochemistry of K-Na-H3O jarosites[J]. Geochimica et Cosmochimica Acta, 2003, 67(11): 2063-2076.
基金项目:国家自然科学基金创新研究群体科学基金资助项目(50321402);国家重点基础研究发展规划资助项目(2004CB619201)
收稿日期:2006-06-20;修订日期:2007-01-12
通讯作者:邱冠周,教授, 博士;电话:0731-8879212;E-mail: qgzfblw@163.com


