规则球形纳米银粉的制备及表征
刘素琴,樊 新,黄健涵,黄可龙
(中南大学 化学化工学院,湖南 长沙,410083)
摘 要:
摘 要:采用液相化学还原法,以聚乙二醇和聚乙烯吡咯烷酮为保护剂,以次磷酸钠直接还原硝酸银得到银溶胶;将银溶胶经过后续离心分离和真空干燥处理后制备分散性好的规则球形纳米银粉;利用紫外-可见分光光度计考察反应温度和溶液的pH值对制备的纳米银粉粒度分布的影响,利用粒度分析仪测试纳米银粉的粒径分布,利用透射电镜观察纳米银粉的形貌,利用X射线衍射分析纳米银粉的晶体结构。研究结果表明,在温度为318 K,pH值为10时,可制备规则球形、面心立方晶系纯相的纳米银粉,粒径为15~25 nm,放置30 d后仍具有很强的稳定性。
关键词:
中图分类号:TG146.32; TF123.73 文献标识码:A 文章编号:1672-7207(2007)03-0497-05
Preparation and characterization of uniform spherical
nanometer silver powder
LIU Su-qin, FAN Xin, HUANG Jian-han, HUANG Ke-long
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: Silver sols was synthesized from silver nitrate by chemical reduction in the liquid phase with sodium hypophosphite as the reducing agent, polyethylene glycol and polyvinyl pyrrolidone as protecting agents. Spherical and well-dispersive nanometer silver powder was gained by silver sols after succedent centrifugal-separating and vacuum-dryness disposal. The influences of the reaction temperature and pH on the granularity distributions of nanometer silver powder were investigated by UV-Vis spectrophotometer, and greater intensity of absorption peak and more narrow granularity distributions of nanosilver powder were gained at different temperatures and pH values, and the prepared nanometer silver powder was characterized by granularity analysis instrument for the granularity distributions, transmission electron microscope for the figure and X-ray diffraction for the crystal configuration. The results show that the obtained nanometer silver powder is excellent with the uniform spherical shape and face-centered cubic (FCC) system with the temperature at 318 K and pH at 10. Its granularity distribution is narrow with 15-25 nm in diameter, and it is still stable after 30 d.
Key words: nanometer silver powder; spherical; chemical reduction
近年来,纳米银粉因具有特异的量子尺寸效应和表面效应使得其在催化、微电子、光电子和电导材料等领域应用广泛[1-8]。不同的应用领域对纳米银粉的粒径有不同的要求。球形、粒径小和粒度分布窄的纳米银粉导电性好,是一种优良的电极材料。因此,制备规则球形纳米银粉,对提高电池性能很关键。液相还原法制备纳米银粉具有工艺简单、操作方便等优点,目前被得到广泛应用。Ullah等[9]以丙三醇为还原剂,在间苯二胺的保护下还原高浓度硝酸银,得到各向异性的纳米银粒子;顾大明等[10]在强酸性条件下制备了粒径为10~30 nm的纳米银粉;孙红刚等[11]考察了酸性条件下pH值对纳米银粉粒径的影响;Suber等[12]在强酸性条件下用萘磺酸钠和甲醛共聚物作保护剂,以抗坏血酸还原硝酸银,得到各种形貌的纳米银粒子。但是,在酸性条件下要得到规则球形且粒径分布均匀的纳米银粉操作较复杂。而在碱性条件下制备形状规则、粒径小和粒度分布窄的纳米银粉还没有见文献报道。为此,本文作者在碱性条件下采用液相化学还原法制备规则、稳定、球形的纳米银粉,并考察反应温度和溶液的pH值对纳米银粉粒度分布的影响,用透射电镜观察银粉的形貌,用X射线衍射分析银粉的晶体结构。
1 实 验
1. 1 仪器与试剂
仪器为:UV-3802型紫外-可见分光光度计,MASTERSIZER 2000粒度分析仪,JEOL JEM-1230透射电子显微镜,XD-98型X射线衍射仪。
试剂为:硝酸银,次磷酸钠,氨水,乙醇和丙酮等(均为分析纯试剂);聚乙烯吡咯烷酮、聚乙二醇等(均为化学纯试剂)。
1. 2 纳米银粉的制备
将硝酸银粉末溶解于去离子水中,加入表面活性剂聚乙烯吡咯烷酮,充分搅拌后得氧化液。将次磷酸钠和聚乙二醇溶解在去离子水中,加入氨水调节溶液的pH值,配制成还原液。在超声振荡和恒温磁力搅拌下,以30滴/min的速度将氧化液滴加到还原液中,滴加完成后继续搅拌30 min,制得银溶胶。在超声振荡下用去离子水洗涤银溶胶,以10 000 r/min的转速离心分离,用乙醇、丙酮洗涤沉淀物2次,离心分离后于313 K真空干燥5 h,得纳米银粉。
1. 3 纳米银粉表征方法
用紫外-可见分光光度计测银溶胶的紫外吸收光谱;用粒度分析仪分析纳米银粉的粒度分布;用透射电子显微镜表征其形貌;用X射线衍射仪测试样品的物相(Cu Kα1管电压为40 kV,管电流为300 mA,波长λ为0.154 056 nm,扫描范围为10°~90°,扫描速度为4.0 ℃/min)。
2 结果与讨论
2. 1 反应温度对纳米银粉的影响
一定粒径的贵金属纳米粒子对光的吸收是由价电子与电磁场的相互作用产生的连续振动即表面等离子体共振而产生的,这是小粒子尺寸效应的表现。纳米粒子吸收峰的位置、半高宽和峰值强度与粒子尺寸、粒度分布和产物浓度有很大关系[13]。图1所示为不同温度下制备的纳米银溶胶的紫外可见吸收光谱图。可见,温度为318 K时得到的纳米银粉的吸收强度最大,吸收峰对称性好,半高宽最窄,说明得到的纳米银粉产率高,粒度分布窄;温度由308 K升高到318 K时,紫外可见吸收光谱的最大吸收峰位置基本不变,都在408 nm处,与李德刚等[14]用相转移方法得到的银纳米粒子的结果相吻合。但当温度升高到323 K时,吸收峰位置发生红移,吸收强度变小,半高宽变宽。吸收强度的降低是由于自由电子密度发生变化,吸收峰变宽;最大吸收峰位置红移是纳米粒子的团聚所致[14]。图1表明,制备纳米银粉的适宜温度为318 K。
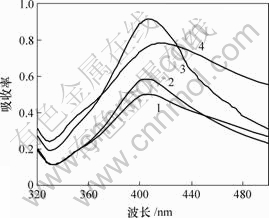
T/K: 1—308; 2—313; 3—318; 4—323
图1 反应温度不同时所制备的纳米银胶紫外-可见光谱图
Fig.1 UV-Vis spectra of the nanometer silver sols prepared at different reaction temperatures
2.2 溶液的pH值对纳米银粒子的影响,后时拌LNaOHe 研究最广的制备纳米银粉的方法。(这句话是什么意思?)
图2所示是固定温度为313 K, pH值不同时得到的纳米银胶的紫外可见吸收光谱图。可见,当pH值为8时,吸收峰强度很弱;随着pH值的增大,吸收峰强度逐渐增大,说明碱性增强有利于提高反应产物产率;当pH值为10时,得到的纳米银粉的吸收强度大,吸收峰对称性好,半高宽最窄。这说明得到的纳米银粉产率高,粒度分布窄。当pH值增大到11后,曲线半高宽变大,最大吸收峰位置发生红移,制备的银粉粒径变大且粒度分布变宽。由此可知,要得到粒经小且粒经分布窄的纳米银粉,最适宜pH值为10。
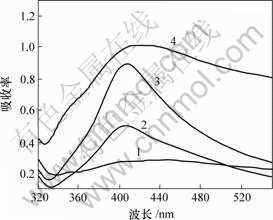
pH: 1—8; 2—9; 3—10; 4—11
图2 pH值不同时制备的纳米银胶紫外-可见吸收光谱
Fig.2 UV-Vis absorption spectra of the nanometer silver sols prepared at different pH values of reacting solution
2. 3 纳米银溶胶稳定性分析
为了分析纳米银粒子的稳定性,测试了温度为318 K,pH值为10时所得纳米银粉在1~30 d的紫外-可见吸收光谱,如图3所示。由图3可知,放置1 d后测得的纳米银粒子在408 nm处出现最大吸收峰;随着放置时间的延长,纳米银粒子的吸收强度略微变小,吸收峰的半高宽略微变小,但是,总体来说,吸收峰的峰形非常相似,最大吸收峰位置没有发生明显的变化,说明在聚乙二醇和聚乙烯吡咯烷酮共同保护下,制备的纳米银粒子稳定性很强。
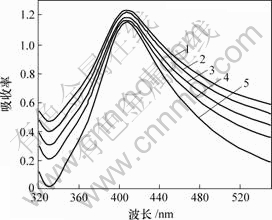
t/d: 1—1; 2—5; 3—10; 4—15; 5—30
图3 纳米银胶放置不同时间的紫外-可见吸收光谱
Fig.3 UV-Vis absorption spectra of the nanometer silver sols at different setting time
2. 4 粒度分析
图4所示是温度为318 K,pH值为10时所得纳米银粉粒径分布图。由图4可知,得到的纳米银粉粒径为15~25 nm,平均粒径为20 nm,这与文献[14]中用相转移方法制备的纳米银粉的粒径相当。
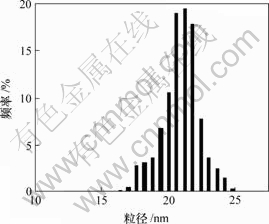
图4 纳米银粉的粒径分布图
Fig.4 Particle size distribution graphs of nanometer silver powder
2. 5 透射电镜(TEM)分析
在温度为318 K,pH值为10时所得纳米银粉和放置30 d后纳米银粉的透射电镜(TEM)照片如图5所示。由图5可知,所得银纳米粒子为球形,分散性较好,颗粒粒径均一,大部分颗粒粒径在20 nm左右,这与图4所示结果相吻合;放置30 d后,纳米银粉的形状和粒径没有发生明显的变化,也没有发生明显的团聚,得到的仍然是分散性好的纳米银粉。由此可知,制备的纳米银粉具有很强的稳定性。
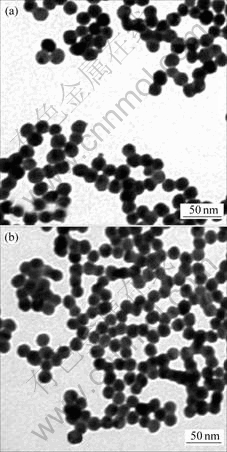
(a) 0 d; (b) 30 d
图5 纳米银粉放置不同时间的TEM照片
Fig.5 TEM images of nanometer silver powder at different setting time
2. 6 X射线衍射(XRD)分析
图6所示是温度为318 K,pH值为10时所得纳米银粉X射线衍射(XRD)图谱。图中纳米银在2θ为38.06?,44.24?,64.38?和77.36?处有明显的吸收峰,与JCPDS卡04-0783上数据(2θ为38.096?,44.257?,64.406?和77.452?)基本吻合,分别对应于立方晶系银的(111),(200),(220)和(311)晶面,说明产品为立方晶系纯相单质银。该曲线衍射峰相当尖锐,表明产品结晶性能良好。
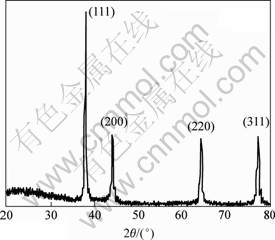
图6 纳米银粉的XRD图谱
Fig.6 XRD pattern of nanometer silver powder
2. 7 反应机理
以硝酸银为原料,次磷酸钠为还原剂,发生的反应化学方程式为:
![]()
反应中pH值的影响主要体现在对各对电极电势的影响。在25 ℃时,反应体系中各对电极电势如下:
φ0(Ag+/Ag)=0.800 V。
溶液为碱性时,
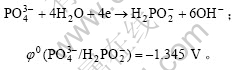
通过计算得出反应方程式(1)的自由能ΔG0= –827.84 kJ/mol,反应自发进行。
NaH2PO2是一种常用的强还原剂,要得到纳米粒子,就必须加入保护剂降低反应速度。聚乙烯吡咯烷酮是制备纳米粒子的一种很好的保护剂,对控制纳米粒子的形状和粒径起到非常好的作用,但仍有部分纳米银粒子发生快速团聚,形成大颗粒银粒子[15]。聚乙二醇分子具有轻微的负极性,易溶于水等极性溶剂,是一种比较好的保护剂和还原剂,其结构式为CH2(OH)- (CH2CH2O)nCH2OH。聚乙二醇长链上大量的氧原子包围在纳米粒子的表面,增强了纳米粒子的稳定性,而且可以得到粒经分布窄的纳米粒子[16]。所以,聚乙二醇能与聚乙烯吡咯烷酮共同作用,可制备规则形状的纳米银粉。
3 结 论
a. 采用液相化学还原法,以聚乙二醇和聚乙烯吡咯烷酮为保护剂,次磷酸钠直接还原硝酸银得到银溶胶,经过超声振荡、高速离心分离和真空干燥后可制备粒度分布窄的规则球形纳米银粉。
b. 纳米银粉放置30 d后仍具有很强的稳定性,且没有发生明显的团聚。
c. 纳米银粉粒度分布为15~25 nm,平均粒径为20 nm,分散性好,属面心立方晶系纯相纳米银,呈规则球形。
参考文献:
[1] Slocik J M, Wright D W. Biomimetic mineralization of noble metal nanoclusters[J]. Biomacromolecules, 2003, 4(5): 1135-1141.
[2] Claudia P, Andreas K, Horst W. Site-specific photodeposition of silver on ZnO nanorods[J]. Angewandte Chemie International Edition, 2004, 43(36): 4774-4777.
[3] 马运柱, 黄伯云, 范景莲. 表面活性剂对制备纳米(W, Ni, Fe)复合氧化物粉末的影响[J]. 中南大学学报: 自然科学版, 2004, 35(5): 736-741.
MA Yun-zhu, HUANG Bai-yun, FAN Jing-lian. Influence of surfactants on preparation of nanometer (W, Ni, Fe) composite oxide powder[J]. Journal of Central South University: Science and Technology, 2004, 35(5): 736-741.
[4] Cho K H, Park J E, Osaka T, et al. The study of antimicrobial activity and preservative effects of nanosilver ingredient[J]. Electrochimica Acta, 2005, 51(5): 956-960.
[5] El-Sayed M A. Some interesting properties of metals confined in time and nanometer space of different shapes[J]. Accounts of Chemical Research, 2001, 34(4): 257-264.
[6] 李 卫. 单分散纳米氧化铋的制备[J]. 中南大学学报: 自然科学版, 2005, 36(2): 175-178.
LI Wei. Preparation of monodisperse nanometer Bi2O3 powder[J]. Journal of Central South University: Science and Technology, 2005, 36(2): 175-178.
[7] Narayanan R, El-Sayed M A. Shape-dependent catalytic activity of platinum nanoparticles in colloidal solution[J]. Nano Letters, 2004, 4(7): 1343-1348.
[8] 席晓丽, 聂祚仁, 付晓天, 等. 掺杂Ce的纳米W复合粉末的制备及其表征[J]. 中南大学学报: 自然科学版, 2005, 36(1): 6-9.
XI Xiao-li, NIE Zuo-ren, FU Xiao-tian, et al. Preparation and characterization of Ce-W composite nanopowder[J]. Journal of Central South University: Science and Technology, 2005, 36(1): 6-9.
[9] Ullah M H, Kim I L, Ha C S. Preparation and optical properties of colloidal silver nanoparticles at a high Ag+ concentration[J]. Material Letters, 2006, 60(12): 1496-1501.
[10] 顾大明, 高 农, 程谨宁. 次磷酸盐液相还原法快速制备纳米银粉[J]. 精细化工, 2002, 19(11): 634-636.
GU Da-ming, GAO Nong, CHENG Jing-ning. High-speed preparation of nanometer silver by reduction with sodium hypophosphite in liquid phase[J]. Fine Chemicals, 2002, 19(11): 634-636.
[11] 孙红刚, 刘 恒, 尹光福, 等. 粒经可控纳米银的制备研究[J]. 材料导报, 2005, 19(F11): 154-156.
SUN Hong-gang, LIU Heng, YIN Guang-fu, et al. Study on the preparation of controlled sizes of silver nanoparticles[J]. Materials Review, 2005, 19(F11): 154-156.
[12] Suber L, Sondi I, Matijivic E, et al. Preparation and the mechanisms of formation of silver particles of different morphologies in homogenous solutions[J]. Journal of Colloid and Interface Science, 2005, 288(2): 489-495.
[13] Alvarez M M, Khoury J T, Schaaf T G, et al. Optical absorption spectra of nanocrystal gold molecules[J]. Journal of Physical Chemistry B, 1997, 101(19): 3706-3712.
[14] 李德刚, 陈慎豪, 赵世勇, 等. 相转移方法制备银纳米粒子单层膜[J]. 化学学报, 2002, 60(3): 408-412.
LI De-gang, CHEN Shen-hao, ZHAO Shi-yong, et al. Production of the monolayer of Ag nanoparticles by phase transferring[J]. Acta Chimica Sinica, 2002, 60(3): 408-412.
[15] QI Li-min, GAO Yue-ying, MA Ji-ming. Synthesis of ribbons of silver nanoparticles in lamellar liquid crystals[J]. Colloids and Surfaces A, 1999, 157(3): 285-294.
[16] LUO Cheng-cai, ZHANG Yu-hong, ZENG Xiao-wei, et al. The role of poly (ethylene glycol) in the formation of silver nanoparticles[J]. Journal of Colloid and Interface Science, 2005, 288(2): 444-448.
收稿日期:2006-11-28
基金项目:国家“863”高技术项目(2002AA323100)
作者简介:刘素琴(1966-),女,湖南攸县人,教授,从事功能材料化学研究
通讯作者:黄可龙,男,教授,博士生导师;电话:0731-8879850; E-mail: klhuang@mail.csu.edu.cn
[3] 马运柱, 黄伯云, 范景莲. 表面活性剂对制备纳米(W, Ni, Fe)复合氧化物粉末的影响[J]. 中南大学学报: 自然科学版, 2004, 35(5): 736-741.
[6] 李 卫. 单分散纳米氧化铋的制备[J]. 中南大学学报: 自然科学版, 2005, 36(2): 175-178.
[8] 席晓丽, 聂祚仁, 付晓天, 等. 掺杂Ce的纳米W复合粉末的制备及其表征[J]. 中南大学学报: 自然科学版, 2005, 36(1): 6-9.
[10] 顾大明, 高 农, 程谨宁. 次磷酸盐液相还原法快速制备纳米银粉[J]. 精细化工, 2002, 19(11): 634-636.
[11] 孙红刚, 刘 恒, 尹光福, 等. 粒经可控纳米银的制备研究[J]. 材料导报, 2005, 19(F11): 154-156.
[14] 李德刚, 陈慎豪, 赵世勇, 等. 相转移方法制备银纳米粒子单层膜[J]. 化学学报, 2002, 60(3): 408-412.
" target="blank">[16] LUO Cheng-cai, ZHANG Yu-hong, ZENG Xiao-wei, et al. The role of poly (ethylene glycol) in the formation of silver nanoparticles[J]. Journal of Colloid and Interface Science, 2005, 288(2): 444-448.


