空气氧化法生产焦锑酸钠的氧化后液中砷和锑的脱除
杨天足1,刘伟锋1,赖琼林1,江名喜1,王志明2,王卫东2
(1.中南大学 冶金科学与工程学院,湖南 长沙,410083;
2.华锡集团 金城江矿山机械厂,广西 河池,547000)
摘要: 研究了空气氧化法生产焦锑酸钠的氧化后液中脱除砷和锑的方法,并探讨了提高副产品硫代硫酸钠产量的途径。研究结果表明:采用硫酸和SO2中和脱除砷和锑,终点pH值分别控制在6.0和7.0,砷的脱除率分别为26.9%和19.3%,锑的脱除率分别为94.5%和93.5%;而采用硫酸亚铁、水合肼和硫化钠3种试剂脱除砷和锑,过量系数分别为1.0,2.0和1.0时砷的脱除率分别为70.0%,50.0%和60.0%,锑的脱除率分别为96.7%,95.6%和96.7%;在加硫磺反应中,当过量系数为1.1和时间为90 min时,硫向硫代硫酸钠的转化率能达到83.3%。
关键词: 空气氧化法; 焦锑酸钠; 硫代硫酸钠; 除杂
中图分类号:TF111.31 文献标识码:A 文章编号: 1672-7207(2005)04-0576-06
Removal of arsenic and antimony from oxidated solution
of sodium thioantimonite production by air oxidation
YANG Tian-zu1, LIU Wei-feng1,LAI Qiong-lin1,
JIANG Ming-xi1, WANG Zhi-ming2, WANG Wei-dong2
(1.School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2.Jingchengjiang Mechanical Plant of Mine, Huaxi Group, Hechi 547000, China)
Abstract: The removal of arsenic and antimony from the oxidated solution was investigated in the sodium thioantimonite production by air oxidation, and the approach of enhancing the by-product output of sodium thiosulfate was explored. The results show that when sulphuric acid and SO2 gas are separately used to neutralize the oxidation solution, as the ending pH is controlled at 6.0 and 7.0, respectively,the removal ratio of arsenic is 26.9% and 19.3%; the removal ratio of antimony is 94.5% and 93.5%, respectively. When FeSO4, N2H4 and Na2S with the excessive coefficient of 1.0,2.0,1.0 respectively are used to remove arsenic and antimony, the removal ratio of arsenic are 70.0%,50.0% and 60.0%, separately; the removal of antimony can reach 96.7%, 95.6% and 96.7%, respectively. The transform ratio of sulfur can reach 83.3% when the sulphuric excessive coefficient is 1.1 and the time is 90 min.
Key words: air oxidation; sodium thioantimonite; sodium thiosulfate; removing impurities
焦锑酸钠在玻璃工业作为澄清剂和脱色剂,特别是作为电视荧光屏显像管玻璃、计算机显示器玻璃等高档玻璃生产的澄清剂,使玻璃透明度高,光照不变色,其效果远远优于传统的澄清剂,而且毒性小。在阻燃工业中,焦锑酸钠可以用作协同增效剂;[CM(22] 此外,还可以用作优质陶瓷和搪瓷的原料;以焦锑 酸钠为原料,可以开发出一系列新的锑深加工产品[1-8]。
生产焦锑酸钠的方法很多,有硝酸钠氧化法,双氧水氧化法,钾盐法,氯化法和空气氧化法等[2-4]。其中最经济的方法为空气氧化法,这也是现在国内使用最多的一种方法。空气氧化法可以使用单一的锑矿石、复杂锑矿等作为原料,用硫化钠和氢氧化钠为溶剂进行浸出,这也是大多数湿法炼锑的主要工序[1];往得到的浸出液中鼓入空气,在催化剂的作用下,3价锑被氧化成焦锑酸钠沉淀,氧化后液中的硫大部分氧化成硫代硫酸钠,部分为亚硫酸钠和硫酸钠。硫代硫酸钠可以作为副产品大苏打回收。但是,由于此方法生产焦锑酸钠的原料来自矿石,其氧化后液中含有杂质砷,同时氧化后液中还残存少量未沉淀的锑。
为了能从氧化后液中尽可能回收硫代硫酸钠,并得到合格的副产品(大苏打),需从氧化后液中除去砷和锑。在此,作者以空气氧化法生产焦锑酸钠过程中产生的氧化后液为研究对象,研究pH值对砷和锑脱除效果的影响;采用不同的试剂,如硫酸亚铁、水合肼和硫化钠去除砷和锑,并探讨提高硫代硫酸钠产率的途径[1-3,9-12]。
1 实 验
1.1 试剂与仪器
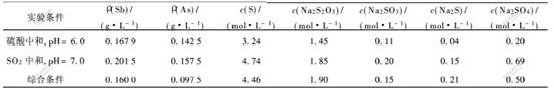
含硫代硫酸钠的溶液为焦锑酸钠生产过程的氧化后液,主要成分见表1。
表 1 氧化后液的化学成分
Table 1 Chemical compositions of oxidated solution
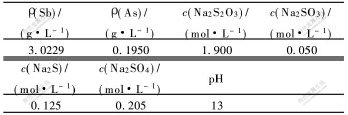
所用试剂为分析纯的七水硫酸亚铁(FeSO4·7H2O)、水合肼、硫化钠、硫磺、硫酸铈、溴酸钾、硫酸以及工业级亚硫酸钠(Na2SO3);
实验仪器主要有电热套、磁力搅拌器、机械搅拌器和PHB-4型pH计。
1.2 实验过程
1.2.1 中和除杂实验
将一定体积氧化后液加入250 mL烧杯中,中和温度为30 ℃,然后分别加入硫酸或者通入SO2气体进行中和,控制终点pH值。当体系达到所要求的pH值时,稳定10 min后,过滤取样分析中和后溶液中砷和锑的含量,考察采用不同试剂中和时pH值对砷和锑含量的影响;最后,选取除杂效果较好的pH值时的中和后液,分析其中硫的形态。
1.2.2 药剂除杂实验
选硫酸亚铁、水合肼和硫化钠3种除杂剂;将盛有一定氧化后液的烧杯置于电热套上,中和温度为30 ℃,用机械搅拌器搅拌,然后用硫酸中和到pH=6.0,分别取一定过量系数的3种除杂剂进行实验,每个实验时间为60 min左右,每次实验结束时用硫酸将体系pH值调回至6.0,以确保实验准确性;最后,过滤取样分析滤液中的锑和砷的含量,分析除杂剂用量对砷和锑含量的影响。
1.2.3 加硫转化实验
在用硫酸中和至pH=6.0,硫酸亚铁过量系数为1.0的条件下,将脱除砷和锑的氧化后液升温至沸腾,考察不同过量系数时硫磺对溶液中砷、锑含量和硫代硫酸钠含量的影响;然后,选择合适反应时间,在同样条件下进行硫的过量系数实验,分析溶液中砷、锑含量和硫代硫酸钠含量。
1.3 分析方法
在整个实验中,锑和砷采用连续滴定法分析,锑采用硫酸铈滴定法分析,砷则采用溴酸钾滴定法分析[5-7];各种硫的形态分析则采用碘标—硫代硫酸钠滴定法分析[8];酸度采用PHB-4型pH计测量。
2 结果与讨论
2.1 pH值对砷和锑脱除效果的影响
氧化后液呈碱性,其中砷和锑以硫代酸盐的形式稳定存在,而氧化后液中也有S2-,在pH〈7的条件下,硫代酸盐发生离解,离解的部分砷和锑则能以硫化物形式沉淀下来。控制氧化后液的中和pH值,中和后稳定时间10 min,分别用硫酸和SO2气体中和,考察不同试剂、不同pH值对砷、锑脱除效果的影响,其结果见图1和图2。
从图1可以看出,用硫酸中和,当pH=6.0时中和后液中砷和锑的含量最低。
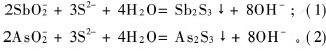
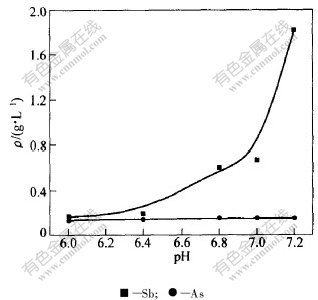
图 1 硫酸中和时pH值对As和Sb质量浓度的影响
Fig. 1 Effect of neutralization pH value on concentration of As and Sb by sulfuric acid
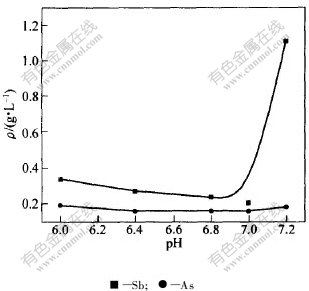
图 2 SO2气体中和时pH值对As和Sb质量浓度的影响
Fig. 2 Effect of neutralization pH value on concentration of As and Sb by SO2 gas
当pH〈6.0时,随着pH值减小,酸度过高,溶液中的S2-以H2S的形式挥发,不利于砷和锑的脱[CM(22] 除;而当pH >6.0时,随着pH值增大,砷和锑脱[CM)] 除率降低。这是由于部分S2-会与Sb2S3起络合反应,使已经沉淀的Sb2S3重新溶解,进而无法起到除杂的效果。
![]()
氧化后液用硫酸中和到pH=6.0,以脱除砷和锑。
从图2可以看出:采用SO2气体中和时,其硫代硫酸盐直接与SO2作用生成Sb2S3和As2S3沉淀,控制pH=7.0时中和后液中砷和锑的含量最低,其砷和锑的脱除率分别达到19.3%和93.5%。
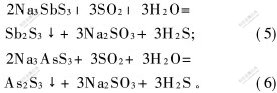
当pH>7.0时,会发生类似的沉淀重新溶解现象,所以,中和后液中的杂质含量增加。当pH〈7.0时,pH值越小,H2S在溶液中的溶解度越小,不能很好地参与生成硫化物沉淀的反应。可见,pH值不能太低。
选用2种试剂中和除砷和锑以后,分析除杂效果最好的中和后液中硫的形态,结果见表2。可以看出,用SO2气体中和,当pH=6.0时,其中和后液中的硫代硫酸钠浓度比用硫酸中和时的浓度高0.40 mol·L-1,其硫代硫酸钠的含量提高了27.6%;而亚硫酸钠的浓度也提高了0.09 mol·L-1,这是由于用SO2中和时,抑制了原氧化后液中硫代硫酸钠的分解,而用硫酸中和时,强烈的酸性使局部的硫代硫酸钠分解,导致其含量降低。
2.2 药剂除杂试验
无论选用何种试剂中和,其锑的脱除率均可达到90%以上,而砷的脱除率只有20%左右。主要原因可能是溶液氧化过程中部分砷和锑转化成As5+和Sb5+,而As5+和Sb5+要转化成As2S5和Sb2S5沉淀从溶液中脱除很难。为了尽可能地除去砷和[CM(22] 锑,拟采用还原的途径,选择的试剂有3种:硫酸亚铁,水合肼和硫化钠。
表 2 不同条件下中和后液中硫的形态分布
Table 2 Distribution of sulf-conformation in neutralized solution by different reagents
2.2.1 硫酸亚铁用量对砷和锑脱除效果的影响
在用硫酸中和至pH=6.0,实验温度为30 ℃和反应时间为60 min的条件下,考察硫酸亚铁过量系数对砷和锑的脱除效果的影响,结果见图3。可以看出,硫酸亚铁的过量系数为1.0时,溶液中砷和锑的含量最低,砷和锑的脱除率可以达到70.0%和96.7%;加入硫酸亚铁后,部分Fe2+在溶液中氧化成Fe3+,部分Fe2+可以将Sb5+还原成Sb3+,而其氧化成Fe3+,同时Sb3+和溶液中的S2-生成Sb2S3沉淀,见反应式(1);另外,AsO3-3则和Fe3+形成砷酸铁沉淀得以除去,也有部分Fe3+形成Fe(OH)3沉淀,当然也有部分锑与它们同时共沉淀被除去,见反应式(7)。
![]()

图 3 Fe(SO4)2用量对As和Sb质量浓度的影响
Fig. 3 Effect of dosage of Fe(SO4)2 on concentration of As and Sb
而随着硫酸亚铁过量系数的增大,砷和锑的浓度有增加的趋势。这是因为硫酸亚铁过量时,会引起沉淀不完全和部分沉淀重新溶解的现象。硫酸亚铁过量不利于脱除氧化后液中的砷和锑。硫酸亚铁的过量系数为1.0时的除杂效果较好。
2.2.2 水合肼用量对砷和锑脱除效果的影响
控制硫酸中和pH=6.0,实验温度为30 ℃和反应时间为60 min的条件下,考察水合肼的用量对砷和锑浓度的影响,实验结果见图4。可以看出,当水合肼的过量系数为2.0时,水溶液中砷和锑的浓度最低,砷和锑的脱除率可以达到50.0%和95.6%。加入的水合肼将中和后液中As5+离子和Sb5+还原成As3+和Sb3+,见反应式(8)和(9)。
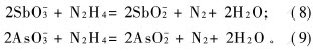
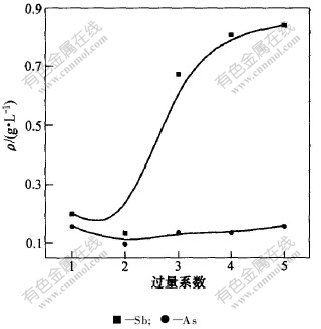
图 4 N2H4用量对As和Sb质量浓度的影响
Fig. 4 Effect of dosage of N2H4 on concentration of As and Sb
然后,As3+和Sb3+再和溶液中的S2-形成沉淀而被除去。而随着水合肼过量系数的增大,砷和锑的脱除效果逐渐变差,因此,水合肼过量不利于砷和锑的脱除。这可能是由于还原剂用量增大时,与砷和锑离子结合为沉淀的S2-容易被还原成单质S,从而使溶液中S2-减少,导致水合肼的除杂效果变差。
2.2.3 硫化钠用量对砷和锑脱除效果的影响
在用硫酸中和至pH=6.0,温度为30 ℃和反应时间为60 min的条件下,考察硫化钠用量对砷和锑脱除效果的影响,其结果见图5。可以看出,选用过量系数为1.0时,水溶液中砷和锑的含量最低,砷和锑的脱除率可以达到60.0%和96.7%;在pH=6.0时,增大Na2S的用量,不仅不能起到产生硫化物沉淀脱除砷和锑的效果,过量的Na2S反而起了浸出的作用,已经沉淀的硫化物和过量的S2-作用,生成硫代砷酸钠和硫代锑酸钠等,使沉淀重新溶解到中和后液中,其反应式见式(3)和(4)。所以,硫化钠过量不利于砷和锑等杂质的脱除。选择硫化钠的过量系数为1.0比较合适。
2.2.4 综合条件下的实验
在上面实验的基础上,选择如下综合条件:用SO2中和氧化后液到pH=7.0,温度为30 ℃,硫酸亚铁的过量系数为1.0,研究砷和锑的脱除效果和溶液中硫代硫酸钠含量的变化,结果见表2。可见,用SO2气体中和及硫酸亚铁除杂过程后的溶液中砷、锑的浓度明显减小,与硫酸中和以后硫酸亚铁除杂的作用相当。用SO2气体中和具有一个十分突出的优点:提高了中和除杂后液中硫代硫酸钠的浓度,其浓度比用硫酸中和提高了28.3%,即增加了副产品的产量。
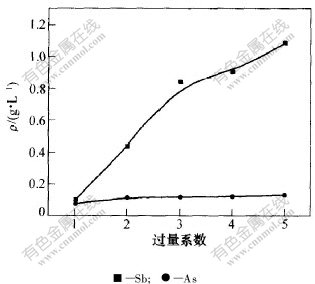
图 5 Na2S用量对As和Sb质量浓度的影响
Fig. 5 Effect of dosage of Na2S on concentration of As and Sb
2.3 加硫磺转化实验
针对工业生产过程中出现的硫代硫酸钠产量过低的问题,通过分析氧化后液中硫的形态,选择加入硫磺使溶液中的亚硫酸钠转化成硫代硫酸钠[12,13],同时抑制溶液中原有的硫代硫酸钠分解的途径,以提高大苏打的含量,其反应式为:
![]()
2.3.1 反应时间对硫代硫酸钠含量的影响
控制pH=6.0,硫酸亚铁的过量系数为1.0,硫磺的过量系数为1.0,温度为100 ℃,考察硫代硫酸钠的含量与反应时间的关系,其结果如图6所示。可见,在反应90 min时,溶液中Na2S2O3的浓度最高,可以达到2.10 mol·L-1;硫磺的转化率可以达到75.3%;延长反应时间,有利于提高硫代硫酸钠的浓度。
同时,溶液中砷和锑的含量在反应时间为90 min时最低,其中脱除砷的效果比较理想。只是溶液中的锑浓度相对偏高,但是提高了溶液中硫代硫酸钠和亚硫酸钠的浓度。所以,选择反应时间为90 min较合理。
2.3.2 硫磺过量系数对硫代硫酸钠含量的影响
控制硫酸中和的pH=6.0,硫酸亚铁的过量系数为1.0,温度为100 ℃,反应时间为90 min,考察硫代硫酸钠的含量与硫磺过量系数的关系,结果见图7。可以看出,Na2S2O3的浓度在硫磺过量系数达到1.1时最大,为2.175 mol·L-1,溶液中硫代硫酸钠浓度提高0.325 mol·L-1,此时硫磺的转化率为83.0%,而随着硫磺过量系数的增大,由于热分解等作用,硫代硫酸钠的浓度反而降低,而此时溶液中砷和锑的含量又有所降低。所以,选择硫磺的过量系数为1.1比较合理。
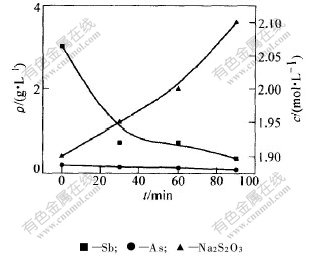
图 6 反应时间对As,Sb和Na2S2O3浓度的影响
Fig. 6 Effect of reaction time on concentration of As, Sb and Na2S2O3
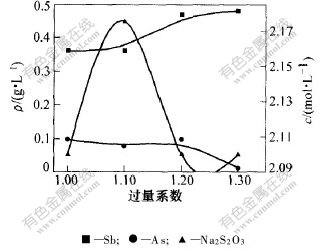
图 7 硫磺过量系数对As,Sb和Na2S2O3浓度的影响
Fig. 7 Effect of sulfur excessive coefficient on concentration of As, Sb and Na2S2O3
3 结 论
a. 在选用硫酸中和除杂时控制pH值为6.0,砷和锑的脱除率分别达到26.9%和94.5%;而选用SO2中和除杂pH值控制在7.0时,砷和锑的脱除率分别达到19.3%和93.5%;在这2种条件下,氧化后液中的锑都能达到很好的脱除效果;而采用SO2中和除杂时,溶液中硫代硫酸钠的浓度也提高了27.6%。
b. 当中和至pH值为6.0,反应温度为30℃,反应时间为60 min,硫酸亚铁过量系数为1.0时,砷和锑的脱除率可以分别达70.0%和96.7%;水合肼过量系数为2.0时,砷和锑的脱除率可以分别达到50.0%和95.6%;硫化钠过量系数为1.0时,其砷和锑的脱除率可以分别达到60.0%和96.7%。故选用上述每一种除杂试剂,都能有效地除去杂质砷和锑。
c. 在加硫磺转化的试验中,控制硫酸亚铁的过量系数为1.0,温度为100 ℃,在反应时间为90 min,硫磺的过量系数为1.1时,硫向硫代硫酸钠的转化率可达83.0%,而溶液中的硫代硫酸钠浓度提高0.325 mol·L-1。
参考文献:
[1]ZHAO Tian-cong. Metallurgy of antimony[M] . Changsha: Press of Central South University of Technology, 1987: 358-462.
[2]杨天足, 唐建军, 宾万达, 等. 焦锑酸钠生产工艺及研究进展[J]. 无机盐工业, 1999, 31(1): 20-22.
YANG Tian-zu, TANG Jian-jun, BIN Wan-da, et al. Review of the process and study for producing sodium thioantimonite[J]. Inorganic Chemicals Industry, 1999, 31(1): 20-22.
[3]YANG Tian-zu, LAI Qiong-lin, TANG Jian-jun, et al. Precipitation of antimony from the solution of sodium thioantimonite by air oxidation in the presence of catalytic agents[J]. Journal of Central South University of Technology(English Edition), 2002, 9(2): 107-111.
[4]刘述平. 我国的锑深加工产品[J]. 矿产综合利用, 2003(1): 29-33.
LIU Shu-ping. The further processing antimony products in China[J]. Multipurpose Utilization of Mineral Resources, 2003(1): 29-33.
[5]株州冶炼厂. 有色冶金中的元素分离与测定[M]. 北京: 冶金工业出版社, 1979: 156-173.
Zhuzhou Smeltery. Separation and analysis of elements in the non-ferrous industry[M]. Beijing: Metallurgic Industry Press, 1979: 156-173.
[6]武汉大学. 分析化学[M]. 北京: 人民教育出版社, 1979: 310-363.
Wuhan University. Analysis chemistry[M]. Beijing: Peoples Education Press, 1979: 310-363.
[7]吴辛友, 袁盛铨, 翟全铣. 分析试剂的提纯与配制手册[M]. 北京:冶金工业出版, 1989: 212-221.
WU Xin-you, YUAN Sheng-quan, ZHAI Quan-xian. Mannal of analytical reagents purification and preparation[M]. Beijing: Metallurgic Industry Press, 1989: 212-221.
[8]舒红英. 脱硫液中硫代硫酸钠的测定[J]. 江西冶金, 2002, 22(3): 38-39.
SHU Hong-ying. Determination of sodium thiosulphate in desulfurization solution[J]. Jiangxi Metallurgy, 2002, 22(3): 38-39.
[9]李运姣, 孙昭明, 李洪桂, 等. Na2WO4溶液结晶过程中除砷、硅等杂质[J]. 中南工业大学学报(自然科学版), 2001, 32(3): 251-254.
LI Yun-jiao, SUN Zhao-ming, LI Hong-gui, et al. Removal of arsenic and silicon from sodium tungsten solution by crystallization[J]. Journal of Central South University of Technology(Natural Science), 2001, 32(3): 251-254.
[10]唐谟堂. 用AC法处理高锑低银类铅阳极泥[J]. 中南工业大学学报(自然科学版), 2002, 33(4): 360-363.
TANG Mo-tang. AC process for treating lead electrolysis refining anodicslime bearing high antimony and lower siliver[J]. Journal of Central South University of Technology(Natural Science), 2002, 33(4): 360-363.
[11]陈寿椿. 重要的无机化学反应[M]. 上海:上海科学技术出版社,1984: 107-176.
CHEN Shou-chun. Important inorganic chemical reactions[M]. Shanghai: Shanghai Science and Technology Press, 1984: 107-176.
[12]唐建军, 杨天足, 宾万达, 等. 空气氧化硫代亚锑酸钠溶液沉锑研究[J]. 矿产综合利用, 2001(2): 11-14.
TANG Jian-jun, YANG Tian-zu, BIN Wan-da, et al. A study on antimony precipitation from sodium thioantimonite by air oxidization[J]. Multipurpose Utilization of Mineral Resources, 2001(2): 11-14.
收稿日期:2004-09-05
基金项目:国家“九五”科技攻关项目(96-915-08-04)
作者简介:杨天足(1958-),男,湖南长沙人,教授,博士生导师,从事贵、重金属冶炼和提纯以及相关化工产品的开发
论文联系人: 杨天足,男,教授;电话:0731-8836791(O);E-mail:13508482570@hnmcc.com
[2]杨天足, 唐建军, 宾万达, 等. 焦锑酸钠生产工艺及研究进展[J]. 无机盐工业, 1999, 31(1): 20-22.
[4]刘述平. 我国的锑深加工产品[J]. 矿产综合利用, 2003(1): 29-33.
[5]株州冶炼厂. 有色冶金中的元素分离与测定[M]. 北京: 冶金工业出版社, 1979: 156-173.
[6]武汉大学. 分析化学[M]. 北京: 人民教育出版社, 1979: 310-363.
[7]吴辛友, 袁盛铨, 翟全铣. 分析试剂的提纯与配制手册[M]. 北京:冶金工业出版, 1989: 212-221.
[8]舒红英. 脱硫液中硫代硫酸钠的测定[J]. 江西冶金, 2002, 22(3): 38-39.
[9]李运姣, 孙昭明, 李洪桂, 等. Na2WO4溶液结晶过程中除砷、硅等杂质[J]. 中南工业大学学报(自然科学版), 2001, 32(3): 251-254.
[10]唐谟堂. 用AC法处理高锑低银类铅阳极泥[J]. 中南工业大学学报(自然科学版), 2002, 33(4): 360-363.
[11]陈寿椿. 重要的无机化学反应[M]. 上海:上海科学技术出版社,1984: 107-176.
[12]唐建军, 杨天足, 宾万达, 等. 空气氧化硫代亚锑酸钠溶液沉锑研究[J]. 矿产综合利用, 2001(2): 11-14.


