文章编号:1004-0609(2009)07-1332-06
NaOH-NaAl(OH)4-Na2CO3-H2O体系活度因子的计算模型
彭小奇1, 2, 3,宋国辉1,宋彦坡1, 2,张建智1,刘振国1
(1. 中南大学 能源科学与工程学院,长沙 410083;
2. 中南大学 信息科学与工程学院,长沙 410083;
3. 湖南第一师范学院 信息科学与工程系,长沙 410205)
摘 要:
应用Bromley模型,通过对氢氧化钠、铝酸钠和碳酸钠等溶液体系活度因子的实验数据进行校验与回归分析,获得了各电解质合理的Bromley参数,建立基于Bromley模型的NaOH-NaAl(OH)4-Na2CO3-H2O体系活度因子的计算模型,其适用范围为:质量摩尔浓度分别为m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg,m(Na2CO3)≤3 mol/kg且离子强度I≤9 mol/kg。使用该模型和Rard方法计算所得水的活度比较结果表明:该模型正确有效,计算精度较高,各电解质的Bromley参数取值合理;该模型也可用于NaOH-NaAl(OH)4-H2O体系活度因子的计算。
关键词:
中图分类号:TF 801 文献标识码:A
Calculation model of activity coefficient for NaOH-NaAl(OH)4-Na2CO3-H2O system
PENG Xiao-qi1, 2, 3, SONG Guo-hui1, SONG Yan-po1, 2, ZHANG Jian-zhi1, LIU Zhen-guo1
(1. School of Energy Science and Engineering, Central South University, Changsha 410083, China;
2. School of Information Science and Engineering, Central South University, Changsha 410083, China;
3. Deportment of Information Science and Engineering, Hunan First Normal University, Changsha 410205, China)
Abstract: According to Bromley model, the reasonable Bromley parameters for NaOH, NaAl(OH)4 and Na2CO3 were obtained by calibration regression on their experimental activity coefficients. The activity coefficient calculation model for NaOH-NaAl(OH)4-Na2CO3-H2O system was established based on Bromley model and the molatlity in the molal scale is that m(NaOH)≤8 mol/kg, m(NaAl(OH)4)≤3 mol/kg, m(Na2CO3)≤3 mol/kg, respectively, and ionic strength I≤9 mol/kg. The comparison of the activities of water calculated by the presented model with that of Rard’s method shows that the presented model is reliable and accurate and the values of the parameters for the three electrolytes are appropriate. Furthermore, the presented model can also be applied in the activity coefficient calculation for NaOH-NaAl(OH)4-H2O system.
Key words: sodium aluminate solution; Bromley model; activity coefficient
铝酸钠溶液是氧化铝生产的主要中间产物,多年来,人们对铝酸钠溶液体系的活度性质进行大量研究。APPS和NEIL[1]以及POKROVSKII和HELGESON[2]进行了大量的溶解度实验,为从溶解度方面研究铝酸钠溶液的活度提供了原始数据。WESOLOWSKI[3]和PARK和ENGLEZOS等[4]使用Pitzer电解质理论研究了含Na+、OH?、Cl?和Al(OH)4?等离子体系的活度因子,但其研究成果不能准确地预测铝酸钠溶液体系的活度因子。ZHOU等[5]采用等压法和Pitzer理论研究了313.2 K下总苛性碱浓度为0.05~12 mol/kg、苛性比为1.64~5.53的铝酸钠溶液的渗透系数和活度因子,为进一步的深入研究提供了极有价值的参考。李小斌等[6?8]应用Debye-Hückel理论,借助表观介电常数的概念,通过回归拟合建立了适用温度范围为25~100 ℃,总苛性碱浓度范围为0.1~10 mol/kg,苛性比为1.5~10.5的铝酸钠溶液体系中NaAl(OH)4活度因子的计算模型。
实际生产中的工业铝酸钠溶液常含多种杂质,其中碳酸钠含量较大,尤其是在碳酸化分解工艺流程中,不能忽略其对工业铝酸钠溶液热力学性质的影响,如密度、比热容和饱和蒸汽压等[9?10]。目前,关于NaOH- NaAl(OH)4-Na2CO3-H2O体系活度因子的研究鲜有报道。考虑到活度因子在实际溶液热力学问题处理中的重要性,有必要深入研究工业铝酸钠溶液的活度性质。本文作者基于Bromley模型浓度的适用范围较宽,可用于多组分电解质水溶液体系和预测性较好[11]等特点,结合Na2CO3水溶液活度因子的研究[12?13],建立NaOH-NaAl(OH)4-Na2CO3-H2O体系活度因子的计算模型,用于解决工业铝酸钠溶液体系活度性质的预测与估算问题。
1 Bromley模型概述
以质量摩尔浓度为计量单位计算多组分电解质水溶液中单一离子活度因子的Bromley模型为
![]()
式中:Am为Debye-Hückel理论常数;25 ℃和40 ℃时Am的值分别为0.510 0[14]和0.524 2[15];i为溶液中第i种离子;zi为第i种离子的离子价;I为溶液的离子强度。
![]()
式中:mi为第i种离子的质量摩尔浓度;n为溶液中总的阴阳离子种类数。
对于某种待计算的阳离子c或阴离子a,Fi的表达式分别为
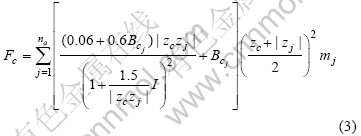
式中:na和j分别表示溶液中能与待计算阳离子c结合的总的阴离子种类数和第j种阴离子;![]() 为电解质cj的Bromley参数;mj为第j种阴离子的质量摩尔浓度。
为电解质cj的Bromley参数;mj为第j种阴离子的质量摩尔浓度。

式中:nc和k分别表示溶液中能与待计算阴离子a结合的总的阳离子种类数和第k种阳离子;Bka为电解质ka的Bromley参数;mk为第k种阳离子的质量摩尔浓度。
Bromley模型关于水的活度计算式[16]为
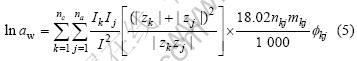
式中:aw为水的活度;mkj为电解质kj的质量摩尔浓度;nkj为1 mol电解质kj完全电离所形成离子的物质的量的总和;Ik和Ij为溶液中阳离子k和阴离子j的离子强度;![]() 为电解质kj单独形成的渗透系数,其计算式为
为电解质kj单独形成的渗透系数,其计算式为
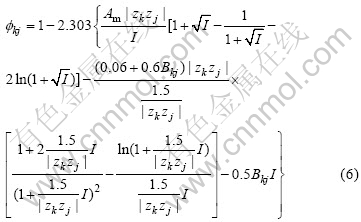
对于每种电解质,Bromley模型只需一个与该电解质有关的Bromley参数。因此,应用Bromley模型的关键是NaOH、NaAl(OH)4和Na2CO3的Bromley参数B(NaOH)、B(NaAl(OH)4)和B(Na2CO3)。
2 Bromley参数的确定
2.1 NaOH的参数B(NaOH)的选取
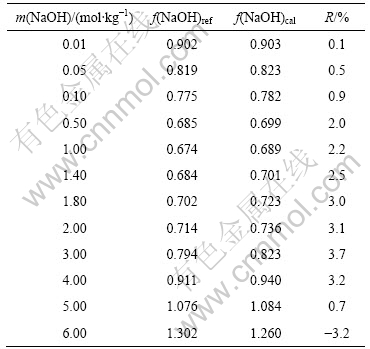
BROMLEY[17]所给的NaOH的参数B(NaOH)值为0.057 4,但由于当时实验数据的限制,该值只适用于I≤6 mol/kg的情况。BORGE等[18]回归得出适用于质量摩尔浓度范围为7~29 mol/kg的NaOH的参数B(NaOH)=0.075 9,但未指明其在低离子强度范围内的适用性。为此,本文作者首先研究B(NaOH)=0.075 9在低离子强度范围内的适用性。将B(NaOH)=0.075 9应用于NaOH水溶液活度因子的Bromley模型,比较25 ℃时NaOH活度因子的计算值与文献值[19],结果如表1所列。由表1可见,计算值f(NaOH)cal与文献值f(NaOH)ref的相对误差(R)较小,说明m(NaOH)= 0.075 9在低离子强度范围内依然有较好的适用性。因此,为简化模型,可以将NaOH的参数B(NaOH)统一选为0.075 9。
表1 25 ℃时f(NaOH)的Bromley模型计算值与文献值的 比较
Table 1 Comparison of f(NaOH) calculated by Bromley model and reference value at 25 ℃
2.2 NaAl(OH)4参数B(NaAl(OH)4)的确定
目前尚无关于NaAl(OH)4的Bromley参数值的报道。在选取B(NaOH)=0.075 9的基础上,对40 ℃时NaOH-NaAl(OH)4-H2O体系的活度因子数据[6]进行回归分析,得到NaAl(OH)4的参数B(NaAl(OH)4)=0.018 8,方差σt=0.005 060,其定义如下:
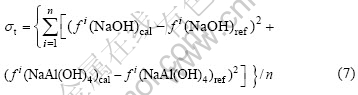
式中:f(NaOH)ref和f(NaOH)cal分别为NaOH活度因子的文献值和计算值;f(NaAl(OH)4)ref和f(NaAl(OH)4)cal分别为NaAl(OH)4活度因子的文献值和计算值。
当B(NaOH)=0.075 9,B(NaAl(OH)4)=0.018 8时,苛性比ak(ak=m(NaOH)t/m(NaAl(OH)4))分别为1.5、3和5的NaOH-NaAl(OH)4-H2O体系活度因子的Bromley模型计算值与其文献值[6]的比较如图1所示,图中横坐标表示总苛性碱浓度m(NaOH)t,m(NaOH)t=m(NaOH)+m(NaAl(OH)4),根据图1,经换算可得,当m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg时,计算数据与文献数据吻合较好,且变化规律也与相关文献[9]报道一致。另外,导致高浓度段误差较大的原因主要有如下两点。
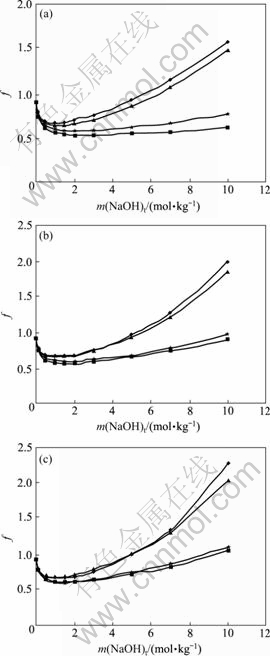
图1 40 ℃时f(NaOH)和f(NaAl(OH)4)的Bromley模型计算值与文献值的比较
Fig.1 Comparison of f(NaOH) and f(NaAl(OH)4) calculated by Bromley model and corresponding reference values at 40 ℃ (◆: Activity coefficient of NaOH calculated by Bromley model; ▲: Reference value of activity coefficient of NaOH; ■: Activity coefficient of NaAl(OH)4 calculated by Bromley model; ★: Reference value of activity coefficient of NaAl(OH)4): (a) ak=1.5; (b) ak=3; (c) ak=5
1) 溶液浓度较高时,铝酸根Al(OH)4?离子脱水形成[Al2O(OH)6]2?二聚离子,离子半径与价态都发生了变化,因此,B(NaAl(OH)4)的取值以及Bromley计算式中相应的离子价随之改变,从而产生相应的误差。
2) 铝酸钠溶液是一种缔合型电解质溶液,浓度越高越有利于缔合离子对的形成,而本研究使用的Bromley模型未考虑缔合离子的影响,因此,会造成一定的误差。
2.3 Na2CO3参数B(Na2CO3)的确定
Na2CO3是一种弱电解质,关于Na2CO3溶液活度因子的研究较少。本研究在ROBINSON和MACASKILLI[12]关于25 ℃时Na2CO3水溶液活度因子的等压法研究基础上,忽略弱电解质的电解平衡,假定碳酸钠在水中完全电解,然后通过回归分析得到适用于m(Na2CO3)≤3 mol/kg的Na2CO3的参数B(Na2CO3)= 0.000 1,Na2CO3的方差σC=0.001 736。σC为方差,其定义如下:
![]()
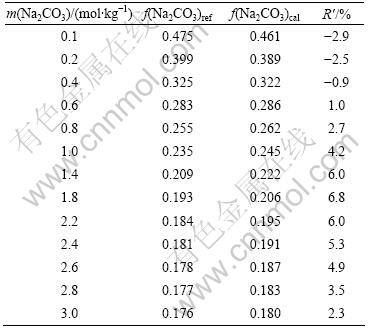
B(Na2CO3)=0.000 1时,Na2CO3的活度因子Bromley模型计算值f(Na2CO3)cal与文献值f(Na2CO3)ref[12]的对比及其相对误差(R′)如表2所列。结果表明:当I≤9mol/kg时,Na2CO3的Bromley参数级值为B(Na2CO3)= 0.000 1时计算结果具有较高的精度。
表2 25 ℃时f(Na2CO3)的Bromley模型计算值与文献值的 比较
Table 2 Comparison of f(Na2CO3) calculated by Bromley model and reference value at 25 ℃
3 计算模型的建立及其适用性
3.1 计算模型的建立
将NaOH、NaAl(OH)4和Na2CO3的Bromley参数带入式(1)~(3),结合电解质活度因子与其离子活度因子之间的关系,即可推导出NaOH-NaAl(OH)4- Na2CO3-H2O体系中各电解质活度因子的计算模型。为了便于实际计算和计算机编程,将该模型中各计算式进行数学变换,可得到该模型的简易形式如下:
![]()
![]() (9)
(9)
![]()
![]() (10)
(10)
![]()
![]() (11)
(11)
式中:f(NaOH)、f(NaAl(OH)4)和f(Na2CO3)分别为NaOH、NaAl(OH)4和Na2CO3的活度因子;m(Na)、m(OH)、m(Al(OH)4)和m(CO3)分别表示Na+、OH?、Al(OH)4?和CO3?等离子的质量摩尔浓度;
![]() (12)
(12)
![]() (13)
(13)
![]() (14)
(14)
![]() (15)
(15)
上述计算式仅含Debye-Hückel理论常数、溶液离子强度和各离子的质量摩尔浓度,显然,式(9)~(15)更为简明易用。
另外,将NaOH、NaAl(OH)4和Na2CO3的Bromley参数带入式(5)和(6),即可计算工业铝酸钠溶液中水的活度。
3.2 适用性分析
影响活度因子计算模型适用范围的主要因素是溶液的温度、电解质的质量摩尔浓度和离子强度。鉴于高温下铝酸根Al(OH)4?离子会向[Al2O(OH)6]2?二聚离子转变,从而可能造成较大误差,因此本计算模型用于中低温的工业铝酸钠溶液活度因子的计算较为精确,25~40 ℃内尤为适宜,不可超过100 ℃。由图1和表2可知,本研究提出的计算模型所适用的质量摩尔浓度范围为:m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg,m(Na2CO3)≤3 mol/kg。另外,由于受Na2CO3的参数B(Na2CO3)在离子强度方面的使用范围限制,本计算模型在I≤9 mol/kg的情况下才具有较好的预测性。尽管如此,考虑到生产中的实际情况,本研究的计算模型基本满足实际工艺设计与运行分析中活度因子的预测与估算的要求。
另外,由推导过程可知,当m(CO3) =0,即式(8)和(9)中的0.5p3m(CO3)项恒为0时,式(8)和(9)即为NaOH-NaAl(OH)4-H2O体系活度因子的计算模型,其适用范围为m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg且I≤10 mol/kg。与文献[8?9]报道的同类计算模型相比,该计算模型具有形式简单、使用方便、适用范围广和精度好等优点。4 校验
RARD[20]等提出了使用实际溶液的蒸汽压求解实际溶液中水的活度的计算模型:
![]()
式中:ps为溶液蒸气压力;p0为水蒸气的压力;B为水蒸气的第二维里常数。
本文作者借助工业铝酸钠溶液的饱和蒸汽压来校验本研究提出的计算模型。以中州氧化铝厂四效三级蒸发系统的进料原和各效各级的出料的某次实测数据为例,分别使用Rard方法和本文提出的方法计算 25 ℃下工业铝酸钠溶液中水的活度,结果如表3所列。由表3可见,两种方法计算所得的结果非常接近,这既反映了Bromley模型对工业铝酸钠溶液体系的活度性质描述的适用性,也间接证明了本文作者所给出的NaOH、NaAl(OH)4、Na2CO3的Bromley参数取值的合理性。
表3 工业铝酸钠溶液中水的活度的Bromley模型验证
Table 3 Verification of Bromley model for activity of water in industrial sodium aluminate solution
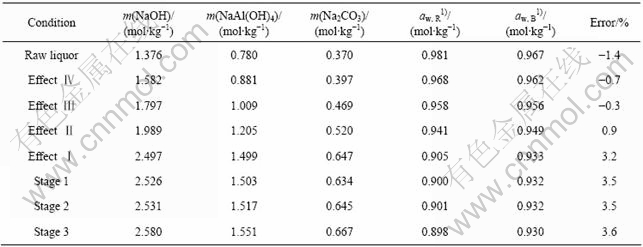
1) aw, R is calculated by Rard method; aw, B is calculated by Bromley model.
5 结论
1) 通过对氢氧化钠水溶液、铝酸钠溶液及碳酸钠溶液活度因子数据的校验和回归分析,确定了工业铝酸钠溶液体系中NaOH、NaAl(OH)4和Na2CO3的Bromley参数分别为0.075 9、0.018 8和0.000 1。
2) 建立了NaOH-NaAl(OH)4-Na2CO3-H2O体系的活度因子计算模型,其适用范围为:m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg,m(Na2CO3)≤3 mol/kg且I≤9 mol/kg。本计算模型具有形式简单、使用方便、适用范围广、精度高等优点,可用于工业铝酸钠溶液的混合热、扩散![]() 等热力学性质的计算。
等热力学性质的计算。
3) 碳酸钠的质量摩尔浓度为0时,本计算模型即为NaOH-NaAl(OH)4-H2O体系活度因子的计算模型,其适用范围为:m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg且I≤10 mol/kg。
[1] APPS J A, NEIL J M. Solubilities of aluminum hydroxides and oxyhydroxides in alkaline solution[C]//MELCHIOR D C, BASSETT R L. Chemical Modeling of Aqueous Systems Ⅱ. Washington DC: American Chemical Society, 1990: 414?428.
[2] POKROVSKII V A, HELGESON H C. Thermodynamic properties of aqueous species and the solubilities of minerals at high pressures and temperatures: the system Al2O3-H2O-NaCl[J]. Am J Sci, 1995, 295(10): 1255?1342.
[3] WESOLOWSKI D J. Aluminum speciation and equilibria in aqueous solution (Ⅰ): The solubility of gibbsite in the system Na-K-Cl-OH-Al(OH)4 from 0 to 100 ℃[J]. Geochim Cosmochim Ac, 1992, 56(3): 1065?1091.
[4] PARK H, ENGLEZOS P. Osmotic coefficients data for NaOH-NaCl-NaAl(OH)4-H2O system measured by an isopiestic method and modeled using Pizter’s model at 298.15 K[J]. Fluid Phase Equilibr, 1999, 155(2): 251?259.
[5] ZHOU Jun, CHEN Qi-yuan, LI Jie, YIN Zhou-lan, ZHOU Xia, ZHANG Ping-min. Isopiestic measurement of the osmotic and activity coefficients for the NaOH-NaAl(OH)4-H2O system at 313.2 K[J]. Geochim Cosmochim Ac, 2003, 67(18): 3459?3472.
[6] LI Xiao-bin, LU Wei-jun, FENG Gang-tao, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng, MENG Yun. The applicability of Debye-Hückel model in NaAl(OH)4-NaOH-H2O system[J]. The Chinese Journal of Process Engineering, 2005, 5(5): 525?528.
[7] LI Xiao-bin, LU Wei-jun, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng, MENG Yun, REN Wan-neng. Activity coefficient calculation model for NaAl(OH)4-NaOH-H2O system[J]. Trans Nonferrous Met Soc China, 2005, 15(4): 908?912.
[8] 李小斌, 任万能, 刘桂华, 彭志宏, 周秋生. NaOH-NaAl(OH)4-H2O体系活度因子的计算模型[J]. 中南大学学报: 自然科学版, 2006, 37(3): 493?497.
LI Xiao-bin, REN Wan-neng, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng. Activity coefficient calculation model for NaOH-NaAl(OH)4-H2O system[J]. Journal of Central South University: Science and Technology, 2006, 37(3): 493?497.
[9] 毕诗文, 于海燕. 氧化铝生产工艺[M]. 北京: 化学工业出版社, 2006: 25?26.
BI Shi-wen, YU Hai-yan. The technology of alumina production[M]. Beijing: Chemical Industry Press, 2006: 25?26.
[10] REYNOLDS J G, CARTER R. Density model for sodium hydroxide-sodium aluminate solutions[J]. Hydrometallurgy, 2007, 89: 233?241.
[11] 李以圭, 陆九芳. 电解质溶液理论[M]. 北京: 清华大学出版社, 2005.
LI Yi-gui, LU Jiu-fang. The theory of electrolyte solution[M]. Beijing: Tsinghua University Press, 2005.
[12] ROBINSON R A, MACASKILLL J B. Osmotic coefficients of aqueous sodium carbonate solutions at 25 ℃[J]. J Solution Chem, 1979, 8(1): 35?40.
[13] GE Xin-lei, WANG Xi-dong, ZHANG Mei, SEETHARAMAN S. A new three-particle-interaction model to predict the thermodynamic properties of different electrolytes[J]. J Chem Thermodyn, 2007, 39(4): 602?612.
[14] 高丕英. 德拜?休克尔活度因子方程中A与B 值的探讨[J]. 大学化学, 2005, 20(5): 40?41.
GAO Pei-ying. A discussion of A and B in the Debye-Hückel limiting law for the activity coefficient[J]. University Chemistry, 2005, 20(5): 40?41.
[15] 朱元保, 沈子琛, 张传福. 电化学数据手册[M]. 长沙: 湖南科学技术出版社, 1985.
ZHU Yuan-bao, SHEN Zi-chen, ZHANG Chuan-fu. Data manual of electrochemistry[M]. Changsha: Hunan Science and Technology Press, 1985.
[16] LEE M S. Use of the bromley equation for the analysis of ionic equilibria in mixed ferric and ferrous chloride solutions at 25 ℃[J]. Metall Mater Trans B, 2006, 37(2): 173?179.
[17] BROMLEY L A. Thermodynamic properties of strong electrolytes in aqueous solutions[J]. AIChE J, 1973, 19(2): 313?320.
[18] BORGE G, CASTA?O R, CARRIL M P, CORBILL?N M S, MADARIAGA J M. Development of a Modified Bromley's Methodology (MBM) for the estimation of ionic media effects on solution equilibria Part Ⅰ. Calculation of the interaction parameters in the molar and molal scales at 25 ℃[J]. Fluid Phase Equilibr, 1996, 121(1/2): 85?98.
[19] 姚允斌. 物理化学手册[M]. 上海: 上海科学技术出版社, 1985.
YAO Yun-bin. Handbook of physical chemistry[M]. Shanghai: Shanghai Science and Technology Press, 1985.
[20] 张廷芳, 陆嘉星. 电解质溶液[M]. 上海: 上海科学技术出版社, 1991.
ZHANG Ting-fang, LU Jia-xing. Electrolyte solution[M]. Shanghai: Shanghai Science and Technology Press, 1991.
基金项目:国家自然科学基金资助项目(60634020);湖南省教育厅科技资助项目(08W003)
收稿日期:2008-11-17;修订日期:2009-03-19
通讯作者:彭小奇,教授,博士;电话:0731-88836713;E-mail: pengxq@mail.csu.edu.cn
(编辑 李艳红)
摘 要:应用Bromley模型,通过对氢氧化钠、铝酸钠和碳酸钠等溶液体系活度因子的实验数据进行校验与回归分析,获得了各电解质合理的Bromley参数,建立基于Bromley模型的NaOH-NaAl(OH)4-Na2CO3-H2O体系活度因子的计算模型,其适用范围为:质量摩尔浓度分别为m(NaOH)≤8 mol/kg,m(NaAl(OH)4)≤3 mol/kg,m(Na2CO3)≤3 mol/kg且离子强度I≤9 mol/kg。使用该模型和Rard方法计算所得水的活度比较结果表明:该模型正确有效,计算精度较高,各电解质的Bromley参数取值合理;该模型也可用于NaOH-NaAl(OH)4-H2O体系活度因子的计算。


