100文章编号:1004-0609(2010)02-0346-08
混合高温菌浸出黄铜矿及浸出过程中微生物群落的演替
刘 凯1,刁梦雪1,杨 宇1, 2,覃文庆1, 2,吴学玲1, 2
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 生物冶金教育部重点实验室,长沙 410083)
摘 要:研究3株极端嗜热古菌(金属硫叶菌,Sulfolobus metallicus JCM 9184;瑟杜生金属球菌,Metallosphaera sedula JCM 9185和万座酸菌,Acidianus manzaensis YN25)在不同起始pH值和不同温度条件下对黄铜矿的混合浸出,并对浸矿过程中混合菌群落的动态演替进行分析。结果表明:在起始pH 1.5时的铜浸出率明显高于在起始pH 2.5时的铜浸出率,而65 ℃条件下的铜浸出率高于75 ℃时的铜浸出率。利用限制性长度多态性(RFLP)分析65 ℃、起始pH 1.5条件下的微生物群落演替,结果显示:在黄铜矿的浸出前期Sulfolobus metallicus是占据优势的菌种,而到后期Acidianus manzaensis的比例则会上升,并最后取代Sulfolobus metallicus成为优势种。
关键词:
中图分类号:Q 939 文献标识码:A
Bioleaching of chalcopyrite concentrate using
mixed thermophilic culture and succession of
microbial community during leaching process
Liu Kai1, Diao Meng-xue1, Yang Yu1, 2, Qin Wen-qing1, 2, Wu Xue-ling1, 2
(1. School of Minerals Processing and Bioengineering, Changsha 410083, China;
2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China)
Abstract: A mixed thermophilic culture consisting of Sulfolobus metallicus JCM 9184, Metallosphaera sedula JCM 9185 and Acidianus manzaensis YN25 was used to study the combined effect of pH value and temperature in bioleaching of a chalcopyrite concentrate. The results show that the copper extraction at initial pH 1.5 is higher than that at intial pH 2.5. The copper extraction at 75 ℃ is lower than that at 65 ℃, but the lower copper extraction at 75 ℃ is not due to the inhibition of the high temperature. The succession of the microbial community during the leaching process was analysed by restriction fragment length polymorphism (RFLP). The analysis shows that Sulfolobus metallicus is dominant in the microbial community at the early stage of leaching, whereas Acidianus manzaensis thrives at the latter stage. This phenomenon might be caused by the change of ferrous ion concentration during leaching process.
Key words: bioleaching; chalcopyrite concentrate; extremely thermophilic microorganisms; microbial community; succession
黄铜矿是自然界中主要的铜矿物,但是由于其特殊结构,浸出速率很慢,故黄铜矿浸出已成为铜工业关注的热点。与传统工艺相比,生物浸出具有工艺简单、成本低和对环境友好等优点。生物浸出黄铜矿所涉及的化学反应式包括[1]:其中,微生物参与的反应有反应式(3)和反应式(4)。
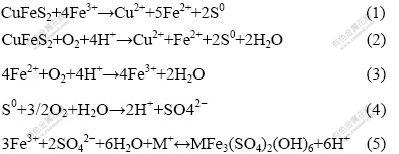
通过对比中温菌、中等嗜热菌和极度嗜热古菌分别浸出黄铜矿的实验结果可知,浸出效率与温度大致呈正相关[2?3]。采用中温菌浸出时(35 ℃),由于浸出过程中矿物表面会形成元素硫、中间硫化产物和黄钾铁矾等物质而使表面钝化,铜的浸出速率和浸出率较 低[4?7],通常在30%左右[8]。但在较高的温度下(68 ℃),这种中间硫化产物则会溶解[7],铜浸出率会增高,一般可达90%左右[8]。STOTT等[9]采用Sulfolobus metallicus, Acidianus brierley 和Metallosphaera sedula等极端嗜热菌浸出黄铜矿时,获得了较好的铜浸出效果。BHP Billiton公司开发的BioCop?技术成功地应用极端嗜热微生物处理黄铜矿精矿,实现了半工业生产[10]。在一些金属硫化矿的堆浸中,由于硫化矿氧化的放热反应,矿堆内局部的温度会升高到70~80 ℃,在这种条件下中温菌和中等嗜热菌均不能正常生长,但极端嗜热微生物却能正常生长并进行硫化物的氧化。因此,利用高温菌浸矿是提高黄铜矿生物浸出效率的有效手段和途径。
黄铜矿生物浸出伴随着酸的产生和消耗,因此浸出体系中的pH值对铜的浸出有着重要的影响。温度同样对化学反应速率产生很大影响,在黄铜矿浸出过程中升高温度可以提高铜的浸出速率,但温度过高又会抑制浸矿微生物的生长使得浸出减慢。而硫化矿氧化的放热反应也会使浸矿体系的温度发生变化,从而影响浸矿效率并导致微生物的群落结构发生变化。因此,了解在矿物浸出过程中混合浸矿微生物的群落结构,鉴定出最具有活力的菌株,可以为优化和控制浸出条件提供有用的信息。目前,已有不少关于生物冶金过程中微生物多样性和群落的研究报道,但多数是以中温微生物和中等嗜热微生物作为研究对象,关于浸矿过程中极端嗜热微生物群落结构变化的报道还不多见,而且就黄铜矿而言,对于如何设计一个最优化的浸矿微生物组合还需要进一步的研究和探索 [11]。因此,本文作者利用3株极度嗜热微生物在不同温度、不同pH条件对黄铜矿进行混合浸出,分析浸出过程中的古菌群落,了解高温菌在黄铜矿浸出过程中的作用、浸矿效果、影响因素和群落变化,为进一步的开发和应用极度嗜热微生物浸出黄铜矿提供依据。
1 实验
1.1 实验矿样
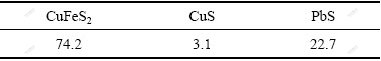
实验所用的黄铜矿由生物冶金教育部重点实验室提供。矿样经过破碎、研磨、筛分,粒径小于74 μm,矿样元素分析及化学物相分析见表1和2。
表1 矿样化学元素分析
Table 1 Element analysis of sample (mass fraction, %)
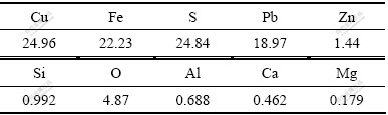
表2 矿样化学物相分析
Table 2 Component analysis of sample (mass fraction, %)
1.2 菌种及培养条件
本实验中用到的极度嗜热古菌包括:金属硫叶菌(Sulfolobus metallicus JCM 9184)、瑟杜生金属球菌(Metallosphaera sedula JCM 9185)和万座酸菌(Acidianus manzaensis YN25),前两种来自日本微生物保藏中心(JCM),后一种由本实验室从云南腾冲的温泉中分离得到。3株菌都用9K基础培养基[12]加酵母浸出膏,以单质硫或硫酸亚铁为能源物质传代培养,配方如下:(NH4)2SO4 3 g/L,KCl 0.1 g/L,K2HPO4 0.5 g/L,MgSO4·7H2O 0.5 g/L,Ca(NO3)2 0.01 g/L,酵母浸出膏 0.2 g/L,S0 10 g/L或者FeSO4·7H2O 30 g/L。用10 mol/L的硫酸调节培养基的pH值。
1.3 黄铜矿浸出实验
浸出实验采用500 mL的锥形瓶作为容器,瓶内装入200 mL灭菌的培养基,矿浆浓度4%,接入对数生长期的嗜热古菌。各菌种等量(分别为1.6×107个/ mL)接入三角瓶中, 在转速为150 r/min的高温水浴摇床中振荡培养,每个条件均包括3个平行实验, 并设无菌空白对照。每隔两天取样测定浸出液的pH值、氧化还原电位、菌浓度、Cu2+、Fe2+和总铁浓度,取样前用蒸馏水补足蒸发掉的水分。
1.4 物理化学分析
用原子吸收光谱测定浸出液中Cu2+和总铁的浓度。用重铬酸钾滴定法测定溶液中的Fe2+浓度。用pHS?3C酸度计测量浸出体系的pH值,用甘汞参比电极和金属铂电极测定浸出体系的氧化还原电位,在光学显微镜下用血球计数板测定浸出液中游离细胞数。浸出结束后用X射线衍射技术分析浸出值的矿物组成。
1.5 古菌总DNA提取和16S rDNA扩增
在浸出过程中,对不同时期取浸出液样品用天根公司的细菌DNA提取试剂盒提取其中古菌的总DNA。16S rDNA基因的扩增体系如下:33 μL无菌水、10×PCR buffer 5 μL、dNTPs 5 μL(10 mmol/L)、引物4F[13]和1492R[14]各2 μL(5 pmol/μL)、Taq DNA聚合酶1 μL、古菌总DNA 2 μL,总共50 μL。扩增程序如下:94 ℃,5 min;94 ℃,45 s,55 ℃,45 s,72 ℃,1 min(共30个循环);72 ℃,10 min。
1.6 16S rDNA的克隆和限制性长度多态性分析(RFLP)
16S rDNA基因的扩增产物用pGEM-T载体连接后转入大肠杆菌DH5α感受态细胞中,构建16S rDNA基因文库。从文库中挑选阳性克隆进行菌落PCR和限制性长度多态性分析,方法见文献[15]。根据限制性长度多态性分析结果,挑选出有代表性的克隆子送上海生工生物技术有限责任公司测序。对各序列采用Blast软件在GenBank进行相似性搜索(http://www.ncbi. nlm.nih.gov/blast/),获取序列对应菌种信息。
2 结果和讨论
2.1 pH值对黄铜矿浸出的影响
目前关于浸出体系的pH值对黄铜矿浸出率的影响有着不同的观点, VILC?EZ等[1]认为较低的pH值(1.0)能够促进铜的浸出,而C?RDOBA等[16]则认为较高的pH值(2.0)更利于铜的浸出。在预实验的结果表明,3株菌在亚铁/硫培养基中的最适pH值分别为1.5和2.5,最适温度范围为65~75 ℃。为了进一步研究pH值对黄铜矿浸出的影响,本研究在65 ℃条件下设置两个不同的起始pH值:1.5和2.5。对不同pH条件下浸出液中的Cu2+浓度进行测定。图1所示为不同起始pH值条件下浸出液中Cu2+浓度变化曲线。从图1可以看出,在起始pH为1.5时,浸出的Cu2+浓度要明显高于起始pH为2.5时所浸出的Cu2+浓度。在为期24 d的浸出周期内,前者的铜浸出率达到90.8%,而后者的铜浸出率只有56.9%。
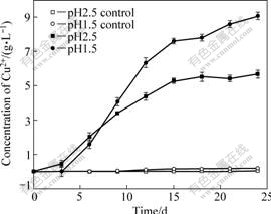
图1 不同起始pH值条件下浸出液中Cu2+浓度变化曲线
Fig.1 Changing curves of Cu2+ concentration in solution at different initial pH values
不同pH条件下浸出液中总铁和Fe3+的浓度变化如图2所示。从图2中可以看出,在不同条件下,总铁的浓度变化趋势都比较相似,即在浸出初期上升很快,到达一个顶点后,又快速地下降。在起始pH为2.5条件下,总铁浓度在浸出的第6天达到最高点(1.52 g/L),然后迅速地降低,到浸出后期浓度不足0.01 g/L。在起始pH为1.5条件下,总铁浓度在浸出的第9天达到最高的3.09 g/L,然后迅速地降低至1.19 g/L。
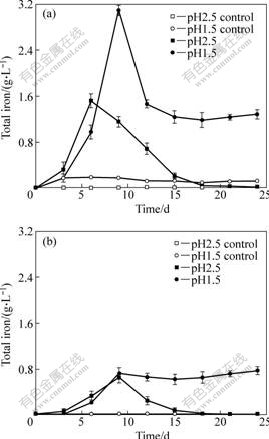
图2 不同起始pH值条件下浸出液中总铁和Fe3+浓度变化曲线
Fig.2 Changing curves of total iron (a) and Fe3+ (b) concentrations in solution at different initial pH values
总铁浓度的下降主要是形成了大量的Fe3+沉淀,在浸出的后期可以观察到矿浆的颜色由一开始的黑色变成了泥黄色,而且对浸出渣的X射线衍射分析也证实了大量黄钾铁矾的生成。生成的黄钾铁矾容易在矿物表面形成钝化层,阻挡了微生物、营养基质、三价铁氧化剂与矿物表面的相互接触,因此阻碍了黄铜矿的溶解[17?18]。即使在起始pH 1.5的条件下,黄钾铁矾的形成依然很明显。但是与在起始pH 2.5时的实验结果相比,pH值较低的浸出液体系能减缓黄钾铁矾的生成。
浸出液中pH值变化和菌浓度变化如图3所示。从图3(a)可以看出,在起始pH2.5条件下,在浸出的前9天,pH值持续地从2.5下降到1.5,第9天以后,pH值开始回升至最终的1.65。这主要是因为硫氧化生成了硫酸导致pH值下降,但黄铜矿的化学浸出是一个耗酸的过程[1, 19],当硫氧化所产的酸少于消耗的酸时,体系的pH值会略有回升。而在起始pH 1.5时,由于硫的氧化和铁的沉淀,浸出液的pH值逐渐地下降,到浸出结束时达到1.16。
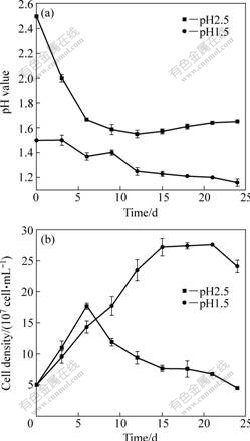
图3 不同起始pH条件下浸出液中pH值和菌浓度的变化曲线
Fig.3 Changing curves of pH value (a) and cells density (b) in solution at different initial pH values
2.2 温度对黄铜矿浸出的影响
对比两个不同pH值对黄铜矿浸出的影响可知,在温度为65 ℃条件下,起始pH为1.5时的铜浸出率高于起始pH为2.5时的铜浸出率。预实验结果表明,3株古菌的最适温度在65~75 ℃之间。因此,在浸出率较高的pH 1.5条件下,本研究在最适温度范围内设置两个温度(65和75 ℃)来比较温度对极端嗜热古菌对黄铜矿浸出的影响。化学反应动力学的研究表明,在通常情况下,随着反应温度的升高,化学反应的速率也会相应地提高,而且提高温度能够减少浸出过程中覆盖在矿物表面的元素硫和其他中间产物的数量,从而提高铜浸出率[20]。但是,本研究结果表明,75 ℃条件下铜的浸出率为87.7%,并不比在65 ℃条件下的铜浸出率高(90.8%)(见图4)。由图4(b)可以看出,75 ℃条件下的菌的浓度比65 ℃条件下的菌的浓度更高,其生长速率也更快,这说明较高的温度并没有抑制浸矿微生物的生长,铜浸出率较低不是较高温度直接影响的结果。
`
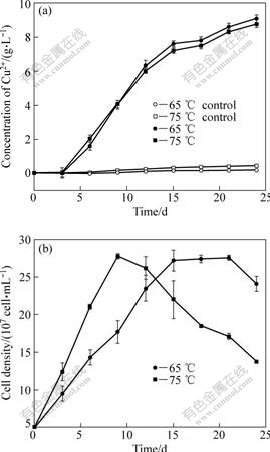
图4 不同温度条件下浸出液中Cu2+浓度和菌浓度的变化曲线
Fig.4 Changing curves of Cu2+ concentration (a) and cells density (b) in solution at different temperatures
图5所示为在65和75 ℃条件下浸出液中总铁和Fe3+浓度的变化曲线。根据文献报道,升高温度更容易导致铁的沉淀[1, 21]。从图5中可以发现,同在pH 1.5条件下,75 ℃的体系中总铁浓度下降的量比65 ℃的体系中的大。对比其中总铁和Fe3+浓度,以及它们的差值(Fe2+浓度)的变化可知,在浸出后期65 ℃的体系中的铁大部分是以Fe3+形式存在,而75 ℃的体系中的大部分铁则是以Fe2+形式存在。
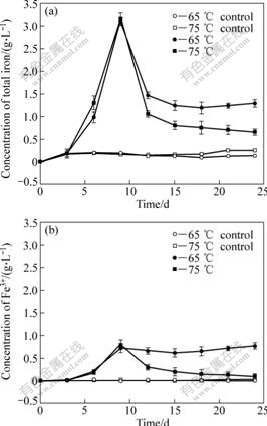
图5 不同温度下浸出液中总铁和Fe3+浓度变化曲线
Fig.5 Changing curves of total iron (a) and ferric ion (b) concentration in solution at different temperatures
同样条件下浸出液中氧化还原电位和pH值的变化如图6所示。在65 ℃条件下,浸出体系的氧化还原电位最终达到560 mV,而在75 ℃条件下,浸出体系的氧化还原电位一直低于400 mV。浸出体系中的氧 化还原电位主要与溶液中的Fe3+和Fe2+的浓度比值有 关[22]:在65 ℃条件下,浸出后期溶液中的铁离子大部分是Fe3+,而75 ℃条件下溶液中的铁离子大部分是Fe2+。结合不同条件下的铜浸出率可知,溶液中Fe3+浓度较高时铜的浸出率也较高。同时,Fe2+的存在对黄铜矿的浸出也很重要,因为它提供浸矿微生物的生长能源并转化为Fe3+,这与文献报道相符合[1, 23]。
如图6(b)所示,不管是在65 ℃还是在75 ℃条件下,浸出过程中的pH值变化规律总体上比较相似,都呈下降趋势。只是在浸出的第9天,pH值稍微升高,这是由于在第9天有大量的铁浸出(见图5(a)),该反应是个耗酸的反应。但在75 ℃条件下,浸出后期的浸出液pH值降到了最低(1.07),这个值大大低于实验中所用到的微生物的最适生长pH值[24?25],因此在浸出后期细胞浓度降低(见图4(b)),活性下降。
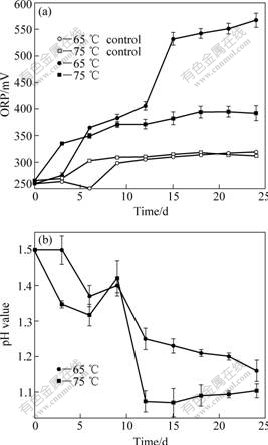
图6 不同温度下浸出液氧化还原电位(a)和pH值(b)的变化曲线
Fig.6 Changing curves of ORP (a) and pH (b) in solution at different temperatures
2.3 浸出渣X射线衍射分析
浸出结束后,用X射线衍射分析浸出渣成分。在所有的浸出条件下,浸出渣的成分基本相同,都含有未完全浸出的黄铜矿、硫酸铅和黄钾铁矾,只是各组分的含量不同。根据式(1)和(2),黄铜矿浸出过程中会有单质硫的生成,但在所有的浸出渣中,均没有发现有元素硫的存在。这说明实验用到的极端嗜热古菌氧化硫的能力很强,浸出过程中产生的元素硫被微生物氧化生成了硫酸,因此可以推测,本实验中阻碍黄铜矿完全浸出的主要因素不是元素硫的积累,而是黄钾铁矾的大量存在。即便是在起始pH为 1.5且浸出后期pH值降到了1.2以下,实验中沉淀的黄钾铁矾仍然不溶解。
2.4 浸矿过程中古菌群落的动态演替
在所有浸出条件中,选取黄铜矿浸出率最高的浸出体系(起始pH 1.5,65 ℃)作为研究对象,分析其中的古菌群落动态演替。分别在浸出的第3天、第9天、第15天和第24天从浸出液中取样提取古菌的总DNA,通过PCR扩增、连接、转化建立了16S rDNA文库,分别从各文库中挑取了70~92个阳性克隆子,用作菌落PCR和酶切分析。各样品中3种古菌的比例如图7所示。从图7中可以看出,在第3天的样品中S. metallicus所占的比例最高,达到55%,而M. sedula和A. manzaensis分别各占27.3%和17.7%。第9天样品中的微生物组成结构与第3天类似,S. metallicus仍然是最优势的菌种,而且比例有所上升,达到73.3%,而M. sedula和A. manzaensis则分别为18.8%和7.9%。当浸出进行到了后半段时,浸矿微生物的群落组成发生了比较明显的变化。在第15天的样品中,A. manzaensis所占的比例从样品B中的7.9%迅速增加到31.4%,而S. metallicus和M. sedula的比例则分别下降到51.5%和17.1%。这一趋势一直持续到浸出结束,在第24天的样品中,A. manzaensis的比例增加到53.1%,而S. metallicus和M. sedula的比例则分别下降到37%和9.9%。
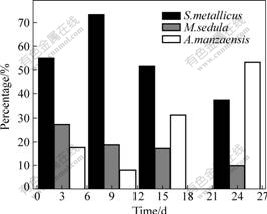
图7 各菌种在4个样品中所占比例
Fig.7 Percentages of each identified clone in 16S rDNA libraries from four samples
通过各样品分析结果的对比可知,在黄铜矿的浸出前期S. metallicus是占据优势的菌种。而到了后期A. manzaensis的比例则会上升,并最后取代 S. metallicus成为优势种。因此,可以推测在浸出过程中浸出液的理化性质的改变对古菌的群落组成产生了影响,这些因素可能是浸出液中的金属离子浓度、 pH值、作为微生物生长能源的Fe2+浓度或元素硫的浓度等。
如图8所示,对比浸出液中Fe2+浓度和各菌种在群落中的比例变化可知,S. metallicus在群落中所占比例的变化趋势与Fe2+浓度的变化趋势比较相似,而A. manzaensis在群落中所占比例的变化则与Fe2+浓度的变化趋势相反。在第9天样品中,Fe2+浓度是整个浸出过程中最高的(2.37 g/L),而到了第15天样品中,Fe2+浓度则降到了0.62 g/L。因此,可推测当Fe2+浓度较高时,S. metallicus是优势菌种,而当Fe2+较低时,A. manzaensis占优势,或者说S. metallicus具有很强的氧化亚铁能力。之前的报道也表明S. metallicus的氧化亚铁能力较强,VILC?EZ等[26]比较了S. metallicus、M. sedula 和A. brierleyi纯菌浸出黄铜矿的实验结果,认为S. metallicus具有最强的氧化亚铁能力,M. sedula次之,而A. brierleyi最弱。本研究结果与文献[26]报导的结果基本相符。
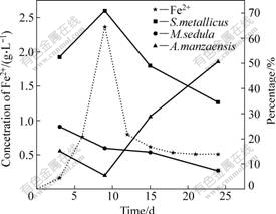
图8 浸出液中Fe2+浓度的变化和各菌种的比例变化曲线
Fig.8 Changing curves of Fe2+ concentration and percentages of each identified clone in solution
3 结论
1) 黄铜矿的混合浸出实验表明,极端嗜热古菌具有较高的浸出效率,在pH 1.5和65 ℃条件下,摇瓶混合浸出第24天时铜浸出率能达到90%以上。
2) pH值为 1.5时铜浸出率为90.8%,而pH 值为2.5时铜浸出率为56.9%,这说明在一定范围内较低的pH值更有利于黄铜矿的浸出。
3) 在pH 1.5条件下,温度从65 ℃升高到75 ℃时,黄铜矿的铜浸出率(87.7%)并未增加,说明温度增加时铜浸出率并不一定相应增高。
4) 在黄铜矿的浸出前期S. metallicus是占据优势的菌种,而到了浸出后期A. manzaensis在群落中所占比例则会上升,并最后取代S. metallicus成为优势种。
REFERENCES
[1] Vilcáez J, Yamada R, Inoue C. Effect of pH reduction and ferric ion addition on the leaching of chalcopyrite at thermophilic temperatures[J]. Hydrometallurgy, 2009, 96(1/2): 62?71.
[2] 邹 平, 张曙光, 周兴龙, 杨家明. 低品位原生硫化铜矿嗜热嗜酸菌强化浸出[J]. 有色金属, 2004, 56(1): 34?36.
zou ping, ZHANG Shu-guang, ZHOU Xing-long, YANG Jia-ming. Intensified bioleaching of low grade chalcopyrite with thermoacidophile[J]. Nonferrous Metals, 2004, 56(1): 34?36.
[3] Norris P R, Owen J P. Mineral sulphide oxidation by enrichment cultures of novel thermoacidophilic bacteria[J]. FEMS Microbiology Reviews, 1993, 11(1/3): 51?56.
[4] 舒荣波, 阮仁满, 温建康. 黄铜矿生物浸出中钝化现象研究进展[J]. 稀有金属, 2006, 30(3): 395?400.
Shu Rong-bo, RUAN Ren-man, WEN Jian-kan. Review on passivation of chalcopyrite during bioleaching process[J]. Chinese Journal of Rare Metals, 2006, 30(3): 395?400.
[5] 周洪波, 曾伟民, 李莹, 邱冠周, 柳建设. 硫化矿高温生物浸出工艺研究和应用进展[J]. 金属矿山, 2006, 364(10): 5?8.
zhou Hong-bo, ZENG Wei-min, LI Ying, QIU Guan-zhou, LIU Jian-she. Advances in research and application of bioleaching process for sulfide ores using thermophilic microorganism[J]. Metal Mine, 2006, 364(10): 5?8.
[6] 张雁生, 覃文庆, 王 军, 任浏祎, 何名飞. 中温嗜酸硫杆菌浸出低品位硫化铜矿[J]. 矿冶工程, 2007, 27(4): 25?30.
zhang yan-sheng, QIN Wen-qing, WANG Jun, REN Liu-yi, HE Ming-fei. Bioleaching of copper sulfide ore by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans [J]. Mining and Metallurgical Engineering, 2007, 27(4): 25?30.
[7] Rodriguez Y, Ballester A, Blázquezm L, González F, Mu?oz J A. New information on the chalcopyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003, 71(1/2): 47?56.
[8] Konishi Y, Asai S, Tokushige M, Suzuki T. Kinetics of the bioleaching of chalcopyrite concentrate by acidophilic thermophile Acidianus brierleyi[J]. Biotechnology Progress, 1999, 15(4): 681?688.
[9] Stott M B, Watling H R, Franzmann P D, Sutton D C, Parker A J. Biohydrometallurgy: fundamentals, technology and sustainable development, Part A[C]//International Biohydrometallurgy Symposium. Amsterdam: Elsevier Science, 2001.
[10] Brierley J A. Biohydrometallurgy—This microbiologist’s perspective[C]//Biohydrometallurgy: From the Single Cell to the Environment (IBS 2007). Frankfurt: Trans Tech Publications Ltd, 2007.
[11] Rawlings D E, Johnson D B. The microbiology of biomining: development and optimization of mineral-oxidizing microbial consortia[J]. Microbiology, 2007, 153(2): 315?324.
[12] SILVERMAN M P, LUNDGREN D C. Study on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans: I. An improved medium and harvesting procedure for securing high cell yield[J]. Journal of Bacteriology, 1959, 77: 642?647.
[13] Hershberger K L, Barns S M, Reysenbach A L, Dawson S C, Pace N R. Wide diversity of Crenarchaeota[J]. Nature, 1996, 384(6608): 420?420.
[14] DeLONG E F. Archaea in coastal marine environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(12): 5685?5689.
[15] Yang Yu, Wan Min-xi, Shi Wu-yang, Peng Hong, Qiu Guan-zhou, Zhou Ji-zhong, Liu Xue-duan. Bacterial diversity and community structure in acid mine drainage from Dabaoshan mine, China[J]. Aquatic Microbial Ecology, 2007, 47(2): 141?151.
[16] Córdoba E M, Mu?oz J A, Blázquez M L, González F, Ballester A. Passivation of chalcopyrite during its chemical leaching with ferric ion at 68 °C[J]. Minerals Engineering, 2009, 22(3): 229?235.
[17] Hackl R P, Dreisinger D B, Peters E. Passivation of chalcopyrite during oxidative leaching in sulfate media[J]. Hydrometallurgy, 1995, 39(1):25-48.
[18] Stott M B, Waliting H R, Franzmann P D, Sutton D. The role of ironhydroxy precipitates in the passivation of chalcopyrite during bioleaching[J]. Minerals Engineering, 2000, 13(10): 1117?1127.
[19] Mousavi S M, Jafari A, Yaghmaei S, Vossoughi M. Bioleaching of low-grade sphalerite using a column reactor[J]. Hydrometallurgy, 2006, 82(1/2): 75?82.
[20] Rawlings D E, Dew D, Plessis C D. Biomineralization of metal-containing ores and concentrates[J]. Trends in Biotechnology, 2003, 21(1): 38?44.
[21] Hita R, WANG Hong-mei, Bigham J M, Torrent J, Tuovinen O H. Bioleaching of a pyritic sludge from the Aznalcóllar (Spain) mine spillage at ambient and elevated temperatures[J]. Hydrometallurgy, 2008, 93(1/2): 76?79.
[22] 胡凯光, 谭凯旋, 杨仕教, 刘国福, 梁建龙. 微生物浸矿机理和影响因素探讨[J]. 湿法冶金, 2004, 23(3): 113?121.
HU Kai-guang, TAN Kai-xuan, YANG Shi-jiao, LIU Guo-fu, LIANG Jian-long. Bacteria leaching mechanism and effect factors[J]. Hydrometallurgy of China, 2004, 23(3): 113?121.
[23] Fowler T A, Crundwell F K. Leaching of zinc sulfide by Thiobacillus ferrooxidans: experiments with a controlled redox potential indicate no direct bacterial mechanism[J]. Applied and Environmental Microbiology, 1998, 64(10): 3570?3575.
[24] Schippers A. Microorganisms involved in bioleaching and nucleic acid-based molecular methods for their identification and quantification[C]//Microbial Processing of Metal Sulfides, Netherlands: Springer, 2007: 3?33.
[25] Yoshida N, Nakasato M, Ohmura N, Ando A, Saiki H, Ishll M, Igarashi Y. Acidianus manzaensis sp. nov., a novel thermoacidophilic archaeon growing autotrophically by the oxidation of H2 with the reduction of Fe3+[J]. Current Microbiology, 2006, 53(5): 406?411.
[26] Vilcáez J, Suto K, Inoue C. Bioleaching of chalcopyrite with thermophiles: Temperature–pH–ORP dependence[J]. International Journal of Mineral Processing, 2008, 88(1/2): 37?44.
基金项目:国家重点基础研究发展计划资助项目(2010CB630901)
收稿日期:2008-11-14;修订日期:2009-12-04
通信作者:吴学玲,副教授,博士;电话:0731-88879815;E-mail:xueling0714@yahoo.com.cn
[2] 邹 平, 张曙光, 周兴龙, 杨家明. 低品位原生硫化铜矿嗜热嗜酸菌强化浸出[J]. 有色金属, 2004, 56(1): 34?36.
[4] 舒荣波, 阮仁满, 温建康. 黄铜矿生物浸出中钝化现象研究进展[J]. 稀有金属, 2006, 30(3): 395?400.
[5] 周洪波, 曾伟民, 李莹, 邱冠周, 柳建设. 硫化矿高温生物浸出工艺研究和应用进展[J]. 金属矿山, 2006, 364(10): 5?8.
[6] 张雁生, 覃文庆, 王 军, 任浏祎, 何名飞. 中温嗜酸硫杆菌浸出低品位硫化铜矿[J]. 矿冶工程, 2007, 27(4): 25?30.
[22] 胡凯光, 谭凯旋, 杨仕教, 刘国福, 梁建龙. 微生物浸矿机理和影响因素探讨[J]. 湿法冶金, 2004, 23(3): 113?121.


