DOI: 10.11817/j.issn.1672-7207.2018.09.005
水厂反冲洗铁锰泥颗粒吸附剂的制备及其除As(Ⅲ)效果
曾辉平1,吕赛赛1,曹瑞华1,杨航2,李冬1,张杰1, 2
(1. 北京工业大学 建筑工程学院,北京,100124;
2. 哈尔滨工业大学 环境学院,黑龙江 哈尔滨,150090)
摘 要:
锰水厂反冲洗铁锰泥为主要原料制备除砷颗粒吸附剂(granular adsorbents for arsenic removal, GAAR)的最佳工艺和除砷效果,通过正交试验优化制备工艺,利用扫描电镜与能谱分析(SEM-EDS),X线衍射(XRD)和比表面积分析技术(BET)对GAAR进行表征并考察其对As(Ⅲ)的吸附效果。研究结果表明:预热温度为180 ℃、预热时间为20 min、焙烧温度为350 ℃、焙烧时间为120 min为制备GAAR的最优条件;焙烧温度是影响除砷效果的主要因素,高温促使铁氧化物向赤铁矿转变并加剧孔道合并从而降低该温度下制得颗粒吸附剂的吸附能力;GAAR表面粗糙,内部物相成分为水铁矿和部分赤铁矿、石英,比表面积为43.8 m2/g,是典型的介孔材料;GAAR对砷的吸附过程符合准二级动力学,等温吸附符合Freundlich方程,GAAR对As(Ⅲ)的最大吸附量为4.77 mg/g。
关键词:
中图分类号:X703.1 文献标志码:A 文章编号:1672-7207(2018)09-2143-09
Preparation and As(Ⅲ) adsorption performance of granular adsorbents for arsenic removal made from backwashing residuals from deironing and demanganization biofilter
ZENG Huiping1, LU Saisai1, CAO Ruihua1, YANG Hang2, LI Dong1, ZHANG Jie1, 2
(1. School of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China;
2. School of Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China)
Abstract: An orthogonal test was designed to explore the appropriate preparation of granular adsorbents for arsenic removal based on the backwashing residuals from deironing and demanganization granular adsorbents for arsenic removal(GAAR).The structure of granulars was analyzed by SEM-EDS microscopy, X-ray powder diffraction and nitrogen adsorption analysis for specific surface area, respectively, and the arsenite removal efficiency was also analyzed. The results show that the best calcination condition is that the pre-heat temperature is 180 ℃, pre-heat time is 20 min, calcination temperature is 350 ℃ and calcination time is 120 min. Calcination temperature is the main factor impacting arsenic removal. The higher calcination temperature leads to the more hematite generated in the granular adsorbent, and makes the surface area decline and enlarges the average pore size. GAAR is a kind of mesoporous material (the surface area is 43.8 m2/g), with small fractions of hematite and quartz. Arsenate adsorption on GAAR can be described by pseudo-second-order kinetic equation and the Freundlich isotherm equation. The maximum adsorption capacity for arsenite of GAAR is 4.77 mg/g.
Key words: arsenic removal; granular adsorbents; adsorption; calcination temperature; characterization
砷是一种毒性很高的原生质毒物,广泛存在于天然水环境中[1],在我国,受高砷水影响的人口涉及10个省市267万多人[2]。水中的砷主要以三价砷和五价砷形式存在,As(Ⅲ)的毒性比As(Ⅴ)的毒性强[3]。自2007-01-01起,我国实施的GB 5749—2006“生活饮用水卫生标准”规定将砷质量浓度限值由50 μg/L修改为10 μg/L,对除砷工艺提出了更严格的要求。吸附除砷法因其高效、经济、操作简单的优点而得到了广泛应用[4]。在众多吸附剂中,铁基吸附剂因其除砷活性强并且具有经济环保的优点,成为新型除砷吸附剂开发的热点[5]。有研究表明,除铁除锰生物滤池反冲洗泥(以下简称“铁锰泥”)中,含有大量Fe(Ⅲ)(氢)氧化物和Mn(Ⅳ)氧化物,未经处理直接排放会造成环境压力[6],使用该种铁锰泥粉末进行除砷试验,其对As(Ⅲ)最大吸附量可达36.53 mg/g,作为除砷材料有较广阔的应用前景[7]。然而,由于其呈粉末形态,应用于水体除砷后泥水分离困难,若处理不当又会带来新的环境问题,无法用于工程实际。利用铁锰泥为主要原料,通过高温焙烧制成的颗粒吸附剂除As(Ⅴ)能力较强,同时又易于从水中回收[8]。但由于反冲洗泥成分为含有硅、钙、锰等大量杂质的含水氧化铁[7],在不同时间、不同温度下焙烧时,会导致内部结构产生不同程度的变化,进而对颗粒吸附剂除砷效果造成不同程度的影响[9-12]。为此,本文作者对颗粒吸附剂的最佳焙烧工艺进行研究,利用扫描电镜与能谱分析(SEM-EDS),X线衍射(XRD)和比表面积分析技术(BET)等手段对颗粒吸附剂进行表征,并分析温度对颗粒吸附剂结构的影响,通过吸附实验测试其吸附除As(Ⅲ)的性能,以期为颗粒吸附剂的制备和水体除As(Ⅲ)应用提供优化思路和技术参考。
1 材料与方法
1.1 原材料及其预处理
原材料铁锰泥来源于水厂稳定运行阶段的除铁除锰生物滤池,该水厂进水水质如下:总铁质量浓度为14.9 mg/L,Fe2+质量浓度为10.0 mg/L,Mn2+质量浓度为0.8~1.0 mg/L;收集滤池的反冲洗废水,静沉数日,将沉积在底部的污泥取出,自然风干,用研钵磨碎后过0.15 mm筛置于干燥处备用[8]。
1.2 颗粒吸附剂的制备
1.2.1 正交试验样本颗粒制备
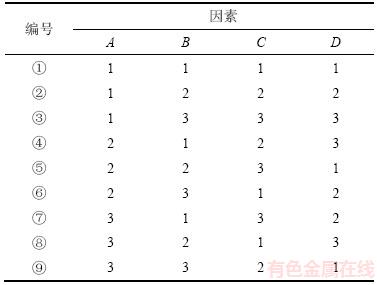
正交试验设计中的因素水平如表1所示。选取预热温度、预热时间、焙烧温度和焙烧时间作为制备工艺优化的4个因素,根据表2中的正交试验设计表L9(34)设计正交试验。按质量比10:2:0.5分别称取一定质量的铁锰泥粉末、海藻酸钠与葡萄糖,置于研钵中研磨混匀后取出,加入适量去离子水混匀,制成粒径为1~2 mm的颗粒,置于阴凉通风处24 h陈化晾干。分别在不同的制备工艺下利用马弗炉进行焙烧,待经焙烧的颗粒冷却后,使用去离子水冲洗3次后于100 ℃条件下烘干至恒质量,得到一系列样本颗粒。
表1 正交试验设计中的因素水平
Table 1 Experimental factors and distribution levels of orthogonal experimental design

表2 正交试验设计
Table 2 Design of orthogonal experimental
1.2.2 正交试验样本颗粒制备
在正交试验筛选出的最优制备工艺下制备水厂反冲洗铁锰泥颗粒吸附剂(granular adsorbents for arsenic remove,GAAR)。改变最优制备工艺中的焙烧温度至550 ℃并保持其他条件不变,制备高温颗粒吸附剂(以下简称“高温颗粒”)。
1.3 表征与分析
使用日本Hitachi公司S-570型扫描电镜对GAAR和高温颗粒表面形貌进行表征并分析GAAR的化学组成,加速电压为20 kV。使用德国布鲁克公司BRUCKER D8型X线粉末衍射仪分析GAAR和高温颗粒的内部物相组成,衍射仪采用Co靶Kα射线,管电压为50 kV,管电流为50 mA,扫描速率为6 (°)/min,扫描范围2θ为10°~90°,分析软件为Jade 8.0。使用瑞士梅特勒公司ASAP2020型物理吸附仪对GAAR和高温颗粒比表面积和介孔孔径进行分析,采用BET法计算比表面积,采用BJH法计算孔径。分析前将2种颗粒吸附剂置于200 ℃下脱气2 h(以上检测项目均由北京中科百测技术服务有限公司提供技术支持),数据拟合和分析均使用Origin 9.1。
1.4 实验方法
1.4.1 吸附试验
称取0.1 g样本颗粒置于250 mL具塞锥形瓶中,加入100 mL质量浓度为25 mg/L的As(Ⅲ)溶液。使用NaOH和HCl调节pH=7,在25 ℃时,以100 r/min的转速恒温振荡12 h后,取上清液,经0.45 μm微孔滤膜过滤后使用原子荧光分光光度计测定砷的剩余量。将吸附后的颗粒取出,置于烘箱中于 100 ℃烘干至恒质量后称质量。
吸附量计算公式为
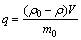 (1)
(1)
式中:q为取样时颗粒累积吸附量,mg/g; 为As的初始质量浓度,mg/L;
为As的初始质量浓度,mg/L; 为振荡结束时溶液中剩余As质量浓度,mg/L;V为溶液体积,L;m0为样本颗粒投加量,g。回收率计算公式为
为振荡结束时溶液中剩余As质量浓度,mg/L;V为溶液体积,L;m0为样本颗粒投加量,g。回收率计算公式为
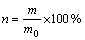 (2)
(2)
式中:n为颗粒吸附剂回收率; m0为颗粒吸附剂投加量,g;m为振荡结束时颗粒态吸附剂剩余量,g。
1.4.2 吸附动力学试验
称取0.8 g GAAR置于1 L聚乙烯瓶中,加入800 mL质量浓度为25 mg/L的As(Ⅲ)溶液,在25 ℃下,以100 r/min的转速恒温振荡As(Ⅲ)溶液。自反应开始至36 h,间隔一定时间取5 mL水样,经0.45 μm微孔滤膜过滤后,使用原子荧光分光光度计测定砷的残余量。
1.4.3 等温吸附试验
称取0.1 g GAAR置于一系列250 mL具塞锥形瓶中,分梯度加入100 mL质量浓度范围为0.1~50.0 mg/L As(Ⅲ)溶液,在25 ℃下,以100 r/min转速下恒温振荡12 h后取水样,经0.45 μm微孔滤膜过滤后,测定砷的残余量。
2 结果与讨论
2.1 制备工艺正交优化
由于铁锰泥黏接性能较差,自身难以直接制成有较高机械强度的颗粒,需要添加少量黏接剂辅助成型。海藻酸钠是水体中天然有机质的重要组成成分,具有很好的溶胶-凝胶特性[13],因此,加入海藻酸钠以提高铁锰泥粉末间的结合强度,提高颗粒机械性能。造孔剂的添加有利于促进吸附剂的内部孔道形成进而增大其比表面积,葡萄糖只含C,H和O共3种元素,是一种环境友好的绿色造孔剂[14],因此,本文采用适量海藻酸钠和葡萄糖作为黏接剂和造孔剂,并利用正交试验对铁锰泥颗粒吸附剂的制备工艺进行优化。试验结果如表3所示。
表3中,各个样本颗粒回收率均高于96.1%,力学性能较好。从各个因素不同水平平均吸附除砷效果看,在不同预热温度(A)下,吸附砷量从大至小依次对应水平2,1和3;在不同预热时间(B)下,吸附砷量从大至小依次对应水平1,3和2;在不同焙烧温度(C)下,吸附砷量从大至小依次对应水平1,2和3;在不同焙烧时间(D)下,吸附砷量从大至小依次对应水平3,2和1。可以确定铁锰泥颗粒吸附剂制备中的最佳焙烧条件组合为A2B1C1D3,即预热温度为180 ℃,预热时间为20 min,焙烧温度为350 ℃,焙烧时间为120 min。
表3 正交试验设计与结果
Table 3 Design of orthogonal experimental design and its experimental results

根据表3中极差分析结果(极差RC=1.10,RA=0.45,RD=0.27,RB=0.27,RC>>RA>RD=RB)可知:预热温度、焙烧时间与预热时间对吸附量的影响相对较小,焙烧温度是影响样本颗粒除砷性能的最主要因素;随着焙烧温度升高,吸附量平均值显著降低(K1>K2>K3)。造成这一现象的原因可能是高温对颗粒吸附剂内部物相和比表面积产生不利影响[15]。
2.2 温度对铁锰泥颗粒吸附剂性能和结构的影响
在得到的最佳制备工艺下制备GAAR,并将上述最佳制备工艺中的焙烧温度升高至550 ℃(其余工艺参数不变)制备高温颗粒,考察GAAR和高温颗粒的吸附除砷性能和力学性能。两者制备工艺与性能参数如表4所示。
从表4可知:焙烧温度升高对制得颗粒的力学性能有利;高温颗粒吸附剂回收率比颗粒吸附剂回收率上升2.5%;但对吸附效果有显著的不利影响,高温颗粒除砷吸附量仅为颗粒吸附量的19.3 %。
表4 2种颗粒吸附剂的制备工艺、吸附量与回收率
Table 4 Preparation conditions, adsorption capacities and retrieve rates

2.2.1 温度对铁锰泥颗粒吸附剂微观形貌的影响
使用SEM技术对GAAR和高温颗粒的表面形貌进行表征,结果如图1所示。图1(a)和(b)所示分别为GAAR和高温颗粒的表面形貌图像,可见两者表面均分布着大量粒径不一、排布散乱的凸起颗粒状,且有丰富的表面孔结构。颗粒状凸起能提高颗粒的比表面积,表面孔结构是由于颗粒内部的造孔剂在高温热解时产生混合气体从其表面逸出,从而生成一种开放性的孔道,这种形式生成的孔道连通性强,孔隙率高,有利于吸附质向吸附剂内部的充分扩散,从而有利于吸附过程的进行[15]。与GAAR相比,高温颗粒表面颗粒状凸起与孔道平均直径有一定程度增加。文献[16]指出,随温度升高,水铁矿等向赤铁矿转变,赤铁矿不断生长并发生团聚现象,纳米孔隙也逐渐合并成更大的孔,与上述现象相一致。
图2和表5所示分别为GAAR的表面EDS谱图和化学元素组成。从表5可见:Fe和Mn元素质量分数明显比其他元素的高,且氧元素的大量存在意味着两者应主要以铁、锰氧化物的形式存在,说明颗粒吸附剂富含铁氧化物与锰氧化物,具有一定的氧化能力和良好的除砷潜力[17]。

图1 GAAR与高温颗粒的SEM图片
Fig. 1 SEM images of GAAR and granular adsorbents prepared at high temperature

图2 GAAR的EDS图谱
Fig. 2 EDS spectrum of GAAR
表5 GAAR的元素组成
Table 5 Chemical composition of GAAR

研究表明:不同温度的热处理会致使铁氧化物晶体结构产生变迁,而不同晶型结构的铁氧化物除砷能力也各不相同[12, 18]。在铁锰泥颗粒吸附剂的制备过程中,不同焙烧温度对其除砷效果有较大影响,推测可能是颗粒吸附剂内部铁氧化物晶型结构的差异性所致。
2.2.2 温度对铁锰泥颗粒吸附剂晶型结构的影响
采用X线粉晶衍射分析装置(XRD)对原料铁锰泥、GAAR和高温颗粒的物相组成进行分析,三者的XRD图谱分别见图3(a),(b)和(c)。
本实验采用铁锰泥的主要成分为γ-FeOOH,是含有硅、钙、锰等大量杂质的含水氧化铁[8]。当衍射角为26°~42°时,图3(a),(b)和(c)中均出现了较宽且弱的馒头峰,类似于水铁矿的XRD谱图[9],说明原料铁锰泥为无定形态,存在晶型很差的水铁矿成分。同理,可推测GAAR和高温颗粒中也含有水铁矿。在GAAR和高温颗粒的XRD谱图中出现赤铁矿晶体衍射峰,说明在制备过程中可能伴随着晶型的转化,水铁矿等无定形态的含水氧化铁失水转化为赤铁矿。水铁矿在形成赤铁矿的过程中会释放硅,硅通过一系列作用生成单相石英[9],这也解释了图3(b)和(c)所示谱图中均可观测到石英晶体衍射峰现象的原因。
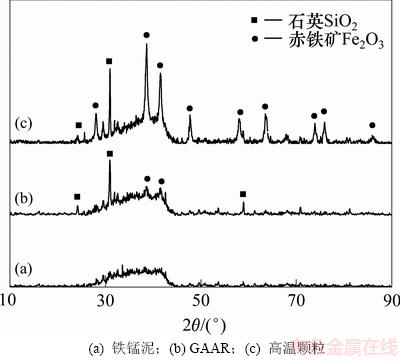
图3 550 ℃时铁锰泥、GAAR与高温颗粒的XRD图谱
Fig. 3 XRD patterns of backwashing residuals, GAAR and granular adsorbents prepared at 550 ℃
在GAAR的XRD谱图中,赤铁矿晶体衍射峰很弱,说明在最优工艺下制备GAAR时,仅有少量含水氧化铁在焙烧过程中由于脱羟基作用而脱水生成赤铁矿衍射峰。这种现象表明,焙烧温度升高会导致制成的颗粒吸附剂内部更多含水氧化铁继续脱水转化生成赤铁矿,赤铁矿晶粒不断增大,使得赤铁矿在物相组成中的优势地位更加明显。该结果与邹雪华等[18]关于热处理针铁矿向赤铁矿转变的研究结果相一致。
高温导致水铁矿等无定形的含水氧化铁向赤铁矿转变,且温度越高,转化越彻底。由于赤铁矿对As(Ⅲ)的吸附效果远远低于水铁矿的吸附效果[13-14],因此,温度越高,除砷效果越差,即焙烧温度通过影响颗粒吸附剂内部的物相组成,进而影响其除砷效果。
2.2.3 温度对铁锰泥颗粒吸附剂比表面积与内部孔结构的影响
GAAR与高温颗粒的N2吸附脱附曲线及孔径分布见图4和图5,比表面积与孔结构分析结果见表6。参照国际理论(化学)与应用化学联合会(IUPAC)对吸附等温线类型的划分,颗粒吸附剂与高温颗粒吸附剂的N2吸附脱附曲线均为Ⅳ型等温线,滞后环呈H3型,具有典型的介孔材料的吸附曲线特征[9]。
在图4和图5所示的GAAR与高温颗粒的N2吸附脱附曲线中,滞后环均在p/p0=0.4位置处闭合,根据Ⅳ型等温线在不同吸附阶段的特点,说明两者中均存在较小的介孔[19];在临近饱和蒸汽压处,图4和图5中均出现吸附分支的陡然上升现象,说明吸附剂中主要孔结构形式可能为有平行壁的狭缝状毛细孔,此类型孔常出现在片状粒子形成的吸附剂中,GAAR和高温颗粒内部形貌可能呈片状[20]。
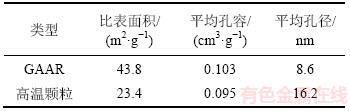
在GAAR的孔径分布图中,在介孔孔径为3.8 nm和12.4 nm处均出现明显的介孔峰,且仍有微孔存在。而在高温颗粒的孔径分布图中,在介孔孔径为3.7 nm和29.2 nm处分别出现了介孔峰,微孔则完全消失;随着焙烧温度从360 ℃提升至550 ℃,颗粒吸附剂内部平均孔径从8.6 nm上升至16.2 nm,而平均孔容则从0.103 cm3/g降低至0.095 cm3/g。造成上述孔结构变化的原因可能是高温使得颗粒内部结晶水脱除更严重,物相发生变化,赤铁矿晶粒大量生成,微孔和介孔合并成较大的介孔和大孔,造成平均孔径增大以及孔容降低。以上过程直接导致吸附剂的比表面积大幅度下降,最终在350 ℃时制成的GAAR比表面积为43.8 m2/g,而在550 ℃时制成的高温颗粒的比表面积仅为23.4 m2/g。以上结果说明过高的焙烧温度能够导致吸附剂内部孔结构变大和比表面积降低,最终影响吸附除砷的效果,导致在550 ℃焙烧温度下制备的高温颗粒的除砷吸附量仅为GAAR(350 ℃时)的18.8%。
2.3 GAAR的除砷性能
2.3.1 吸附动力学
为考察最佳制备工艺下制得的GAAR对As(Ⅲ)的去除效果,采用准一级动力学速率方程(式(3))与准二级动力学速率方程(式(4))分别对GAAR吸附As(Ⅲ)的动力学参数进行非线性拟合。拟合曲线见图6,拟合参数见表7。
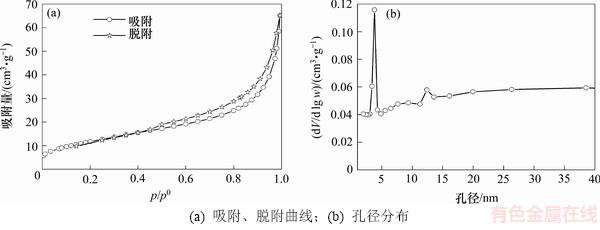
图4 GAAR的N2吸附、脱附曲线与孔径分布
Fig. 4 Isotherm of nitrogen adsorption and desorption and distribution of pore size for GAAR
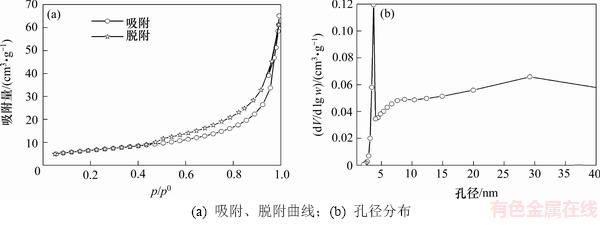
图5 550 ℃时颗粒的N2吸附脱附曲线与孔径分布
Fig. 5 Isotherm of nitrogen adsorption and desorption and distribution of pore size for granular adsorbents prepared at 550 ℃
表6 颗粒吸附剂与高温颗粒吸附剂孔结构分析
Table 6 Analysis of pore structure for granular adsorbents and granular adsorbents (550 ℃)
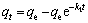 (3)
(3)
 (4)
(4)
式中:t为反应时间,h;qt为在t时刻GAAR的吸附量,mg/g;qe为吸附达到平衡时GAAR的吸附量,mg/g;k1和k2分别为准一级和准二级动力学方程的速率常数,g/(mg·h)。

图6 吸附动力学模型曲线
Fig. 6 Curves of kinetic models
从图6可见:反应开始时,吸附速率较快,吸附量累计较快;随着反应时间延长,溶液中砷质量分数有所下降,吸附速率随之下降;当反应时间到达12 h时,基本达到反应平衡阶段。从表7可见:GAAR对As(Ⅲ)的吸附更符合准二级动力学模型,说明该过程更符合化学吸附的特征。该化学反应可能是As(Ⅲ)被氧化为As(Ⅴ),并在GAAR表面发生专性吸附,生成内球形络合物[17]。
表7 准一级和准二级动力学模型拟合参数
Table 7 Parameters of kinetic models

2.3.2 吸附等温线
采用Langmuir方程(式(5))和Freundlich方程(式(6))拟合吸附等温线如图7所示,参数见表8。
Langmuir吸附等温式为
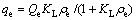 (5)
(5)
式中: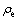 为达到平衡时溶液中砷的质量浓度,mg/L;Qe为达到饱和时的极限吸附量,mg/g;KL为吸附常数,与吸附能有关。
为达到平衡时溶液中砷的质量浓度,mg/L;Qe为达到饱和时的极限吸附量,mg/g;KL为吸附常数,与吸附能有关。
Freundlich吸附等温式为
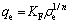 (6)
(6)
式中:KF为Freundlich吸附系数;n为常数。
吸附等温线拟合参数见表8,部分吸附剂对As(Ⅲ)的最大吸附量见表9[21-28]。从表8可知:使用Langmuir或Freundlich吸附等温方程均能进行较好地拟合吸附等温线,Langmuir方程拟合得出的Qe=4.77 mg/g,与表9中数据进行对照,发现GAAR对As(Ⅲ)的吸附能力明显强于改性矿物材料和传统吸附材料的吸附能力,并且避免了表9中粉末状材料因材料粒径过小导致吸附后难以从水中分离的不足,用于除砷吸附有广阔的应用前景。
与Langmuir方程相比,适用于多层吸附和表面异质的非理想吸附方程即Freundlich方程对GAAR吸附As(Ⅲ)的过程拟合效果更好,推测该过程主要为多分子层吸附[21]。且根据XRD结果,GAAR中铁氧化物呈赤铁矿和无定形态,符合异质化的特点[22],与方程的拟合结果相互佐证。Freundlich方程中拟合参数1/n<1表明反应容易进行,且发生化学吸附;1/n>2表明反应很难进行。本文中,1/n =0.627,说明该反应较易进行,且进一步证实吸附过程中发生了化学吸附过程[17]。
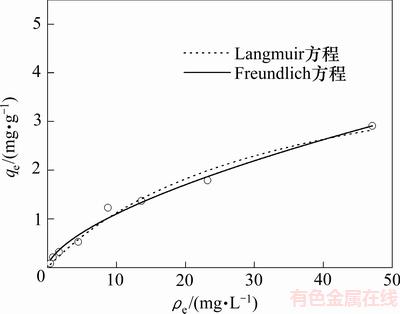
图7 25 ℃时Langmuir和Freundlich方程拟合吸附等温线
Fig. 7 Langmuir and Freundlich isothermal adsorption simulation at 25 ℃
表8 吸附等温线拟合参数
Table 8 Isotherm parameters for arsenic adsorption on the granular absorbent
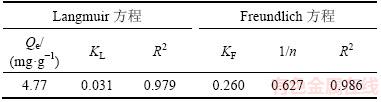
表9 部分吸附剂对As(Ⅲ)的最大吸附量*
Table 9 Maximum adsorption capacity of some adsorbents

3 结论
1) 预热温度为180 ℃、预热时间为20 min、焙烧温度350 ℃、焙烧时间120 min是铁锰泥颗粒吸附剂制备的最优工艺,焙烧温度是控制颗粒吸附剂除砷效果的主要因素,温度越高,除砷效果越差。
2) GAAR内部晶型较差,主要物相有弱结晶态水铁矿和少量赤铁矿晶体与石英晶体。GAAR为典型的介孔材料,比表面积为43.8 m2/g,孔隙类型为狭缝型。
3) 焙烧温度对颗粒吸附剂内部结构有显著影响。较高的焙烧温度能促进赤铁矿的生成,不利于除砷;较高的焙烧温度会导致颗粒吸附剂比表面积降低。
4) GAAR对As(Ⅲ)的吸附符合准二级动力学方程和Freundlich方程,GAAR对As(Ⅲ)的最大吸附量为4.77 mg/g。
参考文献:
[1] BAI Yaohui, YANG Tingting, LIANG Jinsong, et al. The role of biogenic Fe-Mn oxides formed in situ, for arsenic oxidation and adsorption in aquatic ecosystems[J]. Water Research, 2016, 98: 119-127.
[2] 林璐, 胥嘉瑞, 吴昊, 等. 不同粒径铁铝泥对砷(Ⅲ)的吸附效果[J]. 环境科学, 2013, 34(7): 2758-2765.
LIN Lu, XU Jiarui, WU Hao, et al. Effectiveness of Arsenite adsorption by ferric and alum water treatment residuals with different grain sizes[J]. Environmental Science, 2013, 34(7): 2758-2765.
[3] 高晓慧, 董玉良, 任丽英, 等. 复合氧化物对水中砷的去除作用研究进展[J]. 环境科学与技术, 2015, 38(5): 201-206.
GAO Xiaohui, DONG Yuliang, REN Liying, et al. Advances in application of binary oxide in removal of arsenic from aqueous solution[J]. Environmental Science & Technology, 2015, 38(5): 201-206.
[4] 冯彦房, 薛利红, 杨梖, 等. 载镧生物炭的优化制备及其对水体中砷的吸附[J]. 中国环境科学, 2015, 35(8): 2433-2441.
FENG Yanfang, XUE Lihong, YANG Bei, et al. Optimized preparation of lanthanum uploaded biochar and its application in adsorbing pentavalent arsenic ions from aqueous solution[J]. China Environmental Science, 2015, 35(8): 2433-2441.
[5] ZHANG Yu, YANG Min, HUANG Xia. Arsenic(Ⅴ) removal with a Ce(Ⅳ)-doped iron oxide adsorbent[J]. Chemosphere, 2003, 51(9): 945-952.
[6] 赵运新, 曾辉平, 吕育锋, 等. 生物除铁除锰滤池反冲洗铁锰泥除As(Ⅴ)研究[J]. 中国给水排水, 2017, 33(11): 1-6.
ZHAO Yunxin, ZENG Huiping, LU Yufeng, et al. As(Ⅴ) removal with iron and manganese oxide sludge from biological iron and manganese removal filter[J]. China Water & Wastewater, 2017, 33(11): 1-6.
[7] 曾辉平, 赵运新, 吕育锋, 等. 除铁除锰水厂反冲洗泥吸附除砷[J]. 哈尔滨工业大学学报, 2018, 50(2): 19-26.
ZENG Huiping, ZHAO Yunxin, LU Yufeng, et al. Arsenic adsorption behaviors of backwash sludge from waterworks for iron and manganese removal[J]. Journal of Harbin Institute of Technology, 2018, 50(2): 19-26.
[8] 曾辉平, 吕赛赛, 杨航, 等. 铁锰泥除砷颗粒吸附剂对As(Ⅴ) 的吸附去除[J]. 环境科学, 2018, 39(1): 180-188.
ZENG Huiping, LU Saisai, YANG Hang, et al. Arsenic(Ⅴ) removal by granular adsorbents made from backwashing residuals from biofilters for iron and manganese removal[J]. Environmental Science, 2018, 39(1): 80-188.
[9] 王小明, 杨凯光, 孙世发, 等. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 2011, 18(2): 339-347.
WANG Xiaoming, YANG Kaiguang, SUN Shifa, et al. The structure and composition of ferrihydrite and its environmental geochemical behaviors[J]. Earth Science Frontiers, 2011, 18(2): 339-347.
[10] NAONO H, NAKAI K, SUEYOSHI T, et al. Porous texture in hematite derived from goethite: Mechanism of thermal decomposition of geothite[J]. Journal of Colloid & Interface Science, 1987, 120(2): 439-450.
[11] 豆小敏, 于新, 赵蓓, 等. 5种铁氧化物去除As(V)性能的比较研究[J]. 环境工程学报, 2010, 4(9): 1989-1994.
DOU Xiaomin, YU Xin, ZHAO Bei, et al. A performance comparison of arsenate removal from water by five iron oxides[J]. Chinese Journal of Environmental Engineering, 2010, 4(9): 1989-1994.
[12] 孙林, 王寅, 司友斌. 三种铁氧化物对As(Ⅲ)和As(Ⅴ)的吸附研究[J]. 土壤通报, 2016, 47(1): 198-206.
SUN Lin, WANG Yin, SI Youbin. Comparison of adsorption of As (Ⅲ) and As (Ⅴ) by three iron oxides[J]. Chinese Journal of Soil Science, 2016, 47(1): 198-206.
[13] 林勇新, 曹西华, 宋秀贤, 等. 海藻酸钠对改性黏土絮凝特征的影响[J]. 中国环境科学, 2013, 33(2): 263-269.
LIN Yongxin, CAO Xihua, SONG Xiuxian, et al. The effect of sodium alginate on the coagulation rate and flocs formation of modified clay[J]. China Environmental Science, 2013, 33(2): 263-269.
[14] 王献辉. 喷雾干燥法制备铁基吸附剂及吸附除砷性能研究[D]. 长沙: 湖南大学化学化工学院, 2016: 24.
WANG Xianhui. Preparation of Fe-based adsorbents by spray drying and its arsenic adsorption performances[D]. Changsha: Hunan University. School of Chemistry and Chemical Engineering, 2016: 24.
[15] 鲍腾, 陈冬, 陈天虎, 等. 铁氧化物生物多孔陶粒的制备工艺及性能[J]. 复合材料学报, 2014, 31(2): 408-415.
BAO Teng, CHEN Dong, CHEN Tianhu, et al. Preparation and characterization od iron oxide-based porous ceramsite[J]. Acta Materiae Copositae Sinica, 2014, 31(2): 408-415.
[16] 曾辉平, 赵运新, 吕育锋, 等. 水厂反冲洗铁锰泥热处理产物结构及除砷变化[J]. 中国环境科学, 2017, 37(8): 2986-2993.
ZENG Huiping, ZHAO Yunxin, LU Yufeng, et al. Adsorption behaviors towards As and structural change of iron and manganese oxide sludge by thermal treatment[J]. China Environmental Science, 2017, 37(8): 2986-2993.
[17] OCI SKI D, JACUKOWICZ-SOBALA I, MAZUR P, et al. Water treatment residuals containing iron and manganese oxides for arsenic removal from water: characterization of physicochemical properties and adsorption studies[J]. Chemical Engineering Journal, 2016, 294(6): 210-221.
SKI D, JACUKOWICZ-SOBALA I, MAZUR P, et al. Water treatment residuals containing iron and manganese oxides for arsenic removal from water: characterization of physicochemical properties and adsorption studies[J]. Chemical Engineering Journal, 2016, 294(6): 210-221.
[18] 邹雪华, 陈天虎, 刘海波, 等. 热处理针铁矿的结构与色度演化[J]. 硅酸盐学报, 2013, 41(5): 669-673.
ZOU Xuehua, CHEN Tianhu, LIU Haibo, et al. Structuraland chromatic evolution of goethite by thermal treatment[J]. Journal of the Chinese Ceramic Society, 2013, 41(5): 669-673.
[19] 近藤精一, 石川达雄, 安部郁夫, 等. 吸附科学[M]. 李国希, 译. 2版. 北京: 化学工业出版社, 2005: 31-35.
KONDO E, ISHIKAWA D, ABE I, et al. Adsorption science[M]. LI Guoxi, trans. 2nd ed. Beijing: Chemical Industry Press, 2005: 31-35.
[20] 孔婷婷, 张颖萍, 张亚刚, 等. 钛锂铝水滑石/延迟焦的制备及其CO2吸附性能研究[J]. 中南大学学报(自然科学版), 2017, 48(4): 880-888.
KONG Tingting, ZHANG Yingping, ZHANG Yagang, et al. Preparation and CO2 adsorption performance of Ti/Li/Al-LDHs/ delayed cock[J]. Journal of Central South University (Science and Technology), 2017, 48(4): 880-888.
[21] 付宏渊, 邱祥, 王琼, 等. 铁盐改性柚子皮对含镉废水的吸附性能[J]. 中南大学学报(自然科学版), 2017, 48(9): 2271-2278.
FU Hongyuan, QIU Xiang, WANG Qiong, et al. Adsorption performance of Fe(Ⅲ)-modified pomelo peel on wastewater containing Cr(Ⅵ)[J]. Journal of Central South University (Science and Technology), 2017, 48(9): 2271-2278.
[22] 刘喜, 敖鸿毅, 刘剑彤. 铁改性竹炭去除水中的As(Ⅲ)和As(Ⅴ)[J]. 环境工程学报, 2012, 6(9): 2958-2962.
LIU Xi, AO Hongyi, LIU Jiantong. Removal of As(Ⅲ) and As(Ⅴ) from water by iron-modified bamboo charcoal[J]. Chinese Journal of Environmental Engineering, 2012, 6(9): 2958-2962.
[23] 赵凯, 郭华明, 李媛, 等. 天然菱铁矿改性及强化除砷研究[J]. 环境科学, 2012, 33(2): 459-468.
ZHAO Kai, GUO Huaming, LI Yuan, et al. Modification of natural siderite and enhanced adsorption of arsenic[J]. Environmental Science, 2012, 33(2): 459-468.
[24] ZHU Jin, BAIG S A, SHENG Tiantian, et al. Fe3O4 and MnO2 assembled on honeycomb briquette cinders(HBC) for arsenic removal from aqueous solutions[J]. Journal of Hazardous Materials, 2015, 286(4): 220-228.
[25] 吴昆明, 郭华明, 魏朝俊. 天然磁铁矿化学改性及其在水体除砷中的应用[J]. 岩矿测试, 2017, 36(1): 32-39.
WU Kunming, GUO Huaming, WEI Chaojun. Chemical modification of natural magnetite and its application in arsenic removal from a water environment[J]. Rock and Mineral Analysis, 2017, 36(1): 32-39.
[26] LIN T F, WU J K. Adsorption of arsenite and arsenate within activated alumina grains: equilibrium and kinetics[J]. Water Research, 2001, 35(8): 2049-2057.
[27] 代天娇, 彭彤, 陶晨, 等. 天然锰砂去除水中的砷[J]. 环境工程学报, 2013, 7(1): 58-64.
DAI Tianjiao, PENG Tong, TAO Chen, et al. Removal of arsenic from water by natural manganese sand[J]. Chinese Journal of Environmental Engineering, 2013, 7(1): 58-64.
[28] 聂东阳, 黎飞虎, 周宏仓. 铁基介孔微球的合成、表征及其对水中微量As(Ⅴ)的吸附[J]. 科学技术与工程, 2014, 14(23): 265-270.
NIE Dongyang, LI Feihu, ZHOU Hongcang. Fe-based microsphere: synthesis, characterization and adsorption performance for aqueous trace As(Ⅴ)[J]. Science Technology and Engineering, 2014, 14(23): 265-270.
(编辑 陈灿华)
收稿日期:2017-11-16;修回日期:2018-01-12
基金项目(Foundation item):国家自然科学基金资助项目(51308009);北京市教委科技计划项目(KM201510005021) (Project(51308009) supported by the National Natural Science Foundation of China; Project(KM201510005021) supported by the Scientific and Technological Research Program of Education Commission of Beijing Municipal)
通信作者:曾辉平,博士,讲师,从事地下水水质净化理论及工程应用研究;E-mail: zenghuiping@bjut.edu.cn
摘要:为探索以除铁除锰水厂反冲洗铁锰泥为主要原料制备除砷颗粒吸附剂(granular adsorbents for arsenic removal, GAAR)的最佳工艺和除砷效果,通过正交试验优化制备工艺,利用扫描电镜与能谱分析(SEM-EDS),X线衍射(XRD)和比表面积分析技术(BET)对GAAR进行表征并考察其对As(Ⅲ)的吸附效果。研究结果表明:预热温度为180 ℃、预热时间为20 min、焙烧温度为350 ℃、焙烧时间为120 min为制备GAAR的最优条件;焙烧温度是影响除砷效果的主要因素,高温促使铁氧化物向赤铁矿转变并加剧孔道合并从而降低该温度下制得颗粒吸附剂的吸附能力;GAAR表面粗糙,内部物相成分为水铁矿和部分赤铁矿、石英,比表面积为43.8 m2/g,是典型的介孔材料;GAAR对砷的吸附过程符合准二级动力学,等温吸附符合Freundlich方程,GAAR对As(Ⅲ)的最大吸附量为4.77 mg/g。
[2] 林璐, 胥嘉瑞, 吴昊, 等. 不同粒径铁铝泥对砷(Ⅲ)的吸附效果[J]. 环境科学, 2013, 34(7): 2758-2765.
[3] 高晓慧, 董玉良, 任丽英, 等. 复合氧化物对水中砷的去除作用研究进展[J]. 环境科学与技术, 2015, 38(5): 201-206.
[4] 冯彦房, 薛利红, 杨梖, 等. 载镧生物炭的优化制备及其对水体中砷的吸附[J]. 中国环境科学, 2015, 35(8): 2433-2441.
[6] 赵运新, 曾辉平, 吕育锋, 等. 生物除铁除锰滤池反冲洗铁锰泥除As(Ⅴ)研究[J]. 中国给水排水, 2017, 33(11): 1-6.
[7] 曾辉平, 赵运新, 吕育锋, 等. 除铁除锰水厂反冲洗泥吸附除砷[J]. 哈尔滨工业大学学报, 2018, 50(2): 19-26.
[8] 曾辉平, 吕赛赛, 杨航, 等. 铁锰泥除砷颗粒吸附剂对As(Ⅴ) 的吸附去除[J]. 环境科学, 2018, 39(1): 180-188.
[9] 王小明, 杨凯光, 孙世发, 等. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 2011, 18(2): 339-347.
[11] 豆小敏, 于新, 赵蓓, 等. 5种铁氧化物去除As(V)性能的比较研究[J]. 环境工程学报, 2010, 4(9): 1989-1994.
[12] 孙林, 王寅, 司友斌. 三种铁氧化物对As(Ⅲ)和As(Ⅴ)的吸附研究[J]. 土壤通报, 2016, 47(1): 198-206.
[13] 林勇新, 曹西华, 宋秀贤, 等. 海藻酸钠对改性黏土絮凝特征的影响[J]. 中国环境科学, 2013, 33(2): 263-269.
[14] 王献辉. 喷雾干燥法制备铁基吸附剂及吸附除砷性能研究[D]. 长沙: 湖南大学化学化工学院, 2016: 24.
[15] 鲍腾, 陈冬, 陈天虎, 等. 铁氧化物生物多孔陶粒的制备工艺及性能[J]. 复合材料学报, 2014, 31(2): 408-415.
[16] 曾辉平, 赵运新, 吕育锋, 等. 水厂反冲洗铁锰泥热处理产物结构及除砷变化[J]. 中国环境科学, 2017, 37(8): 2986-2993.
[18] 邹雪华, 陈天虎, 刘海波, 等. 热处理针铁矿的结构与色度演化[J]. 硅酸盐学报, 2013, 41(5): 669-673.
[19] 近藤精一, 石川达雄, 安部郁夫, 等. 吸附科学[M]. 李国希, 译. 2版. 北京: 化学工业出版社, 2005: 31-35.
[20] 孔婷婷, 张颖萍, 张亚刚, 等. 钛锂铝水滑石/延迟焦的制备及其CO2吸附性能研究[J]. 中南大学学报(自然科学版), 2017, 48(4): 880-888.
[21] 付宏渊, 邱祥, 王琼, 等. 铁盐改性柚子皮对含镉废水的吸附性能[J]. 中南大学学报(自然科学版), 2017, 48(9): 2271-2278.
[22] 刘喜, 敖鸿毅, 刘剑彤. 铁改性竹炭去除水中的As(Ⅲ)和As(Ⅴ)[J]. 环境工程学报, 2012, 6(9): 2958-2962.
[23] 赵凯, 郭华明, 李媛, 等. 天然菱铁矿改性及强化除砷研究[J]. 环境科学, 2012, 33(2): 459-468.
[25] 吴昆明, 郭华明, 魏朝俊. 天然磁铁矿化学改性及其在水体除砷中的应用[J]. 岩矿测试, 2017, 36(1): 32-39.
[27] 代天娇, 彭彤, 陶晨, 等. 天然锰砂去除水中的砷[J]. 环境工程学报, 2013, 7(1): 58-64.
[28] 聂东阳, 黎飞虎, 周宏仓. 铁基介孔微球的合成、表征及其对水中微量As(Ⅴ)的吸附[J]. 科学技术与工程, 2014, 14(23): 265-270.


