文章编号:1004-0609(2011)07-1705-08
含砷铁矿石脱砷过程的热力学
张淑会, 吕 庆,胡 晓
(河北联合大学 冶金与能源学院, 唐山 063009)
摘 要:
采用HSC Chemistry 5.0热力学分析软件研究不同气氛和温度条件对华南含砷铁矿石中砷平衡组成及脱砷率的影响,并结合实验进行验证。结果表明:在惰性气氛中,增加Ar及初始As含量能降低体系的O2分压、提高脱砷率;在还原性气氛中,铁矿石脱砷体系气氛需要适宜的CO含量。当CO含量较高时,O2及CO2能削弱体系的强还原性气氛,促进脱砷;当CO含量较低时,O2的存在不利于脱砷,但CO2的影响微弱。不论在何种气氛中,提高温度均有利于脱砷,实验结果与热力学分析结果基本吻合。在氧化性气氛或强还原性气氛中,由于受动力学条件的限制,仍能获得一定的脱砷率。
关键词:
中图分类号:TF511 文献标志码:A
Thermodynamics of arsenic removal from arsenic-bearing iron ores
ZHANG Shu-hui, L? Qing, HU Xiao
(College of Metallurgy and Energy, Hebei United University, Tangshan 063009, China
Abstract: The effects of different atmosphere and temperature conditions on the equilibrium species and arsenic removal about arsenic-bearing ores from South of China were investigated by HSC Chemistry 5.0 thermodynamic analysis software. And some experiments were made to verify the thermodynamic analysis data. The results show that the increase of Ar and initial As content can improve arsenic removal due to the decrease of the partial pressure of O2. In the reducing atmosphere, arsenic removal requires an appropriate CO concentration of the system. When the CO concentration is high in the system, O2 and CO2 promote the arsenic removal by slaking down the strong reducing atmosphere. When the CO concentration is low, O2 has a negative effect on the arsenic removal but the effect of CO2 is feeble. A rise of temperature enhances the arsenic removal in any atmosphere. The experiment results are in good agreement with those of the thermodynamic analysis. But in the oxidizing or strong reducing atmosphere an appropriate arsenic removal can be obtained due to dynamic limit.
Key words: arsenic-bearing iron ores; arsenic removal; thermodynamic analysis
随着钢铁工业的迅速发展,我国铁矿石资源日趋紧张,一些复杂铁矿资源正在被大力开发利用[1]。我国储藏了大量的含砷铁矿,目前已探明的储量达18.8亿t[2]。但砷作为钢材中的有害元素,对钢材性能可造成一系列不良影响。近年来,研究人员采用焙烧和烧结等工艺对矿石预处理脱砷进行了研究[3-6]。其中,气化脱砷具有成本低廉、处理规模大及工艺简单等特点,是开发利用含砷铁矿资源的有效途径[7]。
然而,铁矿石的砷含量均较低,给实验研究带来了较大困难。热力学分析是研究矿石脱砷工艺的重要手段之一,前人在该方面已进行了大量研究。例如,CHARCRABORTI和LYNCH[4, 8]研究了Fe-As-S-O体系的平衡组成;NAKAZAWA等[6]研究了含砷铜矿石脱砷的热力学;CONTRERAS等[9]、KARIN等[10]及D?AZ-SOMOANO和MART?NEZ-TARAZONA[11]研究了砷在烟气中的分布规律;WU和BARTON[12]研究了金属氧化物对砷的吸附作用。本文作者通过热力学计算分析不同气氛和温度条件对华南含砷铁矿石中砷平衡组成及脱砷率的影响,并通过实验进行验证,为获得适宜的铁矿石脱砷工艺参数提供理论依据。
1 气化脱砷的热力学基础
吕庆等[3]指出,华南含砷铁矿石中砷主要以FeAsS形式存在。根据已有的热力学数据可知,FeAsS在220 ℃下可发生如下离解反应:
![]() (1)
(1)
在弱氧化性气氛中,As2(g)可被氧化为AsO气体,如式(2)所示:
![]() (2)
(2)
但是,若O2分压p(O2)过高及CaO、Al2O3、MgO和Fe2O3存在,砷容易被氧化为固态砷酸盐,如式(3)~(8)所示:
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
![]() (8)
(8)
在还原性气氛中,部分As2(g)经过反应(9)形成AsS气体。但若还原性气氛过强,砷容易形成固态砷化铁,如式(10)~(11)所示:
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
由此可知,气化脱砷需严格控制体系的气氛,p(O2)、p(CO)过高或过低均不利于脱砷。图1所示为采用文献[13-14]中的热力学数据绘制的Fe-As-O和Ca-As-O系及Mg-As-O和Al-As-O系叠加的优势区图。 对于Fe-Ca-As-O系(见图1(a)),在低温及较高p(O2)条件下,FeAsO4、Fe3(AsO4)2及Ca(AsO2)2为稳定相;随着温度的升高,Fe3(AsO4)2和Ca3(AsO4)2分别分解为Fe3O4及CaO。其中,高温下砷酸铁较砷酸钙更容易分解。若p(O2)过低,砷以固态FeAs及FeAs2形式存在,升高温度或提高p(O2)均能降低砷化铁的稳定性。图1(b)表明,Mg-Al-As-O系与Fe-Ca-As-O系的性质较为接近,提高温度或降低p(O2)均有利于砷酸盐的分解,但需防止AlAs的生成。图2所示为反应(3)~(8)在不同温度下对应的平衡氧分压,假设含砷铁矿石中的砷全部形成AsO气体,气体总含量为1 kmol,即lg[p(AsO)/pΘ]= -3.425(pΘ为标准态压力)。由图2可知,随着温度的升高,砷酸盐的稳定性降低,平衡氧分压升高。其中,600~1 200 ℃时,Ca(AsO2)2及Mg(AsO2)2的稳定性最高。但随着温度的升高,二者的分解趋势加大。1 200 ℃以上时,反应(4)及(8)的平衡氧分压最低,即Ca3(AsO4)2及AlAsO4的稳定性最高。其中,FeAsO4在温度为600~1 400 ℃时的稳定性最差。为防止脱砷过程固态砷酸盐的生成,体系的氧分压须低于反应(3)~(8)的最低平衡氧分压。
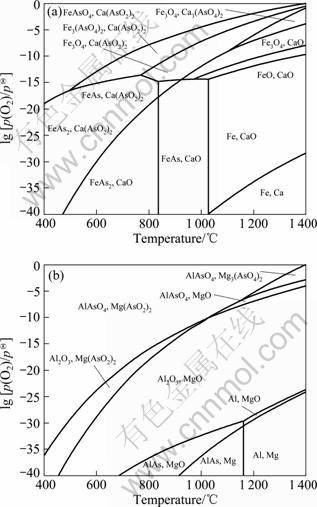
图1 lg[p(As)/pΘ]=-7时Fe-As-O和Ca-As-O系及Mg-As-O和Al-As-O系叠加的优势区图
Fig.1 Overlapped predominance area phase diagrams of Fe-As-O, Ca-As-O (a) and Mg-As-O, Al-As-O (b) systems at lg[p(As)/pΘ]=-7
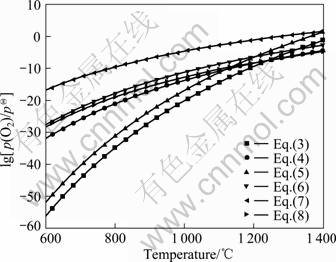
图2 在温度为600~1 400 ℃、lg[p(AsO)/pΘ]=-3.425条件下反应(3)~(8)的平衡氧分压
Fig.2 Equilibrium oxygen partial pressure of Eqs.(3)-(8) at 600-1 400 ℃ and lg[p(AsO)/pΘ]=-3.425
由上述分析可知,升高温度有利于脱砷,但气氛对脱砷的影响较为复杂。由于热力学参数状态图并未考虑各个元素间的相互作用关系,很难确定含砷铁矿石的最佳脱砷气氛。
2 热力学平衡计算原理
采用HSC Chemistry 5.0软件中的Equilibrium compositions组件进行热力学平衡计算[15]。HSC Chemistry是芬兰Outokumpu研究中心针对化学反应平衡计算开发的集成热力学数据库软件,包括15 000多种无机物热力学性质的热力学数据库和多元多相平衡计算软件。其理论基础为体系总吉布斯自由能最小法[16]。
假设体系有ND个独立组元和NU个非独立组元,包括Ni种元素,分布在P个相中,进行了R次反应。在第j相中,独立组元D和非独立组元U的摩尔分数分别为xD, j和xU, j,化学位分别为μD, j和μU, j,则体系的总吉布斯自由能G为
![]() (12)
(12)
根据物料平衡,第e种元素在体系中的总摩尔分数xe应等于各组元中该元素的摩尔分数之和:
![]() (13)
(13)
式中:αD, e和αU, e分别代表独立组元和非独立组元中第e种元素的原子数。在恒温、恒压及物料平衡的前提下,体系平衡的条件为总吉布斯自由能达到最小值(即G=Gmin)。
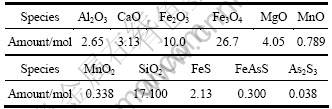
取含砷铁矿石10 kg,其化学成分参见文献[3]。计算初始条件如表1所列,平衡压力为1×105 Pa。为了直观反映不同条件对气化脱砷的影响,引入平衡脱砷率概念,按下式计算:
×
![]() (14)
(14)
式中:R(As)代表平衡脱砷率(摩尔分数,%),Ninit(As)代表矿石的初始As含量(kmol);Ni(As)代表平衡状态下气态砷化物i的摩尔数;ai代表砷化物i中的砷原 子数。
表1 平衡计算初始条件
Table 1 Initial condition for equilibrium analysis
3 计算结果及分析
图3所示为含砷铁矿石在1 kmol Ar气氛及温度为400~1 200 ℃时砷化物的平衡组成。由图3可知,当温度低于800 ℃时,砷主要以Mg(AsO2)2形式存在;600 ℃以上时,AlAsO4逐渐取代Mg(AsO2)2成为平衡产物;气态AsO(g)的生成量极少,1 100~1 200 ℃时其含量仅1%左右。而计算表明,在组成为0.1 kmol O2及0.9 kmol Ar的混合气氛下,砷在温度为400~1 200 ℃时均以固态砷酸盐形式存在,这与CHARCRABORTI和LYNCH[4]得到的结论并不一致,该作者认为毒砂(FeAsS)在氧化性气氛下将以氧化砷形式气化。与惰性气氛的情况相比,毒砂在弱氧化性气氛(p(O2)/pΘ=0.1)下可获得更高的脱砷率。NAKAZAWA等[6]对含砷铜矿石(砷含量为5.3%,质量分数)脱砷的热力学进行模拟,结果亦表明,当p(O2)/pΘ小于0.55时,增加O2能促进脱砷。而姜涛 等[5]对含砷铁矿石(砷含量为0.344%,质量分数)的脱砷进行了研究,结果表明,当氧含量4%~9%(质量分数)时,脱砷率随体系O2的增加而降低。由此可知,矿石中初始As含量对气化脱砷有重要影响。
通过计算得到Ar及初始As含量对脱砷率的影响,结果如图4所示。由图4可知,800 ℃以上,含砷铁矿石的脱砷率随着Ar及初始As含量的增加而升高。其中,初始As含量对脱砷率的影响较大,而Ar含量的影响较小。图5所示为图4对应条件下体系的氧分压。由图5可知,在相同温度下,随着铁矿石中初始As含量的增加,体系的氧分压明显降低;而Ar含量对体系氧分压的影响很小。由此可得出,含砷铁矿石初始As含量较低,O2容易将AsO(g)氧化为砷酸盐形式,不利于脱砷,如式(3)~(8)所示。
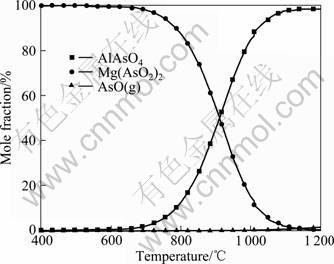
图3 1 kmol Ar气氛、温度为400~1 200 ℃时砷化物的平衡组成
Fig.3 Equilibrium compositions for arsenic in 1 kmol Ar at 400-1 200 ℃
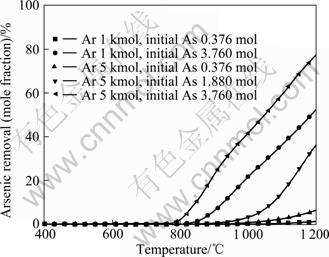
图4 400~1 200 ℃下Ar及初始As含量对含铁矿石脱砷率的影响
Fig.4 Effects of Ar and initial As contents on arsenic removal of arsenic-bearing iron ores at 400-1 200 ℃
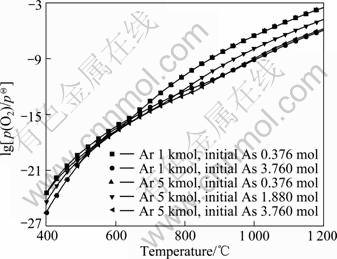
图5 400~1 200 ℃下Ar及初始As含量对体系氧分压的 影响
Fig.5 Effects of Ar and initial As contents on oxygen partial pressure of system at 400-1 200 ℃
图6所示为5 kmol Ar、初始砷含量为3.76 mol及温度为400~1 200 ℃条件下砷化物的平衡组成。由图6可知,其主要脱砷产物为As2(g),其次为AsO(g)及AlAsO4,即此条件下脱砷过程主要依靠反应(1)完成。
图7所示为含砷铁矿石在组成为0.1 kmol CO和0.9 kmol Ar的混合气氛及400~1 200 ℃下砷化物的平衡组成。由图7可知,400~600 ℃时,砷主要以FeAs形式存在,其次为FeAs2及Mg(AsO2)2;600~900 ℃时,Mg(AsO2)2及气态As2(g) 成为主要平衡产物;900~ 1 200 ℃时,砷主要以As2(g)及AsS(g) 形式存在,Mg(AsO2)2含量逐渐降低至消失,AsO(g)含量略微增加。
图8所示为含砷铁矿石在温度为1 100 ℃、CO及Ar混合气体总含量为1 kmol 的条件下,CO含量对砷化物平衡组成的影响。当CO含量低于3%时,砷主要以AlAsO4形式存在,同时伴随少量Mg(AsO2)2及气态AsO(g);随着CO含量的增加,AlAsO4及AsO(g)逐渐被还原成As2(g)和AsS(g)。当CO含量为5%~17%时,随着CO含量的增加,体系中As2(g)的含量逐渐增加,而AsS(g)的含量逐渐降低。当CO含量超过17%时,过强的还原性气氛将气态砷还原成FeAs形式。
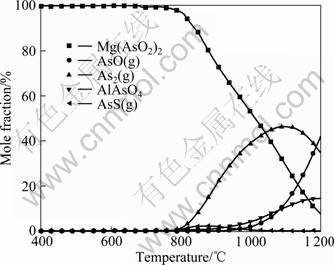
图6 5 kmol Ar、初始As含量3.76 mol及400~1 200 ℃条件下砷化物的平衡组成
Fig.6 Equilibrium compositions for arsenic in conditions of 5 kmol Ar, 3.76 mol As and 400-1 200 ℃
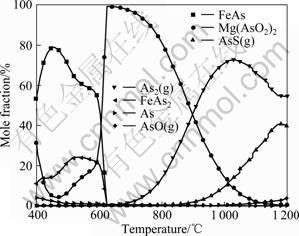
图7 0.9 kmol Ar、0.1 kmol CO及400~1 200 ℃条件下砷化物的平衡组成
Fig.7 Equilibrium compositions of arsenic in conditions of 0.9 kmol Ar, 0.1 kmol CO and 400-1 200 ℃
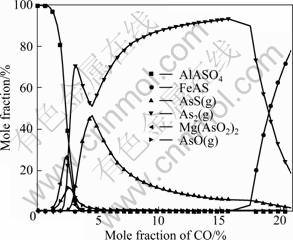
图8 1 100 ℃和不同CO含量下砷化物的平衡组成
Fig.8 Equilibrium compositions of arsenic in conditions of different CO concentrations and 1 100 ℃
含砷铁矿石在900~1 200 ℃及不同CO含量下的脱砷率如图9所示。当CO含量超过2%时,随着CO含量的增加,脱砷率均迅速上升;当CO含量为3%~5%时,获得最大脱砷率。继续增加CO,脱砷率首先在一定范围内保持不变,随后迅速下降。在相同CO含量条件下,提高温度有利于脱砷。对于图9左侧区域,CO含量较低,还原性气氛较弱,砷以固态Mg(AsO2)2及AlAsO4形式存在,提高温度有利于固态砷酸盐的分解(见图1和2)。对于图9右侧区域,CO含量较高,还原性气氛较强,砷主要以固态FeAs形式存在(见图6)。提高温度一方面能降低砷化铁的稳定性,同时也能提高体系的氧分压,抑制强还原性气氛,有利于脱砷(见图1(a)和图5)。
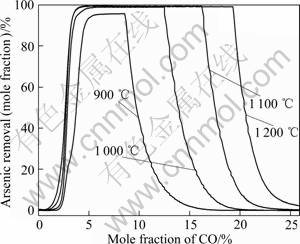
图9 900~1 200 ℃时不同组成CO-Ar混合气氛对含砷铁矿石脱砷率的影响
Fig.9 Effect of CO-Ar mixed atmosphere on arsenic removal of arsenic-bearing iron ores at 900-1 200 ℃
含砷铁矿石在1 100 ℃、O2-CO-Ar混合气氛下的脱砷率如图10(a)所示。与CO-Ar混合气氛下的脱砷规律类似,随着CO含量的增加,脱砷率迅速上升至最大值,随后保持稳定;继续增加CO含量,脱砷率逐渐降低至0。当CO含量较低及相同CO含量下,脱砷率随着O2的增加而降低;而当CO含量较高时,砷以FeAs形式存在。O2能削弱体系的还原性气氛,将FeAs氧化为AsO(g)及As2(g),分别如式(2)和(15)所示。
![]() (15)
(15)
当CO含量较高及相同CO含量下,脱砷率随着O2的增加而增加。因此,获得最大脱砷率需适宜的O2与CO含量范围。由图10(a)可知,二者呈较好的线性关系,CO含量(摩尔分数)为:0.051+2.638x(O2)<x(CO)<0.171+9.673 x(O2)。其中,x(O2)表示体系中O2的摩尔分数。
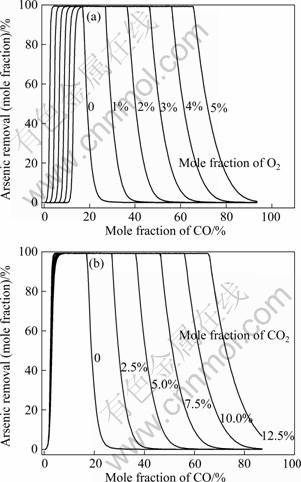
图10 1 100 ℃及不同组成的O2-CO-Ar及CO2-CO-Ar混合气氛对含砷铁矿石脱砷率的影响
Fig.10 Effects of O2-CO-Ar(a) and CO2-CO-Ar(b) mixed atmosphere on arsenic removal of arsenic-bearing iron ores at 1 100 ℃
图10(b)表明,CO2-CO-Ar气氛下的脱砷规律与O2-CO-Ar气氛存在一定差异。由于CO2的氧化能力较弱,当CO含量较低时,CO2几乎不阻碍脱砷;而当CO含量较高时,CO2与O2可起到相同的作用,促进脱砷。CO2-CO-Ar气氛件下获得最大脱砷率的CO含量(摩尔分数)为:0.072<x(CO)<0.171+3.914 x(CO2)。其中,x(CO2)表示体系中CO2的摩尔分数。
4 实验验证
为验证热力学分析方法的可靠性,对含砷铁矿石进行脱砷试验。试验方法参见文献[3],其中,所用CO和Ar均为标准气体(纯度>99.9%)。以Ar充当平衡气体,混合气体总流量保持200 L/h,恒温时间15 min,试验在1.013×105 Pa下进行。由于全铁(FeT)含量在高温焙烧过程中不因挥发而损耗,因此,根据反应前、后试样中FeT及As的含量,按式(16)计算脱砷率:
×
![]() (16)
(16)
式中:η(As)为脱砷率(%);w(FeT)b和w(FeT)a分别代表反应前、后试样的全铁含量(质量分数,%);w(As)b和w(As)a分别代表反应前、后试样的砷含量(质量分数,%)。
图11所示为含砷铁矿石在600~1 200 ℃、不同CO及O2含量下的脱砷率。前面的热力学分析表明,氧化性气氛下砷主要以砷酸盐形式存在,不利于脱砷。但实验研究表明,含砷铁矿石在氧化性气氛下仍可获得一定的脱砷率。这是因为,砷在铁矿石中的脱出过程主要经历了气化(反应(1))、氧化(反应(2))和固化(反应(3)~(8)) 3个阶段。气化反应(1)在220 ℃以上即发生,高温下砷的挥发速率明显加快,同时,少量O2的存在还能促进砷的气化。与反应(1)相比,固砷反应(3)~(8)的速率较慢。由于反应后试样的砷含量较低以及铁矿石中杂质元素干扰等因素,用实验很难准确测定未反应FeAsS与生成砷酸盐的含量,为此,无法对反应(1)~(8)进行动力学研究。LI等[17]及STERLING和HELBLE[18]指出,反应(3)受温度的影响较大,砷酸钙在高温下的生成速率较快。这也解释了600~750 ℃时,气氛对脱砷率的影响较小,而750~1 000 ℃和不同气氛下脱砷率差异明显,O2对脱砷表现出明显的抑制作用。当温度超过1 050 ℃时,高温下砷酸盐的分解趋势较大,氧化性气氛不再阻碍脱砷;当温度为1 150~ 1 200 ℃,脱砷率出现不同程度的下降。高温下铁矿石出现收缩变形,同时伴随低共熔液相的生成,不利于气态砷的扩散及挥发,反应的动力学条件变差,因此,脱砷率下降。
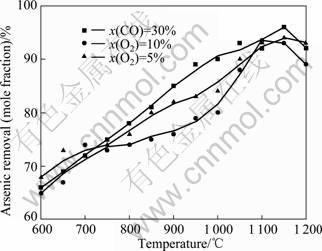
图11 400~1 200 ℃及CO和O2含量对含砷铁矿石脱砷率的影响
Fig.11 Effect of mole fractions of CO and O2 on arsenic removal of arsenic-bearing iron ores at 400-1 200 ℃
由于900 ℃下气氛对脱砷率的影响最大,因此,在该温度下研究了不同组成的还原性气氛对脱砷率的影响,结果如图12所示。对于CO-Ar气氛,当CO含量由0增加至10%,脱砷率迅速上升;当CO含量为10%~40%,脱砷率略微增加;继续增加CO含量,脱砷率逐渐降低。热力学分析表明,As2(g)及AsS(g)仅稳定存在于弱还原性气氛中,否则将发生反应(10)和(11),形成固态砷化铁。但由于动力学条件的限制,实验中仅少量的砷被还原为FeAs,随着CO含量的增加,脱砷率缓慢降低。对于CO2-CO-Ar及O2-CO-Ar气氛,实验结果与热力学分析吻合较好。
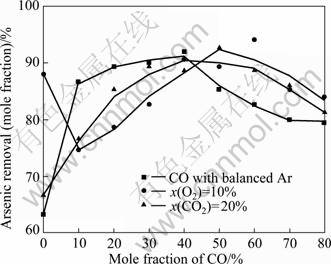
图12 900 ℃下不同组成还原性气氛对含砷铁矿石脱砷率影响
Fig.12 Effect of reduction atmosphere on arsenic removal of arsenic-bearing iron ores at 900 ℃
5 结论
1) 运用HSC Chemistry 5.0软件研究了含砷铁矿石在不同条件下的平衡组成。惰性气氛下,砷主要以AlAsO4及Mg(AsO2)2形式存在;还原性气氛下,温度及CO含量对平衡组成均有影响。当CO含为量0.1 kmol时,随着温度升高,主要平衡产物含量由高到低的顺序为FeAs、Mg(AsO2)2、As2(g)和AsS(g)。1 100 ℃下,随着CO含量的增加,主要平衡产物含量由高到低的顺序为AlAsO4、As2(g)和FeAs。
2) 热力学分析表明,O2不利于脱砷。惰性气氛下,增加Ar及初始As含量能降低体系的氧分压,促进脱砷。还原性气氛下,脱砷需适宜的CO含量。当CO含量较高时,砷被还原成固态FeAs形式,O2及CO2能削弱体系的强还原性气氛,促进脱砷;当CO含量较低时,O2的存在不利于脱砷,但CO2不构成影响。升高温度既有利于砷酸盐的分解,同时能抑制砷化铁的生成,有利于脱砷。
3) 含砷铁矿石在氧化性气氛下仍可获得一定的脱砷率。这是由于砷的气化反应速率较快、而固砷反应速率较慢造成的,但O2在脱砷过程中仍表现出抑制作用。还原性气氛下的脱砷规律与热力学分析结果基本吻合。但由于动力学条件的限制,强还原性气氛下,气态砷并不能被全部还原为砷化铁,随着CO含量的增加,脱砷率缓慢降低。
REFERENCES
[1] 张泾生. 我国铁矿资源开发利用现状及发展趋势[J]. 钢铁, 2007, 42(2): 1-6.
ZHANG Jing-sheng. Status and trend of exploitation and utilization of iron ore resources in China [J]. Iron & Steel, 2007, 42(2): 1-6.
[2] 姚培慧. 中国铁矿志[M]. 北京: 冶金工业出版社, 1993, 35.
YAO Pei-hui. Records of China’s iron ores [M]. Beijing: Metallurgical Industry Press, 1993: 35.
[3] 吕 庆, 张淑会, 胡 晓. 含砷铁矿石烧结过程脱砷的实验研究[J]. 钢铁, 2010, 45(6): 7-11.
L? Qing, ZHANG Shu-hui, HU Xiao. Experimental study on removal arsenic in iron ore with arsenic sintering process [J]. Iron & Steel, 2010, 45(6): 7-11.
[4] CHARCRABORTI N, LYNCH D C. Thermodynamics of roasting arsenopyrite[J]. Metallurgical and Materials Transactions B, 1982, 14(2): 239-251.
[5] 姜 涛, 黄艳芳, 张元波, 韩桂洪, 李光辉, 郭宇峰. 含砷铁精矿球团预氧化-弱还原焙烧过程中砷的挥发行为[J]. 中南大学学报: 自然科学版, 2010, 41(1): 1-7.
JIANG Tao, HUANG Yan-fang, ZHANG Yuan-bo, HAN Gui-hong, LI Guang-hui, GUO Yu-feng. Behavior of arsenic in arsenic-bearing iron concentrate pellets by preoxidizing-weak reduction roasting process [J]. Journal of Central South University: Science and Technology, 2010, 41(1): 1-7.
[6] NAKAZAWA S, YAZAWA A, JORGENSEN F R A. Simulation of the removal of arsenic during the roasting of copper concentrate[J]. Metallurgical and Materials Transactions B, 1999, 30(3): 393-401.
[7] 胡 晓, 吕 庆, 张淑会. 含砷铁矿石脱砷研究现状[J]. 钢铁研究, 2010, 38(4): 47-51.
HU Xiao, L? Qing, ZHANG Shu-hui. A review on arsenic removal from arsenic-bearing iron ores[J]. Research on Iron and Steel, 2010, 38(4): 47-51.
[8] CHARCRABORTI N, LYNCH D C. Thermodynamic analysis of the As-S-O vapor system[J]. Canadian Metallurgical Quarterly, 1985, 24(1): 39-45.
[9] CONTRERAS M L, AROSTEGUI J M, ARMESTO L. Arsenic interactions during co-combustion processes based on thermodynamic equilibrium calculations[J]. Fuel, 2009, 88(3): 539-546.
[10] KARIN L, ANDERS N, RAINER B. Trace element speciation in combustion processes—Review and compilations of thermodynamic data[J]. Fuel Processing Technology, 2007, 88(11): 1061-1070.
[11] D?AZ-SOMOANO M, MART?NEZ-TARAZONA M R. Trace element evaporation during coal gasification based on a thermodynamic equilibrium calculation approach[J]. Fuel, 2003, 82(2): 137-145.
[12] WU C Y, BARTON T. A thermodynamic equilibrium analysis to determine the potential sorbent materials for the control of arsenic emissions from combustion sources[J]. Environmental Engineering Science, 2001, 18(3): 177-190.
[13] BARIN I. Thermodynamic data of pure substances[M]. New York: VCH, 1995: 19, 418, 677, 994.
[14] GONZALEZ-ALVAREZ D, GR?NVOLD F, FALK B, WESTRUM E, BLACHNIK R, KUDERMANN G. FeAs: Heat capacity, enthalpy increments,other thermodynamic properties from 5 to 1350 K, and magnetic transition[J]. The Journal of Chemical Thermodynamics, 1989, 21(4): 363-373.
[15] ROINE A. User’s guide. Outokumpu HSC chemistry for windows-chemical reaction equilibrium software with extensive thermodynamic data base[M]. Pori: Outokumpu Research OY, 2002: 1-39.
[16] 周 勇, 李正邦. V2O5直接合金化的热力学分析[J]. 钢铁钒钛, 2006, 27(4): 38-42.
ZHOU Yong, LI Zheng-bang. Thermodynamic analysis on direct alloying of V2O5[J]. Iron Steel Vanadium Titanium, 2006, 27(4): 38-42.)
[17] LI Yu-zhong, TONG Hui-ling, ZHUO Yu-qun, LI Yan, XU Xu-chang. Simultaneous removal of SO2 and trace As2O3 from flue gas:Mechanism kinetics study and effect of main gases on arsenic capture[J]. Environmental Science and Technology, 2007, 41(8): 2894-2900.
[18] STERLING R O, HELBLE J J. Reaction of arsenic vapor species with fly ash compounds kinetics and speciation of the reaction with calcium silicates[J]. Chemosphere, 2003, 51(10): 1111-1119.
(编辑 陈卫萍)
基金项目:国家自然科学基金资助项目(50774028)
收稿日期:2010-08-09;修订日期:2010-11-20
通信作者:张淑会,副教授,博士;电话:0315-2592155;E-mail: zhang_shts@163.com


