DOI:10.19476/j.ysxb.1004.0609.2019.03.19
Al-Ga-Mg-Sn多元铝合金的水解产氢行为
张建斌,刘志冬,姚冰楠,魏 梅,李庆林
(兰州理工大学 省部共建有色金属先进加工与再利用国家重点实验室,兰州 730050)
摘 要:
采用坩埚电阻炉熔炼制备了6种不同成分的Al-Ga-Mg-Sn多元铝合金。利用光学显微镜(OM)、扫描电镜(SEM)、X射线衍射仪(XRD)和产氢性能测试装置等系统研究了多元铝合金铸态下的显微组织和相组成、水解反应产物的相组成以及在30、50、70和90 ℃纯水中的产氢速率和产氢量。结果表明:Al-Ga-Mg-Sn多元铝合金铸态组织由铝基体相、Mg2Sn和Ga2Mg相组成,水解反应产物主要为AlO(OH)等;同一成分试样,产氢速率和产氢量均随温度的升高而增加;不同成分试样在同一温度下,产氢速率和产氢量与低熔点元素Ga含量和合金相中铝基体相/第二相的比例有关;产氢的起始温度主要由低熔点元素Ga+Sn含量决定。进一步分析发现:水解产氢行为发生后,产氢速率k与热力学温度T服从阿伦尼乌斯公式,即ln k与1/T呈线性规律。
关键词:
文章编号:1004-0609(2019)-03-0598-08 中图分类号:TG146.2 文献标志码:A
石油、煤炭等化石燃料作为当今世界的主要能源,具有不可再生和环境破坏严重等缺点,威胁着人类的生存和发展[1]。中国目前是世界上化石燃料消耗最多的国家[2]。要从根本上解决我国环境污染与能源危机问题,就必须开发新能源。氢能以其燃烧热值高、产物为水和用途广等优点成为研究焦点,未来氢能将取代化石燃料成为全球能源[3-6]。现阶段,制氢方法主要有化石燃料制氢、分解水制氢、生物质制氢和铝基、镁基、硼氢化物水解制氢[7]。铝是地壳中含量最多的金属元素,它具有高活泼性、低成本、低密度、高能量密度的优点,同时铝基材料水解制氢与其他制氢技术相比较,具有低环境温度、短诱导时间、快产氢速率、高转化率、轻便环保等优点[8-9]。因此,依靠铝水反应原理的铝基水解制氢是众多制氢方法中最具发展潜力的一种氢能开发利用方法之一。
金属铝性质活泼,但是它具有很强的亲氧性,在与水反应时表面会形成致密的惰性氧化膜,阻止反应的持续进行[8]。PARMUZINA等[10]发现在铝中添加低熔点金属(Li、Sn、Ga、In等)可以提高铝的活泼性,可以使铝与水持续反应。HU等[11]在井式炉中熔炼制得一类Al-Sn合金,Sn含量为27%时,该合金在室温下最大产氢速率可达2.3 mL/(min·g)和最大产氢量可达700 mL/g。FAN等[12]采用机械球磨法制得一类Al-Li粉末合金,该合金在室温下的最大产氢速率可达233 mL/(min·g)和最大产氢量可达743 mL/g。于嘉等[13]通过熔炼法制备了一类Al-In-Mg合金,用机械方法把合金破碎成金属粉末,在常温下测得最大产氢速率为200 mL/(min·g)和最大产氢量为29 mL/g。HE等[14]采用电弧熔炼制备了一类Al-Ga-In-Sn合金,在40 ℃的纯水中的最大产氢速率为12.3 mL/(min·g)和最大产氢量为989 mL/g,在75 ℃纯水中的最大产氢速率为600 mL/(min·g)和最大产氢量为1200 mL/g。WANG等[15]通过机械球磨法制备了一类Al-Ga-In-Sn合金,在室温下该合金在水中的最大产氢量可达840 mL/g。HUANG等[16]制备的Al-In-Ga-Sn-Bi五元合金在常温就可以与纯水反应,最大产氢速率可达15.6 mL/(min·g)和最大产氢量可达500 mL/g。实现高纯度氢的低成本、高效率生产,是氢能源大规模工业化应用的关键。
本文采用电阻炉熔炼制备出了一种低温产氢、速率可控、高产氢量的铝合金,研究该类铝合金在不同温度下的产氢行为及其微观组织结构,为铝基水解制氢材料的产业化生产和实际应用提供依据。
1 实验
实验所使用的原材料纯度为99.70% Al锭、99.93% Mg锭、99.90% Sn锭和99.99% Ga锭。本实验通过金属熔炼法制备6种不同成分配比的Al-Ga-Mg-Sn铝合金材料(试样编号为H1、H2、H3、H4、H5和H6)。将按比例称好的纯铝置于石墨坩埚中,在温度设为720~780 ℃的节能坩埚电阻炉(型号SG2-7.5-10)中熔化,然后把称量好的镁块拿钟罩压入到铝液中,待其熔化后,依次加入Sn、Ga金属,静置20 min,充分搅拌,等到合金熔体温度降到630~680 ℃时浇铸进预热过的金属模具中,模具尺寸为d 16 mm×100 mm。
铸态试样经粗磨和精磨后,用氧化铝悬浮液(型号:AO-P)抛光。采用4XC型光学显微镜观察组织,利用扫描电镜(JSM-6700 F型)和配套的EDS进行成分分析,并配以图像分析软件(Image J)对合金中组织进行定量分析。在X射线衍射仪分析(XRD,D/max-2200PC,Cu Kα (40 kV and 20 mA))进行合金和水解产物的物相确定,扫描角度20°~ 90°,扫描速率2 (°)/min。
图1所示为产氢性能测试装置示意图。把一个容积300 mL的烧瓶加满纯水置于电子恒温不锈钢水浴锅(HH2-4S,恒温精确度±0.5 ℃)中,待烧瓶中的水温达到所需温度时,取0.3000 g的试样放入烧瓶中,反应所产生的氢气经过干燥器把集气瓶中的水排入到烧杯中,用电子天平(CP214,实际分度值0.0001 g,工作温度10~30 ℃),分别测得6种试样在30、50、70和90 ℃排出水的质量,然后由公式(1)计算出产生氢气的体积,每种试样在每个温度下分别测量3组数值,取平均值。由公式(2)计算出试样在不同水温中的制氢转化率。
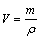 (1)
(1)
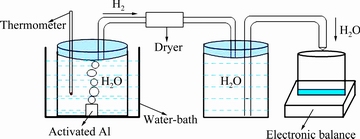
图1 产氢性能测试装置示意图
Fig. 1 Schematic diagram for hydrogen generation performance test device
式中:V为产生氢气的体积;m为排出水的质量;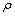 为水的密度。
为水的密度。
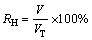 (2)
(2)
式中:RH为制氢转化率;V为实际生产氢气体积;VT为理论计算产氢体积。
2 结果与讨论
2.1 XRD相分析
图2所示为6种不同成分铝合金铸态的XRD谱。由图2可见,6种合金均有Al固溶体和Mg2Sn相,配料中Ga含量(质量分数)大于等于8%时,会出现Ga2Mg相。从Al-Ga二元共晶相图[17]可知,Ga在Al中的固溶度约为9%,因此在Ga加入量为4%、6%和8%时不能形成Al、Ga化合物。从Mg-Sn二元相图[17]可知,在778℃时Mg与Sn可形成Mg2Sn相。从Ga-Mg二元相图[17]可知,Ga和Mg能形成Mg5Ga2、Mg2Ga5、MgGa和Ga2Mg一系列化合物。少量Al3Ti是由于添加了晶粒细化剂铝钛硼的原因。从Al-Sn二元相图[17]可知,Sn几乎不溶于Al。
2Al+6H2O→2Al(OH)3↓+3H2↑ (3)
2Al+4H2O→2AlO(OH)↓+3H2↑ (4)
2Al+3H2O→Al2O3↓+3H2↑ (5)
DIGNE等[18]通过了理论计算得出,从室温到280 ℃,铝水反应主要按反应(3)进行,生成Al(OH)3(氢氧化铝);从280 ℃到480 ℃,主要按反应(4)进行,生成AlO(OH)(勃姆石);480 ℃以上,主要按反应(5)进行,生成Al2O3(三氧化二铝)。图3所示为H6在30、50和70 ℃水温中反应产物的XRD谱。从图3可以看出,反应产物主要为AlO(OH),可知本反应虽然是在室温下到90 ℃下进行,但是该铝合金与水反应是按照反应(4)进行的,这是由于铝水反应是放热反应(833.12 kJ/mol)[18],铝水反应在100 ℃下按(4)式反应所需的活化能值为63 kJ/mol[19],该合金中Al与水反应由无数个点接触组成,反应放出的热量能够使各个点的温度达到活化能,使得反应按照式(4)进行。
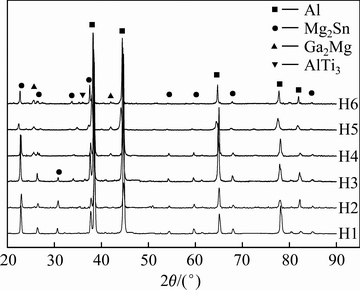
图2 试样的XRD谱
Fig. 2 XRD patterns of samples
2.2 组织分析
由于Ga含量过高时,铸态试样的金相组织图不易获得,因此采用金相显微镜和扫描相结合的方式对铸态试样显微组织进行研究。图4(a)、(b)、(c)所示为铸态试样H1、H2和H3的金相组织图,图4(d)、(e)、(f)所示为铸态试样H4、H5和H6的SEM像。由图表可见,各试样组织均为等轴晶,这是由于加入晶粒细化剂的作用。不同成分试样光学组织均主要由白色基体(Al固溶体)和灰色晶界(Mg2Sn)组成;扫描电子显微组织中晶界相形态更清晰,第二相呈条状、岛状沿晶界分布,在三叉晶界处呈块状分布,有鱼骨状共晶组织且晶粒内有点状物存在。随着Ga含量升高,试样光学组织中可见到团聚状黑色局域,这是由于在试样磨制和抛光过程中,试样温度升高而与水反应生成的水解产物,沉积在样品晶界处,随Ga含量升高铸态试样中晶粒趋于细化。
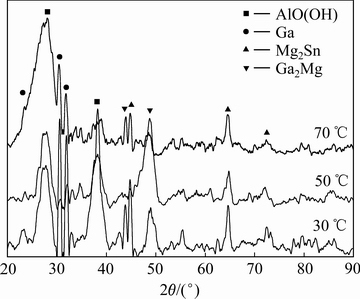
图3 不同渐温度下H6水解产物的XRD谱
Fig. 3 XRD patterns of H6 hydrolyzate at different temperatures

图4 铸态试样的金相组织和SEM像
Fig. 4 OM micrographs and SEM images of as-cast samples
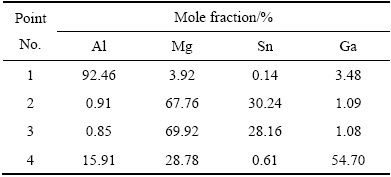
为了进一步分析试样中元素的分布特性和相组成,对图4(e)中方框内物相进行面扫描和EDS分析,其结果分别见图5和表1所示。从图5可看出,有规则多边形块状物、鱼骨状和点状物;Al均匀分布于晶粒,在晶界含量极少,未发现Al的化合物存在,这与图2 XRD衍射结果相一致。Ga、Mg和Sn元素分布不均匀,Mg和Sn存在对应关系,由表1可知,多边形块状物2处与鱼骨状组织3处的Mg与Sn摩尔比均接近2:1,结合XRD结果,确定为Mg2Sn;Mg和Ga也存在对应关系,结合表1可认为有Ga2Mg化合物生成。综上所述,该多元铝合金主要组成相为基体Al固溶体、亮白色多边形块状物及鱼骨状为Mg2Sn和晶界处为Ga2Mg。
2.3 产氢性能分析
产氢速度与产氢量是衡量产氢性能的两个重要指标。表2所列为用图1装置测得6种试样在不同温度下的产氢速率和产氢量。从表2中可以看出,不同试样的起始水解温度有所差异;试样在不同温度下的产氢速率和产氢量不同。H1和H2试样在70 ℃水温开始发生水解反应,H3和H4试样在50 ℃开始发生水解反应,H5和H6试样在30 ℃时就开始发生水解反应,这是由于起始反应温度是由低熔点元素Ga+Sn含量决定,总量越高起始反应温度越低。若水解反应能够开始进行,同一成分试样,产氢速率和产氢量均随温度的升高而增加,这与文献[14]和[16]的研究成果相类似。针对不同试样中的第二相,采集300倍视场的背散射图片,对其中的第二相定量分析得到各试样中的二次相的体积分数如图6所示。从图6可以看出,随着Ga含量的增加,第二相的含量也随之增加,结合表2可以得出随着低熔点元素Ga含量和合金中第二相的增多,试样的产氢速率和产氢量也随之增加。
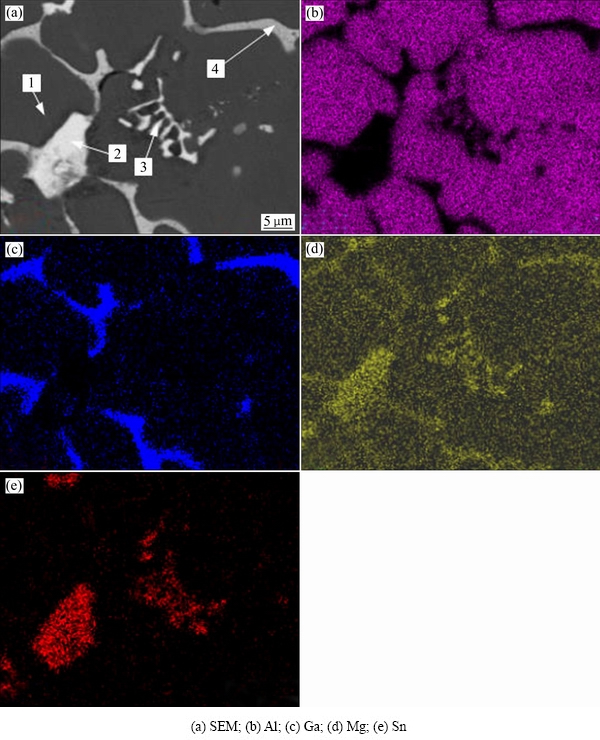
图5 H5 EDS面扫描图
Fig. 5 EDS surface scanning of H5
表1 H5EDS分析结果
Table 1 EDS results of H5 shown in Fig.5
通过公式(2)对试样水解制氢转化率进行计算,得到各试样在不同温度下制氢转化率如图7所示。从图7可以看出,相同温度下,随着Ga含量增加,试样制氢转化率也随之增加;同一试样制氢转化率随着温度升高而增大,如H1试样的制氢转化率在30 ℃和50 ℃时为0,在90 ℃时达到79.8%,而H6试样的在30 ℃时为62.5%,在90 ℃时达到93.6%。
基于产氢性能,结合组织和物相分析可知:低熔点元素的存在提高了铝合金的活性[10],其机理是破坏铝表面氧化膜的完整性。单质Ga影响了铝表面惰性氧化膜的张力,为氢气的逸出提供通道,使氧化膜的连续性和致密性降低,在产氢速率或产氢量达到一定临界值时氧化铝不能完全覆盖住Al表面,裸露出新鲜铝表面,反应可持续进行;反之,低于临界值时,氧化膜完全覆盖住Al表面,阻止后续反应的进行;合金相、化合物等第二相与Al基体间存在电位差,形成微观原电池加速铝合金水解产氢。
图8所示为试样H6在30、50、70和90 ℃下水溶液中产氢量随时间的变化曲线。由图8可以看出,产氢量与时间符合直线规律,初始阶段稍有偏离,反应完成阶段平直。这是由于初始阶段试样表面粗糙度引起的实验误差,结束阶段是由于反应完成,继续延长时间没有氢气产生,而且随着温度的升高,其产氢速率变化非常明显。水温从30 ℃增加到90 ℃,产氢速率提高了将近19.3倍。
由图8中可以看出,随着温度的不断增高,反应速率成倍数增加,而且本反应属于等温、非均相反应动力学范畴,可采用阿伦尼乌斯公式(Arrhenius equation)来描述其反应动力学过程:
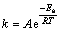 (6)
(6)
式中:k为速率常数;A为频率因子;Ea 因为表观活化能;R为摩尔气体常数;T为热力学温度。
反应速率与温度间关系可由式(6)推导出式(7):
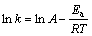 (7)
(7)
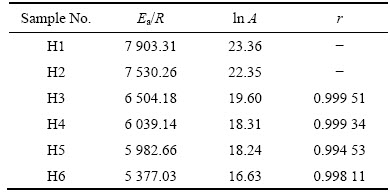
基于式(7),对各试样产氢速率和温度之间做线性拟合,得到图9试样产氢速率与温度之间的关系图,拟合后得到相关参数见表3,其中r为拟合度,拟合度越接近1,拟合程度越高。从图9中可以看出,产氢速率和热力学温度倒数之间呈线性关系。
表2 试样在不同温度下的产氢速率和产氢量
Table 2 Hydrogen generation rate and hydrogen yield of samples at different temperatures
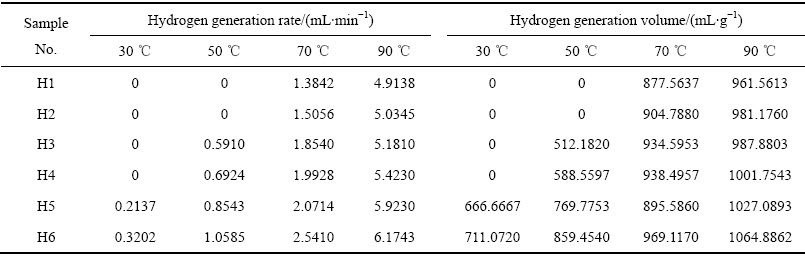
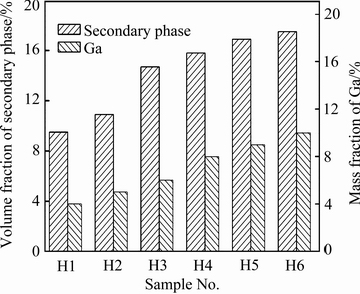
图6 试样中二次相的体积分数
Fig. 6 Secondary phase volume fractions of samples
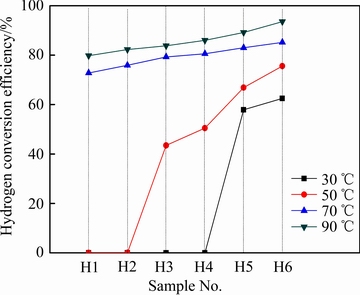
图7 试样在不同温度下的制氢转化率
Fig. 7 Hydrogen conversion efficiencies of samples at different temperatures
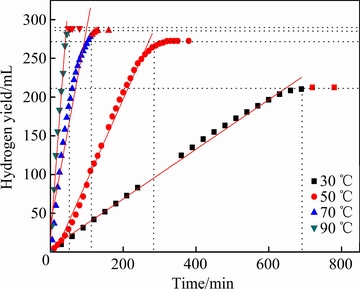
图8 不同温度下H6产氢量
Fig. 8 Hydrogen yields ofH6 at different temperatures
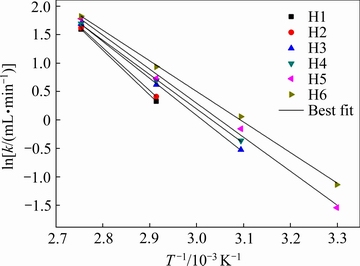
图9各试样产氢速率和温度拟合图
Fig. 9 Hydrogen generation rate and temperature fitting of samples
表3 拟合结果相关参数
Table 3 Fitting results related parameters shown in Fig. 8
3 结论
1) 当Ga的含量小于8%时,铸态Al-Ga-Mg-Sn合金的显微组织由铝基体相和Mg2Sn相组成,水解产物主要为AlO(OH)(勃姆石)和少量的Ga单质、Mg2Sn化合物;当Ga的含量大于等于8%时,合金的显微组织由铝基体相、Mg2Sn和Ga2Mg相组成,水解产物主要为AlO(OH)(勃姆石)和少量的Ga单质、Mg2Sn和Ga2Mg化合物。
2) 该种类铸态合金在30 ℃下的最大产氢量可达711.0720 mL/g,在90 ℃下的最大产氢量可达1064.8862 mL/g。同一成分试样,产氢速率和产氢量均随温度的升高而增大,水温从30 ℃增大到90 ℃,产氢速率提高了将近19.3倍。不同成分试样在同一温度下,Ga的含量越高、金相中二次相铝/基体相的比例越大,产氢速率和产氢量越大。低熔点元素Ga+Sn的含量越大,产氢起始温度越低,当两元素和含量达到15%时,合金在30 ℃开始产氢。
3) 铸态合金的产氢速率k与反应温度服从阿伦尼乌斯公式,即ln k=a/T+b,其中当Ga的含量为10%时,ln k=-5377.03/T+16.63,拟合度r=0.99811。
REFERENCES
[1] ELSARRAG E, ELHOWERIS A, ALHORR Y. The production of hydrogen as an alternative energy carrier from aluminium waste[J]. Energy Sustainability & Society, 2017, 7(1): 9.
[2] 周庆凡. 2015年中国能源生产与消费现状[J]. 石油与天然气地质, 2016(4): 454.
ZHOU Qing-fan. 2015 China’s energy production and consumption status quo[J]. Oil and Gas Geology, 2016(4): 454.
[3] ELITZUR S, ROSENBAND V, GANY A. Study of hydrogen production and storage based on aluminum-water reaction[J]. International Journal of Hydrogen Energy, 2014, 39(12): 6328-6334.
[4] LATTIN W C, UTGIKAR V P. Transition to hydrogen economy, the United States: A 2006 status report[J]. International Journal of Hydrogen Energy, 2007, 32(15): 3230-3237.
[5] 汪广溪. 氢能利用的发展现状及趋势[J]. 低碳世界, 2017(29): 295-296.
WANG Guang-xi. Development and trend of hydrogen energy utilization[J]. Low-carbon world, 2017(29): 295-296.
[6] 陈立新, 范修林, 肖学章, 薛晶文, 李寿权, 葛红卫, 陈长聘. TiC催化剂对铝剂化钠吸放氢行为和微观结构的影响[J]. 中国有色金属学报, 2011, 21 (6): 1297-1302.
CHEN Li-xin, FAN Xiu-lin, XIAO Xue-zhang, XUE Jing-wen, LI Shou-quan, GE Hong-wei, CHEN Chang-pin. Influence of TiC catalyst on absorption/desorption behaviors and microstructures of sodium aluminum hydride[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(6): 1297-1302.
[7] 陈星宇. 铝基材料快速水解制氢的研究[D]. 长沙: 中南大学, 2010.
CHEN Xing-yu. Research of rapid hydrogen generation through Al-based materials hydrolysis[D]. Changsha: Central South University, 2010.
[8] WANG H Z, LEUNG D Y C, LEUNG M K H, Ni M. A review on hydrogen production using aluminum and aluminum alloys[J]. Renewable & Sustainable Energy Reviews, 2009, 13(4): 845-853.
[9] 赵 冲, 徐 芬, 孙立贤, 范明慧, 邹勇进, 褚海亮. 铝基材料水解制氢技术[J]. 化学进展, 2016, 28(12): 1870-1879.
ZHAO Chong,XU Fen,SUN Li-xian,FAN Ming-hui,ZOU Yong-jin, CHU Hai-liang. Hydrogen generation by Al-based materials hydrolysis[J]. Progress in Chemistry, 2016, 28(12): 1870-1879.
[10] PARMUZINA A V, KRAVCHENKO O V. Activation of aluminium metal to evolve hydrogen from water[J]. International Journal of Hydrogen Energy, 2008, 33(12): 3073-3076.
[11] HU X, ZHU G Z, ZHANG Y J, ZHANG Y, WANG Y M, GU M S, YANG S, SONG P X, Li X J, FANG H J, JIANG G S, WANG Z F. Hydrogen generation through rolling using Al-Sn alloy[J]. International Journal of Hydrogen Energy, 2012, 37(15): 11012-11020.
[12] FAN M Q, SUN L X, XU F, MEI D, CHEN D, CHAI W X, HUANG F L, ZHANG Q M. Microstructure of Al–Li alloy and its hydrolysis as portable hydrogen source for proton-exchange membrane fuel cells[J]. International Journal of Hydrogen Energy, 2011, 36(16): 9791-9798.
[13] 于 嘉, 郑邯勇, 赵文忠, 陈支厦. 一种新型铝合金的制备及其水反应性能研究[J]. 舰船科学技术, 2016, 38(5): 124-127.
YU Jia, ZHENG Han-yong, ZHAO Wen-zhong, CHEN Zhi-xia. Synthesis of new Al-based alloys and their reaction with water[J]. Ship Science and Technology, 2016, 38(5): 124-127.
[14] HE T T, WANG W, CHEN W, CHEN D M, YANG K. Influence of In and Sn compositions on the reactivity of Al-Ga-In-Sn alloys with water[J]. International Journal of Hydrogen Energy, 2017, 42(8): 5627-5637.
[15] WANG F Q, WANG H H, WANG J, LU J, LUO P, CHANG Y, MA X G, DONG S J. Effects of low melting point metals(Ga, In, Sn) on hydrolysis properties of aluminum alloys[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(1): 152-159.
[16] HUANG T, GAO Q, LIU D, XU S N, GUO C B, ZOU J J, WEI C D. Preparation of Al-Ga-In-Sn-Bi quinary alloy and its hydrogen production via water splitting[J]. International Journal of Hydrogen Energy, 2015, 40(5): 2354-2362.
[17] MASSALSKI T B, MURRAY J L, BENNETT L H, BAKER H. Binary alloy phase diagrams[M]. Materials Park, Ohio: American Society of Metals, 1990.
[18] DIGNE M, SAUTET P, RAYBAUD P, TOULHOAT H, ARTACHO E. Structure and Stability of Aluminum Hydroxides: A Theoretical Study[J]. J Phys Chem B, 2002, 106(20): 5155-5162.
[19] YAVOR Y, GOROSHIN S, BERGTHORSON J M, FROST D L, STOWE R, RINGUETTE S. Enhanced hydrogen generation from aluminum-water reactions[J]. International Journal of Hydrogen Energy, 2013, 38(35): 14992-15002.
Hydrogen generation by hydrolysis of Al-Ga-Mg-Sn multi-element aluminum alloy
ZHANG Jian-bin, LIU Zhi-dong, YAO Bing-nan, WEI Mei, LI Qing-lin
(State key Laboratory of Advanced Processing and Recycling of Non-ferrous Metals, Lanzhou University of Technology, Lanzhou 730050, China)
Abstract: Six kinds of Al-Ga-Mg-Sn multi-element aluminum alloys with different compositions were prepared by crucible resistance furnace. The microstructure and phase composition of as-cast aluminum alloy, the phase composition of the hydrolyzate, the hydrogen generation rate and hydrogen yield in pure water at 30, 50, 70 and 90 ℃ were investigated by means of optical microscope (OM),scanning electron microscopy (SEM),X-ray diffraction (XRD) and hydrogen generation performance test device. The results indicate that the as-cast Al-Ga-Mg-Sn multi-phase aluminum alloy consists of an aluminum matrix phase, Mg2Sn and Ga2Mg phases and the hydrolyzate is mainly AlO(OH).The hydrogen generation rate and hydrogen yield increase with the increment of temperature for the same composition. At the same temperature, for the samples with different compositions, the content of the low melting point element Ga, the proportion of the aluminum matrix phase and the second phase in the alloy phase depend on the hydrogen generation rate and hydrogen yield. The starting temperature of hydrogen generation is mainly determined by the content of low melting point elements Ga and Sn. Further analysis finds that the hydrogen generation rate k and thermodynamic temperature T obey Arrhenius formula, namely the ln k is linear with 1/T after hydrogen generation by hydrolysis occurring.
Key words: aluminum alloy; hydrolysis; hydrogen generation rate; hydrogen yield; temperature
Received date: 2017-12-18; Accepted date: 2018-04-16
Corresponding author: ZHANG Jian-bin; Tel: +86-13519630320; E-mail: jbzhangjb@qq.com
(编辑 何学锋)
收稿日期:2017-12-18;修订日期:2018-04-16
通信作者:张建斌,副教授,博士;电话:13519630320;E-mail:jbzhangjb@qq.com
摘 要:采用坩埚电阻炉熔炼制备了6种不同成分的Al-Ga-Mg-Sn多元铝合金。利用光学显微镜(OM)、扫描电镜(SEM)、X射线衍射仪(XRD)和产氢性能测试装置等系统研究了多元铝合金铸态下的显微组织和相组成、水解反应产物的相组成以及在30、50、70和90 ℃纯水中的产氢速率和产氢量。结果表明:Al-Ga-Mg-Sn多元铝合金铸态组织由铝基体相、Mg2Sn和Ga2Mg相组成,水解反应产物主要为AlO(OH)等;同一成分试样,产氢速率和产氢量均随温度的升高而增加;不同成分试样在同一温度下,产氢速率和产氢量与低熔点元素Ga含量和合金相中铝基体相/第二相的比例有关;产氢的起始温度主要由低熔点元素Ga+Sn含量决定。进一步分析发现:水解产氢行为发生后,产氢速率k与热力学温度T服从阿伦尼乌斯公式,即ln k与1/T呈线性规律。
[2] 周庆凡. 2015年中国能源生产与消费现状[J]. 石油与天然气地质, 2016(4): 454.
[5] 汪广溪. 氢能利用的发展现状及趋势[J]. 低碳世界, 2017(29): 295-296.
[7] 陈星宇. 铝基材料快速水解制氢的研究[D]. 长沙: 中南大学, 2010.
[9] 赵 冲, 徐 芬, 孙立贤, 范明慧, 邹勇进, 褚海亮. 铝基材料水解制氢技术[J]. 化学进展, 2016, 28(12): 1870-1879.
[13] 于 嘉, 郑邯勇, 赵文忠, 陈支厦. 一种新型铝合金的制备及其水反应性能研究[J]. 舰船科学技术, 2016, 38(5): 124-127.


