中国有色金属学报 2003,(01),255-258 DOI:10.19476/j.ysxb.1004.0609.2003.01.047
CaO-SiO2-Al2O3-MgO-Na2O-CrOx炉渣中铬氧化物间的氧化还原平衡
东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,沈阳市煤气总公司 沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110015
摘 要:
采用化学平衡法研究了 16 73和 1773K下CaO SiO2 Al2 O3 MgO Na2 O CrOx 渣系中铬氧化物间的氧化还原平衡。在实验条件下 ,渣中铬氧化物主要以Cr2 + 形式存在。lg[x(Cr2 + ) /x(Cr3 + ) ]与 -lgp(O2 )呈线性关系 ,斜率在 1/ 4左右 ,与理论分析相符。x(Cr2 + ) /x(Cr3 + )随碱度的增加而减小 ,随氧分压的降低、温度升高和铬氧化物总量的增加而增大
关键词:
中图分类号: TF64
作者简介:陈四红(1976),男,博士研究生;
收稿日期:2002-04-04
基金:国家自然科学基金资助项目 (5 95 740 12 );
Redox equilibrium between chromium oxides in CaO-SiO2-Al2O3-MgO-Na2O-CrOx molten slags
Abstract:
The redox equilibrium between the chromium oxides in CaO-SiO 2-Al 2O 3-MgO-Na 2O-CrO x molten slags was studied by me ans of chemical equilibrium method at 1 673 and 1 773 K.The experimental resu lts show that under the present experimental conditions, the chromium oxides exi st mainly in the form of Cr 2+ in the slags. lg[( x (Cr 2+ )/ x ( Cr 3+ )]is linear with -lg p (O 2) and the slope is around 1/4, which i s corresponding to the theoretical analysis. x (Cr 2+ )/ x (Cr 3+ ) decreases with the increment of basicity of slag and oxygen partial press ure, while increases with the increment of temperature and total content of chro mium oxides.
Keyword:
slag containing chromium; chromium oxides; redox equilibriu m;
Received: 2002-04-04
铬作为过渡族金属元素, 受其原子结构的影响, 其价态可变, 随条件的变化可形成多种化合物
1实验
1.1实验设备
采用二硅化钼高温炉, 结合DWT-703温度控制仪和经校准的PtRh6-PtRh10热电偶控温, 而恒温带采用UT-31a型电位差计结合XMT型数显温度表及PtRh6-PtRh30热电偶测温。 除化渣过程用石墨坩埚, 其它坩埚均由d24 mm钼棒加工而成。
1.2实验方法
由CO-CO2混合气体控制氧分压, 并配入氩气以防止热扩散。 其中通过高纯CO2气瓶获得CO2, 利用甲酸滴入盛有80 ℃浓硫酸的烧瓶中反应生成CO。 实验中所用的气体全部经过净化系统, 采用硅胶、 分子筛和P2O5三级脱水, 通过KOH脱去CO中的CO2, 氩气则经金属镁屑(600 ℃)和海绵钛(900 ℃)二级脱氧。 净化后的CO, CO2和氩气, 分别用经标定校准的毛细管流量计控制流量, 在混合器中混合后, 通入实验炉内。
实验原料CrO3, SiO2, Al2O3, MgO, CaCO3, Na2CO3均为分析纯试剂, CaCO3和Na2CO3在高温下分解生成CaO和Na2O。 按表1给定的成分配制碱度R(m(CaO)/m(SiO2))分别为0.6(1#)和1.0(2#)的母渣, 经混匀、 压块后置于石墨坩埚中, 加热至1 400 ℃并恒温1 h后, 取出冷却, 破碎至74 μm以下制得母渣。 向母渣中添加不同量的CrO3制成实验用渣。
表1 母渣成分表
Table 1 Composition of matrix-slags (%)
No. |
CaO | SiO2 | Al2O3 | MgO | Na2O |
1# |
22.5 | 37.5 | 20.0 | 10.0 | 10.0 |
2# |
30.0 | 30.0 | 20.0 | 10.0 | 10.0 |
称取适量渣放入钼坩埚中, 置于加热炉恒温带处, 密封后程序升温, 同时通入Ar气。 脱氧炉和CO造气炉提前1 h升温, 以确保反应时Ar气的洁净和CO的正常供应。 1 300 ℃后通入经净化的CO, 达设定工作温度时, 通入根据所需氧分压配制的CO-CO2混合气。 反应达平衡后继续充Ar气10 min, 然后开炉取样并将其在N2保护下于水中淬冷。
将渣样磨至89 μm以下, 采用化学物相分析法分析渣中不同价态铬氧化物的质量分数。
1.3平衡实验条件的选取
实验中炉渣碱度分别取0.6和1.0, 炉渣中CrO3含量取5%, 8%, 12%3个水平。 温度选取1 673和1 773K两个值。 为避免钼坩埚的氧化, 经计算后选取了10-11, 10-13和10-15 MPa 3种不同的氧分压
表2 温度与氧分压的对应表
Table2 Oxygen partial pressures at experimental temperatures
p(O2)/MPa |
p(CO)/p(CO2) |
|
1 673 K |
1 773 K | |
10-11 |
4.786 | 14.95 |
10-13 |
47.86 | 149.5 |
10-15 |
478.6 | 1 495 |
选取最不利于氧化还原反应达平衡的实验条件(表3)进行预备实验, 通过分样恒条件法确定反应平衡时间。 试样成分不变时, 反应即达到平衡。 预备实验反应平衡时间为2 h, 为确保完全平衡, 正式实验中反应平衡时间定为3 h。
表3 预备实验条件
Table 3 Conditions for preliminary experiments
Basicity, R |
w(CrO3)/% | T/K | p(O2)/MPa |
1.0 |
5 | 1 673 | 10-11 |
2分析与讨论
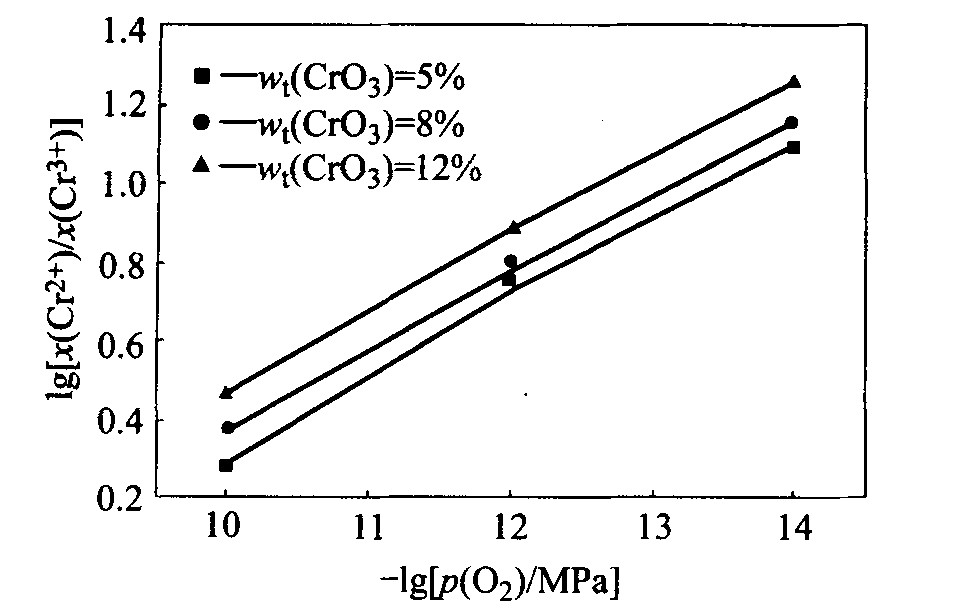
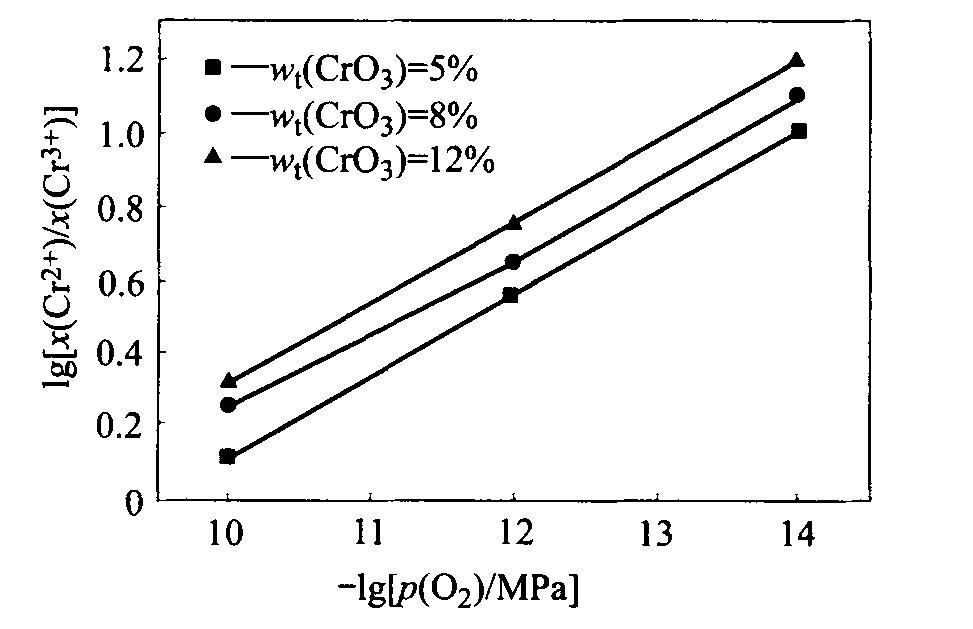
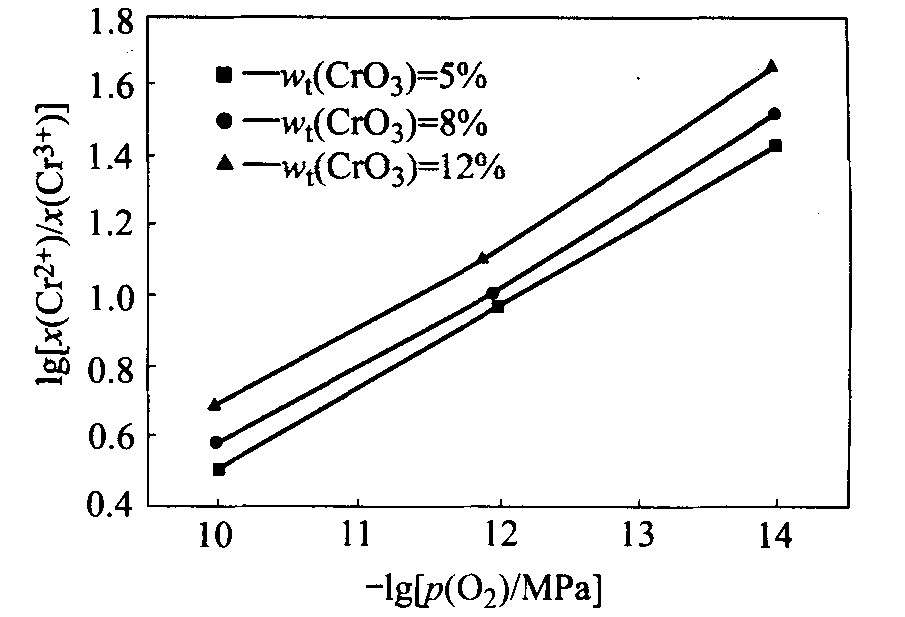
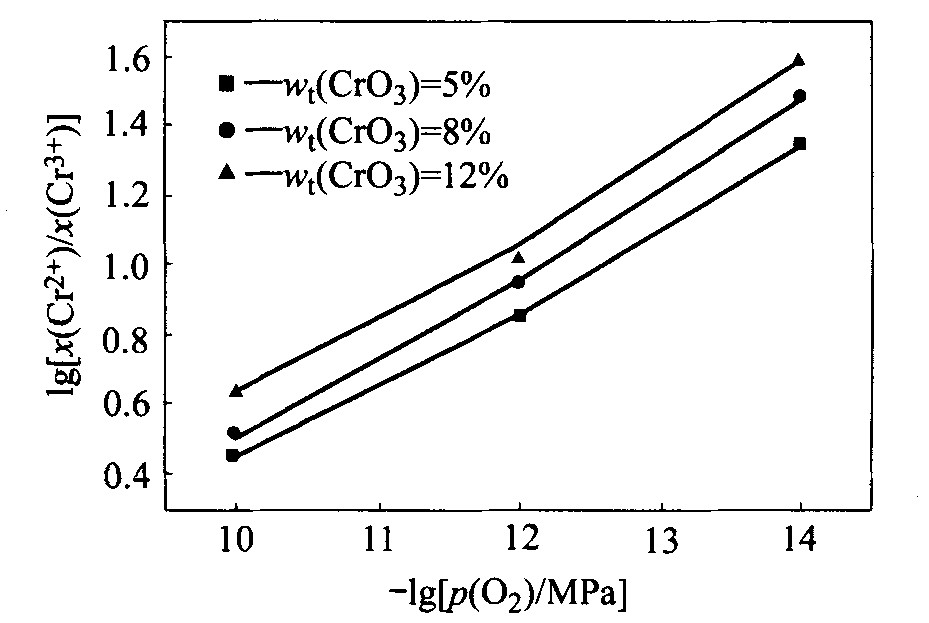
对预备实验平衡后的渣样进行化学分析发现, 渣样中没有六价铬, 由此确定其他条件下渣样平衡后只有二价和三价铬。 直接分析出了各渣样中的全铬(以六价铬折算)、 二价铬和三价铬的质量分数, 计算得到了二价和三价铬的摩尔分数之比及其对数值, 图1~4所示为不同实验条件下的lg[(x(Cr2+)/x(Cr3+)]与-lgp(O2)的关系。
二价铬和三价铬之间的反应为
CrO+1/4O2=CrO1.5 (1)
平衡常数
式中 a为各氧化物的活度, γ为各氧化物的活度系数。 温度一定时, K为常数; 渣成分一定时, 假定各氧化物的活度系数也为常数, 则
可见, 当温度和渣成分一定时, -lgp(O2)与
2.1碱度对x(Cr2+)/x(Cr3+)的影响
比较图1~4可以发现, 在温度和铬氧化物总量一定的情况下, 碱度增加使x(Cr2+)/x(Cr3+)值减小, 即当碱度增加时, 渣样中CrO的含量减少, 铬氧化物形态趋向于高价氧化物, 而碱度减小使低价氧化物更加稳定。
2.2温度对x(Cr2+)/x(Cr3+)的影响
一般而言, 高价氧化物的还原过程为吸热反应, 升高温度将使高价氧化物趋向于被还原成低价氧化物。 本实验在对温度与x(Cr2+)/x(Cr3+)之间的关系的研究中亦得出了相同的结论。 由图1和3及2和4可见, 温度的升高均使x(Cr2+)/x(Cr3+)值增加, 渣中低价铬氧化物的含量增加, 说明升高温度促进高价铬向低价铬的还原。
2.3渣中铬氧化物总量对x(Cr2+)/x(Cr3+)的影响
由图1~4均可见, 改变铬氧化物总量将使x(Cr2+)/x(Cr3+)的值改变, 且x(Cr2+)/x(Cr3+)随铬氧化物总量的增加而增大, 使得渣中低价铬氧化物所占比例增加。
图1 温度为1 673 K、 碱度为0.6时CrO3含量 不同的炉渣中lg[x(Cr2+)/x(Cr3+)]与-lgp(O2)的关系
Fig.1 Dependence of lg[x(Cr2+)/x(Cr3+)] on -lgp(O2) for slags with basicity of 0.6 and various CrO3 contents at 1 673 K
图2 温度为1 673 K、 碱度为1.0时CrO3含量 不同的炉渣中lg[x(Cr2+)/x(Cr3+)]与-lgp(O2)的关系
Fig. 2 Dependence of lg[x(Cr2+)/x(Cr3+)] on -lgp(O2) for slags with basicity of 1.0 and various CrO3 contents at 1 673 K
2.4氧分压对铬渣中氧化物价态的影响
综合图1~4发现, 当碱度、 温度和铬氧化物总量变化时, lg[x(Cr2+)/x(Cr3+)]与-lgp(O2)总保持线性关系, 且斜率总在0.23~0.253之间, 即lg[x(Cr2+)/x(Cr3+)]的值总随着氧分压的降低而增加, 而氧分压的降低意味着还原性气氛的增强, 所以还原性气氛越强, 铬氧化物越趋向于低价氧化物。 与理论值0.25相比, 以上各图的斜率稍有误差, 这主要是由于有一些铬的非化学计量化合物存在造成的。
图3 温度为1 773 K、 碱度为0.6时CrO3含量 不同的炉渣中lg[x(Cr2+)/x(Cr3+)]与-lgp(O2)的关系
Fig. 3 Dependence of lg[x(Cr2+)/x(Cr3+)] on -lgp(O2) for slags with basicity of 0.6 and various CrO3 contents at 1 773 K
图4 温度为1 773 K、 碱度为1.0时CrO3含量 不同的炉渣中lg[x(Cr2+)/x(Cr3+)]与-lgp(O2)的关系
Fig. 4 Dependence of lg[x(Cr2+)/x(Cr3+)] on -lgp(O2) for slags with basicity of 1.0 and various CrO3 contents at 1 773 K
3结论
在本文实验条件下, 铬渣中铬氧化物主要以Cr2+形式存在, 基本没有Cr6+。 lg[x(Cr2+)/xCr3+)]与-lgp(O2)保持线性关系, 且斜率在1/4左右, 与理论分析基本相符。 碱度的增加使x(Cr2+)/x(Cr3+)减小。 氧分压的降低使x(Cr2+)/x(Cr3+)明显增加, 温度升高促使x(Cr2+)/x(Cr3+)增加, 铬氧化物总量的增加使x(Cr2+)/x(Cr3+)增大。
参考文献
[9] XiaoYP .ThermodynamicstudyonCrOcontainingslags[D].Helsinki:HelsinkiUniversityofTechnology,1993.
[10] BoltenBA ,SadowayDR .Onbinaryp—Tphasedia grams[J].MetallTransB ,1983,14B(2):231237.