文章编号: 1004-0609(2005)06-0940-06
氧化石墨在H2还原过程中的结构与性能变化
邹艳红1, 刘洪波1, 傅 玲1, 陈宗璋2
(1. 湖南大学 材料科学与工程学院, 长沙 410082;
2. 湖南大学 化学化工学院, 长沙 410082)
摘 要:
对氧化石墨进行了热解和H2还原处理, 通过元素分析、 X射线衍射分析、 傅立叶变换红外光谱仪(FT-IR)分析和粉末电阻率测定, 初步探讨了氧化石墨的分子组成、 官能团、 晶体结构和电导率随还原温度的变化规律。 结果表明: 对经220℃热处理的热解氧化石墨进行H2还原处理时, 随着还原温度的升高, 还原氧化石墨中氧元素的质量百分含量减小, 晶体结构逐渐回复为石墨的晶体结构, 但存在明显的晶粒细化现象; 随温度的升高, 还原氧化石墨的电导率增大, 并在500℃时达到最大值6.67S/cm; 当还原温度超过500℃时, 由于层间距增大及晶粒进一步细化, 其电导率又逐渐降低; 热解氧化石墨在H2中的还原过程可以分为两个阶段, 第Ⅰ阶段主要发生—C=O基团和C—OH基团的还原反应, 第Ⅱ阶段残余的C—OH基团被还原。
关键词: 氧化石墨; 还原; 晶体结构; 电导率
中图分类号: TB321 文献标识码: A
Changes of structures and properties of
graphite oxide in process of reduction under H2
ZOU Yan-hong1, LIU Hong-bo1, FU Ling1, CHEN Zong-zhang2
(1. School of Materials Science and Engineering,
Hunan University, Changsha 410082, China;
2. School of Chemistry and Chemical Engineering,
Hunan University, Changsha 410082, China)
Abstract: Reduced graphite oxide at different temperatures was synthesized from graphite oxide by high temperature treatment and reduction under H2. Composition, functional group, crystal structure and conductivities of reduced graphite oxide at different temperatures were investigated by elemental analysis, XRD, FT-IR and automatic multi-function resistivity measuring instrument. The results show that with the increasing of temperature oxygen content of pyrolytic graphite oxide at 220℃(PGO220) decreases. Although the grain is refined, the crystal structure is similar with that of graphite. The conductivity of reduction graphite oxide increases with the increasing temperature and at 500℃ it reaches the maximum, 6.67S/cm. when above 500℃ its conductivity decreases because of excursions and grain refining.There are two stages in the process of GO reduction. During the first stage —C =O and C—OH are reduced, then the residual C—OH is reduced during the second stage.
Key words: graphite oxide; reduce; crystal structure; conductivity
自19世纪40年代Brodie首次合成氧化石墨以来, 有关氧化石墨的研究曾引起人们极大的兴趣, 研究工作主要集中在氧化石墨的合成方法和结构模型等方面[1-6]。 近年来, 随着纳米科技的发展与进步, 人们开始关注具有独特光、 电、 磁性能的过渡金属/碳纳米复合材料, 氧化石墨又成为人们研究的热点之一[7-11]。 氧化石墨是石墨经深度液相氧化得到的一种层间距远大于原石墨的层状化合物, 层间含有大量的极性基团如—C=O、 —OH、 C—O—C等, 这些极性基团的存在, 使氧化石墨在水溶液中具有良好的层间吸附性[12, 13]。 因此利用氧化石墨层间可吸附大量离子的特性使过渡金属离子吸附到氧化石墨层间, 再通过一定的方式还原成过渡金属, 则可望发展成一种新的制备过渡金属/碳纳米复合材料的方法。
大量研究表明[14, 15], 在H2还原过程中不仅过渡金属离子被还原成过渡金属原子, 而且氧化石墨本身也有不同程度的还原, 因此为了更好地研究过渡金属/碳纳米复合材料, 本文作者采用在高纯H2中对氧化石墨进行还原处理的方法, 考察了氧化石墨的分子组成、 官能团、 晶体结构和电导率随还原温度的变化规律, 并据此对氧化石墨的H2还原过程及还原氧化石墨导电性能提高的原因进行了初步探讨。
1 实验
1.1 实验原料
天然鳞片石墨(粒径小于44μm, 碳含量为99%)、 98%浓硫酸(化学纯)、 硝酸钠(分析纯)、 高锰酸钾(分析纯)、 H2(高纯)。
1.2 氧化石墨的制备与热解预处理
氧化石墨(GO)采用Hummers法自制, 具体参见文献[1]。
本文作者的前期研究发现快速加热氧化石墨时, 当加热温度达到180~210℃时, 氧化石墨会发生爆炸性分解, 生成絮状的无定形碳, 而缓慢加热则不会发生上述现象, 因此在进行H2 还原之前需先将氧化石墨进行预处理。 预处理的方法是将装有氧化石墨的瓷坩埚埋在石墨填料中, 在马弗炉中以0.2℃/min的速度加热到220℃, 到达目标温度后保温2h, 试样记为PGO220。
1.3 还原氧化石墨的制备
将预处理后的氧化石墨置于管式电阻炉中的石英管中, 在高纯H2气氛中以2℃/min的升温速度分别加热到300、 500、 700、 900和1000℃, 到达目标温度后保温8h, 即得到不同还原温度下的还原氧化石墨, 分别记为RGO300、 RGO500、 RGO700、 RGO900和RGO1000。
1.4 组成、 结构与性能分析方法
采用美国立克公司CS-444型碳、 硫分析仪和TC-436型氮、 氧分析仪对H2还原前后的试样进行碳、 氧元素分析。 采用美国尼高力公司Nicolet Nexus型傅里叶变换红外光谱仪分析试样中的官能团。 采用日本理学D/max X2550型全自动转靶X射线衍射仪分析试样的晶体结构。 采用中国科学院山西煤炭化学研究所科学仪器厂GM-Ⅱ型多功能电阻率自动测定仪测定试样的电阻率(在测定氧化石墨的电阻率时对仪器进行了适当的改进, 以扩大其量程)。
2 结果与讨论
2.1 还原氧化石墨的分子组成与还原温度的关系
采用碳、 硫分析仪和氮、 氧分析仪对热解氧化石墨和H2还原后的还原氧化石墨试样进行碳、 氧元素分析时, 如果忽略H以外其它元素的影响, 则通过测定试样碳、 氧元素的百分含量, 可以计算出各试样的分子组成。 热解氧化石墨和不同还原温度下的还原氧化石墨的碳、 氧元素质量百分含量及分子组成如表1所示。 由于氧化石墨的分子组成随含水量的不同有较大的变化, 再加上测定碳、 氧元素含量时会发生爆炸性分解而无法得到其准确的数据, 故表1中未列出氧化石墨的碳、 氧元素含量及分子组成。 从表1可以看出, 与热解氧化石墨相比, 随着还原温度的升高, 还原氧化石墨中氧元素的百分含量减小, 相应地碳元素的百分含量增加。 当还原温度从300上升到500℃时, 氧含量从17.61%迅速下降到5.1%, 表明氧化石墨中有大量的含氧官能团发生了还原反应。 当还原温度上升到900℃ 时, 试样中氧原子含量仅为0.5%左右, 说明氧化石墨中的含氧官能团已基本上被还原了。
表1 热解氧化石墨及还原氧化石墨的分子组成
Table 1 Oxygen content of PGO and RGO at different temperatures(mass fraction, %)

2.2 还原氧化石墨的官能团与还原温度的关系
图1所示为氧化石墨、 热解氧化石墨及不同还原温度下的还原氧化石墨的红外光谱, 各试样的吸收峰归属如表2所示。 图1中曲线(a)为氧化石墨的红外光谱, 在3433cm-1附近出现了较强的C—OH基团和—OH基团(H2O)的伸缩振动特征吸
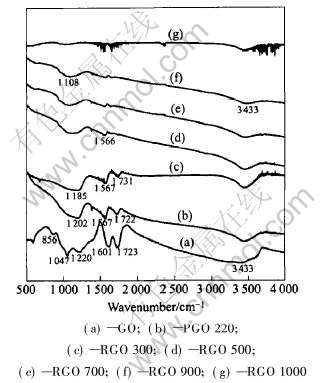
图1 氧化石墨、 热解氧化石墨及还原温度不同的还原氧化石墨的红外光谱
Fig.1 FT-IR spectra of GO, PGO and RGO at different temperatures
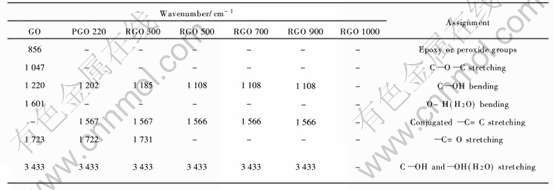
收峰, 1601cm-1附近出现了较强的O—H基团(H2O)弯曲振动特征吸收峰, 在1723、 1220、 1047及856cm-1附近出现分别出现了—C=O基团的伸缩振动、 C—OH基团的弯曲振动、 C—O—C基团的伸缩振动和环氧或过氧基团的特征吸收峰, 说明氧化石墨中存在吸附水和多种含氧基团。 图1中曲线(b)为经220℃热处理的热解氧化石墨的红外光谱, 可见3433cm-1附近的C—OH基团和O—H基团的伸缩振动特征吸收峰强度降低, 1601cm-1附近的O—H基团的弯曲振动特征吸收峰消失, 说明氧化石墨经220℃热处理后表面和层间的吸附水已被脱出。 曲线(b)中未出现C—O—C基团的伸缩振动、 环氧或过氧基团的特征吸收峰, 表明氧化石墨中的C—O—C、 环氧及过氧基团已发生了分解反应。 而在1567cm-1附近出现共轭—C=C键伸缩振动的特征吸收峰, 这是上述含氧基团分解所带来的必然结果。 经300℃处理的还原氧化石墨(曲线(c))与热解氧化石墨(曲线(b))的红外光谱没有太大差别, 说明在该温度下H2的还原作用不明显。 但由于—C=O基团的还原, C—OH基团弯曲振动的峰位从1202cm-1位移到1185cm-1(500℃处理后位移至1108cm-1)。 经500℃处理的还原氧化石墨(曲线(d))中—C=O基团的特征吸收峰消失, 说明—C=O基团与H2发生了还原反应且反应较完全, 因此还原温度在300~500℃之间时, 氧含量应有较大幅度的下降, 这与表1中所列的元素分析结果一致。 900℃处理的还原氧化石墨(曲线(f)))与700℃处理的还原氧化石墨(曲线(e))相比较可以看出, 不仅随还原温度的升高逐渐向低波数方向位移的C—OH基团弯曲振动吸收峰强度进一步减弱, 而且3433cm-1处C—OH基团伸缩振动的特征吸收峰强度也明显减弱, 说明氧化石墨中残余的C—OH基团已基本被还原, 因此氧含量的下降幅度增加。 随着还原温度的进一步升高, 还原氧化石墨中各基团的含量几乎趋向于零, 以致1000℃处理的还原氧化石墨曲线(g)中未出现任何吸收峰。
表2 氧化石墨、 热解氧化石墨及还原温度不同的还原氧化石墨的红外光谱峰位归属表
Table 2 FT-IR spectral assignments for GO, PGO and RGO at different temperatures
2.3 还原氧化石墨的晶体结构与还原温度的关系
图2所示为天然鳞片石墨(a)、 氧化石墨(b)、 220℃热处理的热解氧化石墨(c)及还原温度不同的还原氧化石墨(d~h)的X射线衍射谱。 由图2可见, 经220℃处理的热解氧化石墨(曲线(c))由于层间吸附水的脱出以及C—O—C基团、 环氧及过氧基团的分解, 在一定程度上破坏了原有氧化石墨的晶体结构, 因此热解氧化石墨(曲线(c))的(001)峰位移至19.5°附近, 且强度显著降低。 此外在20°~28°之间还出现了一个较为弥散的衍射峰, 说明220℃处理的热解氧化石墨(曲线(c))结晶性较差, 为无定形态。 300℃处理的还原氧化石墨(曲线(d)) 中(001)峰位移至24.4°附近, 与此同时, 试样中开始出现石墨晶体特有的(002)衍射峰, 这显然是由于氧化石墨中的碳六角网格平面由锯齿状结构逐渐回复为平面结构所造成的。 还原氧化石墨(曲线(e))与天然鳞片石墨(曲线(a))的X射线衍射谱非常接近, 表明经500℃处理的还原氧化石墨(曲线(e))已重新回复为石墨的晶体结构, 但从(002)和(004)衍射峰变宽, (100)和(101)衍射峰不明显来看, 还原过程中存在明显的晶粒细化现象。 700~1000℃处理的还原氧化石墨(曲线(f)、 (g)、 (h))在26.5°附近都出现了石墨(002)面的特征衍射峰, 但从700℃开始随着还原温度的升高, 衍射峰有变宽、 变弱和向低角度方向位移的趋势, 说明还原温度过高时会产生层间距增大和晶粒进一步细化等结构变化现象。
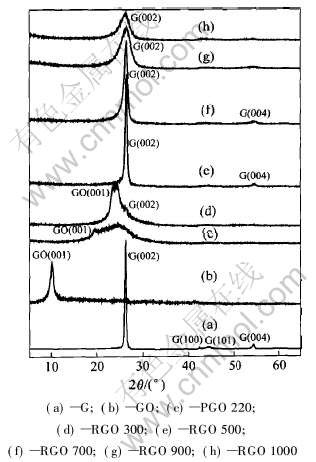
图2 石墨、 氧化石墨、 热解氧化石墨及还原氧化石墨的X射线衍射谱
Fig.2 XRD patterns of G, GO, PGO and RGO at different temperatures
2.4 还原氧化石墨的电导率与还原温度的关系
表3列出了各试样的电导率、 碳六角网格平面层间距d002和沿c轴方向的堆积厚度Lc。 由于220℃处理的热解氧化石墨和300℃处理的还原氧化石墨的衍射峰较为弥散, 因此未计算d002和Lc值。 从表3可以看出, 氧化石墨的层间距为0.898nm, 比石墨的0.338nm大了0.56nm, 且层面中的碳六角网格由石墨特有的平面结构变成了锯齿状结构, 破坏了石墨层间的π电子结构, 因而其导电性很差, 电导率比原石墨降低了5个数量级。 220℃处理的热解氧化石墨由于层间吸附水的脱出、 C—O—C基团、 环氧及过氧基团的分解及大量共轭—C=C 键的出现, 使氧化石墨层间距降低, π电子浓度增
表3 石墨、 氧化石墨、 热解氧化石墨及还原温度不同的还原氧化石墨的晶格常数和电导率
Table 3 Crystal lattice constant and conductivities of G, GO, PGO and RGO at different temperatures
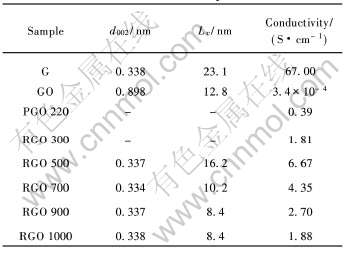
加, 因此电导率从氧化石墨的3.4×10-4 S/cm提高到了0.39S/cm, 提高了3个数量级。 随着还原温度的升高, 氧化石墨的晶体结构逐渐回复为石墨的晶体结构, 层间距也逐渐接近原石墨, 因此电导率逐渐增加, 并且在还原温度为500℃时达到最大值。 当还原温度超过500℃时, 还原氧化石墨的晶体结构开始偏离石墨的晶体结构, 其表现为层间距(d002)增大和晶粒细化(Lc减小), 因此电导率又逐渐降低。 值得指出的是, 尽管还原氧化石墨在一定程度上具有石墨的晶体结构, 但从图2可以看出, 所有的还原氧化石墨的X射线衍射谱中都没有出现晶体发育完整的原石墨的(100)或(101)衍射峰, 说明还原氧化石墨并不完全具有石墨的晶体结构, 再加上晶粒细化导致π电子的迁移率减小, 故即使经500℃处理的电导率最大的还原氧化石墨, 其电导率仍比原石墨的电导率(67S/cm)低一个数量级。
2.5 热解氧化石墨的还原过程
随着还原温度的升高, 还原氧化石墨的氧含量、 官能团、 晶体结构以及电导率都发生了很复杂的变化。 尽管发生此种变化的原因目前还不十分清楚, 但按照还原氧化石墨的氧含量、 官能团、 晶体结构以及电导率随还原温度的变化趋势, 我们仍可以大致将热解氧化石墨的还原过程分为两个阶段, 图3所示为以还原氧化石墨的氧含量随还原温度的变化表示的还原过程。 第Ⅰ阶段即还原温度在300~500℃之间时, 主要发生—C=O基团和C—OH基团的还原反应, 氧含量明显降低, 晶体结构逐渐回复为石墨的晶体结构, 电导率逐渐增大, 500℃时达到最大值6.67S/cm; 第Ⅱ阶段即热解温度在700~900℃之间时, 随着还原温度的进一步升 高, 残余的C—OH基团被还原, 氧含量进一步降低, 晶体结构逐渐偏离石墨的晶体结构, 电导率也逐渐降低。
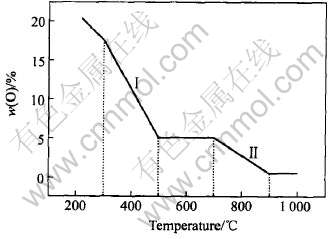
图3 热解氧化石墨的还原过程
Fig.3 Reduced process of PGO
3 结论
1) 经220℃处理的热解氧化石墨, 其层间吸附水被脱出, C—O—C基团和环氧或过氧基团发生了分解反应, 电导率提高了3个数量级。
2) 随着还原温度的升高, 氧化石墨中氧元素的质量分数逐渐减小, 碳元素的质量分数缓慢增加。
3) 随着还原温度的升高, 还原氧化石墨的晶体结构逐渐回复为石墨的晶体结构, 但存在明显的晶粒细化现象, 电导率逐渐增大并在500℃时达到最大值6.67S/cm。 当还原温度超过500℃时, 由于层间距增大和晶粒进一步细化, 还原氧化石墨的电导率又逐渐降低。
4) 热解氧化石墨在H2中的还原过程可分为两个阶段, 第Ⅰ阶段主要发生—C=O基团和C—OH基团的还原反应, 第Ⅱ阶段残余的C—OH基团被还原。
REFERENCES
[1]Hummers W S, Offeman Jr R E. Preparation of graphite oxide[J]. J Am Chem Soc, 1958, 80(2): 1339.
[2]Nakajima T, Mastsuo Y, Hagiwara R, et al. A new structure model of graphite oxide[J]. Carbon, 1988, 26(3): 357-361.
[3]Nakajima T, Mastsuo Y, Hagiwara R, et al. Formation process and structure of graphite oxide[J]. Carbon, 1994, 32(3): 469-475.
[4]Mermoux M, Chabre Y, Rousseau A, et al. FTIR and 13C NMR study of graphite oxide[J]. Carbon, 1991, 29 (3): 469-474.
[5]Hontoria-Lucas C, Lopez-Peinddo A J. Study of oxygen-containing groups in a series of graphite oxides: physical and chemical characterization[J]. Carbon, 1995, 33(11): 1585-1592.
[6]Anton Lerf, Heyong Hee. Structure of graphite oxide revisited[J]. J Phys Chem, 1998, 102: 4477-4482.
[7]张海燕, 何艳阳, 薛新民, 等. 碳弧法中碳包Fe纳米晶及其相关碳微团的形成[J]. 无机材料学报, 1999, 14(2): 291-296.
ZHANG Hai-yan, HE Yan-yang, XUE Xin-min, et al. Formations of carbon-coated Fe nanocrystals and related carbon cluster[J]. Journal of Inorganic Materials, 1999, 14(2): 291-296.
[8]LI Xuan-ke, LEI Zhong-xing, REN Rong-cui, et al. Characterization of carbon nanohorn encapsulated Fe particles[J]. Carbon, 2003, 41(15): 3063-3074.
[9]Cassagneau T, Fendler J H. Preparation and layer-by layer self-assembly of silver nanoparticles capped by graphite oxide nanosheets[J]. J Phys Chem B, 1999, 103(11): 1789-1793.
[10]LIU Ping-gui, GONG Ke-cheng. Synthesis of polyaniline-intercalated graphite oxide by an in situ oxidative polymerization reaction[J]. Carbon, 1999, 37(4): 701-711.
[11]Matsuo Y, Sugie Y. Preparation, Structure and electrochemical property of pyrolytic carbon from graphite oxide[J]. Carbon, 1998, 36(3): 301-303.
[12]Peckett J W, Trens P, Gougeon R D, et al. Electrochemically oxidized graphite characterization and some ion exchange properties[J]. Carbon, 2000, 38(3): 345-353.
[13]邹艳红, 傅玲, 刘洪波, 等. 对天然鳞片石墨和椰壳活性炭进行液相氧化的初步研究[J]. 湖南大学学报, 2004, 31(5): 22-26.
ZOU Yan-hong, FU Ling, LIU Hong-bo, et al. Preliminary research on the liquid phase oxidation of natural graphite flakes and activated carbon[J]. Journal of Hunan University(Natural Sciencses), 2004, 31(5): 22-26.
[14]Matsuo Y, Sugie Y. Electrochemical lithication of carbon prepared from pyrolysis of graphite oxide[J]. Journal of the Electrochemical Society, 1999, 146(6): 2011-2014.
[15]XIAO Min, DU Xu-sheng, MENG Yue-zhong, et al. The influence of thermal treatment conditions on the structures and electrical conductivities of graphite oxide[J]. New Carbon Materials, 2004, 19(2): 92-96.
(编辑龙怀中)
基金项目: 国家自然科学基金资助项目(50372019)
收稿日期: 2004-11-09; 修订日期: 2005-02-25
作者简介: 邹艳红(1976-), 女, 博士研究生.
通讯作者: 刘洪波, 教授, 博士; 电话: 0731-8823222; 传真: 0731-8821483; E-mail: hndxliuhongbo@yahoo.com.cn


