利用离子膜电解槽在氯盐电解质中电沉积金属锰
冯雅丽1,王维大1,李浩然2,杨志超1,毕耜超1
(1. 北京科技大学 土木与环境工程学院,北京,100083;
2. 中国科学院过程工程研究所 生化工程重点实验室,北京,100190)
摘 要:
电解槽在氯盐电解质中电沉积锰进行研究,并采用循环伏安法对其进行电化学分析。研究结果表明:电解最佳条件是锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,电解温度为40 ℃,电流密度为450 A/m2,pH为7.3,SeO2浓度为0.36 mmol/L,在此条件下,金属锰的电沉积效率为90.8%,电耗为4 816 kW·h/t;其晶型为γ型;利用离子膜电解槽电沉积金属锰能有效地防止阴极表面Mn2+的浓差极化,提高电流效率,该过程所发生的还原反应为扩散过程控制。
关键词:
中图分类号:TF803.27 文献标志码:A 文章编号:1672-7207(2014)07-2157-07
Electrodeposition of metallic manganese using electrolytic membrane reactor from chloride-based electrolytic solution
FENG Yali1, WANG Weida1, LI Haoran2, YANG Zhichao1, BI Sichao1
(1. School of Civil and Environmental Engineering, University of Science and Technology Beijing,
Beijing 100083, China;
2. National Key State Laboratory of Biochemical Engineering, Institute of Process Engineering,
Chinese Academy of Science, Beijing 100190, China)
Abstract: The electrodeposition of metallic manganese using electrolytic membrane reactor from chloride-based electrolytic solution was investigated, and the electrochemical scanning of the processes was tested by cyclic voltammetry. The results show that the current efficiency can be up to 90.8% and the power consumption can be reduced to 4 816 kW·h/t under the condition of manganese ion concentration of 0.9 mol/L, ammonium sulfate concentration of 2.4 mol/L, temperature of 40 ℃, current density of 450 A/m2, pH of 7.3 and SeO2 concentration of 0.36 mmol/L, and the manganese phase is γ-manganese. The process can prevent Mn2+ concentration polarization on the cathode surface and increase the current efficiency in the anion-exchange membrane. The metallic manganese reduction is a diffusion-controlled process.
Key words: metallic manganese; anion-exchange membrane; chloride-based electrolytic solution; cyclic voltammetry
电沉积金属锰以其独特的理化性能广泛应用于钢铁冶炼[1-2]、无铁合金[3-5]及电子功能材料[6]等领域。但在实际生产中存在能耗高、电流效率低、环境污染大等缺点,亟需积极开发高效率、低能耗的新型电沉积工艺将会给金属锰生产带来新的机遇。金属锰通常通过电解硫酸锰和氯化锰溶液来生产[7],二者相比,氯化锰溶液导电性强、槽电压低、能耗少、产品质量好。锰为高负电势金属(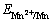 = -1.18 V),电沉积生产时锰离子的还原和氢气的析出同时进行,从而导致金属锰的电沉积效率下降[8],因此,都需要通过隔膜来减弱浓差极化及阳极产生的酸对阴极的影响。离子交换膜对电解液中的离子具有选择透过性,不仅能有效防止pH的降低及Mn2+进入阳极,而且可以提高电沉积效率、提高锰产品质量,将其应用于金属锰的生产具有广阔的应用前景。目前,对于利用离子交换膜电沉积金属锰的研究相对较少,张文山等[9]利用阴离子交换膜电解金属锰获得成功,证实了该技术具有金属锰回收率高、产品质量好、环境污染少等优点,但没有对电沉积条件进一步优化;Wei等[10]对离子膜电解槽在硫酸盐中的电沉积条件进行了研究,并考察了不同添加剂对电沉积金属锰的影响,但缺乏对离子交换膜自身作用机理的研究。为了进一步考察离子交换膜用于电沉积金属锰中的可行性,本文作者对阴离子交换膜在氯盐介质中电沉积金属锰的工艺条件及离子膜的作用机理进行研究,以便为其工业化提供理论基础。
= -1.18 V),电沉积生产时锰离子的还原和氢气的析出同时进行,从而导致金属锰的电沉积效率下降[8],因此,都需要通过隔膜来减弱浓差极化及阳极产生的酸对阴极的影响。离子交换膜对电解液中的离子具有选择透过性,不仅能有效防止pH的降低及Mn2+进入阳极,而且可以提高电沉积效率、提高锰产品质量,将其应用于金属锰的生产具有广阔的应用前景。目前,对于利用离子交换膜电沉积金属锰的研究相对较少,张文山等[9]利用阴离子交换膜电解金属锰获得成功,证实了该技术具有金属锰回收率高、产品质量好、环境污染少等优点,但没有对电沉积条件进一步优化;Wei等[10]对离子膜电解槽在硫酸盐中的电沉积条件进行了研究,并考察了不同添加剂对电沉积金属锰的影响,但缺乏对离子交换膜自身作用机理的研究。为了进一步考察离子交换膜用于电沉积金属锰中的可行性,本文作者对阴离子交换膜在氯盐介质中电沉积金属锰的工艺条件及离子膜的作用机理进行研究,以便为其工业化提供理论基础。
1 实验
1.1 实验原理
在氯盐电解质中,电极反应过程如下。
阴极:Mn2++2e→Mn (E0= -1.182 V)
2H2O+2e→H2+2OH- (E0= -0.67 V)
阳极:2NH4+→N2+8H++6e (E0=0.275 V)
2Cl-→Cl2+2e (E0=1.36 V)
由于阳极NH4+电化学氧化的过电位及高H+浓度,使得Cl-电化学氧化到Cl2是阳极主反应,当Cl2是阳极主产物时,与NH4+发生如下反应[11]:
2NH4+ +3Cl2→N2+8H++6Cl-
1.2 实验材料
(1) 阴离子交换膜。采用UTX-UIF-A均相阴离子交换膜(北京紫光同兴环保工程技术有限公司),其厚度为 0.12 mm,质量含水率≥20%,单位面积电阻≤4 Ω/cm2,迁移数≥88%。
(2) 电解槽。电解槽由有机玻璃材料加工而成,单槽长×宽×高为80 mm×70 mm×80 mm。2个有机玻璃单槽通过螺栓固定在一起,并将离子膜夹在两单槽中间。阴极板采用1Cr18Mn8Ni5N不锈钢材料,阳极板为铱涂层钛板,长×宽分别为50 mm×50 mm,电沉积时阴极板背面涂以绝缘层。
(3) 电解液。
静态实验:阴极液用分析纯试剂氯化锰、氯化铵、二氧化硒按实验所需配置成浓度均匀的电解液;阳极液采用0.5 mol/L的盐酸与1 mol/L的氯化铵混合溶液。
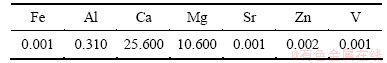
动态实验:广西某地碳酸锰矿(成分见表1)经盐酸浸出、除铁、除重金属后得滤液(成分见表2)作为阴极电解液氯化锰的来源,然后,加入氯化铵和二氧化硒作为阴极室电解液;阳极电解液同静态实验。
表1 碳酸锰矿化学组成(质量分数)
Table 1 Chemical compositions of manganese carbonate ore %
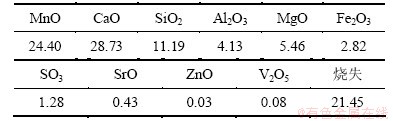
表2 滤液中金属离子含量(质量浓度)
Table 2 Impurity content in purified electrolyte mg/L
1.3 实验方法
1.3.1 静态试验
分别将配制的阴、阳电解液加入到电解槽中,放入水浴锅中加热到预设温度,调节阴极电解液pH,然后将称质量后的电极板放入质量分数为3%的水玻璃溶液中浸泡5 min,按一定间距固定在电解槽中,通电后调节电流至固定值,进行电解。电解2 h后取出阴极板,用去离子水冲洗后放入质量分数为5%的重铬酸钾溶液中钝化2~3 min,再次水洗、烘干后称其质量,计算电流效率和电能消耗。
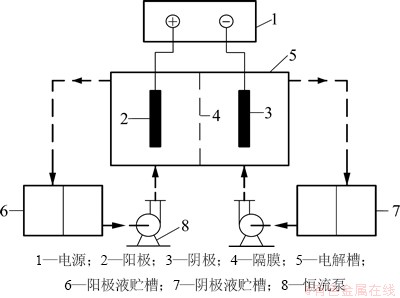
图1 电沉积锰装置
Fig. 1 Installation of metallic manganese
1.3.2 动态试验
电解槽阴阳两室各采用1套循环系统,将配制好的两极电解液通过恒流泵按其流量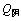 =0.5 mL/s,
=0.5 mL/s,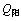 =0.65 mL/s打入各室,使其两室的电解液维持至静态试验最佳条件范围内,溢流出的电解液再返回电解液贮槽,经补给调节后循环使用。每个电解循环为10 h,电解过程及后续处理同静态实验。
=0.65 mL/s打入各室,使其两室的电解液维持至静态试验最佳条件范围内,溢流出的电解液再返回电解液贮槽,经补给调节后循环使用。每个电解循环为10 h,电解过程及后续处理同静态实验。
1.4 电化学分析
采用循环伏安法对阴极沉积金属锰过程及其控制步骤进行电化学分析。所用设备为CHI660D电化学工作站和三电极体系:工作电极为不锈钢电极;辅助电极为铱涂钛电极;参比电极为饱和甘汞电极。扫描速率为20~100 mV/s,选择-1.2 V作为初始电位,扫描范围为-1.2~-0.4 V。
2 结果与讨论
2.1 离子膜电沉积金属锰阴极过程电化学分析
在电沉积条件相同的情况下,分别对无隔膜电解槽和离子交换膜电解槽进行了循环伏安法扫描,研究离子交换膜在整个电沉积过程中的作用机理,所得结果如图2和图3所示。
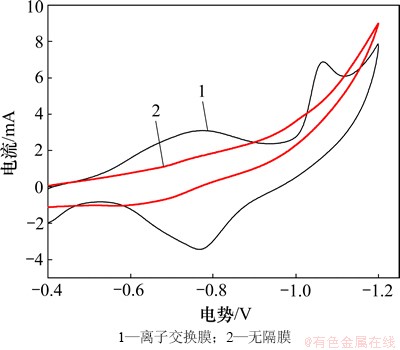
图2 无隔膜电解槽和离子交换膜电解槽的阴极循环伏安曲线
Fig. 2 CV of membrane-less reactor and anion-exchange membrane reactor
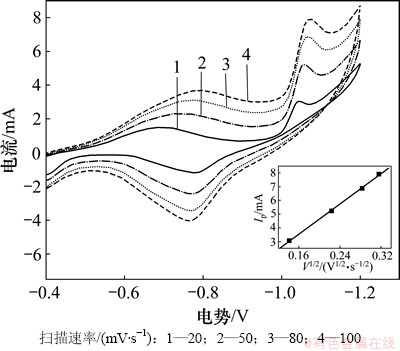
图3 不同扫描速率下金属锰循环伏安曲线及峰电流与扫描速率的关系图
Fig. 3 CV of metallic manganese at different scan rates and plot of peak current against square root of scan rate
由图2可以看出:当扫描电压为-1.0~-1.2 V时,对离子交换膜电解槽的扫描出现了较明显的还原峰,该峰的电位很接近金属锰的标准还原电位为-1.182 V,结合电解质各成分的电化学特性,判定该峰为金属锰的沉积峰,而无隔膜电解槽没有扫描到明显的金属锰还原峰。对比实验现象可知:离子膜电解槽阴极板上沉积的金属锰白而亮,在电沉积过程中有较少的气泡析出,而无隔膜电解槽却恰恰相反,其原因是电解槽中无隔膜时,辅助电极与工作电极争夺锰离子,使工作电极表面出现严重的浓差极化,造成金属锰过电位的变大,并且辅助电极表面产生的氢离子迅速扩散至工作电极表面,造成工作电极表面pH迅速降低,导致阴极表面金属锰的倒溶,加剧了氢气的析出。
由图3可以看出:锰的还原峰可逆性较好,说明锰离子在离子交换膜电解槽中沉积稳定;随着扫描速率的增加,峰电位朝着负方向移动,在不同速率下,峰电流所对应扫描速率平方根的拟合曲线成一条直线,表明锰离子在阴极表明的还原反应为扩散控制过程[12]。
2.2 电解条件对金属锰沉积的影响
2.2.1 锰离子浓度对金属锰沉积的影响
当硫酸铵浓度为2.6 mol/L,电解温度为40 ℃,pH为 7.0,电流密度为500 A/m2,SeO2浓度为0.4 mmol/L时,在0.4~1.1 mol/L之间选取8个锰离子浓度,考查锰离子浓度对电流效率和电耗的影响,结果如图4所示。
由图4可以看出:当锰离子浓度在0.4~1.1 mol/L之间时,随着锰离子浓度的增大,电流效率呈现先增大后减小、电耗呈先减小到一定范围后增大的趋势,其主要原因是当锰离子浓度偏低时,会使电极表面极化加剧,析锰过电位升高,析氢电位降低,导致阴极锰沉积变慢,析氢反应与锰沉积反应竞争加剧,造成电流效率下降,电耗增高;当锰离子浓度过高时,会使其离子迁移速率降低,引起氢氧化锰阴极析出以及电解锰产品发黑,造成产品质量下降;锰离子浓度过高,还会导致锰铵复盐的析出,破坏电解过程。当锰离子浓度为0.9 mol/L时,电流效率达到最高,电耗量降到最低,其值分别为87.6%和4 830 kW·h/t,因此,电沉积锰的锰离子浓度选定为0.9 mol/L。
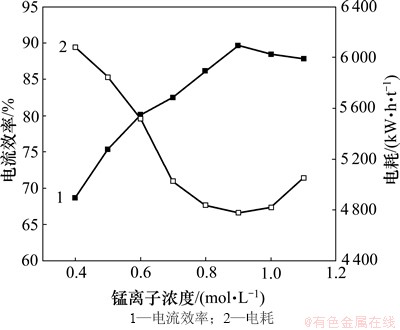
图4 锰离子浓度对电流效率和电耗的影响
Fig. 4 Effect of Mn2+ concentration on current efficiency and energy consumption
2.2.2 氯化铵浓度对金属锰沉积的影响
当锰离子浓度为0.9 mol/L,电解温度为40 ℃,pH为7.0,电流密度为500 A/m2,SeO2浓度为0.4 mmol/L时,在1.8~2.8 mol/L间选取6个氯化铵浓度,以考查其对电流效率和电耗的影响,结果如图5所示。
由图5可以看出:氯化铵浓度在1.8~2.8 mol/L之间时对电流效率的影响较小,均保持较高的电流效率(81.0%~88.5%);但对电耗的影响略大,其值在4 880~ 5 350 kW·h/t之间。氯化铵作为强电解质,在电解液中可以明显地降低溶液的内阻,当其浓度较低时,其导电性受到限制,槽压较高,导致电耗较高;随着氯化铵浓度的升高,其导电性逐渐改善,槽压降低,但随着浓度的升高,电解液黏度增大,电阻随之升高,出现明显的析氨现象,可见氯化铵浓度不宜过高。如图5中,当氯化铵的浓度为2.4 mol/L时,电流效率达到最高值88.5%;当氯化铵的浓度为2.6 mol/L时,电耗最低为4 880 kW·h/t,此时电流效率为86.8%。经综合考虑,电沉积锰的氯化铵浓度选定为2.4 mol/L。
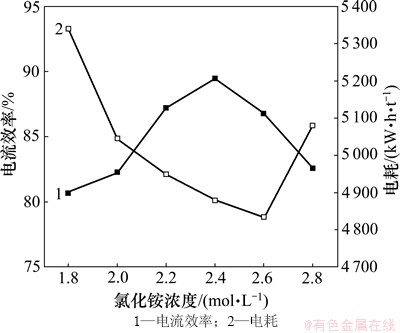
图5 氯化铵浓度对电流效率和电耗的影响
Fig. 5 Effect of NH4Cl concentration on current efficiency and energy consumption
2.2.3 电解液温度对金属锰沉积的影响
当锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,pH为7.0,电流密度为500 A/m2,SeO2浓度为0.4 mmol/L时,在20~50 ℃之间选取6个温度点,以考查其对电流效率和电耗的影响,结果如图6所示。
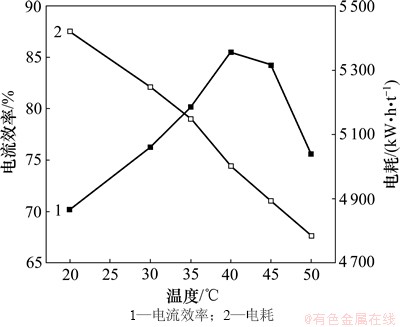
图6 电解温度对电流效率和电耗的影响
Fig. 6 Effect of electrolytic temperature on current efficiency and energy consumption
由图6可以看出:随着电解温度的升高,电流效率呈先上升后下降的趋势,在40 ℃时电流效率取得最大值85.5%;电耗呈持续下降的趋势,温度升高不仅加快了离子迁移速率和电极反应速率,而且使离子膜空隙变大,增大了离子膜的通透性,降低了膜阻力,从而显著地降低电解液的内阻,使电耗降低。但温度过高,阴极气泡增多,即析氢反应加剧,导致锰沉积层起泡分裂,甚至脱落,使电流效率下降。因此,电沉积锰的温度选定为40 ℃。
2.2.4 电流密度对金属锰沉积的影响
当锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,温度为40 ℃,pH为7.0,SeO2浓度为0.4 mmol/L时,在250~500 A/m2之间选取6个电流密度,以考查其对电流效率和电耗的影响,结果如图7所示。
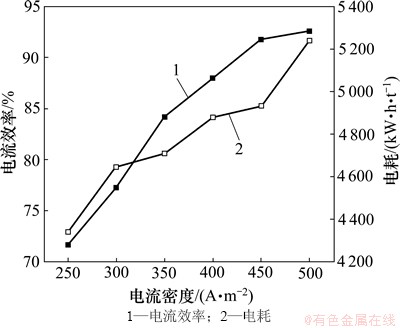
图7 电流密度对电流效率和电耗的影响
Fig. 7 Effect of current density on current efficiency and energy consumption
由图7可以看出:电流密度对电流效率和电耗都有较大的影响,当电流密度由250 A/m2增加到450 A/m2时,电流效率的增加趋势近似线性,但大于450 A/m2时,趋于平缓;而电耗也随着电流密度的增加而增加,当电流密度由400 A/m2增加到450 A/m2时,电耗增加56 kW·h/t,但由450 A/m2增加到500 A/m2时,电耗则增加304 kW·h/t,并且沉积层变的粗糙无光泽,有树枝状的锰生成。因此,电沉积锰的电流密度选定为450 A/m2。
2.2.5 阴极液pH对金属锰沉积的影响
当锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,温度为40 ℃,电流密度为450 A/m2,SeO2浓度为0.4 mmol/L时,在6.0~8.0之间的选取8个pH,以考查其对电流效率和电耗的影响,结果如图8所示。
由图8可以看出:随着pH的升高,电流效率显著增大,但进一步提高pH时,电流效率反而显著下降。其可能的原因是pH过低时,阴极易析氢,使得电流效率降低;当pH过高时,锰离子发生水解,产生氢氧化锰沉淀或被氧化成高价锰化合物,从而影响电沉积锰的电流效率及电耗;当pH为7.3时,电流效率达到最高,而电耗降至最低值,在整个电沉积过程中,阴极液未添加氨水,但pH变化幅度很小,说明在稳定pH方面,离子交换膜较普通物理隔膜具有很大的优势。因此,电沉积锰的pH选定为7.3。
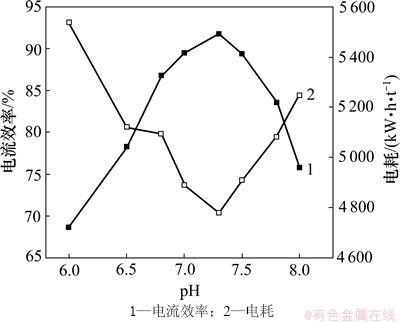
图8 pH对电流效率和电耗的影响
Fig. 8 Effect of pH on current efficiency and energy consumption
2.2.6 SeO2浓度对金属锰沉积的影响
当锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,温度为40 ℃,电流密度为450 A/m2,pH为7.3时,在0.10~0.54 mmol/L之间选取8个SeO2浓度,以考查其对电流效率和电耗的影响,结果如图9所示。
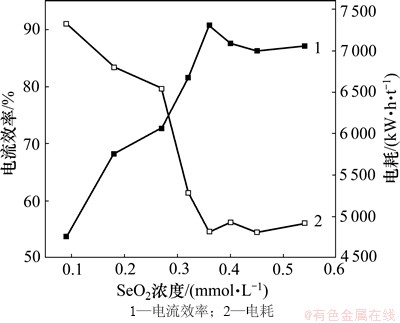
图9 SeO2浓度对电流效率和直流电耗的影响
Fig. 9 Effect of SeO2 concentration on current efficiency and energy consumption
由图9可以看出:随着SeO2浓度的增加,电流效率先增加后趋于平衡;当SeO2浓度达到0.36 mmol/L时,电流效率已达到90.8%,电耗也趋于最低值4 816 kW·h/t;当进一步增加SeO2浓度时,电流效率和电耗的变化幅度变化都较小,由于其具有剧毒性且成本高,不仅污染环境,而且严重影响产品质量,还会增加SeO2用量,增加生产成本。经综合考虑,阴极液SeO2浓度选定为0.36 mmol/L。
在单因素优化条件下,进行了5次动态电沉积金属锰试验,结果表明电流效率和电耗的变化幅度不大,电流效率控制在82%~88%之间,电耗在4 800~5 200 kW·h/t之间。可见:在条件相同下,离子膜电解槽在氯盐介质中电沉积金属锰较为稳定,所得电沉积金属锰的XRD和SEM分别如图10和图11所示。对SEM上点1和点2进行EDS分析,所得结果如图12所示。
从图10可以看出:在2θ=43.5°时出现1个较强的窄峰,另外,在2θ为47.5°,53°和79°等时出现了数个弱峰,经过分析可知这些峰均为γ-锰的特征峰。由图11可以看出:在阴极板上,沉积物以金字塔状和球状团簇的形态交杂生长。利用EDS(图12)对2种形态进行分析,发现二者均为较纯的金属锰,在大的金字塔状金属锰之间有小的金字塔状形成,绕着位错线生长,符合晶体螺旋位错生长理论[13]。
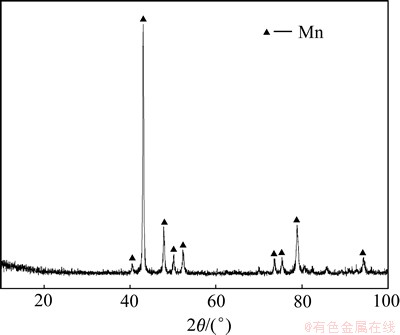
图10 金属锰XRD图
Fig. 10 XRD pattern of metallic manganese
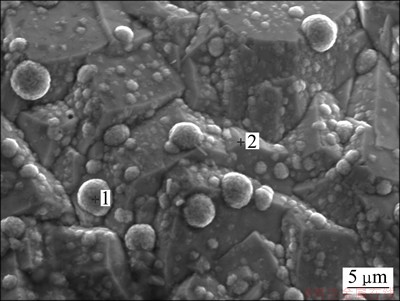
图11 电沉积金属锰的SEM图
Fig. 11 SEM image of metallic manganese
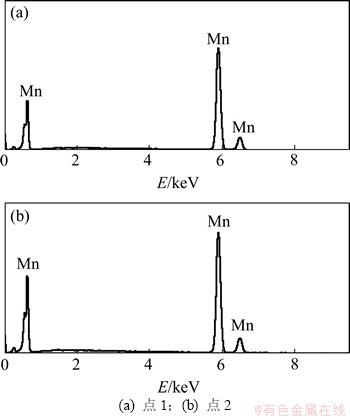
图12 电沉积金属锰的EDS图
Fig. 12 EDS spectra of metallic manganese
3 结论
(1) 当锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,电解温度为40℃,电流密度为450 A/m2,pH为7.3,SeO2浓度为0.36 mmol/L时,电沉积金属锰的电解效率为90.8%,电耗为4 816 kW·h/t。
(2) 使用离子膜电解槽电解金属锰能有效地防止阴极表面Mn2+的浓差极化,保证金属锰在阴极板稳定地沉积,其该过程所发生的还原反应为扩散过程控制。
(3) 在氯盐介质中离子膜电解槽电沉积金属锰的电流效率和电耗较为稳定,所得的金属锰为γ型,整体结晶过程符合晶体错位生长理论。
参考文献:
[1] Yang P, Xie Q, Meng L, et al. Dependence of deformation twinning on grain orientation in a high manganese steel[J]. Scripta Materialia, 2006, 55(7): 629-631.
[2] Han Y, Shi J, Xu L, et al. TiC precipitation induced effect on microstructure and mechanical properties in low carbon medium manganese steel[J]. Materials Science and Engineering, 2011, 530(15): 643-651.
[3] Wu J, Jiang Y, Johnson C, et al. Dc electrodeposition of Mn-Co alloys on stainless steels for sofc interconnect application[J]. Journal of Power Sources, 2008, 177(2): 376-385.
[4] Gong J, Zangari G. Electrodeposition of sacrificial tin- manganese alloy coatings[J]. Materials Science and Engineering, 2003, 344(1/2): 268-278.
[5] WANG Jingfeng, LU Ruopeng, WEI Wenwen, et al. Effect of long period stacking ordered (LPSO) structure on the damping capacities of Mg-Cu-Mn-Zn-Y alloys[J]. Journal of Alloys and Compounds, 2012, 537(5): 1-5.
[6] Waqas H, Qureshi A H, Subhan K, et al. Nanograin Mn-Zn ferrite smart cores to miniaturize electronic devices[J]. Ceramics International, 2012, 38(2): 1235-1240.
[7] Ilea P, Popescu I C, Urda M, et al. The electrodeposition of manganese from aqueous solutions of MnSO4. Ⅳ: Electrowinning by galvanostatic electrolysis[J]. Hydrometallurgy, 1997, 46(2): 149-156.
[8]  P, Antano-Lopez R, Measa Y, et al. EQCM study of the electrodeposition of manganese in the presence of ammonium thiocyanate inchloride-based acidic solutions[J]. Electrochimica Acta, 2006, 51: 4393-4404.
P, Antano-Lopez R, Measa Y, et al. EQCM study of the electrodeposition of manganese in the presence of ammonium thiocyanate inchloride-based acidic solutions[J]. Electrochimica Acta, 2006, 51: 4393-4404.
[9] 张文山, 梅光贵, 李基发, 等. 金属锰阴离子交换膜电解新技术研究[J]. 中国锰业, 2011, 29(4): 17-19.
ZHANG Wenshan, MEI Guanggui, LI Jifa, et al. Researches on new electrolysis technology of manganese metal anion exchange membrane[J]. China’s Manganese Industry, 2011, 29(4): 17-19.
[10] WEI Qifeng, REN Xiulian, DU Jie, et al. Study of the electrodeposition conditions of metallic manganese in an electrolytic membrane reactor[J]. Minerals Engineering, 2010, 23(7): 578-586.
[11] Lewis J E, Scaife P H, Swinkels D A J. Electrolytic manganese metal from chloride electrolytes. I: Study of deposition conditions[J]. Journal of Applied Electrochemistry, 1976, 6: 199-209.
[12] Gong K P, Yu P, Su L, et al. Polymer-assisted synthesis of manganese dioxide/carbon nanotube nanocomposite with excellent electrocatalytic activity toward reduction of oxygen[J]. J Phys Chem C, 2007, 111: 1882-1887.
[13] 陈国华. 电化学方法与应用[M]. 北京: 化学工业出版社, 2003: 10-13.
CHEN Guohua. Electrochemical methods and application[M]. Beijing: Chemical Industry Publishing House, 2003: 10-13.
(编辑 杨幼平)
收稿日期:2013-07-10;修回日期:2013-10-29
基金项目:国家自然科学基金资助项目(21176026,21176242);国家高技术研究发展计划(“863”计划)项目(2012AA062401);中国大洋矿产资源研究计划项目(DY125-15-T-08)
通信作者:李浩然(1968-),男,甘肃合水人,博士,副研究员, 从事矿物加工研究;电话:010-82627064;E-mail: hrli@home.ipe.ac.cn
摘要:对阴离子交换膜电解槽在氯盐电解质中电沉积锰进行研究,并采用循环伏安法对其进行电化学分析。研究结果表明:电解最佳条件是锰离子浓度为0.9 mol/L,氯化铵浓度为2.4 mol/L,电解温度为40 ℃,电流密度为450 A/m2,pH为7.3,SeO2浓度为0.36 mmol/L,在此条件下,金属锰的电沉积效率为90.8%,电耗为4 816 kW·h/t;其晶型为γ型;利用离子膜电解槽电沉积金属锰能有效地防止阴极表面Mn2+的浓差极化,提高电流效率,该过程所发生的还原反应为扩散过程控制。


