中等嗜热菌浸出黄铜矿及其表面钝化的研究
姚国成1, 2,温建康2,高焕芝2,王淀佐2, 3
(1. 北京科技大学 土木与环境工程学院,北京,100083;
2. 北京有色金属研究总院,北京,100088;
3. 中国工程院,北京,100088)
摘 要:
摘 要:针对近年来原生硫化铜矿的生物浸出存在浸出周期长、铜浸出率低、还未得到工业应用等问题,对菌种进行分离,应用分子生物学方法并结合扫描电镜,研究中等嗜热菌生物浸出黄铜矿纯矿物,对细菌的形态、生理生化特征进行描述,并分析细菌与黄铜矿的作用机理,讨论黄铜矿生物浸出过程中钝化膜形成的主要类型,分析表面钝化的有效解决途径,归纳黄铜矿生物浸出技术的几类研究热点,并提出生物浸出技术的重点研究问题。研究结果表明:中等嗜热菌是解决黄铜矿生物浸出难题的有效途径之一。
关键词:
中图分类号:TF18 文献标志码:A 文章编号:1672-7207(2010)04-1234-06
Chalcopyrite bioleaching by moderate thermophilic bacteria and surface passivation
YAO Guo-cheng1, 2, WEN Jian-kang2, GAO Huan-zhi2, WANG Dian-zuo2, 3
(1. School of Civil & Environment Engineering, University of Science and Technology Beijing, Beijing 100083, China;
2. General Research Institute for Non-ferrous Metals, Beijing 100088, China;
3. Chinese Academy of Engineering, Beijing 100088, China)
Abstract: Based on the fact that the primary copper sulfide bioleaching has long leaching time and low leaching rate and has not been used in industry, bacteria isolation was studied using the molecular biology method and scanning electron microscopy. The chalcopyrite bioleaching by moderate thermophilic bacteria was studied, the bacterial morphology, physiological and biochemical characteristics were described and the mechanism of chalcopyrite reaction was analyzed. The types of passivation layer formed in the leaching process was described, the effective solution way for the surface passivation was analyzed, the current research focuses for chalcopyrite bioleaching technology were summarized and key research project of bioleaching technology was prospected. The result show that the moderate thermophilic bacteria used in bioleaching is one of the effective ways for chalcopyrite bioleaching.
Key words: moderate thermophilic bacteria; chalcopyrite; bioleaching; passivation
黄铜矿是分布最广的工业铜矿物,在各种类型铜矿床中广泛产出[1]。近年来,我国生物浸铜技术快速发展,能处理氧化矿和低品位次生硫化铜矿。生物浸出与其他工艺相比,具有流程短、操作简单、投资少、对环境友好等优点;与传统矿冶工艺相比,可大幅度减少对电、煤、油等能源的大量消耗,尤其适用于我国矿产资源品位低、复杂难处理的铜矿。目前,黄铜矿的湿法处理工艺主要有硫酸高铁浸出、氯化物浸出、生物浸出及还原浸出等[2-3]。生物浸出是近年来的研究热点,但由于存在浸出缓慢、铜浸出率低等瓶颈,因而研究进展相对滞后。很多研究者认为生物浸出存在的问题主要是:在生物浸出过程中产生了不溶产物,形成钝化膜,如硫膜、多硫化物层、黄钾铁矾类的膜等。钝化膜阻碍细菌、营养物、反应物以及产物的扩散,从而阻碍黄铜矿进一步溶解,这种影响在生物浸出过程中被称为“钝化作用”。本文作者对研究黄铜矿生物浸出过程中不同的钝化现象以及其有效解决途径进行研究。
1 中等嗜热菌浸出黄铜矿纯矿物研究
黄铜矿的生物浸出有接触作用、间接作用或接触与间接共同作用等。接触作用的反应方程式如下。
有氧时,
![]()
无氧时,
![]()
![]()
间接作用的反应方程式为:
CuFeS2+4Fe3+→Cu2++5Fe2++2S0
![]()
![]()
1.1 实验用菌种及其生长曲线的测定
实验用菌种通过分离某铜矿山酸性矿坑水,经过纯培养、驯化后所得。该菌命名为CLJ菌,为革兰氏阳性菌,无机化能营养菌,细胞呈杆状,细胞尺寸为(0.4~2.0) ?m×(3.0~6.8) ?m,能在铁、硫、硫化矿不同底物上生长;专性好氧,嗜酸,中等嗜热,最适生长温度为50 ℃,在60 ℃时能存活;以Fe2+、硫化矿为能源自养生长,以酵母提取物为能源异养生长,以铁和酵母提取物为能源混合营养生长;当存在酵母提取物时,可氧化元素硫。以无机底物为能源自养生长时,细胞的良好生长需要足够的CO2,在有机物存在的混合营养条件下该菌更易生长。在细胞生长过程中有球形孢子生成。图1所示为CLJ菌的透射电镜图。
由伯杰氏细菌鉴定手册中对Sulfobacillus属的描述可知:Sulfobacillus菌属存在于富含铁、硫、硫化矿的酸热环境中,属革兰氏阳性、无机化能营养菌,细胞呈杆状、棒状,最适生长温度为52 ℃。经对比可知:选育出的CLJ菌为Sulfobacillus中等嗜热菌,典型菌为Sulfobacillus thermosulfidooxidans。
为研究选育出的CLJ菌生长规律,将富集并转代培养后的细菌接入初始pH=1.85的培养基中,接种量为10%。定时检测培养基中的菌数及亚铁量。为减少取样对微生物的影响,采用平行实验测定细菌生长曲线,如图2所示(其中:N为细菌个数)。

图1 CLJ菌透射电镜图
Fig.1 Transmission electron microscope image of CLJ bacteria
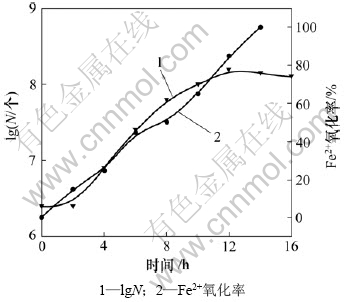
图2 细菌生长曲线
Fig.2 Bacteria growth curves
从图2可以看出:在开始培养的一段时间内,细胞数不增加(但Fe2+氧化率仍然增大),生长速率常数为0 个/s,这段时期称为细菌生长的延滞期。这是因为将细菌接种到新鲜培养液中,刚开始缺乏分解或催化有关底物的酶,或缺乏充足的中间代谢物。为产生诱导酶或合成有关的中间代谢物,就需要有一段适应期,在这个时期,Fe2+的氧化率也很低;随着细菌对环境的适应,细菌进入一个以几何级数速度分裂的一段生长时期,这段时期叫对数期,细胞平衡生长,菌体内各种成分最均匀,酶系活跃,代谢旺盛;经过 14 h后,Fe2+完全氧化。在对数期,平均亚铁氧化速率达到4.17 mmol/(L?h)。经过对数期的生长,细菌进入稳定期。营养物尤其是生长限制因子耗尽,pH、氧化还原电位等物化条件越来越不适宜,出现细菌生长的稳定期。
1.2 黄铜矿纯矿物
对黄铜矿(CuFeS2)进行X线衍射分析和元素分析,结果如表1和图3所示。结果表明:黄铜矿是结晶良好的纯天然矿物。
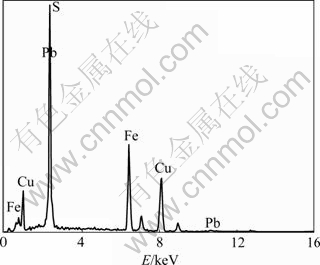
图3 黄铜矿X线衍射图
Fig.3 X-ray diffraction pattern of chalcopyrite
1.3 细菌在黄铜矿表面的吸附
细菌吸附在固体反应物表面是生物浸出过程中的重要环节。硫化矿、元素硫的直接生物氧化,均通过细菌吸附在其表面进行。在细菌氧化黄铁矿的过程中,用透射电镜观察细菌在黄铁矿表面的吸附情况,结果如图4所示。
细菌氧化黄铜矿过程也是细菌吸附在矿石表面的过程,细菌对矿物的吸附具有选择性,易吸附于矿物颗粒自己形成的空洞、裂缝和缺陷处。吸附是微生物生命活动的基本特征。研究表明:细菌在菌毛和矿物表面黏附力的作用下,选择性地吸附在硫化矿物表面的晶界、位错区及某些活性中心(如空洞、裂缝和缺陷),利用其细胞内特有的活性酶的催化氧化作用,来获得自身新陈代谢所需的能量。
2 对钝化现象的讨论
2.1 硫膜
黄铜矿化学和生物氧化过程中有硫膜的中间产物形成,反应如下:
CuFeS2+4Fe3+→Cu2++5Fe2++2S0
在Fe2(SO4)3浸出体系中,黄铜矿浸出缓慢且不完全,90%以上的硫都被氧化成单质硫。Dutrizac[4]认为:在95 ℃时,化学浸出细粒黄铜矿(粒径为10~14 μm),50 h浸出90%的Cu,且矿物表面覆盖了一层逐渐增厚的表面层,主要成分是单质硫,并认为硫是阻碍反应物扩散的主要原因。Wan等[5]的研究表明:如果浸出中断并去除硫层,可以重新回到初始动力学状态。但是,Buttinelli等[6]指出:即使用有机溶剂将硫层去除,浸出过程仍然十分缓慢。Linge[7]认为浸出反应不应由多孔硫层内的反应物/产物扩散控制,但速度仍为固体产物层内的扩散控制。
在低温氧化浸出过程中,温度越高,酸度越低,就越容易产生![]() 产物。舒荣波等[8]在90 ℃时浸出极细颗粒(5 μm)的黄铜矿粉末,10 h后得到Cu浸出率为80%,认为硫及硫酸盐产物是导致反应速率缓慢的主要原因。
产物。舒荣波等[8]在90 ℃时浸出极细颗粒(5 μm)的黄铜矿粉末,10 h后得到Cu浸出率为80%,认为硫及硫酸盐产物是导致反应速率缓慢的主要原因。
2.2 多硫化物
Parker等[9-10]认为:钝化层是一层其他金属含量极少但Cu含量较高的多硫化物层,CuFeS2类型不同,其性质不同,其半导体性质也不同,并认为该多硫化物层阻碍了离子和电子的转移。
Holliday等[11]用旋转圆盘电极实验得出钝化层中Fe2+与Cu2+含量比约为5?1,并认为该过程发生如下反应:
CuFeS2→0.2Cu2++Fe2++Cu0.8S2+2.4e-
即在钝化层中有结构为Cu0.8S2的中间产物生成。
表1 黄铜矿的多元素分析结果(质量分数)
Table 1 Chemical compositions of chalcopyrite %

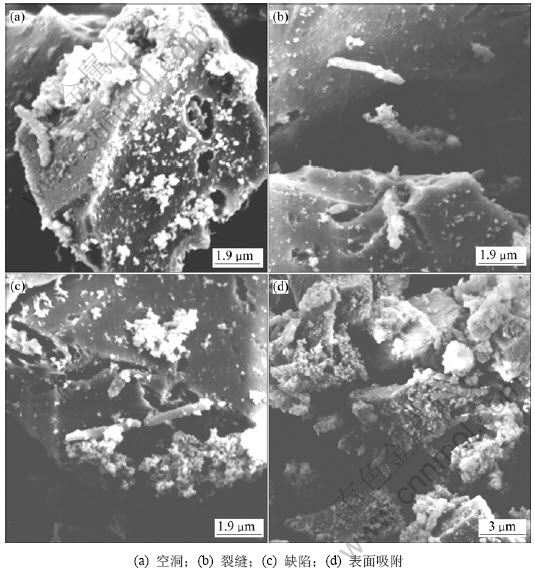
图4 细菌吸附透射电镜图
Fig.4 Transmission electron microscope images of bacteria adsorption
Buckley等[12]用XPS(X-ray photoelectron spectroscopy)研究了黄铜矿及其他硫化物的表面氧化,发现在黄铜矿氧化的初始阶段,Cu以一价与硫结合在一起;而当铁溶解进入溶液时,黄铜矿中无铁剩余部分仍保持原来的晶形,形成一个表面层,金属含量很低。溶解后的硫化矿结构不同于FeS2结构,原子并未重组,还是保持了原来黄铜矿的晶格。
Hackl等[13]用AES(Auger electron spectroscopy)和XPS研究了110~200 ℃时黄铜矿的化学浸出,发现S和铁盐的沉淀都不会影响黄铜矿的钝化,而钝化的主要原因就在于黄铜矿中Fe溶解未改变的晶格即铜的多硫化物。
Rodriguez等[14]认为:在黄铜矿生物浸出过程中,生成的钝化膜主要成分是多硫化物和硫膜;高温菌浸出渣的主要成分为黄钾铁矾,但对浸出过程似乎没什么影响;在黄铜矿和黄铁矿共同存在的情况下,黄铁矿不会出现钝化现象,因为其中间产物是硫酸盐而不是单质硫。
2.3 黄钾铁矾
Stott等[15]认为:黄铜矿在生物浸出过程中的钝化现象部分原因是铁水合物在矿物表面沉淀,主要是黄钾铁矾。反应式如下:
CuFeS2+4Fe3+→5Fe2++Cu2++2S0
2S0+2H2O+3O2→![]()
3Fe3++![]() +6H2O→
+6H2O→![]()
Sctott等[2]发现一些中等嗜热菌能够还原黄钾铁矾中的铁,从而使黄钾铁矾溶解(可达70%)。但是,用这种方法将黄钾铁矾部分除去并没有显著提高铜的浸出速率,只要在矿物表面沉积一层极薄的黄钾铁矾就能阻碍反应继续进行。
Parker等[16]用XPS研究了黄铜矿的氧化机理,认为黄铜矿的溶解是![]() 先受到破坏,
先受到破坏,![]() 把电子传给了Fe3+,自身立即紧密附着在黄铜矿反应界面上,通过表面质子化和水合作用,可能生成硫代硫酸盐;硫代硫酸盐又被进一步氧化成硫酸盐,生成的硫酸盐导致黄钾铁矾产生,最终导致黄铜矿氧化过程中的钝化行为。Cu离子仅仅在黄铜矿溶解后自然进入溶液中,表面层组成为包裹硫化物、二硫化物、元素硫、硫酸盐和黄钾铁矾,既无硫代硫酸盐也无多硫化物,至少可以说明它们并非反应速率的控制步骤。
把电子传给了Fe3+,自身立即紧密附着在黄铜矿反应界面上,通过表面质子化和水合作用,可能生成硫代硫酸盐;硫代硫酸盐又被进一步氧化成硫酸盐,生成的硫酸盐导致黄钾铁矾产生,最终导致黄铜矿氧化过程中的钝化行为。Cu离子仅仅在黄铜矿溶解后自然进入溶液中,表面层组成为包裹硫化物、二硫化物、元素硫、硫酸盐和黄钾铁矾,既无硫代硫酸盐也无多硫化物,至少可以说明它们并非反应速率的控制步骤。
Sandstrom等[17-19]提出:黄铜矿在2种浸出环境(生物浸出和化学浸出)中都表现为低电位下浸出速率较快,而在化学浸出环境下,生成了大量单质硫,在高电位环境中生成大量黄钾铁矾,并产生钝化现象。在生物浸出过程中,硫能完全氧化为硫酸,即使在氧化还原电位较低的情况下也是如此,从而得出:黄铜矿浸出过程的钝化现象主要由黄钾铁矾造成,而并非单质硫所致。
3 解决钝化的有效途径
3.1 Ag+催化
Miller[20]提出了在浸出液中添加Ag+的方法, 取得了较好的浸出效果。后来, 研究者对Ag+催化常温生物浸出进行了大量研究,结果表明:Ag+在黄铜矿表面反应产生Ag2S,改善了黄铜矿阳极溶解特性。主要反应如下:
CuFeS2++4Ag+=2Ag2S+Cu++Fe2+ (晶格取代)
4Fe2++O2+4H+=4Fe3++2H2O (细菌作用)
Ag2S+2Fe3+=2Ag++2Fe2++S (化学再生)
2S0+3O2+2H2O=2H2SO4 (细菌作用)
Mier等[21]研究了Ag和Bi催化浸出黄铜矿的不同。银与黄铜矿表面反应生成Ag2S层,该产物不在黄铜矿表面沉淀,从而加速了黄铜矿的溶解。而Bi则阻止了铁沉淀的生成,提高了(Fe3+/Fe2+)氧化还原电位,加速了黄铜矿的溶解。
3.2 原电池效应
Mehta等[22]研究了在有菌与无菌时混合硫化矿的浸出,结果表明:黄铁矿和黄铜矿的浸出率比单一黄铜矿的铜浸出率高4.6倍,加入细菌可使浸出率再提高2.1倍。Sadnwski等[23]认为:微生物浸出黄铜矿时,添加浓度为3%的FeS2可以增大黄铜矿的最初浸出速率,浸出48 h后,铜浸出率急剧增加到60%;此后,浸出速度减缓,浸出312 h后,铜浸出率达到86%。
3.3 中高温菌的生物浸出技术
研究表明:采用中高温菌浸出黄铜矿,可以大大缩短浸出时间,提高铜浸出率。该技术大部分用于黄铜矿精矿的生物搅拌浸出。Hugues等[24]的实验结果表明:嗜热嗜酸菌(78 ℃)在10%的矿浆浓度下搅拌浸出黄铜矿精矿5 d,铜浸出率可达90%以上,同时,浸出残渣中有大量的元素硫和黄钾铁矾沉淀产生。采用中高温菌能有效解决生物浸出过程中的钝化现象。
国外黄铜矿的生物搅拌浸出工艺已处于工业应用阶段。如BHP Billiton公司采用极端嗜热嗜酸菌在Spence建成生物搅拌浸出—萃取—电积工业试验厂,处理含砷黄铜矿精矿,作业温度为75~80 ℃,浸出周期为7~10 d,铜浸出率能达到95%[25]。
国外黄铜矿的生物堆浸工艺也取得突破性进展。BHP Billiton公司正在建设低品位黄铜矿生物堆浸试验厂[24]。
4 结论与建议
通过实验室研究得出:中等嗜热菌是解决黄铜矿生物浸出难题的有效途径之一。
根据我国矿产资源特点,要解决黄铜矿生物堆浸的难题,笔者认为主要有以下几个方面着手:
(1) 高效浸矿菌种的选育,尤其是中等嗜热菌和极端嗜热嗜酸菌浸出工艺的研究与应用。
(2) 生物堆浸过程中多因素的耦合和关联匹配以及优化,包括矿物因素、物理化学因素以及微生物群落结构与功能等。
(3) 从基因水平分析生物浸出过程中微生物种群的多样性及浸矿机理。
参考文献:
[1] 陈平. 结晶矿物学[M]. 北京: 化学工业出版社, 2006: 128.
CHEN Ping. Crystallography and mineralogy[M]. Beijing: Chemical Industry Press, 2006: 128.
[2] Scott D J. The mineralogy of copper leaching: Concentrates and heaps, copper’91[C]//Copper Hydrometallurgy Short Course. Santiago, 1995: 65.
[3] Rawlings D E. Biomining: Theory, microbes and industrial processed[M]. New York: Springer-Verlag, 1997: 229-245.
[4] Dutrizac J E. Elemental sulphur formation during the ferric sulphate leaching of chalcopyrite[J]. Can Metall Q, 1989, 28(4): 337-344.
[5] Wan R Y, Miller J D, Simkovich G. Enhanced ferric sulphate leaching of copper from CuFeS2 and C particulate aggregates[C]//Mintek 50: International Conference on Mineral Science and Technology. Haughtan L F. Randburg: The Council for Mineral Technology, 1984: 575-588.
[6] Buttinelli D. Leaching by ferric sulphate of raw and concentrated copper-zinc complex sulphide ores[J]. International Journal of Mineral Processing, 1992, 36(4): 245-257.
[7] Linge H G. A study of chalcopyrite dissolution in acidic ferric nitrate by potentiometric titration[J]. Hydrometallurgy, 1996, 20(3): 145-146.
[8] 舒荣波. 黄铜矿生物及其钝化现象研究[D]. 北京: 北京有色金属研究总院, 2006: 10-26.
SHU Rong-bo. Studies on the passivation of chalcopyrite during bioleaching process[D]. Beijing: General Research Institute for Nonferrous Metals, 2006: 10-26.
[9] Parker A J, Paul R L, Power G P. Electrochemical aspects of leaching copper from chalcopyrite in ferric and cupric salt solutions[J]. Aust J Chem, 1981, 34(5): 13-34.
[10] Parker A J, Paul R L, Power G P. Electrochemistry of the oxidative leaching of copper from chalcopyrite[J]. J Electroanal Chem, 1981, 118(2): 305-316.
[11] Holliday R J, Richmond W R. An electrochemical study of the oxidation of chalcopyrite in acidic solution[J]. J Electroanal Chem, 1990, 288(6): 83-98.
[12] Buckley A N, Woods R. An X-ray photoelectron spectroscopic study of the oxidation of chalcopyrite[J]. Aust J Chem, 1984, 37(4): 2403-2413.
[13] Hackl R P, Dreisiger D B, King J A. Effect of sulfur-dispersing surfactants on the oxygen pressure leaching of chalcopyrite[C]// Copper’95. Santiago, Chile, 1995: 26-29.
[14] Rodriguez Y, Ballester A, Blazquez M L. New information on the chalcopyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003, 71(5): 47-56.
[15] Stott M B, Walthing H R, Frauzmann P D, et al. The role of iron-hydroxy precipitates in the passivation of chalcopyrite during bioleaching[J]. Minerals Engineering, 2000, 13(10): 1117-1127.
[16] Parker A. An X-ray photoelectronspectroscopy study of the mechanism of oxidative dissolution of CuFeS2[J]. Hydrometallurgy, 2003, 71(3): 265-276.
[17] Sandstrom A. XPS characterisation of chalcopyrite chemically and bioleached at high and low redox potential[J]. Minerals Engineering, 2005, 18(4): 505-515.
[18] Warren G W, Sohn H J, Wadsworth M E, et al. The effect of electrolyte composition on the cathodic reduction of CuFeS2[J]. Hydrometallurgy, 1985, 14(2): 133-149.
[19] Watling H R. The bioleaching of sulphide minerals with emphasis on copper sulphides: A review[J]. Hydrometallurgy, 2006, 84(3): 81-108.
[20] Miller J D. Electrochemistry in silver catalyzed ferric sulfate leaching of chalcopyrite[C]//Process and Fundamental Considerations of Selected Hydrometallurgical Systems. SEM-AIME 27, 1981: 327-340.
[21] Mier J L. Influence of metallic ions in the bioleaching of chalcopyrite by Sulfolobus BC experiments using pneumatically stirred reactors and massive samples[J]. Minerals Engineering, 1995, 8(4): 949.
[22] Mehta A P, Murr E. Fundamental studies of the contribution of galvanic interaction to acid-bacterial leaching of mixed metal sulfides[J]. Hydrometallurgy, 1983, 9(3): 235.
[23] Sadnwski Z, Jazdzyk E, Karas H. Bioleaching of copper ore flotation concentrates[J]. Minerals Engineering, 2003, 16(4): 51-53.
[24] Hugues P D. Continuous bioleaching of chalcopyrite using a novel extremely thermophilic mixed culture[J]. Int J Miner Process, 2002, 66(4): 107.
[25] 杨显万, 沈庆峰, 郭玉霞. 微生物湿法冶金[M]. 北京: 冶金工业出版社, 2003: 85-120.
YANG Xian-wan, SHEN Qing-feng, GUO Yu-xia. Microbial hydrometallurgy[M]. Beijing: The Metallurgical Industry Press, 2003: 85-120.
收稿日期:2009-10-21;修回日期:2009-12-28
基金项目:国家高技术研究发展计划(“863”计划)项目(2007AA060901)
通信作者:姚国成(1975-),男,重庆人,博士研究生,高级工程师,从事生物冶金和原生电位调控浮选等研究;电话:010-82241888;E-mail: ygc@cae.cn
(编辑 陈灿华)


