文章编号:1004-0609(2008)S1-0192-07
Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中Zn(Ⅱ)配合平衡
王瑞祥1, 2,唐谟堂1,杨建广1 ,杨声海1,张文海1,唐朝波1,何 静1
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 江西理工大学 材料与化学工程学院,赣州 341000)
摘 要:
用双平衡法研究Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中Zn(Ⅱ)配合平衡热力学,求出氨水浓度和氯离子浓度在0~10 mol/L范围内变化时,体系中各物种的平衡浓度,绘制热力学平衡图,并对热力学计算结果进行实验验证和差异分析。结果表明:锌离子浓度理论计算值与实验值之间的平均相对误差为7.47%,这说明该热力学模型是正确的,所选数据的准确性较好。
关键词:
中图分类号:TF 813 文献标识码:A
Thermodynamics of Zn(Ⅱ) complex equilibrium in system of Zn(Ⅱ)-NH3-Cl--CO32--H2O
WANG Rui-xiang1, 2, TANG Mo-tang1, YANG Jian-guang1, YANG Sheng-hai1,ZHAGN Wen-hai1, TANG Chao-bo1, HE Jing1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Faculty of Materials and Chemical Engineering, Jiangxi University of Science and Technology,Ganzhou 341000, China)
Abstract: Thermodynamics of Zn(Ⅱ) complex equilibrium in the system of Zn(Ⅱ)-NH3-Cl--CO32--H2O was studied by the double equilibrium method. Varying the concentration of ammonia and chloride ion, respectively, in range of 0~10 mol/L, the equilibrium concentrations of all the species in the system were calculated, and thermodynamic diagrams were plotted. The relative errors between theoretic calculation and the experimental values of total concentration of zinc were analyzed. The results show that the relative average error between the theoretic calculation and the experimental values is 7.47%. The critical data and the thermodynamic model are believable.
Key words: Thermodynamics; Zn (Ⅱ) complex equilibrium; double equilibrium method
随着锌产品需求的持续增长[1],低品位氧化锌矿的开发利用越来越重要,因此人们越来越重视研究新的湿法冶金方法从低品位氧化锌矿中提取锌[2-3]。氨法冶金在碱性体系中进行,由于自身的优越性近年来倍受人们关注[4-5],因此深入开展氨浸法处理低品位氧化锌矿的理论研究,对推动湿法炼锌技术的进步具有深远的意义。
针对氨浸法处理低品位氧化锌矿的热力学,国内外科技工作者开展了一系列研究,YANG等[6]和巨少华等[7]研究了ZnO-NH3-NH4Cl-H2O体系的热力学,但在研究过程中没有考虑锌与氨和氯之间形成的ZnCl3(NH3)-等复杂配合物[8],同时也没有考虑CO32-对平衡的影响。而实际上在氧化锌矿中大量存在的氧化锌物相是碱式碳酸锌,单纯的ZnO物相几乎没有,碱式碳酸锌溶解后生成大量的CO32-,对体系平衡有着重大影响。石西昌等[9]研究了Zn-Cl--NH3-CO22--H2O系的热力学,也同样没有考虑ZnCl3(NH3)-等复杂配合物,更没有考虑电荷平衡。因此在工程应用时,这些关于金属Zn或者ZnO与氨和氯之间的平衡热力学研究成果具有一定的局限性。
本文作者综合考虑Zn(Ⅱ)与NH3、Cl-、OH-及CO32-等配位体之间的配合平衡问题,采用基于质量平衡和电荷平衡的双平衡原理,利用已有的配合物稳定常数等热力学数据,对Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中Zn(Ⅱ)的配合平衡热力学进行了深入研究,绘制了多种热力学关系图,使金属离子浓度与配位体浓度的隐性关系转化为显性关系,并以实验进行验证,这些研究结果对氨法炼锌具有重要意义。
1 热力学数据
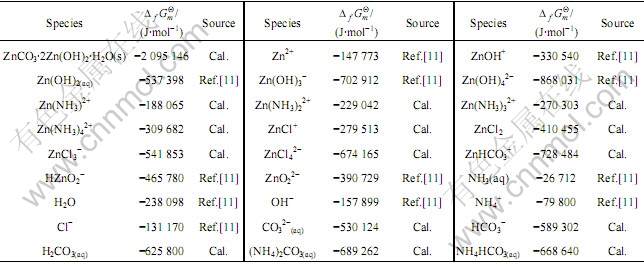
Zn(Ⅱ)-NH3-Cl--CO32--H2O体系是一个十分复杂的体系,体系中存在的物种有Zn2+、Zn(NH3)2+、Zn(NH3)22+、Zn(NH3)32+、Zn(NH3)42+、ZnCl+、ZnCl2( aq)、ZnCl3-、ZnCl42-、Zn(OH)+、Zn(OH)2( aq)、Zn(OH)3-、Zn(OH)42-、HZnO2-、ZnO22-、ZnHCO3+、ZnCl3(NH3)-、H2CO3(aq)、HCO3-、CO32-、(NH4)2CO3(aq)、(NH4)HCO3(aq)、Cl-、NH3( aq)、NH4+、H+、OH- 共27种,锌配合物的稳定常数[10]如表1所列,其他相关化合物的标准生成吉布斯自由能[11]如表2所列。
表1 锌配合物稳定常数[10](T=298 K)
Table 1 Critical stability constants of zinc complexes at 298 K
![]()
表2 相关物种的标准自由能[11](T=298 K)
Table 2 Gibbs free energy of related species at 298 K
2 热力学分析和模型建立
在Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中可能存在的固相物质有ZnCO3·2Zn(OH)2·H2O(s)、ZnCO3(s)、Zn(OH)2(s)和ZnCl2(NH3)2(s)共4种,它们的溶度积[12]如表3所列。
表3 有关固相物质的溶度积[12]
Table 3 Ksp of solid phase at 298 K
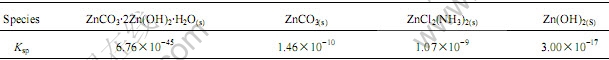
在采用纯NH4Cl作为浸出剂浸出含锌物料时,会生成ZnCl2(NH3)2沉淀[8],而当有氨水存在时不会出现ZnCl2(NH3)2沉淀,即在Zn(Ⅱ)-NH3-Cl--CO32-- H2O体系中,只有在NH3浓度为零的临界条件下才有可能出现ZnCl2(NH3)2沉淀。因此,在本研究中没有将ZnCl2(NH3)2(s)列入模型。而对于ZnCO3(s)、Zn(OH)2(s)、ZnCO3·2Zn(OH)2·H2O(s) 3种固相物质,在Zn(Ⅱ)-NH3- Cl--CO32--H2O体系中存在的固相物质为ZnCO3·2Zn(OH)2·H2O(s)[12],因此在本研究中根据同时平衡原理,每种锌配合离子或物种均与ZnCO3·2Zn(OH)2·H2O(s)平衡:
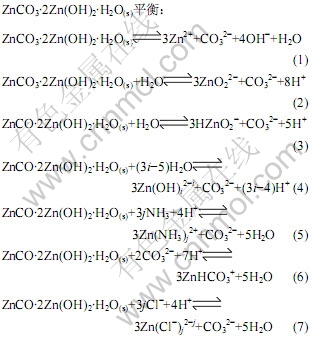
根据双平衡电算指数法[13-14],Zn(Ⅱ)-NH3-Cl-- CO32--H2O体系中,离子或配合物的摩尔浓度可以用以下通式表示:
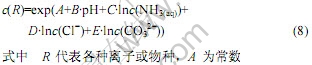
可由反应式平衡方程求得,B为配合物得失质子数与ln10的乘积,C、D、E分别为氨、氯离子和碳酸根离子的配位数。根据以上表中的数据和化学反应方程式,可以计算出各物种浓度表达式中的A、B、C、D和E值列于表4。
表4 各离子的电算指数常数
Table 4 Constants in exponential for calculating species concentration
另外,根据质量守衡定律中建立锌量、氨量、氯量以及碳量平衡方程:
![]()
![]()
![]() (9)
(9)
![]()
![]()
![]() (10)
(10)
![]() (11)
(11)
![]()
![]()
(12)
根据溶液电中性原理,建立电荷平衡方程:
2?c(Zn2+)T+c(NH4+)+c(H+)=c(Cl-)T+c(OH-)+2?c(CO32-)T (13)
式中 c(Zn2+)T和c(Zn2+)以及c(Cl-)T和c(Cl-)分别表示锌离子和氯根的总摩尔浓度以及游离锌离子和游离氯离子的摩尔浓度,c(CO32-)T为溶液中碳酸根的总摩尔浓度,c(NH3)T为溶液中氨和铵的总摩尔浓度,c(NH3(aq))表示游离氨的摩尔浓度,i、j及k分别表示氨、羟基和氯根等配体的配位数。
在以上模型中,有平衡方程式(9)~(13),共有pH、c(NH3(aq))、c(NH3)T、c(Zn2+)T、c(Cl-)T、c(Cl-(aq))、c(CO32-)和c(CO32-)T 8个未知数,由于体系中所有的锌和碳酸根全部由 ZnCO3·2Zn(OH)2·H2O分解产生,所以体系中总锌含量c(Zn2+)T等于总碳酸根含量c(CO32-)T的3倍。因此模型求解时,实际未知数的数量为7个,给定其中两个未知数,求解这个模型,便可以得到其他未知数的值。
在实际计算过程中,因为浸出剂的组成为NH4Cl和NH4OH(氨水),所以在这个体系中,可以选择给定它们的初始浓度值。其中c(NH4OH)=c(NH3)T-c(Cl-)T,c(NH4Cl)=c(Cl-)T。
这样,模型中就共有5个未知数,5个方程。将以上已知数据和方程组输入由MATLAB[15]编写的程序,求出了c(NH4Cl)和c(NH4OH)分别在0~10 mol/L的变化范围里的其它未知的浓度数值和pH值。
3 结果与讨论
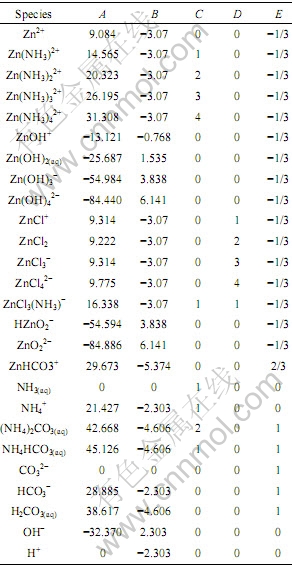
根据计算结果,利用MATLAB绘制出体系平衡时pH值随c(NH4OH)和c(NH4Cl)的变化情况如图1所示。由图1可以看出,pH值随c(NH4OH)的增加而增大,最大达到13.17。随c(NH4Cl)的增大而减小,最小达到6.71。
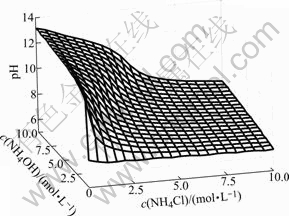
图1 pH值与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.1 Relationship of pH with c(NH4OH) and c(NH4Cl)
游离c(Cl-(aq))随c(NH4OH)和c(NH4Cl)的变化情况如图2所示。由图2可以看出,游离氯离子浓度总的变化趋势是随着氯化铵浓度的增大而增大。当氨水浓度较低时,游离氯离子浓度先是随着氯化铵浓度增加快速增大,但当氯化铵浓度超过2.5 mol/L后,游离氯离子浓度随氯化铵浓度增加而增大的速度趋缓,主要是因为氨离子浓度低,氯离子与锌离子配位,生成了锌与氯的配离子ZnCli2-i,这一点可以由图3清楚地看出。当氨水浓度较高时,游离氯离子浓度随着氯化铵浓度增加而接近直线增大。主要是NH3与Zn的配位能力大,有氨存在时,氨和锌优先配位,溶液中绝大多数Zn2+与NH3形成配合物,因而氯离子浓度直线升高。
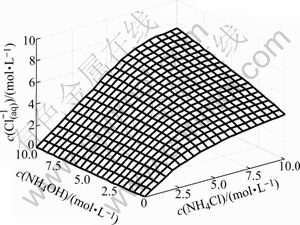
图2 c(Cl-(aq))与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.2 Relationship of c(Cl-(aq)) with c(NH4OH) and c(NH4Cl)
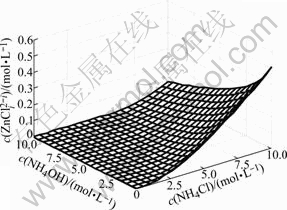
图3 c(ZnCli2-i)与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.3 Relationship of c(ZnCli2-i) with c(NH4OH) and c(NH4Cl)
游离c(NH3(aq))浓度随c(NH4OH)和c(NH4Cl)的变化情况如图4所示。由图4可以看出,当c(NH4OH)/ c(NH4Cl)小于2?1时,游离氨浓度几乎为0,当c(NH4OH)/c(NH4Cl)大于2?1时,游离氨浓度快速增加,这是因为当c(NH4OH)/c(NH4Cl)小于2?1时,几乎所有的NH3都与Zn2+配位,形成了Zn(NH3)i2+配合物。
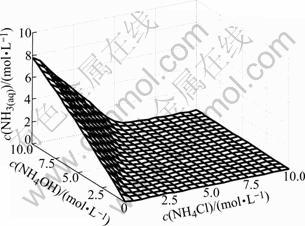
图4 c(NH3(aq))与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.4 Relationship of c(NH3(aq)) with c(NH4OH) and c(NH4Cl)
总c(Zn)T浓度随c(NH4OH)和c(NH4Cl)的变化情况如图5所示。由图5可以看出,在c(NH4OH)/c(NH4Cl)小于2?1时,当c(NH4Cl)一定,c(Zn2+)T随着c(NH4OH)的增加而直线增大;当c(NH4OH)一定时,c(Zn2+)T随着c(NH4Cl)的增加而快速增大。在c(NH4OH)/c(NH4Cl)大于2?1时,当c(NH4Cl)一定,c(NH4OH)的增加对c(Zn2+)T影响不大;当c(NH4OH)一定时,c(Zn2+)T随着c(NH4Cl)的增加而直线增大。这说明当平衡过程中有CO32+生成时,适当提高氨水浓度有利于提高过程的总锌浓度。这些现象与不考虑CO32-时Zn-NH3-NH4Cl体系有较大差异,不考虑CO32-时Zn-NH3-NH4Cl体系c(Zn)T浓度随c(NH4OH)和c(NH4Cl)的变化情况如图6所示。由图6可见,当c(NH4Cl)一定时,c(Zn2+)T随c(NH4OH)的增加而增大,直到c(NH4OH)与c(NH4Cl)相等时,c(Zn2+)T达到最大值,即使继续向体系中添加NH4OH,c(Zn2+)T也不会再增加。
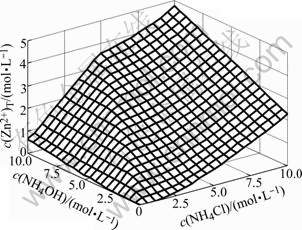
图5 c(Zn2+)T与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.5 Relationship of c(Zn2+)T with c(NH4OH) and c(NH4Cl)
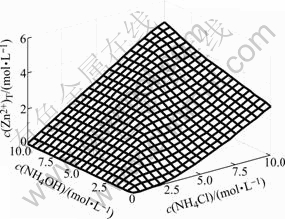
图6 Zn(Ⅱ)-NH3-NH4Cl-H2O体系中c(Zn2+)T与c(NH4OH)和c(NH4Cl)的曲面关系
Fig.6 Relationship of c(Zn2+)T with c(NH4OH) and c(NH4Cl) in system of Zn(Ⅱ)-NH3-Cl--CO32--H2O
4 实验验证
将配好的相应浓度的NH3-NH4Cl水溶液和过量的分析纯ZnCO3·2Zn(OH)2·H2O混合,在25 ℃下搅拌72 h,液固分离,分析溶液中的锌浓度。实验值与理论计算值如表5所列。
表5 不同的c(NH4Cl)和c(NH4OH)下,溶液中平衡c(Zn2+)T的实验值和计算值比较
Table 5 Experimental and calculated values of equilibrium c(Zn2+)T under different c(NH4Cl) and c(NH4OH)
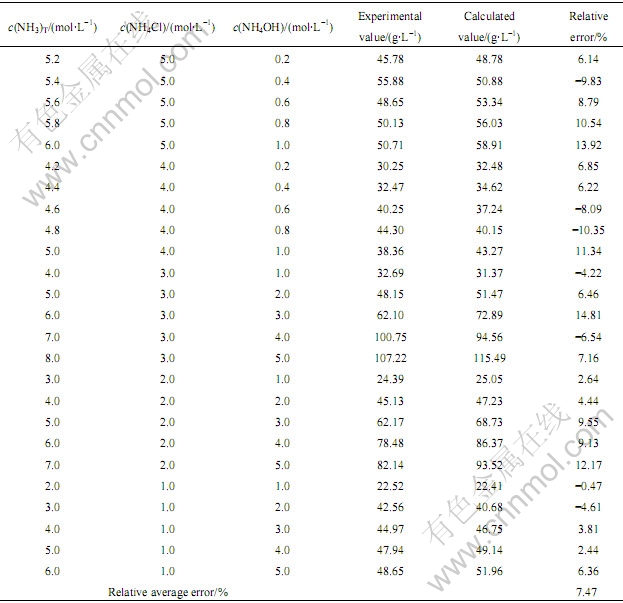
从表5可以看出,在不同的氨和铵浓度下,锌平衡浓度相对误差的绝对平均值为7.47%,这说明该热力学模型是正确的,所选数据的准确性较好,产生大于5%误差的主要原因是用质量摩尔浓度代替活度,其次是实验和分析误差。所构建的热力学图可用来确定浸出剂的成分,优化浸出剂结构,在较高的氯化铵浓度下,大幅降低氨水浓度,同样可以获得较高的锌平衡浓度,可以有效减少氨水挥发,对低品位氧化锌矿的氨法冶炼具有重要的理论指导意义和学术价值。
5 结论
1) 根据电算指数法建立了较精确的Zn(Ⅱ)-NH3- Cl--CO32--H2O体系的热力学模型,通过对模型求解,绘制了各种重要的热力学关系图,反映了体系的热力学规律。
2) 理论计算结果与实验数据符合的较好,锌平衡浓度相对偏差的绝对平均值为7.47%。
3) 在较高的氯化铵浓度下,大幅降低氨水浓度,同样可以获得较高的锌平衡浓度,可以有效减少氨法处理低品位氧化锌矿过程的氨水挥发损失。
REFERENCES
[1] 蒋继穆.我国铅锌冶炼现状与持续发展[J].中国有色金属学报, 2004, 14(1): 52-62.
JIANG Ji-mu. Status and sustainable development of lead and zinc smelting industry in China [J]. The Chinese Journal of Nonferrous Metals, 2004, 14(1): 52-62.
[2] JU Shao-hua, TANG Mo-tang, YANG Sheng-hai. Dissolution kinetics of smithsonite ore in ammonium chloride solution [J]. Hydrometallurgy, 2005, 80: 67-74.
[3] 杨大锦, 谢 刚, 贾云芝, 杨德明, 彭建蓉. 低品位氧化锌矿堆浸实验研究[J]. 过程工程学报, 2006, 6(1): 59-61.
YANG Da-jin, XIE Gang, JIA Yun-zhi, YANG De-ming, PENG Jian-rong. Study on heap leaching of low-grade zinc oxide ore [J]. The Chinese Journal of Process Engineering, 2006, 6(1): 59-61.
[4] JU Sao-hua, TANG Mo-tang, YANG Sheng-hai. Fundamental thermodynamic and technologic study for extracting gold from low-grade gold ore in system of NH4Cl-NH3-H2O [J]. Trans Nonferrous Met Soc China, 2006,16(1): 203-208.
[5] YANG Sheng-hai, TANG Mo-tang, CHEN Yi-feng, TANG Chao-bo, HE Jing. Anodic reaction kinetics of electrowinning zinc in system of Zn(II)-NH3-NH4Cl-H2O [J]. Trans Nonferrous Met Soc China, 2004, 14(3): 626-630.
[6] YANG Sheng-hai, TANG Mo-tang. Thermodynamics of Zn(Ⅱ)NH3-NH4Cl-H2O system [J]. Trans Nonferrous Met Soc China, 2000, 10(6): 830-833.
[7] 巨少华, 唐谟堂, 杨声海. 用MATLAB 编程求解Zn(Ⅱ)NH3-NH4Cl-H2O体系热力学模型 [J]. 中南大学学报: 自然科学版, 2005, 36(5): 821-827.
JU Sao-hua, TANG Mo-tang, YANG Sheng-hai. Thermo- dynamic model of Zn(Ⅱ)NH3-NH4Cl-H2O system using MATLAB programming [J]. Journal of Central South University: Science and Technology, 2005, 36(5): 821-827.
[8] LIMPO J L, LUIS A, CRISTINA M C. Solubility of zinc chloride in ammoniacal ammonium chloride solutions [J]. Hydrometallurgy, 1993, 32: 247-260.
[9] 石西昌, 赵瑞荣, 蒋汉赢. Zn-Cl--NH3-CO22-- H2O系的热力学分析[J]. 中南工业大学学报: 自然科学版, 1998, 29(2): 193- 196.
SHI Xi-chang, ZHAO Rui-rong, JIANG Han-ying. Thermo- dynamic analysis on system of Zn-Cl--NH3- CO22-- H2O [J]. J Cent South Univ Technol: Natural Science Edition, 1998, 29(2): 193-196.
[10] SMITH R M, MATELL A E. Critical stability constants inorganic complexes [M]. New York: Plenum Press, 1976.
[11] DEAN A J. Langes handbook of chemistry [M]. 14th Ed. New York: Plenum Press, 2001.
[12] 张保平. 锰锌软磁铁氧体前躯体碳酸盐共沉淀过程基础理论及工艺研究[D].长沙: 中南大学, 2004.
ZHANG Bao-ping. The basic and technical research on the coprecipitation by carbonate process of Mn-Zn soft magnetic ferrite precursor [D]. Changsha: Central South University, 2004.
[13] TANG Mo-tang, ZHAO Tian-cong. A thermodynamic study on the basic and negative potential fields of the systems of Sb-S-H2O and Sb-Na-S-H2O [J]. J Cent South Inst Min Metall, 1988, 19(1): 35-43.
[14] TANG Mo-tang, ZHAO-Tian cong, LU Jun-le. Principle and application of the new chlorination-hydrolization process [J]. J Cent South Inst Min Metall, 1992, 23(4): 405-411.
[15] 王沫然. MATLAB与科学计算[M]. 北京: 电子工业出版社, 2003.
WANG Mo-ran. MATLAB and science calcunation [M]. Beijing: Electronic Industry Press, 2003.
基金项目:国家重点基础研究发展计划资助项目(2007CB613604);国家自然科学基金资助项目(50674104);江西省教育厅科技计划资助项目(GJJ08279)
通讯作者:王瑞祥,博士;电话:0731-8830470;E-mail:wrx9022@163.com


