文章编号:1004-0609(2016)-05-1136-07
三价铬镀液组分的存在形式及其对电镀的影响规律
刘 洋,王明涌,栗 磊,王 志
(中国科学院 过程工程研究所 湿法冶金清洁生产技术国家工程实验室
绿色过程与工程重点实验室,北京 100190)
摘 要:
通过理论计算和电镀实验研究镀液核心组分存在形式及其对铬电镀的影响规律。结果表明:络合剂脲或甲酸98%以上是以分子形式与Cr(Ⅲ)离子形成三价铬活性络合物。根据三价铬络合物平衡构象图发现:相比于CrL3+,Cr(OH)L2+更高的电化学活性归因于较大的水分子-中心铬离子距离。通过增加三价铬活性络合物浓度,能显著提高铬电镀速率,可高达1.2 μm /min;缓冲剂硼酸主要以B(OH)3的形式存在,最佳pH缓冲范围为8~10,而Al3+最佳的pH缓冲范围为3~3.5。加入0.6 mol/L Al3+使铬镀层边缘和中心厚度之比(hcorner/hcenter)从11降低至2;而加入1 mol/L硼酸仅使hcorner/hcenter从5降低至3,Al3+改善镀层均匀性的作用更为明显。
关键词: 镀液组分;三价铬活性络合物;电镀速率;镀层均匀性
中图分类号:TQ151.8 文献标志码:A
六价铬电镀因环保问题受到限制,三价铬绿色电镀技术备受关注。1854年,人们最早从三价铬溶液中电沉积金属铬的研究[1]。然而,由于六价电镀技术的快速发展,直到1974年,才开发出真正实用化的Alecra-3氯化物三价铬电镀工艺[2]。1981年,英国研究者开发了硫酸盐三价铬电镀工艺[3]。至20世纪后期,三价铬电镀工艺得到迅速发展。2003年,MacDermid公司推出了硫酸盐三价铬电镀液MacDermidⅢ,使电镀速率得到明显提高,满足了三价铬电镀装饰性镀层的基本要求[4],电镀光亮铬已经逐步开始工业化应用。三价铬体系电镀厚铬和铬基合金以改善镀层的物理化学性能也受到越来越广泛的关注[5-6]。
一般认为在简单三价铬电镀液中,Cr(Ⅲ)以正八面体配位化合物Cr(H2O)63+形式存在,这种化合物十分稳定,难以直接电化学还原为金属铬。同时,析氢副反应极为剧烈,使阴极界面OH-大量聚集,与Cr(H2O)63+反应生成稳定的羟桥化合物,阻止了Cr(Ⅲ)的还原[7]。为了实现三价铬的电化学还原,通常需要在三价铬镀液中引入一定量的有机弱酸、酰胺或胺等有机配位体。POLUKAROV等[8]认为有机分子可取代Cr(H2O)63+中的水分子,生成活性铬络合物。而E1-SHARIF等[9]则认为有机酸可以阻碍羟桥化合物的形成,从而促进Cr(Ⅲ)的电还原。ZENG等[10]证实在简单的三价铬溶液中,三价铬离子以Cr(H2O)63+形式存在,通过与配位剂的络合反应生成具有电化学活性的Cr(H2O)5L3+。HE等[11]在离子液体体系研究了三价铬的电化学还原行为。
三价铬镀液主要由主盐、络合剂、缓冲剂、导电盐和添加剂等组成,其中络合剂和添加剂主要为各种有机小分子化合物,导致镀液成分和性质复杂[11-12]。镀液组分及其存在形态显著影响铬活性络合物生成、三价铬电镀工艺和镀层质量[13-16]。然而,目前尚没有对电镀条件下三价铬镀液核心组分的存在形式进行深入的认识。本文作者系统分析镀液核心组分如主盐、络合剂、缓冲剂等在镀液中的存在形式,并研究镀液组分对三价铬电镀的影响规律。
1 实验
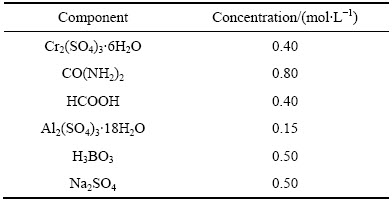
三价铬镀液成分见表1。除Cr2(SO4)3·6H2O为化学纯外,其余试剂均为分析纯。镀液用去离子水配制。
镀液配制方法:先称取392 g溶质质量分数为40%的硫酸铬溶液,加入去离子水,缓慢加入48 g脲,混合均匀后,补充去离子水至500 mL,放入90 ℃振荡器中加热3 h;待上述溶液冷却到室温后,依次加入甲酸、硫酸铝、硼酸、硫酸钠,加入去离子水混合均匀,然后调节pH,定容至1 L。电镀前,镀液pH调节到1.5。
表1 三价铬镀液成分
Table 1 Compositions of Cr(III) baths
采用单槽电镀,阳极采用3 cm×3 cm的铱钽涂层电极,阴极采用4 cm×4 cm的抛光铜片。铜基底首先除蜡,用去离子水清洗,打磨抛光,然后电化学抛光,水洗,干燥后备用。在电镀前,铜基底须先用10%(质量分数)盐酸浸泡5 min。采用恒流电镀,镀液pH为1.5,电流密度为20 A/dm2,温度为30 ℃。
铬镀层点厚度测量采用ET-2型微电脑多功能电解测厚仪测量,根据法拉第定律,当电流与电解面积一定时,镀层厚度由电解时间决定。铬镀层平均厚度用称取质量法测量,称取质量法[17]是先将沉积有镀层的镀件用去离子水清洗干净后,干燥后称取质量;再用30%(质量分数)盐酸将镀件浸泡10 min,使铬镀层溶解,用去离子水清洗干净,干燥后称量,两者之差为镀层质量m(g)。铬的平均沉积速率按下式计算:
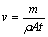 (1)
(1)
式中:ν为铬镀层沉积速率,cm/min;ρ为铬密度,7.19 g/cm3;A为基底面积,cm2;t为通电时间,min。
2 结果与讨论
2.1 铬离子的存在形式
在单纯硫酸铬溶液中,Cr(Ⅲ)以多种络离子的形式存在,并呈现紫色和绿色两种颜色。Cr(H2O)3+呈紫色,当有硫酸根离子进入Cr(H2O)3+內界时,溶液转变为绿色,且硫酸根取代数越多绿色越深[18]。本研究中所使用的硫酸铬是绿色的,应有一定量的Crm(SO4)n(3m-2n)存在。VINOKUROV等[19]总结了硫酸铬水溶液中可能存在的三价铬络合离子及相应的稳定常数,硫酸铬溶液中存在多种铬络合物,且其组成与溶液pH有关。在pH一定时,利用铬元素守恒(式(2))和硫元素(式(3))可计算出各组分的平衡组成。
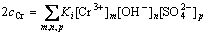 (2)
(2)
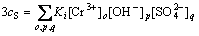 (3)
(3)
式中:cCr和cS分别为溶液中Cr元素和S元素的浓度,mol/L;m、n、l、o、p、q为与各离子计量数相关的常数;Ki为稳定常数。
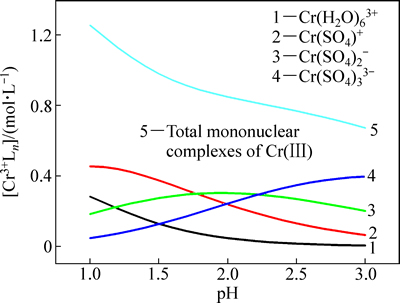
图1 0.8 mol/L硫酸铬水溶液中pH对三价铬单核络合物存在形式的影响
Fig. 1 Effects pH on form of trivalent chromium mononuclear complexes in 0.8 mol/L Cr2(SO4)3 aqueous solution
当硫酸铬浓度为0.8 mol/L时,计算出溶液中主要的单核铬络合物及总单核铬络合物浓度,如图1所示。本研究中所使用的硫酸铬为绿色溶液,即pH大于1.5时,Cr(SO4)+、Cr(SO4)2-、Cr(SO4)33-的浓度都大于Cr(H2O)63+的浓度,这与上面所说的硫酸根离子进入了Cr(H2O)63+內界溶液变为绿色相符合。随着pH增加,Cr(H2O)63+和Cr(SO4)+浓度减少,Cr(SO4)33-浓度增加,而Cr(SO4)2-先增加再减少,但总单核铬络合物浓度降低。值得注意的是,Cr(H2O)63+的浓度随着溶液pH升高而降低,当pH值为1.5时,其浓度仅为0.1 mol/L。该结论与ZENG等[10]分析活性络合物组成时,所假设的溶液中铬离子全部以Cr(H2O)63+形式存在明显不同。
2.2 络合剂的存在形式
甲酸是三价铬镀液最常用的一种羧酸类络合剂。甲酸可分解为HCOO-与H+,其在水溶液中酸度系数为pKa=3.75。因此,可计算出水溶液中pH对甲酸的存在形式的影响。如图2所示,在镀液配制和电镀时(pH为1.5),甲酸在溶液中主要以HCOOH分子的形式存在,占总甲酸的98%以上。
脲在水溶液中的酸度系数为pKa=0.18[20]。据此可计算出,水溶液中pH对脲的存在形式的影响。如图3所示,在镀液配制和电镀时(pH=1.5),脲在溶液中主要以CO(NH2)2分子的形式存在,占总脲的98%以上。
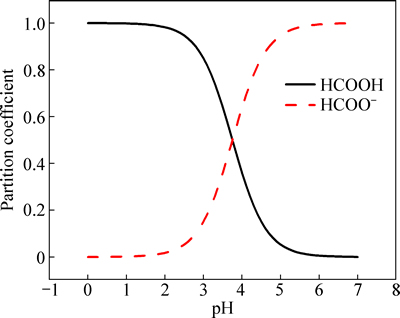
图2 pH对甲酸存在形式的影响
Fig. 2 Effect of pH on form of formic
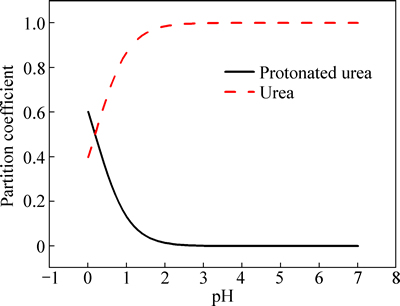
图3 pH对脲存在形式的影响
Fig. 3 Effect of pH on form of urea
根据图1的结果,在硫酸铬溶液里,三价铬正离子能够与负电性的硫酸根离子或水分子形成络合物,但这种络合物没有电化学活性,难以电化学还原为金属铬。根据IBRAHIM等[21]的研究,活性络合物通常具有CrLn3+的形式。图2和3的结果已经证实,甲酸和脲作为络合剂,在镀液配制和电镀条件下,主要是以分子的形式存在,呈电中性,要实现其与铬离子络合生成铬活性络合物,必须实现络合剂分子与硫酸根离子或水分子间的取代反应。从电性和Cr(H2O)63+的结构角度,取代反应的动力学驱动力较弱,因此,三价铬活性络合物的生成速率较低。本文作者的前期研究发现[22],通过提高镀液配制温度来加速三价铬离子与有机配体间的络合反应,可提高三价铬活性络合物的生成速率,这与ZENG等[10]的结论相同。因此,在三价铬镀液配制过程中,往往需要较高的温度和较长的时间。
2.3 缓冲剂的存在形式
三价铬电镀过程由于阴极析氢严重,阴极-溶液界面pH可达到8以上,导致三价铬离子在阴极附近发生羟桥化反应,生成稳定的三价铬离子多聚物,Cr3+难以从聚合物中脱离而在阴极还原。为了防止羟桥化反应消耗三价铬活性络合物和,并保持镀液pH稳定,镀液中通常需要加入缓冲剂。在电镀领域中,硼酸是常见的缓冲剂,其为一元酸,在水中发生如下反应:
B(OH)3+OH- [B(OH)4]- (4)
[B(OH)4]- (4)
该反应pKa=9.24。如图4(a)所示,在镀液配制范围内(<2),硼酸主要以B(OH)3的形式存在。当pH值增加时,B(OH)3可与溶液中的OH-反应生成[B(OH)4]-,起到缓冲的效果,其最佳缓冲范围为8~10之间(见图4(b))。
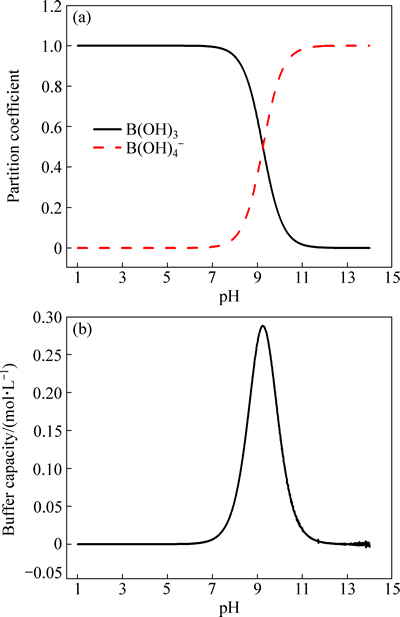
图4 pH对硼酸的存在形式和硼酸缓冲能力的影响
Fig. 4 Effect of pH on form of boric acid (a) and buffer capacity of boric acid (b)
硫酸铝是另外一种常用的缓冲剂。由文献[23]可知,Al3+在水溶液中将发生水解反应,生成各种形式的铝氧水合离子。在镀液操作条件下,Al3+在不同pH下的浓度如图5(a)所示。由图5(a)可知,当pH从3增加到3.5时,Al3+浓度从0.28 mol/L急剧降至0.01 mol/L,这说明在该pH条件下,Al3+与镀液中的OH-发生反应,消耗掉因析氢副反应而生成的OH-,可有效抑制三价铬活性络合物与OH-反应生成三价铬离子多聚物。由图5(b)所示,Al3+最佳缓冲范围在3~3.5间,与图5(a)的结果相一致。
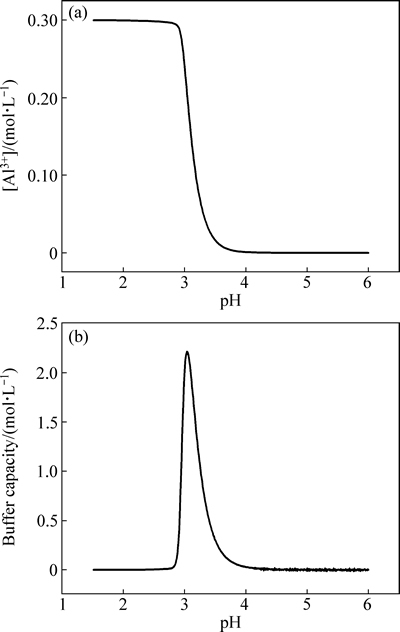
图5 溶液pH对铝离子浓度的影响和铝离子的缓冲能力
Fig. 5 Effect of pH on Al3+concentration (a) and buffer capacity of aluminum ion (b)
在三价铬镀液中同时加入硼酸和硫酸铝,利用两者各自的最佳缓冲范围,使镀液的缓冲能力得到提高,可有效抑制三价铬电镀过程pH,特别是电极/溶液界面处pH的快速升高。
2.4 三价铬活性络合物的确认
根据前期的研究可知[20],二价铬活性络合物Cr(OH)L+(L为脲分子)是三价铬电还原为金属铬的中间产物,由CrL3+接受一个电子直接电还原而成。通过镀液调配,可以直接获得比CrL3+电化学活性更高的Cr(OH)L2+,避免电镀过程CrL2+与OH-的缓慢取代反应,显著提高三价铬电镀速率。
ZENG等[24]认为在六配位的三价铬络合物中只有当铬离子与配体的间距大于2.04 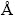 时,络合物中的水分子才容易脱除,获得的三价铬络离子才有可能在电极表面还原。因此,可以通过量化计算的手段确定三价铬络合离子的分子结构,从而判断铬络合物的电化学活性。
时,络合物中的水分子才容易脱除,获得的三价铬络离子才有可能在电极表面还原。因此,可以通过量化计算的手段确定三价铬络合离子的分子结构,从而判断铬络合物的电化学活性。
采用密度泛函理论的广义梯度近似算法计算了Cr(H2O)63+、CrL3+和Cr(OH)L2+的平衡构型。图6中平衡构象1中的Cr3+—H2O间距为2.02 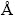 。由于脲络合能力强于水分子,因此,Cr(H2O)63+中的一个水分子容易被脲取代生成具有电活性的Cr(H2O)5L3+,简单表示为CrL3+,而脲的介入会使Cr3+—H2O之间的距离增大。如图6中平衡构象2所示,正对脲的水分子与中心铬离子的距离为2.07
。由于脲络合能力强于水分子,因此,Cr(H2O)63+中的一个水分子容易被脲取代生成具有电活性的Cr(H2O)5L3+,简单表示为CrL3+,而脲的介入会使Cr3+—H2O之间的距离增大。如图6中平衡构象2所示,正对脲的水分子与中心铬离子的距离为2.07 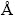 ,所以,这个水分子容易脱离中心铬离子,此时CrL3+在阴极界面上很容易发生电还原。当镀液pH在1.4~2区间时,随着pH的增加,溶液中OH-随之增加。根据前期研究发现[21],当镀液pH增加到1.83时,铬电镀的电流效率可达到28.9%。从平衡构象上分析,当铬活性络合物CrL3+上插入一个OH-后,经计算会形成两种平衡构象3和4。其中,平衡构象3中水分子与中心铬离子的间距可高达2.15
,所以,这个水分子容易脱离中心铬离子,此时CrL3+在阴极界面上很容易发生电还原。当镀液pH在1.4~2区间时,随着pH的增加,溶液中OH-随之增加。根据前期研究发现[21],当镀液pH增加到1.83时,铬电镀的电流效率可达到28.9%。从平衡构象上分析,当铬活性络合物CrL3+上插入一个OH-后,经计算会形成两种平衡构象3和4。其中,平衡构象3中水分子与中心铬离子的间距可高达2.15 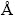 ,而平衡构象4中水分子与中心铬离子的间距达2.08
,而平衡构象4中水分子与中心铬离子的间距达2.08 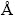 。很显然,平衡构象3中的水分子要比CrL3+中的水分子更容易脱除。因此,可以判断Cr(OH)L2+是比CrL3+的电化学活性更高的络合物,即当pH增大时,铬电镀的电流效率会增加。
。很显然,平衡构象3中的水分子要比CrL3+中的水分子更容易脱除。因此,可以判断Cr(OH)L2+是比CrL3+的电化学活性更高的络合物,即当pH增大时,铬电镀的电流效率会增加。
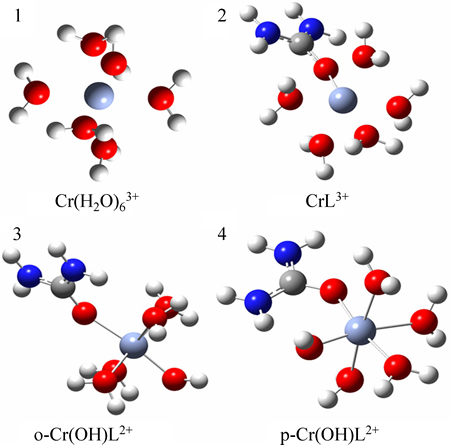
图6 典型三价铬络合物的平衡构象
Fig. 6 Equilibrium geometric structures of typical Cr(III) complexes
2.5 三价铬活性络合物和脲对铬电镀速率的影响
镀液中的三价铬离子真正参与电镀的只有三价铬活性络合物[24]。图7(a)为配制的硫酸铬-脲溶液,稀释到不同比例,然后再添加其他组分,这样得到的镀液的活性络合物浓度与加入的硫酸铬-脲的浓度成正比,故可用加入的脲的浓度来间接表示三价铬活性络合物。图7(b)的镀液是硫酸铬浓度为0.4 mol/L、络合剂脲的浓度为0.1~0.5 mol/L时,先配置硫酸铬和不同浓度脲的混合溶液然后再添加其他组分。图7(a)所示为三价铬活性络合物浓度与铬电镀速率的关系,在图中所示的浓度范围内,铬电镀速率随着三价铬活性络合物浓度的升高而迅速升高,但是当三价铬活性络合物的浓度增加到一定浓度时,其对铬电镀速率的影响逐渐减弱,三价铬沉积速率高达1.2 μm/min。
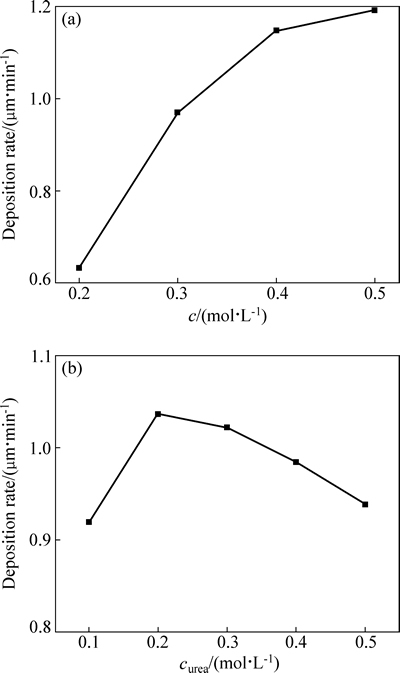
图7 三价铬活性络合物浓度和脲浓度与铬电镀速率的关系
Fig. 7 Relationships between concentration of Cr(Ⅲ) active complexes (a) and concentration of urea (b) and deposition rate
图7(b)所示为镀液中脲浓度与铬电镀速率的关系。从图7(b)中可知,在脲浓度小于0.2 mol/L时,铬电镀速率随着脲浓度的增加而增加。但当脲浓度继续增加时,铬电镀速率反而逐渐下降。实验中所用的三价铬离子的浓度为0.8 mol/L,但铬电镀速率达到最大值时所用的脲浓度只有0.2 mol/L。这说明并不是镀液中所有的三价铬离子都参与形成活性络合物。当脲浓度继续增加时,溶液中的脲会与三价铬活性络合物进一步反应生成活性较低的CrLn3+(n≥2),从而造成铬电镀速率的下降[10]。
2.6 缓冲剂对镀层均匀性的影响
根据缓冲剂的作用原理,添加缓冲剂是为了吸收剧烈析氢副反应释放出的OH-,从而避免阴极界面Cr(OH)3和三价铬离子多聚物的生成,以提高三价铬离子的电沉积速率。缓冲剂不仅对三价铬活性络合物有影响,还对镀层的均匀性有影响。为了表征镀层的均匀性,采用电解测厚仪测取镀层中心厚度hcenter和镀层左下角厚度hcorner,并计算两者比值hcorner/hcenter,比值越大,镀层越不均匀。由于初次电流分布等原因,边角处的电流密度要大于中心处的电流密度,因此,阴极-溶液界面的pH会呈现边缘大,中心小的特点。在较低的pH值范围下,pH升高会促进铬的沉积。而缓冲剂的加入会抑制pH的增加,尤其是对边角处的影响效果更大,因此,缓冲剂的加入会使镀层厚度分布均匀。
由图8可知,Al3+浓度从0增加到0.6 mol/L时,hcorner/hcenter由11降低至2,变化了约5倍,而H3BO3从0增加到1.0 mol/L时,hcorner/hcenter由5降低至3,只变化了约2倍。由此可见,Al3+对镀层均匀性的影响更大,这是由于Al3+的最佳缓冲范围在3~3.5,如图5(b)所示,较图4(b)所示硼酸的8~10的范围更偏酸性,而Al3+的缓冲范围符合三价铬镀液的pH值范围。
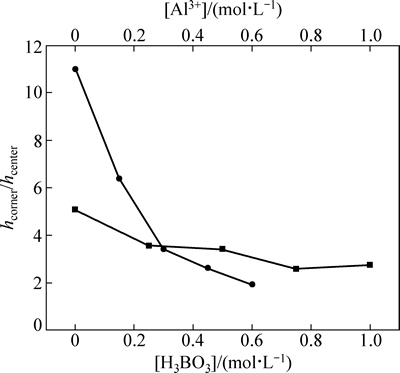
图8 硼酸浓度、铝离子浓度分别与hcorner/hcenter关系
Fig. 8 Relationship between of hcorner/hcenter and concentration of boric acid and aluminumion
3 结论
1) 通过对三价铬镀液核心组分存在形式的分析,发现硫酸铬溶液中Cr(Ш)主要以单核铬络合物形式存在,络合剂甲酸或脲98%以上是以分子形式存在,并与Cr(Ш)络合,生成三价铬活性络合物。
2) Cr(OH)L2+络合物中水分子与中心铬离子的间距明显大于CrL3+的,因此,Cr(OH)L2+具有更高的电化学活性。
3) 铬电镀速率随着三价铬活性物浓度的增加而增加,镀速最高可达1.2 μm/min。
4) 当镀液pH为1.5时,加入Al3+使hcorner/hcenter比值降低约5倍,H3BO3使该比值降低约2倍,说明Al3+对镀层均匀性的改善作用更明显。
REFERENCES
[1] 刘建平, 胡耀红, 詹益腾. 三价铬电镀的研究与发展[J]. 表面技术, 2003, 32(3): 5-7.
LIU Jian-ping, HU Yao-hong, ZHAN Yi-teng. Research and development of trivalent chromium plating[J]. Surface Technology, 2003, 32(3): 5-7.
[2] 郭崇武, 赖奂汶. 硫酸盐体系三价铬电镀装饰铬的突破[J]. 涂装与电镀, 2011, 4: 3-9.
GUO Cong-wu, LAI Huan-wen. Breakthrough in decorative trivalent chromium plating of sulphate system[[J]. Coating and Plating, 2011, 4: 3-9.
[3] 李永彦, 李 宁, 屠振密. 三价铬硫酸盐电镀铬的发展现状[J]. 电镀与精饰, 2009, 31(1): 13-17.
LI Yong-yan, LI Ning, TU Zhen-mi. Development status of chromium plating from trivalent chromium sulfate solution[J]. Plating and Finishing, 2009, 31(1): 13-17.
[4] 杜登学, 隋永红, 周 磊, 李文鹏, 张志鹏. 三价铬电镀的研究现状及发展[J]. 材料保护, 2010, 43(4): 29-34.
DU Deng-xue, SUI Yong-hong, ZHOU Lei, LI Wen-peng, ZHANG Zhi-peng. Current status of research and development of trivalent chromium plating[J]. Journal of Materials Protection, 2010, 43(4): 29-34.
[5] MAHDAVI S, ALLAHKARAM S R. Composition, characteristics and tribological behavior of Cr, Co-Cr and Co-Cr/TiO2 nano-composite coatings electrodeposited from trivalent chromium based baths[J]. Journal of Alloys and Compounds, 2015, 635: 150-157.
[6] RAMEZANI-VARZANEH H A, ALLAHKARAM S R, ISAKHANI-ZAKARIA M. Effects of phosphorus content on corrosion behavior of trivalent chromium coatings in 3.5% wt.% NaCl solution[J]. Surface and Coatings Technology, 2014, 244: 158-165.
[7] TU Z, YANG Z, ZHANG J. Cathode polarization in trivalent chromium plating[J]. Plating and Surface Finishing, 1993, 80(11): 79-82.
[8] POLUKAROV Y M, SAFONOV V A, EDIFARYAN A A, VYKHODTSEVA L N. Chrome plating from sulfate-oxalate Cr(III) baths. structure, composition, and corrosion behavior[J]. Protection of Metals and Physical Chemistry of Surfaces, 2001, 37(5): 447-451.
[9] EL-SHARIF M, MA S, CHISHOLM C U. Environmentally acceptable process for electrodeposition of hard chromium from chromium(Ш) electrolyte[J]. Transactions of the Institute of Metal Finishing, 1999, 77(4): 139-144.
[10] ZENG Z X, ZHANG Y X, ZHAO W J, ZHANG J Y. Role of complexing ligands in trivalent chromium electrodeposition[J]. Surface and Coatings Technology, 2011, 205(20): 4771-4775.
[11] HE X K, HOU B L, LI C, ZHU Q Y, JIANG Y M, WU L Y. Electrochemical mechanism of trivalent chromium reduction in 1-butyl-3-methylimidazolium bromide ionic liquid[J]. Electrochimica Acta, 2014, 130: 245-252.
[12] WIJENBERG J H O J, STEEGH M, AAENTS M P, LAMMERS K R, MOL J M C. Electrodeposition of mixed chromium metal-carbide-oxide coatings from a trivalent chromium-formate electrolyte without a buffering agent[J]. Electrochimica Acta, 2015, 173: 819-826.
[13] 何新快, 陈白珍, 吴璐烨, 李小东, 贺全国. 三价铬脉冲电沉积纳米晶Ni-Cr合金工艺[J]. 中国有色金属学报, 2006, 16(7): 1281-1287.
HE Xin-kuai, CHEN Bai-zhen, WU Lu-ye, LI Xiao-dong, HE Quan-guo. Process of pulse electrodeposition of nanocrystalline Ni-Cr alloy from trivalent chromium bath[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(7): 1281-1287.
[14] CHIEN C W, LIU C L, CHEN F J, LIN K H, LIN C S. Microstructure and properties of carbon-sulfur-containing chromium deposits electroplated in trivalent chromium baths with thiosalicylic acid[J]. Electrochimica Acta, 2012, 72: 74-80.
[15] LEE J Y, KIM M, KWON S C. Effect of polyethylene glycol on electrochemically deposited trivalent chromium layers[J]. Transactions of Nonferrous Metals Society of China, 2009, 19: 819-823.
[16] 吴慧敏, 艾佑宏. 光亮剂对三价铬电沉积行为的影响[J]. 材料保护, 2006, 39(7): 26-28.
WU Hui-min, AI You-hong. Effect of brightener on electrodeposition of trivalent chromium in sulfate bath[J]. Journal of Materials Protection, 2006, 39(7): 26-28.
[17] MCDOUGALL J, EL-SHARIF M, MA S. Chromium electrodeposition using a chromium (III) glycine complex[J]. Journal of Applied Electrochemistry, 1998, 28(9): 929-934.
[18] 丁 翼, 纪 柱. 铬化合物生产与应用[M]. 北京: 化学工业出版社, 2003.
DING Yi, JI Zhu. Production and application of chromium compound[M]. Beijing: Chemical Industry Press, 2003.
[19] VINOKUROV E G, KUZNETSOV V V, BONDAR V V. Aqueous solutions of Cr(Ⅲ) sulfate: modeling of equilibrium composition and physicochemical properties[J]. Russian Journal of Coordination Chemistry, 2004, 30(7): 496-504.
[20] MOHAN S, VIJAYAKUMAR J, SARAYANAN G. Influence of CH3SO3H and AlCl3 in direct and pulse current electrodeposition of trivalent chromium[J]. Surface Engineering, 2009, 25(8): 570-576.
[21] IBRAHIM S K, WATSON A, GAWNE D T. The role of formic acid and methanol on speciation rate and quality in the electrodeposition of chromium from trivalent electrolytes[J]. Transactions of the Institute of Metal Finishing, 1997, 75(5): 181-188.
[22] LI L, WANG Z, WANG M Y, ZHANG Y. The enhancement of Cr(III)electrodeposition by temperature and pH optimization during bath preparation[J]. International Journal of Minerals Metallurgy and Materials, 2013, 20(9): 902-908.
[23] 栾兆坤. 铝的水化学反应及其形态组成[J]. 环境科学丛刊, 1987, 8(2): 1-9.
LUAN Zhao-kun. Chemical reaction of aluminum and its existing form[J]. Journal of Environmental Science, 1987, 8(2): 1-9.
[24] ZENG Z X, SUN Y L, ZHANG J Y. The electrochemical reduction mechanism of trivalent chromium in the presence of formic acid[J]. Electrochemistry Communications, 2009, 11: 331-334.
Existing forms of key components in trivalent chromium plating solution and its effects on chromium plating
LIU Yang, WANG Ming-yong, LI Lei, WANG Zhi
(Key Laboratory of Green Process and Engineering,
National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology,
Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)
Abstract: The components in trivalent chromium plating solution are complex. The existing forms of key components in trivalent chromium solution and their effect on chromium electrodeposition were studied by theoretical calculations and plating experiments. The results indicate that 98% of both urea and formic acid in the molecule form are combined with Cr(Ⅲ) to form active Cr(Ⅲ) complexes. According to the equilibrium conformation diagram of Cr(Ⅲ) complexes, higher electrochemical activity of Cr(OH)L2+ than CrL3+ is ascribed to the larger distance between water molecules and chromium ion. The electrodeposition rate of Cr is enhanced by increasing the concentration of active Cr(Ⅲ) complexes. The maximum rate reaches up to 1.2 μm/min. Boric acid existed in the form of B(OH)3, and the optimum pH buffer range is 8-10. For Al3+, the optimum pH buffer range are 3~3.5. When 0.6 mol/L Al3+ is added, the value of the hcorner/hcenter is decreases from 11 to 2. In the presence of 1 mol/L boric acid, the value decreases from 5 to 3. This means that the effect of Al3+ on the improvement of coating uniformity is greater.
Key words: bath component; active Cr(Ⅲ) complexes; electrodeposition rate; coating uniformity
Foundation item: Project (2013CB632606) supported by the National Basic Research and Development Program of China; Project (51274180) supported by the National Natural Science Foundation of China; Project (2015036) supported by the Youth Innovation Promotion Association, CAS
Received date: 2015-06-17; Accepted date: 2016-01-04
Corresponding author: WANG Ming-yong; Tel: +86-10-82544818; E-mail: mywang@ipe.ac.cn
(编辑 李艳红)
基金项目:国家重点基础研究发展计划资助项目(2013CB632606);国家自然科学基金资助项目(51274180);中国科学院青年创新促进会资助项目(2015036)
收稿日期:2015-06-17;修订日期:2016-01-04
通信作者:王明涌,副研究员,博士;电话:010-82544818;E-mail:mywang@ipe.ac.cn
摘 要:通过理论计算和电镀实验研究镀液核心组分存在形式及其对铬电镀的影响规律。结果表明:络合剂脲或甲酸98%以上是以分子形式与Cr(Ⅲ)离子形成三价铬活性络合物。根据三价铬络合物平衡构象图发现:相比于CrL3+,Cr(OH)L2+更高的电化学活性归因于较大的水分子-中心铬离子距离。通过增加三价铬活性络合物浓度,能显著提高铬电镀速率,可高达1.2 μm /min;缓冲剂硼酸主要以B(OH)3的形式存在,最佳pH缓冲范围为8~10,而Al3+最佳的pH缓冲范围为3~3.5。加入0.6 mol/L Al3+使铬镀层边缘和中心厚度之比(hcorner/hcenter)从11降低至2;而加入1 mol/L硼酸仅使hcorner/hcenter从5降低至3,Al3+改善镀层均匀性的作用更为明显。
[1] 刘建平, 胡耀红, 詹益腾. 三价铬电镀的研究与发展[J]. 表面技术, 2003, 32(3): 5-7.
[2] 郭崇武, 赖奂汶. 硫酸盐体系三价铬电镀装饰铬的突破[J]. 涂装与电镀, 2011, 4: 3-9.
[3] 李永彦, 李 宁, 屠振密. 三价铬硫酸盐电镀铬的发展现状[J]. 电镀与精饰, 2009, 31(1): 13-17.
[4] 杜登学, 隋永红, 周 磊, 李文鹏, 张志鹏. 三价铬电镀的研究现状及发展[J]. 材料保护, 2010, 43(4): 29-34.
[13] 何新快, 陈白珍, 吴璐烨, 李小东, 贺全国. 三价铬脉冲电沉积纳米晶Ni-Cr合金工艺[J]. 中国有色金属学报, 2006, 16(7): 1281-1287.
[16] 吴慧敏, 艾佑宏. 光亮剂对三价铬电沉积行为的影响[J]. 材料保护, 2006, 39(7): 26-28.
[18] 丁 翼, 纪 柱. 铬化合物生产与应用[M]. 北京: 化学工业出版社, 2003.


