中国有色金属学报 2003,(04),1046-1050 DOI:10.19476/j.ysxb.1004.0609.2003.04.045
镁合金化学镀镍溶液的老化
上海交通大学金属基复合材料国家重点实验室,上海交通大学金属基复合材料国家重点实验室,上海交通大学金属基复合材料国家重点实验室,上海交通大学金属基复合材料国家重点实验室 上海200030 ,上海200030 ,上海200030 ,上海200030
摘 要:
采用质量法、X射线能谱法(EDX)及稳定常数法分别测量了镁合金直接化学镀的沉积速度、镀层磷含量,以及镀液稳定性随镀液使用周期的变化。结果表明:在镁合金化学镀工艺中,随着使用周期的增加,镀速和镀液的稳定常数明显下降,镀层中磷含量缓慢增加;镀液使用超过3周期后,由于Na+与F-离子的积累,会产生NaF与NiF2沉淀,沉淀的产生对化学镀过程会产生非常不利的影响。
关键词:
中图分类号: TQ153.1
作者简介:刘新宽(1970),男,博士.上海交通大学轻合金精密成型国家工程中心;Email:xinkuanliu@yahoo.com;
收稿日期:2002-06-10
基金:国家自然科学基金资助项目(50101007);
Ageing of electroless nickel bath of magnesium alloys
Abstract:
Using mass measurement, EDX and stability constant measurement, the variations of deposition rate, phosphorous content and stability of electroless bath during the ageing of electroless nickel bath system were studied. The results show that the ageing of bath causes a dramatic declining of deposition rate and bath stability, while a slow increasing of phosphorous content of deposit. Particles of NaF and NiF2 can precipitate from the bath due to the accumulation of sodium and fluorine ions when the addition of nickel is beyond 3 metal turnovers (MTO). The precipitate has a detrimental effect on EN process.
Keyword:
magnesium alloys; electroless nickel plating; ageing;
Received: 2002-06-10
随着化学镀技术的日渐成熟及其在工业中的大规模应用, 化学镀液的使用寿命已成为目前国际上最为关注的问题, 因为它关系到化学镀的成本及废旧镀液对环境的污染。 镀液使用寿命越长, 化学镀加工的成本越低, 对环境的污染越小。 但是, 关于镁合金直接化学镀的长寿命使用技术的研究资料很少
1 实验
1.1 实验材料与化学镀工艺
材料采用铸造镁合金AZ91。 镁合金化学镀采用直接化学镀镍工艺
1) 碱性除油溶液的配方为:
氢氧化钠(NaOH) 60 g/L
磷酸钠(Na3PO4·12H2O) 10 g/L
温度 ~70 ℃
除油后的表面用水膜破裂法检验除油是否彻底。
2) 酸性浸蚀液配方:
铬酐(CrO3) 200 g/L
氟化钾(KF) 1 g/L
3) 活化溶液的配方:
HF(40%) 375 mL/L
酸性浸蚀和活化均在室温下进行。 酸性浸蚀和活化时间均为10 min。
4) 化学镀液的基本成分和操作条件为:
碱式碳酸镍 10 g/L
柠檬酸 5 g/L
氢氟酸(40%) 10 mL/L
氟化氢铵 10 g/L
次亚磷酸钠 20 g/L
氨水(26%~28%) 30 mL/L
润湿剂 0.3 g/L
pH 6.0~6.5
温度 78~82 ℃
1.2化学镀液的周期使用过程
1) 按上述配方配制镀液1 L, 控制pH值6.5, 进行化学镀覆。
2) 采用0.05 mol/L EDTA滴定法测定化学镀后镀液中的镍浓度
3) 按照原始配方中碱式碳酸镍与氢氟酸的比例, 用氢氟酸将镍盐溶解。
4) 根据测得的镍消耗量, 添加3)中配制的溶液至原始镍浓度值, 并按照原始配方中次亚磷酸钠与碱式碳酸镍的比例, 相应地添加次亚磷酸钠。
5) 用氨水调节镀液的pH值, 再进行镀覆。
6) 每消耗相当于10 g/L碱式碳酸镍的镍作为一个使用周期(MTO)。
1.3镀液稳定性的测定
镀液稳定性实验采用两种方法
采用质量法测定了化学镀的沉积速度, 质量的测定采用精度为0.1 mg的电子天平。 镀层中的磷含量用EDX测量。 镀液产生的沉淀经过滤干燥后用X射线衍射分析确定物相, 仪器用D/MAX-ⅢA型X射线衍射仪, 采用Cu Kα辐射, 管电压40 kV, 管电流60 mA。
2 结果与讨论
2.1 镍沉积速度及镀层磷含量
图1所示为镁合金化学镀液长周期利用时镍的沉积速度。 从图1可以看出: 随着镀液利用周期的增加, 镍的沉积速度降低, 在前两个周期中, 镀速缓慢下降, 而到了第三个周期, 速度很快下降, 到第六个实验周期时, 镍的沉积速度只有原始镀液沉积速度的一半。 这与普通镀液长周期利用时镀速变化不同。 对普通酸性化学镀液, 镀速随镀液利用周期缓慢下降, 而不如镁合金化学镀液镀速下降这么快。 究其原因与镁合金化学镀液使用3个周期后镀液中出现沉淀有关。
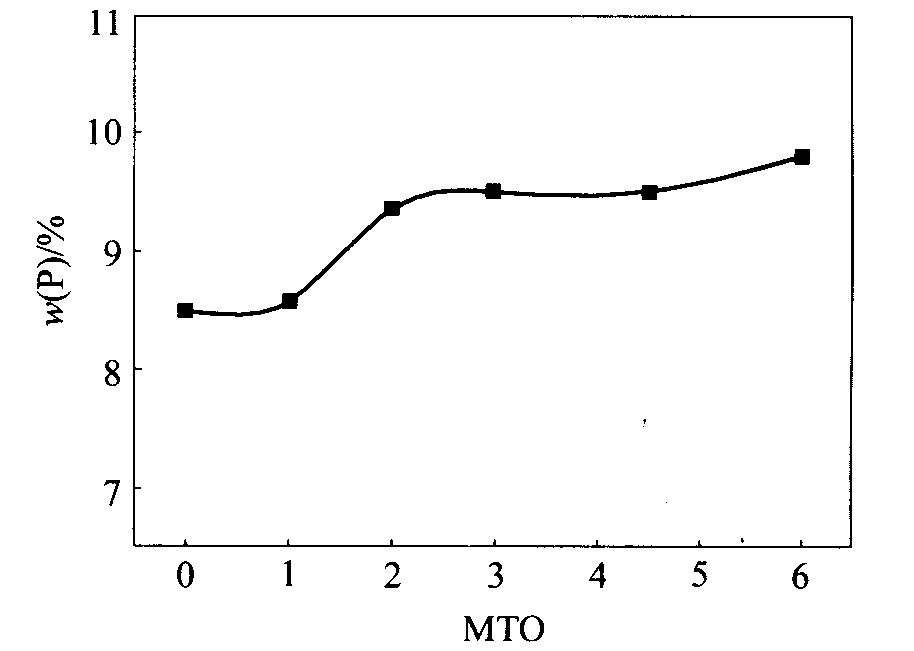
图2所示为镁合金长周期利用时镀层磷含量的变化。 镀层中磷含量随周期增加而缓慢增加, 这与普通化学镀工艺的使用规律相似。 因为尽管镁合金化学镀工艺有其特殊性, 但是, 镀液中镍的自催化反应与普通化学镀工艺相同, 故镀层中磷含量的变化有相似的规律。
图1 镍沉积速度的变化 Fig.1 Variation of deposition rate
图2 镀层中磷含量的变化 Fig.2 Variation of phosphorous content in plating
2.2 镀液稳定性测试
图3所示为用氯化钯测定的镀液稳定性随镀液使用周期的变化。 从0个周期测得的稳定性看, 镀液相当稳定, 但在第一个周期后, 镀液的稳定性极快地降低, 以后随镀液使用周期增加, 镀液稳定性缓慢下降。
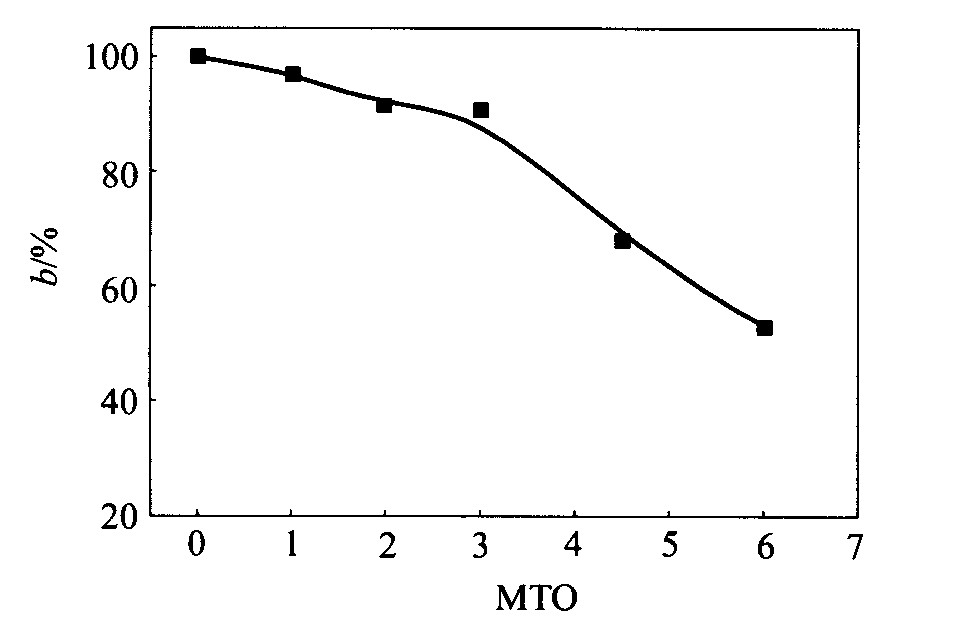
图4所示为镀液稳定常数(b)的变化。 原始镀液的稳定常数为100%, 镀液使用后, 稳定常数逐渐下降, 即镍颗粒的析出量逐渐增加。 镀液使用超过3个周期, 镀液稳定常数快速下降, 这与镁合金化学镀过程中出现的沉淀有关。
2.3 氟化物沉淀
镀液中可形成固体氟化物的阳离子Na+、 Ni2+、 NH+4(不包括H+), 除了NH+4以外, Na+、Ni2+的氟化物溶解度很有限, 25 ℃时, NiF2的溶
图3 镀液氯化钯稳定时间的变化 Fig.3 Stable period measured in PdCl2 solution
图4 镀液稳定常数随使用周期的变化 Fig.4 Variation of stability constant with MTO
解度只有2.5 g/L, NaF的溶解度只有4 g/L。 因此, 随镀液使用周期的增加, 溶液中的F-、 Na+浓度增加, 可能会生成沉淀物NaF和NiF2。
根据NaF和NiF2的溶度积
ks, NaF=[F-][Na+] (1)
ks, NiF2=[F-]2[Ni2+] (2)
式中 [F-]、 [Na+]、 [Ni2+]分别为F-、 Na+、 Ni2+在镀液中的平衡浓度。
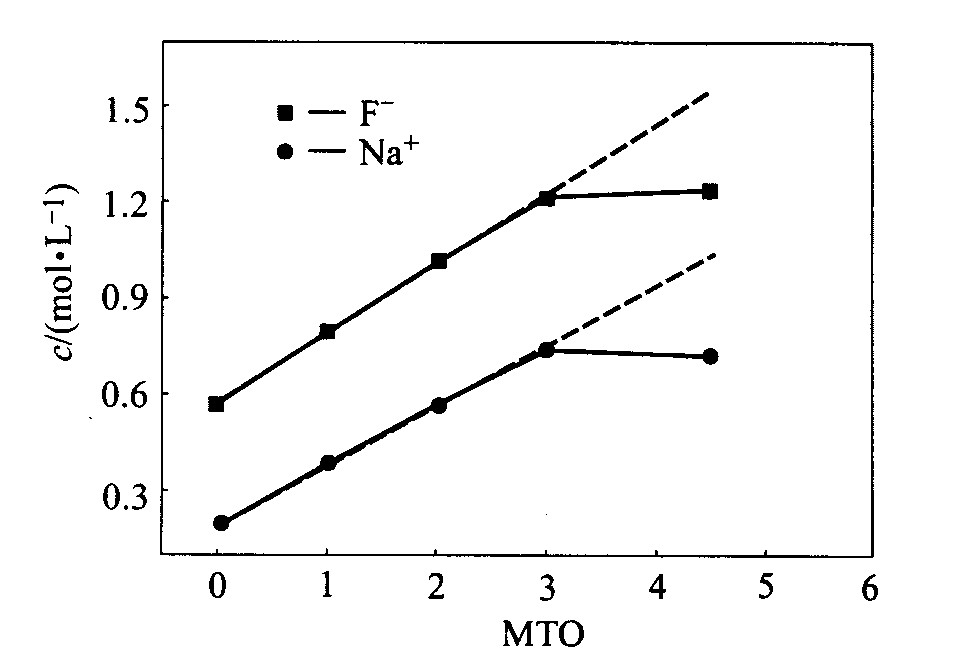
当镀液中[F-]、 [Ni2+]、 [Na+]满足式(1)与(2)时就会生成NaF、 NiF2沉淀。 图5所示为随镀液使用周期的增加, 溶液中F-、 Na+的浓度变化。 图5中虚线表示假设不发生沉淀时, 溶液中F- 、 Na+可能达到的浓度。 对NaF及NiF2而言, 温度对其溶度积影响较小, 为方便起见, 计算时采用室温数据, 分别为: 原始溶液中c(F-)=0.571 mol/L, c(Na+)=0.189 mol/L, 每周期添加c(F-)=0.220 mol/L, c(Na+)=0.189 mol/L。 由图中可看到, 当镀液使用达到3个周期后, 溶液就会出现NaF沉淀, 而且, 每次添加都会产生相应的沉淀。 镀液中游离的Ni2+最大浓度为0.044 mol/L(大部分以络合物形式存在)
图5 镀液中F-与Na+浓度 随使用周期的变化 Fig.5 Concentration variations of sodium and fluorine ions with MTO
上述计算没有考虑镀液蒸发造成的影响。 实际上, 由于镀液的蒸发, 溶液中的F-、 Na-浓度升高, 会在施镀过程中生成沉淀, NiF2沉淀在5周期前就可能生成。 图6所示为生成的沉淀粉末XRD图谱及物相分析。 从图6看出, 沉淀主要含有NiF2(或含结晶水的NiF2·4H2O)与NaF, 这与前面的计算一致。 伴随沉淀产生的是相当数量的镍单质, 大量镍单质的出现, 与沉淀产生有关。
图6 沉淀粉末的物相分析 Fig.6 XRD spectrum of precipitate
2.4沉淀形成对化学镀的影响
2.4.1 沉淀对镀液稳定常数及镍沉积速度的影响
一般地, 镀液中NiHPO3是形成镍颗粒的活性中心, 随镀液使用周期的增加, NiHPO3累积到一定量, 且稳定剂的抑制作用不足时, 就会自发析出镍颗粒, 甚至镀液会自发分解, 相应的镀液稳定常数下降。 在镁合金化学镀过程中, 随着镍的添加, 镀液中F-、 Na+浓度增加, 当F-、 Na+浓度达到一定量时, 镀液出现氟化物沉淀。 镀液中的固体沉淀在某种条件下充当了镍颗粒的活性中心, 也会造成镍颗粒的析出, 这可以从沉淀的物相分析得到证明(见图6)。 在工件上沉积的镍减少, 镀液稳定常数下降。 对照镁合金化学镀液的稳定常数变化与普通镀液的差别可以发现, 在前3个周期, 镁合金化学镀液稳定常数的降低与一般镀液相似, 3个周期以后, 稳定常数的下降才明显加快, 而镀液在正常情况下, 也是在第3个周期后才出现沉淀。 这就说明, 镀液稳定常数的下降确实与镀液中沉淀的出现有关。 另外, 当镀液中出现NiF2 沉淀时, 一部分镍被浪费掉, 也造成镀液稳定常数降低。
从PdCl2测试得到的稳定性变化来看, 镀液老化对稳定常数的影响非常明显, 沉淀的影响似乎不显著。 尽管镀液在PdCl2测试前已经进行过滤, 但不能过滤掉所有尺寸范围的固体颗粒。 两者之间的关系还需要进一步研究。
在第三周期后镍沉积速度的降低也与沉淀的出现有关。 沉积速度是用工件上沉积镍的质量计算的。 当镍单质以颗粒形式伴随沉淀出现时, 工件上沉积的镍就会减少, 相应的沉积速度降低。 同样地, 镀液中出现NiF2沉淀, 镀液中镍离子浓度减小, 镍沉积速度也减小。 此外, 沉淀生成时是以胶体形式出现(从产生丁达尔效应证明
随着镀液使用周期的增加, 镀液中F-浓度增加。 Delong
2.4.2 沉淀对镀层质量及施镀过程的影响
首先, 沉淀会附在试样表面, 被裹带进镀层, 使镀层致密性下降, 保护能力降低。 反应产生的H2不能及时脱离试样, 造成镀层质量下降。 附在试样表面的沉淀微粒, 也可能充当镍沉淀的活性中心, 从而改变镀层的结构。 图7(b)所示为6个周期的镀层表面形貌图, 镀层表面出现了异常的胞状镍, 说明表层有镍的异质形核核心出现。
图7 镀液长周期利用时镀层的微观形貌 Fig.7 SEM morphologies of EN deposition (a)—1 metal turnover; (b)—6 metal turnovers
此外, 胶体极易吸附镀液中的固体杂质, 并随着沉淀的不断产生以及胶体的凝聚, 将杂质, 包括镍颗粒包裹在沉淀里, 沉在溶液底部, 客观上起到了隔离的作用, 因而, 尽管镀液中存在大量的镍颗粒, 但是溶液并没有达到分解的程度。 同时, 胶体的凝聚起到了收集器的作用, 将更微小的固体颗粒收集起来, 在过滤时便于去除。 由于过滤能力的限制, 普通镀液在过滤时, 微小颗粒就不易去除干净。 沉淀还造成镍颗粒的析出增加及NiF2的沉淀, 使镍严重浪费, 施镀成本增加。
很明显, 沉淀的出现是镀液中Na+和F-离子浓度的积累达到NaF和NiF2的溶度积所导致, 因此可以采用以下措施避免或延迟沉淀的生成: 1)还原剂不使用NaH2PO2, 而以NH4H2PO2形式加入; 2)镍盐以其它形式如Ni(H2PO2)2、 硫酸镍或氯化镍形式加入。 这样一来就不需要使用氢氟酸来溶解, 避免了F-离子的积聚。 只是Ni(H2PO2)2的价格偏高。 同时为了调节镀液中Ni2+与H2PO-2的比值, 需要适量加入H3PO2; 而硫酸镍或氯化镍镀镍体系还没有完善的工艺适用于镁合金, 已有研究者正在进行这方面的探索。 3)加大C6H8O7的浓度, 降低可以用来形成NiF2沉淀的游离镍离子浓度, 但会造成镀速有所下降, 磷含量增加。
3 结论
1) 镁合金化学镀镍体系使用超过3个周期后, 镀液会产生氟化物沉淀。 沉淀使镀液使用寿命缩短。
2) 对镁合金的化学镀镍体系, 随着镀液使用周期的增加, 镍沉积速度与镀液稳定常数下降, 镀液使用超过3周期时, 稳定性与沉积速度快速下降。 其原因与镀液中出现沉淀有关。 随着镀液利用周期的增加, 镁合金化学镀镍层磷含量升高。
参考文献
[1] BrownL.UKcompanyleadsthewayinmagnesiumplating[J].Finishing,1994,11:26.
[2] ASTMB48088.Standardguideforpreparationofmagnesiumandmagnesiumalloysforelectroplating[S].
[3] DelongHK.Platingonmagnesium[J].MetalFinishingGuideline,1978,76(1):175183.
[4] DennisJK,WanMKYY,WakeSJ.Platingonmagnesiumalloydiecastings[J].TransIMF,1985,63:7480.
[1] BrownL.UKcompanyleadsthewayinmagnesiumplating[J].Finishing,1994,11:26.
[2] ASTMB48088.Standardguideforpreparationofmagnesiumandmagnesiumalloysforelectroplating[S].
[3] DelongHK.Platingonmagnesium[J].MetalFinishingGuideline,1978,76(1):175183.
[4] DennisJK,WanMKYY,WakeSJ.Platingonmagnesiumalloydiecastings[J].TransIMF,1985,63:7480.