文章编号:1004-0609(2014)11-2921-07
氢氧化钠分解不溶性钼酸盐的浸出热力学
李 飞,陈星宇,何利华,吴金玲
(中南大学 冶金与环境学院,长沙 410083)
摘 要:
辉钼矿经氧化焙烧转化成MoO3的过程中,伴生的铜铅铁等硫化矿亦被氧化,并与MoO3生成难溶钼酸盐。为减少因难溶钼酸盐带来的钼损失,需要对这些钼酸盐进行再浸出处理。针对这些钼酸盐湿法浸出过程进行热力学分析,绘制了25 ℃时Me-Mo-H2O(Me:Cu,Pb,Fe)系组分的浓度对数-pH图。利用热力学平衡图对氢氧化钠分解钼酸盐进行热力学分析。结果表明:整个pH值范围可分为H2MoO4的稳定区、难溶钼酸盐的稳定区、Me(OH)n的稳定区。高pH区钼酸盐中的Me转变为稳定的Me(OH)n物相,即实现了钼酸盐的碱分解。而Fe2(MoO4)3、CuMoO4和PbMoO4的碱浸出难度依次递增,达到一定碱度时这3种难溶盐都能很好地分解,并实现Me与Mo的分离。但过高的碱度又使大量的金属以羟基配合物离子的形式进入溶液,增加了后续除杂难度。
关键词:
中图分类号:TF111.31 文献标志码:A
Leaching thermodynamics of decomposing sparingly soluble molybdate by sodium hydroxide
LI Fei, CHEN Xing-yu, HE Li-hua, WU Jin-ling
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: When molybdnite was roasted, MoS2 converts to MoO3. Meanwhile, sulfides associated with concentrate are oxidized to copper oxide and lead oxide and iron oxide or partial copper sulfate and lead sulfate and iron sulfate, which will react with MoO3 to form sparingly soluble molybdate. Aiming to decrease the loss of molybdenum in the slag, these sparingly soluble salts have to be handled with. According to the laws of conservation of mass and simultaneous equilibria, the logarithm concentration-pH diagram of Me-Mo-H2O (Me: Cu, Pb, Fe) system was established on the basis of thermodynamic data at 25 ℃. Thermodynamic analysis was carried out to discuss the technology of sodium hydroxide disintegrating sparingly soluble molybdate. The results show that the whole pH value of the system is divided into three areas. The first one is the stable area of H2MoO4, the second area is the stable area of sparingly soluble molybdate, the third one is the stable area of Me(OH)n. In the third area, Me(OH)n is gradually supersaturated in solution with the increase of pH value, so the Me(OH)n is deposited as sediment, and MoO42- goes into solution. As a result, the processing of sparingly soluble molybdate leached by sodium hydroxide is carried out. The incremental difficulty of alkali leaching order is as follows: Fe2(MoO4)3, CuMoO4, PbMoO4. Over a certain alkalinity, copper, lead and iron could be leached out of molybdenum. But these metals will be dissolved numerously as hydroxyl complexes in the case of excessive basicity, which increases the difficulty of subsequent purification.
Key words: ferrimolybdate; copper molybdate; thermodynamics; sodium hydroxide; leaching
钼属于高熔点金属之一,具有高导热系数、低热膨胀系数。因此,钼金属被广泛用于各个行业。钢厂是钼的最大消费者,钼在钢铁冶金的消费量约占钼总消费量的81%~82%[1]。随着科技的进步,性能越来越优异的各类含钼合金钢不断问世,以及钼催化剂、钼润滑剂添加剂、钼酸盐颜料的应用与发展对钼的市场需求量亦不断增加,致使对于钼资源的研究开发越来越受到各国科研机构及企业的重视[2-3]。钼在自然界中主要以辉钼矿(MoS2)的形式赋存,还伴生着方铅矿、黄铁矿和黄铜矿等多种硫化矿[4],如金堆城钼矿床中86%铅金属量赋存于方铅矿中[5]。
工业处理辉钼矿的传统方法主要是焙烧法[6],氧化焙烧是火法处理辉钼矿中占统治地位的方法。辉钼精矿经氧化焙烧生成氨溶性质好的三氧化钼,三氧化钼经氨浸得到钼酸铵溶液,再经一系列流程使钼转变为钼酸铵产品。但是在辉钼矿的焙烧过程中,550~600 ℃时精矿中伴生的硫化铜、硫化铅和硫化铁等也会发生氧化反应生成铜、铅和铁的氧化物和部分地生成硫酸盐,进一步与氧化钼结合生成铜、铅和铁等的难溶钼酸盐。这些难溶钼酸盐在后续MoO3氨浸过程中不被浸出,使相当数量的钼损失在渣中,严重影响钼的回收率。随着钼金属的日益消费,高品位钼资源逐渐枯竭,低品位矿[7-8]的开发利用已成必然趋势。据报道,塞浦路斯阿马克斯公司[9]以低品位矿制造的工业氧化钼中含大量的钼酸铜、钼酸铅、钼酸铁等杂质,必须利用回收。另外,成分复杂的废钼酸盐催化剂[10-12]、钼酸盐颜料等是非常宝贵的二次钼资源,由于主要矿物资源日渐匮乏,二次资源的回收利用对钼行业的可持续发展具有重要意义。
目前,从钼酸盐矿物中提取回收钼的技术手段不多,尤其对CuMoO4[13-14]、Fe2(MoO4)3[15-16]的研究却鲜见报道。分解难溶钼酸盐通常使用的浸出剂有硫化钠[17]、氢氧化钠[18]和碳酸钠等,其中比较常用的工艺有硫化钠浸出和氢氧化钠浸出。但目前关于钼酸铜、钼酸铅和钼酸铁湿法处理方面的研究报道都处于工艺研究阶段,对其浸出过程的理论问题研究报道很少,本文作者从热力学角度对氢氧化钠浸出不溶性PbMoO4-Fe2(MoO4)3-CuMoO4混合盐进行理论分析,通过研究Me-Mo-H2O体系的溶解平衡,根据质量守恒原理和同时平衡原理[19-20],并运用已有的热力学数据和热力学计算方法绘制25 ℃时Me-Mo-H2O体系的浓度对数-pH图。
1 lgc-pH图的绘制及计算过程
1.1 Me-Mo-H2O体系相关平衡反应及热力学数据
溶液中存在的平衡反应式表述如下,在缺少有关离子活度的情况下,实验中计算均以浓度代替活度。由所有平衡关系式可得出,溶液中各游离离子均满足表中所列方程。25 ℃时,Pb-Mo-H2O系平衡方程式及平衡常数[21]:
H2MoO4(s) =2H++ Ksp=1×10-13.33[22],[H+]2·[
Ksp=1×10-13.33[22],[H+]2·[ ]=1×10-13.33 (1)
]=1×10-13.33 (1)
H2MoO4(aq)=2H++ ,K=1×10-6.85,[H2MoO4(aq)]= 1×106.85[H+]2·[
,K=1×10-6.85,[H2MoO4(aq)]= 1×106.85[H+]2·[ ] (2)
] (2)
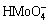 =H++
=H++ ,K=1×10-5.01,[
,K=1×10-5.01,[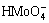 ]=1×105.01[H+]·[
]=1×105.01[H+]·[ ] (3)
] (3)
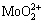 + 2H2O= 4H++
+ 2H2O= 4H++ ,K=1×10-8.33,[
,K=1×10-8.33,[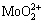 ]=1×108.33[H+]4·[
]=1×108.33[H+]4·[ ] (4)
] (4)
MoO2(OH)++ H2O=3H++ ,K=1×10-7.88,[MoO2 (OH)+]=1×10-7.88[H+]3·[
,K=1×10-7.88,[MoO2 (OH)+]=1×10-7.88[H+]3·[ ] (5)
] (5)
PbMoO4(s)=Pb2++ ,Ksp=1×10-13,[Pb2+]·[
,Ksp=1×10-13,[Pb2+]·[ ]=10-13 (6)
]=10-13 (6)
Pb(OH)2(s)=Pb2++2OH-,Ksp =1×10-15.1,[Pb2+]·[OH-]2=1×10-15.1 (7)
Pb2++2OH-=Pb(OH)2(aq),K=1×1010.9,[Pb(OH)2 ]= 1×1010.9[Pb2+]·[OH-]2 (8)
Pb2++OH-=PbOH+,K=1×106.3,[PbOH+]=1×106.3[Pb2+]·[OH-] (9)
Pb2++3OH-=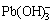 ,K=1×1013.9,[
,K=1×1013.9,[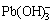 ]=1×1013.9[Pb2+]·[OH-]3 (10)
]=1×1013.9[Pb2+]·[OH-]3 (10)
2Pb2++OH-=Pb2(OH)3+,K=1×107.6,[Pb2(OH)3+] =1×107.6[Pb2+]2·[OH-] (11)
3Pb2++ 4OH-=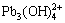 ,K = 1×1032.1,[
,K = 1×1032.1,[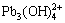 ]=1×1032.1[Pb2+]3·[OH-]4 (12)
]=1×1032.1[Pb2+]3·[OH-]4 (12)
4Pb2++4OH- =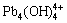 ,K=1×1035.1,[
,K=1×1035.1,[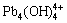 ]=1×1035.1[Pb2+]4·[OH-]4(13)
]=1×1035.1[Pb2+]4·[OH-]4(13)
6Pb2++8OH-= ,K=1×1068.4,[
,K=1×1068.4,[ ]=1×1068.4[Pb2+]6·[OH-]8 (14)
]=1×1068.4[Pb2+]6·[OH-]8 (14)
25 ℃时Fe-Mo-H2O系平衡方程式及平衡常数:
Fe(OH)3(s) = Fe3++3OH-,Ksp=1×10-38,[Fe3+]·[OH-]3 =1×10-38 (15)
Fe2(MoO4)3(s)=2 Fe3++ 3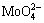 ,Ksp =1×10-52[23],[Fe3+]2·[
,Ksp =1×10-52[23],[Fe3+]2·[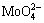 ]3=1×10-52 (16)
]3=1×10-52 (16)
Fe3++OH- =FeOH2+,K=1×1011.81,[FeOH2+]=1×1011.81[Fe3+]·[OH-] (17)
Fe3++ 2OH- =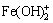 ,K =1×1022.32,[
,K =1×1022.32,[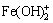 ]=1×1022.32[Fe3+]·[OH-]2 (18)
]=1×1022.32[Fe3+]·[OH-]2 (18)
Fe3++3OH-=Fe(OH)3 (aq),K=1×1030,[Fe(OH)3]=1×1030[Fe3+]·[OH-]3 (19)
Fe3++ 4OH- =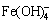 ,K =1×1034.4,[
,K =1×1034.4,[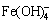 ]=1×1034.4[Fe3+]·[OH-]4 (20)
]=1×1034.4[Fe3+]·[OH-]4 (20)
2Fe3++ 2OH- =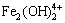 ,K =1×1025.1,[
,K =1×1025.1,[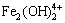 ]=[Fe3+]2·[OH-]21025.1 (21)
]=[Fe3+]2·[OH-]21025.1 (21)
3Fe3++ 4OH- =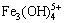 ,K =1×1049.7,[
,K =1×1049.7,[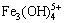 ]=1×1049.7[Fe3+]3·[OH-]4 (22)
]=1×1049.7[Fe3+]3·[OH-]4 (22)
Cu-Mo-H2O系平衡方程式及平衡常数(25 ℃):
Cu2++OH- =Cu(OH)+,K =1×106.3,[Cu(OH)+]=106.3[Cu2+]·[OH-] (23)
CuMoO4(s) = Cu2++ ,Ksp=2.8×10-7[24],[Cu2+]·[
,Ksp=2.8×10-7[24],[Cu2+]·[ ]=2.8×10-7 (24)
]=2.8×10-7 (24)
Cu2++2OH-=Cu(OH)2(aq),K =1×1012.8,[Cu(OH)2(aq)]= 1×1012.8[Cu2+]·[OH-]2 (25)
Cu2++3OH- =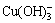 ,K=1×1014.2,[
,K=1×1014.2,[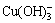 ]=1×1014.2[Cu2+]·[OH-]3 (26)
]=1×1014.2[Cu2+]·[OH-]3 (26)
Cu2++4OH- =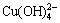 ,K=1×1016.4,[
,K=1×1016.4,[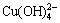 ]=1×1016.4[Cu2+]·[OH-] (27)
]=1×1016.4[Cu2+]·[OH-] (27)
2Cu2++2OH-=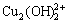 ,K=1×1017.7,[
,K=1×1017.7,[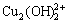 ]=1×1017.7[Cu2+]2·[OH-]2 (28)
]=1×1017.7[Cu2+]2·[OH-]2 (28)
Cu(OH)2(s)=Cu2++2OH-,Ksp=1×10-19.32,[Cu2+]·[OH-]=1×10-19.32 (29)
1.2 溶解组分 lgc-pH 图的绘制
由质量守恒和同时平衡原理可知,溶液中总铅、总铜、总铁、总钼分别满足:
[Pb]T=[Pb2+]+[PbOH+]+[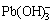 ]+2[Pb2(OH)3+]+3[
]+2[Pb2(OH)3+]+3[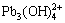 ]+4[
]+4[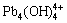 ]+6[
]+6[ ] (30)
] (30)
[Cu]T=[Cu2+]+[ Cu(OH)+]+[Cu(OH)2(aq)]+[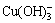 ]+[
]+[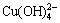 ]+2[
]+2[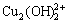 ] (31)
] (31)
[Fe]T=[Fe3+]+[FeOH2+]+[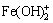 ]+[Fe(OH)3]+[
]+[Fe(OH)3]+[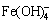 ]+ 2[
]+ 2[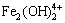 ]+3[
]+3[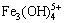 ] (32)
] (32)
[Mo]T=[ ]+[H2MoO4(aq)]+[
]+[H2MoO4(aq)]+[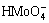 ]+[
]+[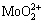 ]+[MoO2(OH)+] (33)
]+[MoO2(OH)+] (33)
难溶钼酸盐的分解过程中恒有  的溶解平衡,故
的溶解平衡,故 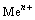 和
和 的浓度恒满足如下关系式:
的浓度恒满足如下关系式:

从表1~3中提供的平衡关系式可知,在不同pH条件下,生成的沉淀物不同。若不考虑钼的各种复杂同多酸,当pH值较低时,体系中 转变为H2MoO4沉淀,金属则以Men+形式存在;当pH值较高时,Men+转变为Me(OH)n沉淀。以此作为限定条件,对该体系进行热力学分析计算。
转变为H2MoO4沉淀,金属则以Men+形式存在;当pH值较高时,Men+转变为Me(OH)n沉淀。以此作为限定条件,对该体系进行热力学分析计算。
根据平衡关系式,当体系中只有H2MoO4时,在Pb-Mo-H2O体系中,溶液中各游离组分满足式(1)~(14)、(30)和(33);Fe-Mo-H2O体系中,溶液中各游离组分满足式(1)~(5)、(16)~(22)、(32) 、(33);Cu-Mo-H2O体系中,溶液中各游离组分满足式(1)~(5)、(23)~(29)、(31)和(33)。
当体系中固体只有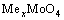 时,可得
时,可得
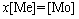 (46)
(46)
此时,Pb-Mo-H2O体系中,溶液中各游离组分满足式(2)~(6)、(8)~(14)、(30)和(33);Fe-Mo-H2O体系中,溶液中各游离组分满足式(2)~(5)、(16)~(22)、(32)和(33);Cu-Mo-H2O 体系中,溶液中各游离组分满足式(2)~(5)、(23)~(28)、(31)和(33)。
当体系中固体只有Me(OH)n时,在Pb-Mo-H2O体系中,溶液中各游离组分满足式(2)~(14)、(30)和(33);在Fe-Mo-H2O体系中,溶液中各游离组分满足式(2)~(5)、(15)~(22)、(32)和(33);在Cu-Mo-H2O体系中,溶液中各游离组分满足式(2)~(5)、(23)~(29)、(31)和(33)。
根据以上计算和平衡关系,可求得生成H2MoO4和 Me(OH)n的边界线a和b处对应的pH值,列于表1;并绘制出25℃时Pb-Mo-H2O体系、Fe-Mo-H2O体系和Cu-Mo-H2O体系溶液组分的 lgc-pH 图,分别如图1、2和3所示。
表1 MexMoO4分解的边界pH
Table 1 Boundary pH of MexMoO4 decomposition
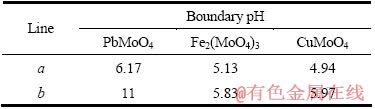
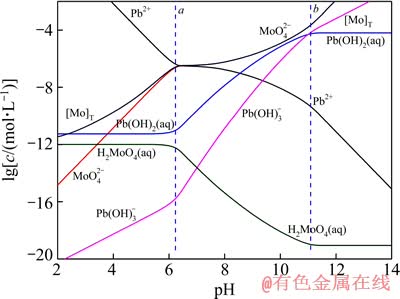
图1 25 ℃时Pb-Mo-H2O体系的lgc-pH图
Fig. 1 lgc-pH diagram of Pb-Mo-H2O system at 25 ℃
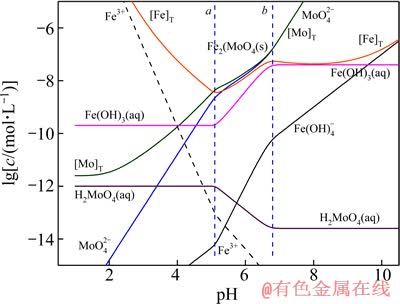
图2 25 ℃时Fe-Mo-H2O体系的lgc-pH图
Fig. 2 lgc-pH diagram of Fe-Mo-H2O system at 25 ℃
2 结果与讨论
由于钼酸盐性质相近,各体系中离子的存在形式相似,故3个体系的lgc-pH图非常相似。由图1、2和3 可见,3个体系中各离子浓度变化趋势一致,在pHa<pH<pHb范围内,MexMoO4稳定存在,pH低于或高于这个范围时,难溶盐开始分解。在pH<pHa时, 会结合H+生成 H2MoO4沉淀,该过程实际上是钼酸盐的酸分解。该过程耗酸高,效率低、设备腐蚀严重,一般不被采纳。
会结合H+生成 H2MoO4沉淀,该过程实际上是钼酸盐的酸分解。该过程耗酸高,效率低、设备腐蚀严重,一般不被采纳。
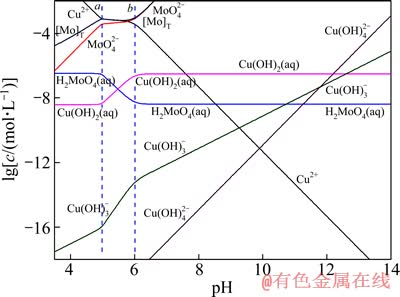
图3 25 ℃时Cu-Mo-H2O体系的lgc-pH图
Fig. 3 lgc-pH diagram of Cu-Mo-H2O system at 25 ℃
在pHa<pH<pHb时,即MexMoO4的稳定区内,溶液中所有离子基团都由沉淀的溶解平衡所制约,其溶度积在所有pH值范围内为一定值,即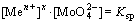 。随着溶液pH值的上升,OH-浓度逐渐增加,其与Men+的结合能力也逐渐增强,因而3个图中Me的各种羟基配合物浓度不断增加,而游离的Men+离子浓度则受到强烈抑制而不断下降。由于
。随着溶液pH值的上升,OH-浓度逐渐增加,其与Men+的结合能力也逐渐增强,因而3个图中Me的各种羟基配合物浓度不断增加,而游离的Men+离子浓度则受到强烈抑制而不断下降。由于 的溶度积一定,游离Men+浓度下降,相应的
的溶度积一定,游离Men+浓度下降,相应的 浓度则迅速上升。其他各种含钼离子基团的浓度变化则与
浓度则迅速上升。其他各种含钼离子基团的浓度变化则与 离子之间的平衡而变化。而且由于pH值增加时OH-的活度增加,当可溶性Me(OH)n浓度恒定时,游离Men+浓度必定迅速下降,如图1~3中Men+浓度曲线所示;而由于
离子之间的平衡而变化。而且由于pH值增加时OH-的活度增加,当可溶性Me(OH)n浓度恒定时,游离Men+浓度必定迅速下降,如图1~3中Men+浓度曲线所示;而由于 溶解平衡的制约关系,相应地
溶解平衡的制约关系,相应地 浓度则会迅速增加,并且随着溶液碱性的增强,钼的平衡浓度增大;当溶液pH值高于图中虚线a处的pH(pHa)值时,可溶性Me(OH)n的浓度不再恒定,而是呈不断增加的趋势,当到达b线对应的pH(pHb)值时,其浓度达到过饱和,溶液中开始析出Me(OH)n的固体,也就是说
浓度则会迅速增加,并且随着溶液碱性的增强,钼的平衡浓度增大;当溶液pH值高于图中虚线a处的pH(pHa)值时,可溶性Me(OH)n的浓度不再恒定,而是呈不断增加的趋势,当到达b线对应的pH(pHb)值时,其浓度达到过饱和,溶液中开始析出Me(OH)n的固体,也就是说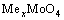 将不断转变成Me(OH)n固体和
将不断转变成Me(OH)n固体和 而被浸出,这在工业上称为碱性浸出,其反应为
而被浸出,这在工业上称为碱性浸出,其反应为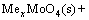
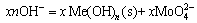 ,Me(OH)n在此区域内为惟一稳定固相物质。值得注意的是,[Me]T浓度的变化趋势仍然是随着溶液pH值的升高而增加,其原因是金属离子与氢氧根生成了各种羟基配合物而进入溶液。
,Me(OH)n在此区域内为惟一稳定固相物质。值得注意的是,[Me]T浓度的变化趋势仍然是随着溶液pH值的升高而增加,其原因是金属离子与氢氧根生成了各种羟基配合物而进入溶液。
对比图1~3可见,pH稳定区域宽度由小到大依次为CuMoO4、Fe2(MoO4)3、PbMoO4,但转化成氢氧化物沉淀的开始pH值的稳定区域宽度由小到大的顺序依次为Fe2(MoO4)3、CuMoO4、PbMoO4,这表明Fe2(MoO4)3的转化较CuMoO4容易,CuMoO4的转化较PbMoO4容易,在足够碱度时,这3种难溶盐都能很好地浸出并实现Me和Mo分离。
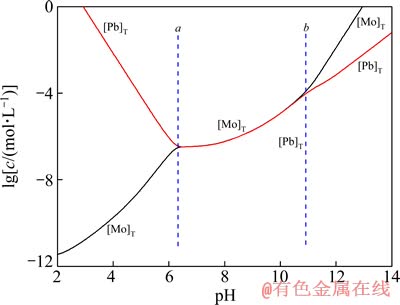
图4 25 ℃时Pb-Mo-H2O体系中[Pb]T与[Mo]T的lgc-pH图
Fig. 4 lgc-pH diagram of [Pb]T and [Mo]T in Pb-Mo-H2O system at 25 ℃
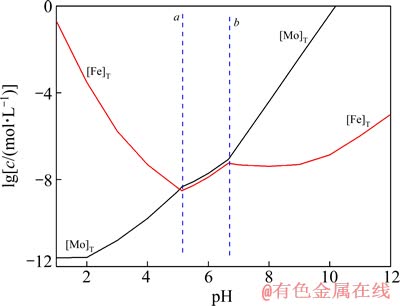
图5 25 ℃时Fe-Mo-H2O体系中[Fe]T与[Mo]T的lgc-pH图
Fig. 5 lgc-pH diagram of [Fe]T and [Mo]T in Fe-Mo-H2O system at 25 ℃
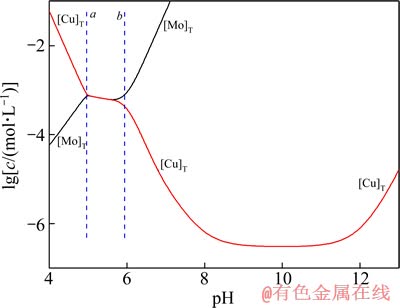
图6 25 ℃时Cu-Mo-H2O体系中[Cu]T与[Mo]T的lgc-pH图
Fig. 6 lgc-pH diagram of [Cu]T and [Mo]T in Cu-Mo-H2O system at 25 ℃
图4~6所列为Me-Mo-H2O体系中[Me]T与[Mo]T的lgc-pH图。由图4~6可见,在b线的右边,随着pH值上升,[Me]T与[Mo]T之间的距离愈来愈远,而且[Mo]T直线上升,表明在强碱体系中难溶钼酸盐能被显著浸出并分离Me和Mo。值得注意的是,当pH值超过12以后,[Me]T浓度明显上升,这是因为随着pH的增大,羟基的活度增加,使得Men+与OH-的配合能力大大加强,Men+与羟基生成多种羟基配合物进入溶液,由于有较多的杂金属存在于浸出液,故在后续的冶炼操作中pH回调时,就会因Men+浓度上升,而抑制 浓度,造成
浓度,造成 与Men+重新结合生成难溶钼酸盐二次沉淀而影响总回收率。解决的办法是添加Na2S作为抑制剂,使之形成更稳定的硫化物沉淀,过滤除去,反应如下:
与Men+重新结合生成难溶钼酸盐二次沉淀而影响总回收率。解决的办法是添加Na2S作为抑制剂,使之形成更稳定的硫化物沉淀,过滤除去,反应如下:
Na2S(aq)+Men+=MeSn(s)+2Na+(47)
由图4~6可见,在碱浸出区域体系中游离的物质浓度:[Fe]T<[Cu]T<[Pb]T。再次印证这些难溶钼酸盐回收利用的困难程度: PbMoO4的高于CuMoO4的,CuMoO4的高于Fe2(MoO4)3。
以上分析结果与文献研究结果是吻合的,如赵德平等[25]报道了用KOH处理含Mo 25.62 %的彩钼铅矿、含Mo 8.21%的高铁钼铅矿以及含Mo 58.40%的辉钼矿,浸出率见表2[25]。
表2 用20% KOH的浸出各矿的浸出结果[25]
Table 2 Leaching result of concentrates by 20% KOH[25]

廖元双等[26]报道了用NaOH处理含Mo 13.48%、含Pb 40.1%的彩钼铅矿,当NaOH用量为理论用量的4.3倍、温度为80 ℃、浸出120 min、液固比为4:1时,Mo的浸出率达到95.3%。
综上所述,在合适的pH范围内,NaOH分解不溶PbMoO4-Fe2(MoO4)3-CuMoO4混合盐中的钼是可行的,不但碱耗量低,而且钼与杂金属分离效果好。
3 结论
1) 绘制出25 ℃时Me-Mo-H2O的浓度对数-pH图,PbMoO4的稳定范围为6.17<pH<11,Fe2(MoO4)3的稳定范围为5.13<pH<5.83,CuMoO4的稳定范围为4.94<pH<5.97,转化的困难程度为Fe2(MoO4)3的转化较CuMoO4容易,CuMoO4的转化较PbMoO4容易。
2) 阐述了溶液中铁、铜和铅与钼的各种离子基团随pH值的变化规律,指出钼酸盐在溶液pH低于pHa时,为酸性浸出,钼转变为H2MoO4固体形式被分解;pH高于pHb时,实现钼酸盐的碱性浸出,钼以MoO42-的形式进入溶液,而此时浸出液中的金属主要以羟基配离子的形式存在,高碱度区域体系中游离的物质浓度:[Fe]T<[Cu]T<[Pb]T。
3) NaOH分解不溶性PbMoO4-Fe2(MoO4)3- CuMoO4混合盐是可行的,控制碱度让铜、铅和铁等少进入溶液体系。针对过量的铜、铁和铅羟基配离子,添加Na2S为抑制剂,形成更稳定的硫化物沉淀过滤除去。不但碱耗量低,而且钼与杂金属分离效果好。
REFERENCES
[1] 张文钲, 刘 燕. 钼多用性洞见[J]. 中国钼业, 2013, 37(2): 1-10.
ZHANG Wen-zheng, LIU Yan. Insights on molybdenum versatility[J]. China molybdenum industry, 2013, 37(2): 1-10.
[2] 李洪桂.有色金属提取冶金手册-稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999: 259-277.
LI Hong-gui. A handbook for extractive metallurgy of nonferrous metals-Rare refractory metals: Part 1[M]. Beijing: Metallurgical Industry Press, 1999: 259-277.
[3] 张启修, 赵秦生.钨钼冶金学[M]. 北京: 冶金工业出版社, 2005: 42-61.
ZHANG Qi-xiu, ZHAO Qing-sheng. Metallurgy of tungsten and molybdenum[M]. Beijing: Metallurgical Industry Press, 2005: 42-61.
[4] 彭 俊, 王学文, 王明玉, 肖彩霞. 从镍钼矿中提取镍钼的工艺[J]. 中国有色金属学报, 2012, 22(2): 553-559.
PENG Jun, WANG Xue wen, WANG Ming yu, XIAO Cai xia. Extraction process of molybdenum and nickel from Ni Mo ore[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(2): 553-559.
[5] 王漪靖. 钼精矿铅高原因分析及对策[J]. 中国钼业, 2002, 26(6): 11-14.
WANG Yi-jing. Analysis and countermeasure on high content of lead in molybdenum concentrates[J]. China molybdenum industry, 2002, 26(6): 11-14.
[6] 李洪桂. 稀有金属冶金学[M]. 北京: 冶金工业出版社, 1990: 68.
LI Hong-gui. Metallurgy of rare metals[M]. Beijing: Metallurgical Industry Press, 1990: 68.
[7] 杨洪英, 俞 娟, 佟琳琳, 罗文杰. 低品位复杂钼精矿的提纯工艺[J]. 中国有色金属学报, 2013, 23(7): 2013-2018.
YANG Hong ying, YU Juan, TONG Lin lin, LUO Wen jie. Purification process of low grade complex molybdenite concentrate[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2013-2018.
[8] 曹占芳, 钟 宏, 姜 涛, 刘广义. 德兴铜矿辉钼矿精矿的选择性电氧化浸出与分离过程[J]. 中国有色金属学报, 2013, 23(8): 2290-2295.
CAO Zhan fang, ZHONG Hong, JIANGTao, LIU Guang yi, WANG Shuai. Selective electric-oxidation leaching and separation of Dexing molybdenite concentrates[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(8): 2290-2295.
[9] 张文钲. 试论钼业技术创新[J]. 中国钼业, 2005, 29(3): 3-5.
ZHANG Wen-zheng. Discussion of technical innovation for molybdenum[J]. China Molybdenum Industry, 2005, 29(3): 3-5.
[10] SOARES A P V, PORTELA M F, KIENNEMANN A, MILLET J M M. Iron-molybdate deactivation during methanol to formaldehyde oxidation: effect of water[J]. Reaction Kinetics and Catalysis Letters, 2002, 75(1): 13-20.
[11] TONG Dong-shen, CHEN Tong, MA Fei, KANG Tao. Transesterification of dimethyl carbonate with phenol over a bimetallic molybdenum and copper catalyst[J]. Reaction Kinetics and Catalysis Letters, 2008, 94(1): 121-129.
[12] BI Jin-hong, WU Ling, ZHANG Yong-fan, LI Zhao-hui. Solvothermal preparation, electronic structure and photocatalytic properties of PbMoO4and SrMoO4[J]. Applied Catalysis B: Environmental, 2009, 91(1): 135-143.
[13] LEYZEROVICH N, BRAMNIK K, BUHRMESTER T, EHRENBERG H. Electrochemical intercalation of lithium in ternary metal molybdates MMoO4(M: Cu, Zn, Ni and Fe)[J]. Journal of Power Sources, 2004, 127(1): 76-84.
[14] HABER J. The role of surfaces in the reactivity of solids[J]. Pure and Applied Chemistry, 1984, 56: 1663-1676.
[15] DURHAM N. Solubilities of natural and synthetic ferrimolybdite[J]. The American Mineralogist, 1965, 50: 12-18.
[16] RAPPOSCH M, ANDERSON J, KOSTINER E. Crystal structure of ferric molybdate, Fe2(MoO4)3[J]. Inorganic Chemistry, 1980, 19(11): 3531-3539.
[17] 马 飞, 赵中伟, 曹才放, 张 刚. 硫化钠分解彩钼铅矿热力学研究[J ]. 中国钼业, 2008, 32(1): 44-47.
MA Fei, ZHAO Zhong-wei, CAO Cai-fang, ZHANG Gang. Thermodynamic analysis on sodium sulfide decomposition of wulfenite[J]. China Moijbdenum Industry, 2008, 32(1): 44-47.
[18] 张 刚, 赵中伟, 李江涛, 陈爱良, 霍广生, 李洪桂. 氢氧化钠分解钼酸铅矿的热力学分析[J]. 中南大学学报: 自然科学版, 2008, 39(5): 902-906.
ZHANG Gang, ZHAO Zhong-wei, LI Jiang-tao, CHEN Ai-liang, HUO Guang-sheng, LI Hong-gui. Thermodynamics analysis on sodium hydroxide decomposition of wulfenite[J]. Journal of Center South University: Science and Technology, 2008, 39(5): 902-906.
[19] 巨少华, 唐谟堂, 杨声海. 用 MATLAB 编程求解Zn (Ⅱ)-NH4 CI-NH3-H2O体系热力学模型[J]. 中南大学学报: 自然科学版, 2005, 36(5): 821-827.
JU Shao-hua, TANG Mo-tang, YANG Sheng-hai. Thermodynamics model of Zn-NH4Cl-NH3-H2O system using MATLAB programming[J]. Journal of Center South University: Science and Technology, 2005, 36(5): 821-827.
[20] 杨建广, 唐谟堂, 杨声海, 唐超波, 陈永明. Sn (Ⅳ)-Sb (Ⅲ)-NH3-NH4Cl-H2O 体系热力学分析及其应用[J]. 中南大学学报: 自然科学版, 2005, 36(4): 582-586.
YANG Jian-guang, TANG Mo-tang, YANG Sheng-hai, TANG Chao-bo, CHEN Yong-ming. Thermodynamic analysis of Sn(Ⅳ)-Sb(Ⅲ)-NH3-NH4Cl-H2O system and its application[J]. Journal of Center South University: Science and Technology, 2005, 36(4): 582-586.
[21]  L. handbook of chemical equilibria in analytical chemistry[M]. Ellis Horwood Limited, 1985: 414.
L. handbook of chemical equilibria in analytical chemistry[M]. Ellis Horwood Limited, 1985: 414.
[22] BARD A J, PARSONS R, JORDAN J. Standard potentials in aqueous solutions[M]. CRC Press, 1985: 26-30.
[23] FOLLETT R F, BARBER S A. Molybdate phase equilibria in soil[J]. Soil Science Society of America Journal, 1967, 31(1): 26-29.
[24] GROBLER S R, SURI S K. Solubilities of the molybdates and tungstates of silver and copper (Ⅱ) in water by ion-selective electrodes[J]. Journal of Inorganic and Nuclear Chemistry,1980, 42(1): 51-53.
[25] 赵德平, 吴继华, 阮鸿兴. 钼矿石中钼的化学物相分析[J]. 云南冶金, 2000, 29(5): 48-50.
ZHAO De-ping, WU Ji-hua, RUAN Hong-xing. The chemical phase analysis of molybdenum concentrate [J]. Yunnan metallurgy, 2000, 29(5): 48-50.
[26] 廖元双, 杨大锦, 鲁顺利. 钼铅矿提钼工艺研究[J]. 有色金属: 冶炼部分, 2006, 4: 26-27.
LIAO Yuan-shuan, YANG Da-jin, LU Shun-li. Study on molybdenum recovering from wulfenite[J]. Non-ferrous Metals: Extractive Metallurgy, 2006(4): 26-27.
(编辑 龙怀中)
基金项目:国家高技术研究发展计划资助项目(2012AA063205)
收稿日期:2014-01-20;修订日期:2014-06-06
通信作者:陈星宇,副教授,博士;电话:0731-88830476;E-mail:xychen@csu.edu.cn
摘 要:辉钼矿经氧化焙烧转化成MoO3的过程中,伴生的铜铅铁等硫化矿亦被氧化,并与MoO3生成难溶钼酸盐。为减少因难溶钼酸盐带来的钼损失,需要对这些钼酸盐进行再浸出处理。针对这些钼酸盐湿法浸出过程进行热力学分析,绘制了25 ℃时Me-Mo-H2O(Me:Cu,Pb,Fe)系组分的浓度对数-pH图。利用热力学平衡图对氢氧化钠分解钼酸盐进行热力学分析。结果表明:整个pH值范围可分为H2MoO4的稳定区、难溶钼酸盐的稳定区、Me(OH)n的稳定区。高pH区钼酸盐中的Me转变为稳定的Me(OH)n物相,即实现了钼酸盐的碱分解。而Fe2(MoO4)3、CuMoO4和PbMoO4的碱浸出难度依次递增,达到一定碱度时这3种难溶盐都能很好地分解,并实现Me与Mo的分离。但过高的碱度又使大量的金属以羟基配合物离子的形式进入溶液,增加了后续除杂难度。
[1] 张文钲, 刘 燕. 钼多用性洞见[J]. 中国钼业, 2013, 37(2): 1-10.
[2] 李洪桂.有色金属提取冶金手册-稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999: 259-277.
[3] 张启修, 赵秦生.钨钼冶金学[M]. 北京: 冶金工业出版社, 2005: 42-61.
[4] 彭 俊, 王学文, 王明玉, 肖彩霞. 从镍钼矿中提取镍钼的工艺[J]. 中国有色金属学报, 2012, 22(2): 553-559.
[5] 王漪靖. 钼精矿铅高原因分析及对策[J]. 中国钼业, 2002, 26(6): 11-14.
[6] 李洪桂. 稀有金属冶金学[M]. 北京: 冶金工业出版社, 1990: 68.
LI Hong-gui. Metallurgy of rare metals[M]. Beijing: Metallurgical Industry Press, 1990: 68.
[7] 杨洪英, 俞 娟, 佟琳琳, 罗文杰. 低品位复杂钼精矿的提纯工艺[J]. 中国有色金属学报, 2013, 23(7): 2013-2018.
[8] 曹占芳, 钟 宏, 姜 涛, 刘广义. 德兴铜矿辉钼矿精矿的选择性电氧化浸出与分离过程[J]. 中国有色金属学报, 2013, 23(8): 2290-2295.
[9] 张文钲. 试论钼业技术创新[J]. 中国钼业, 2005, 29(3): 3-5.
[17] 马 飞, 赵中伟, 曹才放, 张 刚. 硫化钠分解彩钼铅矿热力学研究[J ]. 中国钼业, 2008, 32(1): 44-47.
[18] 张 刚, 赵中伟, 李江涛, 陈爱良, 霍广生, 李洪桂. 氢氧化钠分解钼酸铅矿的热力学分析[J]. 中南大学学报: 自然科学版, 2008, 39(5): 902-906.
[25] 赵德平, 吴继华, 阮鸿兴. 钼矿石中钼的化学物相分析[J]. 云南冶金, 2000, 29(5): 48-50.
[26] 廖元双, 杨大锦, 鲁顺利. 钼铅矿提钼工艺研究[J]. 有色金属: 冶炼部分, 2006, 4: 26-27.


