分离回收废旧锂离子电池电极材料的浮选实验研究
文瑞明,刘长辉,游沛清,邱文辉,林毅辉
(湖南城市学院 化学与环境工程学院,湖南 益阳,413000)
摘 要:
剂、甲基异丁基甲醇(MIBC)作起泡剂对锂离子电池电极材料进行浮选实验研究,考察捕收剂用量、起泡剂用量、分散剂和抑制剂种类及用量对正极材料钴酸锂回收率的影响。研究结果表明:当矿浆质量浓度为0.05 g/mL,pH为6.0时,以0.15 mg柴油为捕收剂,0.75 mg六偏磷酸钠为分散剂,0.75 mg聚丙烯酸钠作抑制剂,0.84 mg MIBC为起泡剂,正极材料钴酸锂的回收率达93%。
关键词:
中图分类号:TM911 文献标志码:A 文章编号:1672-7207(2014)01-0040-05
Flotation on recovery of electrode materials from spent lithium-ion batteries
WEN Ruiming, LIU Changhui, YOU Peiqing, QIU Wenfei, LIN Yifei
(College of Chemistry and Environment Engineering, Hunan City University, Yiyang 41300, China)
Abstract: Lithium cobaltate was separated from lithium-ion battery materials with diesel as collector and methyl isobutyl carbinol (MIBC) as foaming agent. The effect of the amount of collector and foaming agent, the type and the mount of inhibitor agent and dispersing agent were investigated, and the process conditions were optimized. The results show that, under the optimum conditions, i.e., the mass concentration of pulp is 0.05 g/mL, pH is 6.0, the mass of diesel, sodium hexametapho sphate, sodium polyacrylate and MIBC are 0.15,0.75,0.75 and 0.84 mg, respectively, the recovery rate of lithium cobaltate is 93% using sodium hexametapho sphate as dispersing agent and sodium polyacrylate as inhibitor.
Key words: flotation; lithium-ion battery; lithium cobaltate; methyl isobutyl carbinol
锂离子电池因为具有能量密度高、无记忆性、密度低、寿命长等优点而被大量数码产品的厂商所采用,并且受到了广大消费者的喜爱[1]。但是,锂离子电池在被大量使用的同时,其报废量也迅速增加。一方面,锂离子电池使用寿命通常为500~1 000次,使用2~3 a后,电极膨胀,容量下降,以至报废;另一方面,据估计,大型电池企业的废品率为1%~3%,极片生产过程中的边角料废品率为1%~2%,而小型企业的残次品率更高。此外,随着手机型号的变更,大量库存电池和旧电池也需要物尽其用。废旧锂离子电池含有大量有价金属,其中,钴的质量分数为5%~20%,锂为5%~7%,镍为5%~10%[2-3],回收这些有价金属尤其是钴将大大缓解钴资源的紧缺。相反,若这些问题不能得到有效解决,则不但会造成资源浪费,而且会对人类健康和环境产生很大的威胁[4-5]。目前,对废旧锂离子电池进行回收的方法主要有:Fouad等采用的在150~500 ℃通过热处理的火法[6],Saeki 等采用的机械研磨法[7],何汉兵等采用的有机溶剂萃取法[8],陈亮等采用的化学浸出法[9],Contestabile等采用的选择性沉淀法[10],Freitas等采用的电化学法[11]和邓孝荣等采用的生物浸出法[12]。在这些方法中,焚烧法除去有机物时易引起大气污染,后处理仍需一系列净化除杂步骤;湿法的工艺流程长且复杂,对设备要求高,成本也高,有机试剂的使用还会对环境和人体健康产生不利影响;生物浸出法存在周期长、效率低等问题:因此,有必要探索新型、合理、有效、清洁的废旧锂离子电池的处理工艺。由于锂离子电池正极材料主要为钴酸锂,负极材料主要为改性石墨,根据清洁的钴酸锂表面具有亲水性、石墨表面具有疏水性的特点,本文作者在探讨纯钴酸锂[13]和纯石墨[14]浮选实验条件的基础上,考察用浮选法进行分离回收废旧锂离子电池电极材料,以达到循环利用正极材料钴酸锂的目标。
1 实验
1.1 试剂与仪器
试剂:磷酸、六偏磷酸钠、聚丙烯酸钠、草酸、甲基异丁基甲醇(MIBC),均为市售分析纯;钴酸锂、石墨、柴油,为市售药品。
仪器:电子天平、PHS-3E型pH计、JSM-6360型扫描电子显微镜、XFG-5-35型挂槽浮选机(配40 mL浮选槽)及常规玻璃仪器。
1.2 实验方法
根据文献[13-14]中的实验结果,本文选取柴油为捕收剂,MIBC为起泡剂,用磷酸调节pH,分别考察捕收剂用量、起泡剂用量、抑制剂和分散剂的种类与用量对纯LiCoO2和纯石墨的混合样品(质量比为1:1)及废旧锂离子电池实际样品的浮选实验结果。
称取样品2.000 0 g置于40 mL浮选槽中,加入适量蒸馏水。机械搅拌1 min使之混合均匀,再用磷酸调节pH至一定值。调节完毕,用蒸馏水清洗pH电极使水位至刻度,然后加入适量柴油作捕收剂,机械搅拌2 min使之充分混匀。再逐步加入抑制剂、分散剂,机械搅拌1 min使之充分混合。最后,加入适量 MIBC作起泡剂,机械搅拌2 min后放入挡板,2 min后开始刮泡4 min。干燥,称质量,取下层正极材料备用。
2 结果与讨论
2.1 纯LiCoO2和纯石墨混合样品(质量比为1:1)的浮选实验
2.1.1 pH对钴酸锂回收率的影响
浮选过程中由于矿物的水解及对OH-或H+的吸附,不同矿浆具有不同的pH。矿浆的pH对浮选过程的影响是相当复杂的:一方面,它可以影响矿物颗粒表面状态;另一方面,可以影响捕收剂、起泡剂及其它试剂的存在状态以及试剂在矿物颗粒表面的附着条件。这2个方面都会对浮选结果发生影响。
取0.075 mg柴油作捕收剂,0.84 mg MIBC为起泡剂,不加抑制剂、分散剂,用磷酸调节pH,按上述实验方法对2.000 0 g纯LiCoO2和纯石墨的混合样品(质量比为1:1)进行浮选实验,考察pH对下层钴酸锂回收率的影响,实验结果见表1。
表1 pH对下层钴酸锂回收率的影响
Table 1 Influence of pH value on recovery rate of lithium cobaltate

由表1可知:当pH为6.0时,下层钴酸锂的回收率最高,起泡效果较好。根据以上结果,本文选取pH为6.0进行浮选实验。
2.1.2 捕收剂柴油用量对钴酸锂回收率的影响
捕收剂是矿物浮选所用的关键试剂,它的作用是通过改变矿物表面的疏水性、亲水性,使浮游在矿浆中的矿粒黏附于或分离气泡表面,从而达到浮选分离矿物的目的。根据本文2.1.1的实验结果,调节pH为6.0,其他条件和操作方法不变,改变捕收剂柴油用量进行实验,结果见表2。
表2 捕收剂柴油用量对下层钴酸锂回收率的影响
Table 2 Influence of the amount of diesel on the recovery rate of lithium cobaltate
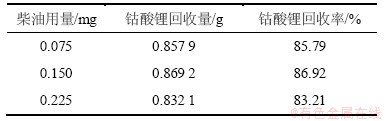
由表2可知:柴油用量为0.15 mg时下层钴酸锂的回收率最高,故本实验选用柴油用量为0.15 mg为宜。
2.1.3 起泡剂MIBC用量对钴酸锂回收率的影响
在浮选中使用的起泡剂一般为表面活性剂,其分子结构主要由非极性的疏水基团和极性的亲水基团构成,从而形成既有亲水性又有亲油性的分子。本文使用的起泡剂为甲基异丁基甲醇(MIBC),其特点是能够形成脆性的泡沫。这种脆性的泡沫不仅选择性强,活性好,用量少,没有捕收性,而且比普通泡沫更致密且容易破裂,因而,能在很大程度上加大选矿泡沫强度,将不需要的矿物带出浮选槽。
取柴油0.15 mg为捕收剂,调节pH为6.0,不加抑制剂、分散剂,改变起泡剂MIBC的用量,对2.000 0 g纯LiCoO2和纯石墨的混合样品(质量比为1:1)进行浮选实验,结果见表3。
表3 起泡剂MIBC用量对下层钴酸锂回收率的影响
Table 3 Influence of the amount of MIBC on the recovery rate of lithium cobaltate
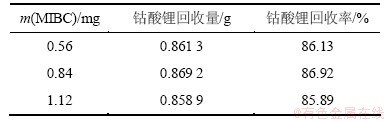
由表3可知:当MIBC用量为0.84 mg时下层钴酸锂回收率最高,起泡效果较好,故本实验选用0.84 mg MIBC作为捕收剂。
2.1.4 抑制剂的种类及用量对钴酸锂回收率的影响
浮选矿物时为了使矿物不易附着于气泡上而采用增加矿物润湿性的方法,在浮选中主要采用加入抑制剂。抑制剂可以增加矿物表面的亲水性,并且能够阻止捕收剂在矿物表面的吸附。
量取柴油0.15 mg,MIBC 0.84 mg,分散剂六偏磷酸钠0.75 mg,pH为6.0,取聚丙烯酸钠、草酸分别作抑制剂,按上述实验方法对2.000 0 g纯LiCoO2和纯石墨的混合样品(质量比为1:1)进行浮选实验,结果见表4。
由表4可知:当聚丙烯酸钠用量为0.75 mg时,下层钴酸锂的回收率最高达94.26%,并且此时起泡效果很好。因此,将0.75 mg聚丙烯酸钠作为浮选纯LiCoO2和纯石墨的混合样品的抑制剂。
2.1.5 分散剂的种类及用量对钴酸锂回收率的影响
为了使矿浆中的矿粒分散,通常需要在矿浆中加入某些分散剂。分散剂是使矿物均匀地分散在矿浆中,并使之不再聚集的一类物质。
量取柴油0.15 mg,MIBC 0.84 mg,聚丙烯酸钠0.75 mg,pH调节为6.0,取六偏磷酸钠、碳酸钠分别作为分散剂,对纯LiCoO2和纯石墨的混合样品(质量比为1:1)进行浮选实验,结果见表5。
表4 抑制剂种类和用量对下层钴酸锂回收率的影响
Table 4 Effect of type and mount of inhibitor agents on recovery of lithium cobaltate
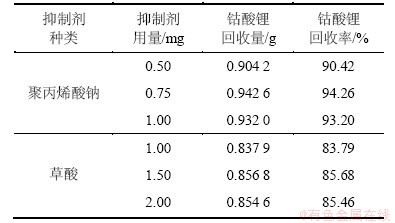
表5 分散剂的种类及用量对下层钴酸锂回收率的影响
Table 5 Effect of type and mount of dispersing agents on recovery of lithium cobaltate

由表5可知:使用0.75 mg六偏磷酸钠作分散剂的效果最佳,此时,起泡效果较好,钴酸锂不沾于浮选槽壁上。综上所述,纯LiCoO2和纯石墨的混合样品(质量比为1:1)的浮选分离最佳条件如下:矿浆质量浓度为0.05 g/mL,pH=6.0,柴油质量为0.15 mg,MIBC质量为0.84 mg,聚丙烯酸钠质量为0.75 mg,六偏磷酸钠质量为0.75 mg。在此最佳条件下,下层钴酸锂的回收率最高达94.26%。
2.2 实际废旧锂离子电池电极粉料的浮选实验
根据前面实验结果,对某废旧锂离子电池拆解厂的电极粉料(LiCoO2 质量分数为67.4%)进行浮选实验研究,实验结果如下。
称取2.000 0 g实际废旧锂离子电池电极粉末置于40 mL浮选槽中,加入蒸馏水调成矿浆质量浓度为0.05 g/mL,调节pH为6.0,按上述最佳浮选条件进行操作,得下层槽内产品(LiCoO2)质量为1.253 6 g,上层产品(主要为石墨)质量为0.745 1 g,LiCoO2回收率达93%。
所得产品用JSM-6360型扫描电子显微镜进行低压能谱分析,结果如图1和图2所示。由图2可知:回收产品LiCoO2的品位较高,经进一步纯化处理后可再次使用。

图1 纯LiCoO2的TEM图和低压能谱分析结果
Fig. 1 TEM micrograph and LVEDS spectra of pure lithium cobaltate
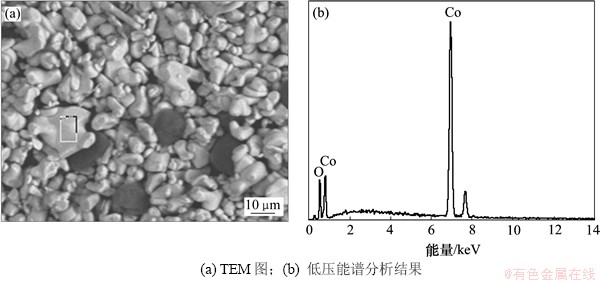
图2 回收LiCoO2 的TEM图和低压能谱分析结果
Fig. 2 TEM micrograph and LVEDS spectra of spectra of reclaimed lithium cobaltate
3 结论
(1) 采用柴油作捕收剂,甲基异丁基甲醇(MIBC)作起泡剂,探讨捕收剂、起泡剂用量、分散剂、抑制剂种类及用量对实际废旧锂离子电池电极材料钴酸锂浮选实验的影响。
(2) 浮选实验最适宜条件如下:在矿浆质量浓度为0.05 g/mL,pH为6.0,捕收剂柴油、分散剂六偏磷酸、抑制剂聚丙烯酸钠、起泡剂MIBC质量分别为0.15,0.75,0.75和0.84 mg时,下层钴酸锂的回收率最高达93%。
(3) 该法所用药品来源广泛,价格低廉,无污染与腐蚀,且操作简便,回收率高,回收产品经进一步纯化后可再次利用,推广应用前景广阔。
参考文献:
[1] Contestabile M, Panero S, Scrosati B. A laboratory-scale lithium-ion battery recycling process[J]. Journal of Power Sources, 2001, 92(1/2): 65-69.
[2] Shin S M, Kim N H, Sohn J S, et al. Development of a metal recovery process from Li-ion battery wastes[J]. Hydrometallurgy, 2005, 79(3/4): 172-181.
[3] Lee C K, Rhee K I. Preparation of LiCoO2 from spent lithium-ion batteries[J]. Journal of Power Sources, 2002, 109(1): 17-21.
[4] Hal A, Angelica V S. Toxicity of lithium to humans and the envmonment: A literature review[J]. Ecotoxicology and Environmental Safety, 2008, 70(3): 349-356.
[5] Castillo S, Ansart F, Labret-Robert C, et al. Advances in the recovering of spent lithium battery compounds[J]. Journal of Power Sources, 2002, 112(1): 247-254.
[6] Fouad O A, Farghaly F I, Bahgat M. A novel approach for synthesis of nanocrystalline γ-LiAlO2 from spent lithium-ion batteries[J]. J Anal Appl Pyrolysis, 2007, 78: 65.
[7] Saeki S, Lee J, Zhang Q W, et al. Co-grinding LiCoO2 with PVC and water leaching of metal chlorides formed in ground product[J]. International Journal of Mineral Processing, 2004, 74(1): 373-378.
[8] 何汉兵, 秦毅红. 有机溶剂分离废旧锂离子电池[J]. 电源技术, 2006, 30(5): 380-382.
HE Hanbing, QIN Yihong. Application of organic solvent partition method on used lithium-ion batteries[J]. Chinese Journal of Power Sources, 2006, 30(5): 380-382.
[9] 陈亮, 唐新村, 张阳, 等. 以废旧锂离子电池为原料制备棒状草酸钴粉末[J]. 中南大学学报(自然科学版), 2012, 43(8): 2921-2925.
CHEN Liang, TANG Xincun, ZHANG Yang, et al. Preparation of rod-like cobalt oxalate powder from spent lithium-ion batteries[J]. Journal of Central South University (Science and Technology), 2012, 43(8): 2921-2925.
[10] Contestabile M, Panero S, Scrostai B. A laboratory-scale lithium-ion battery recycling process[J]. J Power Sources, 2001, 92(1/2): 65-69.
[11] Freitas M B J G, Garcia E M. Electrochemical recycling of cobalt from cathodes of spent lithium-ion batteries[J]. J Power Sources, 2007, 171(2): 953-959.
[12] 邓孝荣, 曾桂生, 罗胜联, 等. 氧化亚铁硫杆菌浸出废旧锂离子电池中钴酸锂的电化学行为[J]. 中南大学学报(自然科学版), 2012, 43(7): 2500-2505.
DENG Xiaorong, ZENG Guisheng, LUO Shenglian, et al. Electrochemical behavior of bioleaching LiCoO2 from spent lithium-ion batteries by Thiobacillus ferrooxidans[J]. Journal of Central South University (Science and Technology), 2012, 43(7): 2500-2505.
[13] 文瑞明, 刘长辉, 胡拥军, 等. 回收锂离子电池正极材料的浮选实验研究[J]. 电源技术, 2013, 37(8): 1322-1324.
WEN Ruiming, LIU Changhui, HU Yongjun, et al. Study on flotation of lithium-ion battery anode material[J]. Chinese Journal of Power Sources, 2013, 37(8): 1322-1324.
[14] 文瑞明, 胡拥军, 齐风佩, 等. 锂离子电池负极材料浮选回收研究[J]. 电池工业, 2013, 18(1/2): 18-20, 37.
WEN Ruiming, HU Yongjun, QI Fengpei, et al. Study on flotation recovery of lithium-ion battery cathode material[J]. Chinese Battery Industry, 2013, 18(1/2): 18-20, 37.
(编辑 陈灿华)
收稿日期:2013-03-21;修回日期:2013-05-24
基金项目:国家自然科学基金资助项目(51074069);湖南省科技计划重点资助项目(2013WK2008)
通信作者:文瑞明(1963-),男,湖南益阳人,教授,从事有机合成与矿物浮选的研究;电话:13332572290;E-mail: wenruiming@sohu.com
摘要:采用柴油作捕收剂、甲基异丁基甲醇(MIBC)作起泡剂对锂离子电池电极材料进行浮选实验研究,考察捕收剂用量、起泡剂用量、分散剂和抑制剂种类及用量对正极材料钴酸锂回收率的影响。研究结果表明:当矿浆质量浓度为0.05 g/mL,pH为6.0时,以0.15 mg柴油为捕收剂,0.75 mg六偏磷酸钠为分散剂,0.75 mg聚丙烯酸钠作抑制剂,0.84 mg MIBC为起泡剂,正极材料钴酸锂的回收率达93%。
[8] 何汉兵, 秦毅红. 有机溶剂分离废旧锂离子电池[J]. 电源技术, 2006, 30(5): 380-382.
[9] 陈亮, 唐新村, 张阳, 等. 以废旧锂离子电池为原料制备棒状草酸钴粉末[J]. 中南大学学报(自然科学版), 2012, 43(8): 2921-2925.
[12] 邓孝荣, 曾桂生, 罗胜联, 等. 氧化亚铁硫杆菌浸出废旧锂离子电池中钴酸锂的电化学行为[J]. 中南大学学报(自然科学版), 2012, 43(7): 2500-2505.
[13] 文瑞明, 刘长辉, 胡拥军, 等. 回收锂离子电池正极材料的浮选实验研究[J]. 电源技术, 2013, 37(8): 1322-1324.
[14] 文瑞明, 胡拥军, 齐风佩, 等. 锂离子电池负极材料浮选回收研究[J]. 电池工业, 2013, 18(1/2): 18-20, 37.


