金属离子强化铁闪锌矿浮选精矿的生物浸出
石绍渊1, 方兆珩2
(1. 北京大学 环境工程研究所, 北京 100871; 2. 中国科学院 过程工程研究所, 北京 100080)
摘 要:
考察了金属离子Cu2+、 Fe3+和Fe2+等对铁闪锌矿浮选精矿生物浸出的影响, 并与无菌条件下对铁闪锌矿浸出的影响进行比较。 结果表明: Cu2+、 Fe3+和Fe2+等金属离子在一定浓度范围内都可以促进铁闪锌矿的生物浸出; 在无菌条件下, 除Fe2+外, Cu2+和Fe3+离子仍对铁闪锌矿溶解有一定的促进作用。 电化学测试和X射线衍射分析表明: 添加Cu2+和Fe3+等离子将影响铁闪锌矿电极发生的电化学反应和浸渣组成; 添加Cu2+离子可取代矿物基质晶格中的Zn而生成CuS沉淀, 并与锌矿产生原电池效应而促进浸出过程; Fe3+和Fe2+两种离子强化铁闪锌矿生物浸出的机理本质上一致, 均可以提高浸出液中氧化剂浓度和促进细菌生长与生物活性。
关键词: 铁闪锌矿; 金属离子; 生物浸出; 强化作用 中图分类号: TF18
文献标识码: A
Enhancement of bioleaching of marmatite flotation concentrate by metallic ions
SHI Shao-yuan1, FANG Zhao-heng2
(1. Institute of Environmental Engineering, Peking University, Beijing 100871, China;
2. Institute of Processing Engineering, Chinese Academy of Sciences, Beijing 100080, China)
Abstract: The effects of Cu2+, Fe2+ and Fe3+ ions on the bioleaching of marmatite flotation concentrate were studied and compared with those of the marmatite leaching under the sterile controls. The results show that these metallic ions can accelerate the marmatite dissolution when suitable concentration of metallic ions is added. In the absence of bacterial strains, Cu2+ and Fe3+ ions still improve the dissolution of marmatite to a certain extent except Fe2+ ion. Electrochemical measurements and X-ray diffraction analyses show that the electrochemical reactions occurring on the interface of a marmatite-carbon paste/leach liquor and the compositions of leached residues can be influenced by the addition of Cu2+ and Fe3+ ions. The formed CuS on the surface of mineral substrate by replacing Zn2+in crystal lattice of mineral substrate with Cu2+ can accelerate the leaching process of marmatite by galvanic effect. The strengthening mechanism of Fe2+ and Fe3+ ions on the marmatite bioleaching are consistent in nature with each other, both of them can increase the concentration of oxidant and improve the growth and activity of bacterial strains in leaching liquor.
Key words: marmatite; metallic ions; bioleaching; strengthening action
生物浸矿技术作为从低品位、 复杂多金属矿物中回收有价金属的重要方法, 具有成本低、 操作简单和对环境友好等优点, 因而受到广泛关注。 目前, 虽然生物浸矿技术已经在低品位硫化矿中浸出铜、 铀和预处理难冶炼金矿等[1-3]得到了广泛应用, 但依然存在浸出周期长、 浸出效率低等问题。 为了加快硫化矿的生物浸出速率和缩短浸出周期, 一些研究者对硫化矿生物浸出的强化措施进行了探讨。 Deng等[4]研究了表面活性剂和多种金属离子对低品位难处理浸出生物氧化的催化作用; Niemela等[5]考察了营养物质对矿物生物浸出的影响; Nakazawa等[6, 7]考察银离子对镍-铜硫化矿和活性炭对黄铜矿精矿生物浸出的影响; Hu等[8]也考察了含Ag+催化剂对黄铜矿细菌浸出的影响。 这些研究表明, 可以采取措施以改善矿物的生物浸出过程和强化浸出效果。
已有研究者对硫化锌矿的生物浸出[9, 10]进行了较为广泛的研究, 但由于其有价金属锌的浸出速率较慢、 浸出周期长等缺点, 而难以实现工业应用。 最近, Pina等[11]考察了Fe2+和Fe3+对Acidithiobacillus sp.浸出闪锌矿的影响, 发现添加Fe3+对闪锌矿的生物浸出尤其在初始阶段具有重要作用。 铁闪锌矿是我国特有的一种重要锌矿资源, 由于其浮选精矿含铁高, 采用传统的焙烧—浸出—净化—电解技术难以获得经济效益, 而采用生物浸出工艺处理这种锌矿资源是一种较好选择。 Shi和Fang等[12, 13]的研究已初步证明, 铁闪锌矿浮选精矿生物浸出工业应用的可行性。 本文作者主要考察了Cu2+、 Fe2+和Fe3+等金属离子对铁闪锌矿浮选精矿生物浸出的影响, 并对比了无菌条件下不同金属离子对铁闪锌矿浸出的影响。 通过电化学方法和浸渣X射线粉晶衍射分析, 进一步探讨其强化作用机理。
1 实验
铁闪锌矿浮选精矿来自云南澜沧铅锌矿。 X射线晶体衍射分析表明, 主要矿物组成为铁闪锌矿和少量黄铁矿, 其化学组成和矿物组成见文献[12]。 在浸出前磨矿15min进行表面活化, 磨矿后粒度小于35.5μm (90%以上)。 接种前在室温下先预浸3d。 浸矿菌种采用中度嗜热铁氧化菌(MLY)和氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, 简写为At. f), 其原菌株由中科院微生物所提供。 在含5%(铁闪锌矿质量与溶液体积之比)铁闪锌矿作为惟一能源的培养基中进行驯化, 经过一年以上连续接种培养得到性能良好的驯化菌株。
采用摇瓶浸出进行分批实验, 在250mL锥形瓶中加入90mL Leathen培养基[14] (不含铁), 中温菌另加0.5g/L酵母浸膏, 再添加5g锌精矿, 分别接种10mL活化5d的菌种培养液, 摇床转速控制在160r/min。 通过血球计数板在生物显微镜下直接计数, 结果表明, 所有接种体系菌种的初始密度约为1.0×107 cell/mL。 采用中度嗜热铁氧化菌(MLY)浸出铁闪锌矿时, 浸出液初始pH为1.5, 温度控制在50℃。 在每组实验中, 同时进行无菌对比实验, 并加入1mL甲醛(分析纯)作为杀菌剂。 浸出液中Zn2+离子浓度采用EDTA络合滴定法测量, 进行两次平行实验取平均值, 误差约在5%以内。 实验中对浸出液的pH值进行监测, 并用3.0mol/L H2SO4溶液调整到初始值。
电化学实验在双层玻璃反应器中进行, 采用标准三电极体系, 工作电极为铁闪锌矿(50%, 质量分数)-碳糊电极(自制)[15], 参比电极和对电极分别采用KCl饱和甘汞电极和铂电极。 通过连接超级恒温槽来控制反应器温度恒定。 电解质溶液中不同浓度的金属离子采用分析纯试剂按要求添加适量。 实验数据通过IM6e电化学工作站和计算机采集并处理。
2 结果与讨论
2.1 金属离子强化铁闪锌矿的生物浸出
不同浓度的金属离子Cu2+, Fe2+, Fe3+等对中度嗜热铁氧化菌(MLY)浸出铁闪锌矿浮选精矿的影响如图1所示。 从图1 (a)可以发现, 在接种浸矿菌种时, 添加适量的Cu2+离子可以提高铁闪锌矿的溶解速率, 且当Cu2+离子浓度约为1.25g/L时浸出效果较好; 当Cu2+ 离子浓度继续增大后, 将对浸矿细菌造成毒害作用[16], 从而对铁闪锌矿的生物浸出起负面影响。 图1(a′)表明, 在无菌条件下铁闪锌矿的溶解速率随着添加Cu2+离子浓度的增大而加快。 虽然较高浓度的Cu2+离子对铁闪锌矿无菌化学浸出时未表现出抑制作用, 但其强化浸出效果随Cu2+浓度增大而变得不如较低浓度时显著。
从图1(b)可以发现, 添加少量Fe2+离子可以提高铁闪锌矿的生物浸出速率, 而且随着Fe2+离子浓度的增大而略有增加; 当Fe2+离子浓度继续增大时, 除了会对细菌造成毒害作用外, 而且过多的Fe2+离子被细菌氧化成Fe3+离子而生成铁钒沉淀[17], 覆盖在矿物表面, 从而阻碍铁闪锌矿的生物浸出。 图1 (b′)表明, 在无菌条件下添加不同浓度的Fe2+离子时, 铁闪锌矿的溶解几乎没有差别, 即添加Fe2+离子对锌矿溶解没有任何促进作用。 在接种和未接种浸矿菌种时, 添加不同浓度的Fe3+离子都会促进铁闪锌矿的溶解(图1 (c, c′))。 可以发现, 在一定的浓度范围内, 在接种和未接种浸矿菌种时铁闪锌矿的溶解速率都随Fe3+离子浓度的增大而略有增加。 与接种体系相比, 在无菌条件下

图1 不同浓度金属离子对应接种与未接种中度嗜热菌时铁闪锌矿的浸出曲线
Fig.1 Leaching curves of marmatite concentrate in presence and absence of moderate thermophile (MLY) by adding different concentrations of metallic ions
矿物中有价金属锌的浸出率明显降低, 这是由于当Fe3+离子被消耗后没有浸矿细菌来氧化再生, 从而导致铁闪锌矿的溶解急剧减小, 甚至停止。
2.2 金属离子对铁闪锌矿-碳糊电极伏安曲线的影响
不同浓度的Cu2+ 和Fe3+ 离子浓度对对铁闪锌矿-碳糊电极在接种氧化亚铁硫杆菌浸出体系中伏安曲线的影响如图2所示。 实验时温度控制为35℃, 电位扫描速率为100mV/s。 从图2 (a)可以发现, Cu2+离子的浓度对峰B′、 B″、 B等有一定影响, 随Cu2+离子浓度增大电流幅值略有减小; 而峰A、 C、 D和E等电流幅值都随铜离子浓度升高而增大。 与没有添加铜离子时最显著的差别在于伏安曲线上峰C和D之间出现了一个新峰, 即图2(a)中的峰F; 在峰A和E之间出现一个较小的峰, 标记为峰F′。 可以推断, 出现新的峰意味着由于添加Cu2+离子导致电极界面可能出现新的反应历程或生成了新的组分。
图2(b)所示为不同浓度的Fe3+离子对铁闪锌矿-碳糊电极在Leathen培养基中接种氧化亚铁硫杆菌时的伏安曲线。 可以发现, 随Fe3+离子浓度增加, 不同浸出条件下的伏安曲线呈现类似的变化特征, 即峰B′、 B″、 B和C的电流幅值减小, 而峰D和E的电流幅值增大。 这是由于随Fe3+离子浓度增加, 即意味着Fe3+与Fe2+的浓度比值也随之增大, 即加速铁闪锌矿的溶解, 同时S2-离子被氧化成元素硫或SO2-4[18]。 由此表明, Fe3+离子浓度和Fe3+与Fe2+的浓度比值对铁闪锌矿的溶解起重要作用。
2.3 浸渣的X射线衍射分析和强化浸出机理
采用X射线粉晶衍射分析考察了添加Cu2+离子时催化中度嗜热菌浸出和无菌条件下Fe3+离子浸出铁闪锌矿时的浸渣产物, 其X射线衍射谱如图3所示。 由图3(a)可以发现, 当添加足够量的Cu2+离子时, 中度嗜热菌浸出铁闪锌矿浸渣中可检测到少量的CuS。 实验证实加入Cu2+离子可以取代矿物中的Zn2+离子, 并生成CuS。 它与铁闪锌矿形成原电池效应, 从而促进铁闪锌矿的溶解。 当Cu2+离子过大时, 会对浸矿菌种产生毒害作用而抑制矿物
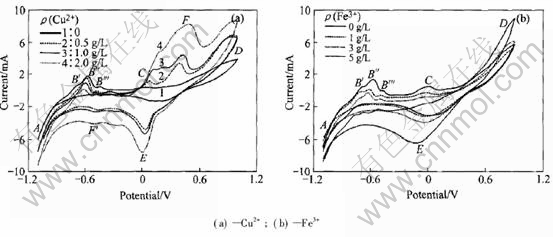
图2 金属离子对铁闪锌矿-碳糊电极伏安曲线的影响
Fig.2 Effect of metallic ions on cyclic voltammogram of marmatite-carbon paste electrode

图3 铁闪锌矿精矿浸渣的X射线衍射谱
Fig.3 XRD patterns of leached residues of marmatite concentrate
的生物浸出; 图3(b′)表明, 在无菌条件下Fe3+离子可以氧化溶解铁闪锌矿, 浸渣产物中生成元素硫, 且在Fe3+离子浓度较高且浸出液碱性较大时生成铁化合物沉淀。
添加Cu2+、 Fe3+ 和Fe2+ 等金属离子, 在一定程度上均可以促进铁闪锌矿浮选精矿的生物浸出, 但不同金属离子的强化机理存在一定的差别。 当添加Cu2+离子时, 极化曲线上可能出现较高的过电位。 由于Cu2+离子半径(0.073nm)与Zn2+离子半径(0.074nm)非常接近, Cu2+离子在铁闪锌矿-碳糊电极表面可以取代矿物晶格中的Zn而转化为CuS或Cu2S[19], 它们在电极表面与铁闪锌矿构成原电池, 由于铁闪锌矿的氧化还原电位较低而作为电池反应的阳极发生氧化溶解。 根据文献[20, 21]中报道的研究结果, 可以推测图2 (a) 中伏安曲线上峰F和F′对应的电极-溶液界面可能发生的电化学反应为:
峰F:
CuS→Cu2++S0+2e或 Cu2S→2Cu2++S0+4e(1)
峰F′:
Cu2++2e→Cu0或 CuS+Cu2++2e→Cu2S(2)
添加Cu2+离子时, X射线衍射分析表明铁闪锌矿浸渣中存在硫化铜。
铁闪锌矿生物浸出过程主要是间接作用的结果, 锌矿的氧化溶解与浸出液中Fe3+离子浓度和Fe3+与Fe2+浓度比密切相关。 添加Fe2+离子可以促进铁闪锌矿生物浸出的原因是, 一方面由于Fe2+离子的添加可以补充浸矿细菌的营养物质从而促进细菌的生长繁殖; 另一方面是细菌可以将Fe2+离子氧化成Fe3+离子从而再生氧化剂, 使浸出液保持较高的Fe3+离子浓度, 而促进铁闪锌矿的氧化溶解。 无菌条件下添加Fe2+离子不会促进铁闪锌矿的溶解, 这是由于Fe2+离子本身对铁闪锌矿不具有氧化作用。 由于铁闪锌矿本身在成矿过程中, 晶格中部分Zn被Fe取代而形成类质同相, 浸出液中添加的Fe2+难以取代矿物晶格中的Zn2+离子而形成原电池效应。 Fe3+离子的添加对铁闪锌矿生物浸出的促进作用本质上相同, 只是次序有些不同。 Fe3+离子的添加首先是提供浸出体系的氧化剂, 与矿物作用后生成的生成Fe2+离子为细菌提供营养物质, 被细菌氧化成Fe3+离子而再生氧化剂, 这个过程重复进行可以促进铁闪锌矿的氧化溶解。 但当液相中Fe3+离子浓度过高时会生成铁矾沉淀, 覆盖在矿物表面而对矿物的溶解造成负面影响。
3 结论
1) 一定浓度范围内的金属离子Cu2+、 Fe3+ 和Fe2+等对铁闪锌矿的生物浸出都有促进作用。 当添加浓度过高时, 则会对浸矿菌种造成毒害作用, 从而抑制浸出过程。 在无菌条件下, 除了Fe2+外, Cu2+ 和Fe3+ 离子仍对铁闪锌矿的溶解起促进作用。
2) 不同金属离子对铁闪锌矿生物浸出的强化机理不完全相同。 Cu2+和Fe3+等金属离子在浸出液中的变化可以改变电极-溶液界面发生的微观电化学反应。 添加的Cu2+离子可以取代矿物基质晶格中的Zn生成CuS沉淀, 并与矿物形成原电池效应, 从而促进锌矿的浸出过程。 Fe3+和Fe2+离子催化铁闪锌矿生物浸出的机理本质上是一致的, 都可以达到提高浸出液的氧化剂(Fe3+)的浓度和添加细菌营养(Fe2+), 从而促进细菌生长与繁殖的作用, 可以起到相互促进作用。 但当添加过多的Fe3+和Fe2+离子时, 除了对浸矿细菌造成毒害作用外, 也可以生成铁化合物沉淀而阻碍铁闪锌矿的生物浸出。
REFERENCES
[1]Gericke M, Pinches A. Bioleaching of copper sulphide concentrate using extreme thermophilic bacterial[J]. Minerals Engineering, 1999, 12(8): 893-904.
[2]Harrison V F, Gow W A, Hughson M R. Factors influencing the application of bacterial leaching to a canadian uranium ore[J]. J Met, 1966, 18: 1189-1194.
[3]Lindsrom E B, Gunneriusson E, Tuovinen O H. Bacterial oxidation of refractory sulfide ores for gold recovery[J]. Critical Reviews in Biotechnology, 1992, 12(2): 133-155.
[4]Deng T L, Liao M X, Wang M H, et al. Investigations of accelerating parameters for the biooxidation of low-grade refractory gold ores[J]. Minerals Engineering, 2000, 13(14-15): 1543-1553.
[5]Niemela S I, Marja R V, Carita S, et al. Nutrient effects on the biological leaching of a black-schist ore[J]. Appl Environ Microbiol, 1994, 60(4): 287-1291.
[6]Nakazawa H, Hadhizume T, Sato H. Effect of silver ions on bacterial leaching concentrate of copper-nickel sulfide ores[J]. Metallurgical Review of MMIJ, 1993, 10(2): 87-97.
[7]Nakazawa H, Fujisawa H, Sato H. Effect of activated carbon on the bioleaching of chalcopyrite concentrate[J]. International Journal of Mineral Processing, 1998, 55(2): 87-94.
[8]HU Yue-hua, QIU Guan-zhou, WANG Jun, et al. The effect of silver-bearing catalysts on bioleaching of chalcopyrite[J]. Hydrometallurgy, 2002, 64(2): 81-88.
[9]Selvi S C, Modak J M, Natarajan K A. Electrobioleaching of sphalerite flotation concentrate[J]. Minerals Engineering, 1998, 11(8): 783-788.
[10]Santhiya D, Subramaian S, Natarajan K A. Surface chemical studies on galena and sphalerite in the presence of Thiobacillus thiooxidans with reference to mineral beneficiation[J]. Minerals Engineering, 2000, 13(7): 747-763.
[11]Pina P S, Leo V A, Silva C A, et al. The effect of ferrous and ferric iron on sphalerite bioleaching with Acidithiobacillus sp[J]. Minerals Engineering, 2005, 18(5): 549-551.
[12]Shi S, Fang Z. Bioleaching of marmatite flotation concentrate by acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2004, 75(1-4): 1-10.
[13]Shi S, Fang Z. Bioleaching of marmatite flotation concentrate by Acidithiobacillus ferrooxidans and Leptospirillum ferrooxidans[J]. Trans Nonferrous Met Soc China, 2004, 14(3): 569-575.
[14]Leathen W W, Mcintyre L D, Brady S A. A medium for the study of bacterial oxidation of ferrous iron[J]. Science, 1951, 114: 280-281.
[15]Shi S, Fang Z, Ni J. Electrochemistry of marmatite-carbon paste electrode in the presence of bacterial strains[J]. Bioelectrochemistry, 2005, 68: 117-122.
[16]Sampson M I, Phillips C V. Influence of base metals on the oxidizing ability of acidophilic bacteria during the oxidation of ferrous sulfate and mineral sulfide concentrates, using mesophiles and moderate thermophiles[J]. Minerals Engineering, 2001, 14(3): 317-340.
[17]Grishin S I, Bigham J M, Tuovinen O H. Characterization of jarosite formed upon bacterial oxidation of ferrous sulfate in a packed-bed reactor[J]. Appl Environ Microbiol, 1988, 54(9): 3101-3106.
[18]Choi W K, Torma A E, Ohiline R W, et al. Electrochemical aspects of zinc sulphide leaching by Thiobacillus ferrooxidans[J]. Hydrometallurgy, 1993, 33(1-2): 137-152.
[19]Baldwin D A, Manton M R, et al. Studies on the flotation of sulphides[J]. Int J Miner Process, 1979, 6(3): 173-192.
[20]Elsherief A E, Saba A E, Afifi S E. Anodic leaching of chalcocite with periodic cathodic reduction[J]. Minerals Engineering, 1995, 8(9): 967-978.
[21]Elsherief A E. Influence of galvanic interactions between chalcocite and sphalerite during the early stage of leaching[J]. Minerals Engineering, 1994, 7(11): 1387-1399.
基金项目: 中国博士后科学基金资助项目(2005037032)
收稿日期: 2005-04-27; 修订日期: 2005-07-11
作者简介: 石绍渊(1971-), 男, 博士, 讲师
通讯作者: 石绍渊, 博士; 电话: 010-62755914; E-mail: shishaoyuan@iee.pku.edu.cn


