文章编号:1004-0609(2012)08-2317-09
镍镁掺杂LiFePO4的电子结构
张冬云1, 2,张培新1,宋申华2,惠文彬1,黄 磊1,任祥忠1
(1. 深圳大学 化学与化工学院,深圳 518060;
2. 哈尔滨工业大学深圳研究生院 材料科学与工程学院,深圳 518055)
摘 要:
采用基于密度泛函理论的第一性原理研究锂离子电池正极材料LiFePO4掺杂Ni和Mg的电子结构。结果表明:Ni氧化物的电子结构和能量性质受d轨道中电子影响,用于掺杂改性时,结构稳定,带隙降低使电子电导率增加,充放电速率提高;Mg掺杂改性时,当掺杂在Li位时,带隙和总能均降低,同时Li离子的扩散运动也提高,有利于改性,而在Fe位掺杂时,费米面附近Fe-d轨道中电子影响能带,使带隙增加,不利于电子电导,键的布居分析也表明Li—O共价性增强,不利于离子扩散,即不利于改性。因此,通过掺杂可对LiFePO4的微观结构产生影响,从而影响其电化学性能,但这种微观结构主要受d轨道中电子运动对费米面附近能带的影响,而与掺杂离子的化合价和半径无关。
关键词:
中图分类号:O64 文献标志码:A
Electronic structure of LiFePO4 doped with Ni and Mg
ZHANG Dong-yun1, 2, ZHANG Pei-xin1, SONG Shen-hua2, HUI Wen-bin1, HUANG Lei1, REN Xiang-zhong1
(1. College of Chemistry and Chemical Engineering, Shenzhen University, Shenzhen 518060, China;
2. School of Materials Science and Engineering, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China)
Abstract: LiFePO4 doped with Ni and Mg was simulated by using the first-principles. Through the energy band, PDOS and population analysis, it shows that, when the transition metal element Ni is used as dopant, the structure is becomes stable and the band gap reduces when Ni is doped on either Li(M1) or Fe(M2) sites, which results in the increase of the electronic conductivity and the discharge-recharge rate, because the electronic structure and energy properties of the transition metal oxides are greatly affected by the electrons in orbital d. When non-transition metal element Mg is doped at Li-site, both the band gap and total energy decrease, and the lithium ion diffusivity improves. When Mg is doped at Fe-site, the band gap increases because of the influence of electronics in Fe-d orbitals near the Fermi level, which is not beneficial to the electronic conductivity. The covalent interaction between Li and O strengthens through the analysis of population, which is not benefit for the lithium ion diffusivity and modification. So, the electrochemical properties of LiFePO4 are influenced by the changes of microstructure which are affected by dopants. The electrons in orbital d mainly affect the electronic structure near the Fermi level, while has no relative with the chemical valence and atomic radius of dopant.
Key words: LiFePO4; Ni-doping; Mg-doping; electronic structures; first principles
自1997年PADHI等[1]首次报道橄榄石结构的LiFePO4可用作锂离子电池正极材料以来,因其具有较高的理论容量、优良的循环性能、良好的热稳定性、资源丰富、价格低廉、环境友好,因而被认为是下一代锂离子电池,特别是锂离子动力电池和储能电池的首选正极材料,但较低的电子及离子传导率阻碍了该材料的实际应用。
CHUNG等[2]研究发现,采用金属阳离子(Mg、Zr、Al、Nb等)掺杂合成具有阳离子缺陷的LiFePO4,提高了电子的导电率,其电化学性能也得到明显改善。NAKAMURA等[3-4]、ZHOU等[5-6]、MORGAN等[7]、WANG等[8]、倪江锋等[9-10]也发现离子掺杂后材料的电子电导和电性能有很大的提高。但是对于离子掺杂提高材料电化学性能的原因却一直存在各种争议,针对离子掺杂对材料电化学性能的影响机理缺乏深入系统的研究,更没有公认的方法与理论,离子掺杂理论仍然处于探索阶段[8-13]。
CEDER等[5-7, 14-16]于1998年首次采用第一性原理计算来指导锂离子电池正极材料的合成,讨论了LiAlyM1-yO2(M=Co, Mn)体系,对解决锂离子电池在实际应用中遇到的安全性、电子电导率等问题,具有重要的指导意义。顾惠敏等[17-18]采用基于密度泛函理论的第一原理,研究了LiMn2O4和LiNiO2及掺杂化合物的结构与稳定性。OUYANG等[19-20]通过第一性原理计算研究了锂离子在LiFePO4中的扩散机理,解释了LiFePO4材料在Li位进行Cr掺杂的电子电导率得到大幅度提高而其电化学性能却没有明显改善的原因。WANG等[21]利用第一性原理计算了Mo掺杂LiFePO4的电子态密度,发现Mo的掺杂改变了LiFePO4费米面附近的电子态密度的分布,改善了LiFePO4的电子导电性能,模拟结果与XAS实验测试的结果相一致。ZHOU等[5]对LiFePO4的带隙采用UV-Vis-NIR测量,并在VASP软件上分别采用GGA 和GGA+U方法计算了LiFePO4和LiMn2PO4 的电子结构。
但就本文作者所查的资料,尚未见到有关镁(Mg)和镍(Ni)离子掺杂的模拟计算,为从微观层次上探讨离子掺杂改善LiFePO4电化学性能的影响机理和作用机制,本文作者采用基于密度泛函理论的第一性原理研究了Ni和Mg掺杂对LiFePO4电子结构的影响,阐明掺杂离子影响LiFePO4微观电子结构的本质。
1 计算方法与模型
在本模拟中,材料电子结构的计算模拟主要采用CASTEP软件包来进行,模拟计算时,通过对超胞(112)中的Li或Fe用Ni或Mg进行置换,得到金属离子掺杂在不同位置的LiFePO4模型(见图1):LiFe7/8M1/8PO4和Li7/8M1/8FePO4,M=Ni, Mg。
LiFePO4为橄榄石型结构,属于正交晶系[22],空间群为Pnma,Z=4,晶胞参数如下:a=1.032 9 nm,b=0.601 1 nm,c=0.469 9 nm,晶胞体积为0.291 03 nm3。图中氧原子成微扭曲的六方密堆积结构;每一个磷原子与邻近的4个氧原子成键形成PO4四面体,并占据四面体的4c位;每一个铁原子和锂原子分别与邻近的6个氧原子成键形成FeO6和LiO6八面体,并占据八面体的4c和4a位[23]。从b轴方向的角度来看,在bc面上,FeO6八面体通过共角连接。LiO6八面体沿b轴方向相互共边,形成链状。一个FeO6八面体分别与一个PO4四面体和两个LiO6八面体共边,同时,一个PO4四面体还与两个LiO6八面体共边。LiFePO4晶体中两个Fe原子和一个P原子共用一个O原子。
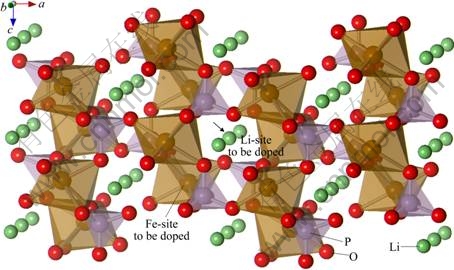
图1 LiFePO4的橄榄石结构
Fig. 1 Structure of LiFePO4
交换关联函数采用广义梯度近似(GGA)下的PBE梯度修正函数,计算时铁原子赝势选取的是规范-守恒赝势,其余元素全采用超软赝势描述价电子和原子实的相互作用。Brillouin区的积分计算采用4×3×2的Monkhorst-Pack(MP) k点网络。在分析中采用了如下的局域轨道基作为价轨道:Li (1s2 2s1),O (2s2 2p4),P (3s2 3p3),Fe (3d6 4s2),Ni (3d8 4s2),Mg (2p6 3s2)。首先进行几何优化,搜索出分子在最小总能量下的构型,即分子平衡构型。几何优化采BFGS算法,收敛标准是:最大能量改变的收敛阈值dE/ion=1.0×10-5 eV,原子间作用力的收敛阈值|F|max=0.3 eV/nm,原子位移的收敛阈值|dR|max=1.0×10-4 nm,原子间内应力的收敛阈值|S|max=5.0×10-2 GPa。对结构优化后的结构进行能带、电子态密度、布居等分析,以探讨LiFePO4的电化学性能与微观结构的关系。
2 计算结果与讨论
表1所列为掺杂LiFePO4中基本元素及掺杂元素的性能,其中镍属于过渡金属第三周期的元素,镁不属于过渡金属,核外无d轨道电子参于成键。取金属Mg[12-13]和Ni[24-26]为掺杂金属,掺杂时均为+2价,进一步考察这两种金属离子掺杂对电子结构的影响,以探讨电化学性能变化的真正原因是离子半径还是核外电子的影响。
根据经验,Mg的共价半径比比被掺杂元素Li和Fe的大,比较难掺杂,尤其是Fe位;而Ni的共价半径比被掺杂元素Li和Fe的都小,应该比Mg容易掺杂。
2.1 Ni掺杂
模拟计算得到的偏态密度与能带图如图2和3所示。可以看出,Ni掺杂后,无论掺杂发生在是Fe位还是Li位,在费米面,Ni-p轨道和Ni-s轨道的作用很小,主要为d轨道电子的作用。
进一步对掺杂前后费米面附近的能带图(见图3)分析:当在Fe位掺杂Ni时,Li减少导致低能级(-44 eV左右)的能带数减少;而-22~-3 eV之间,即LiFe7/8Ni1/8PO4的第9~136条,Li7/8Ni1/8FePO4的第8~135条,均为P—O的s和p轨道作用而成,无论是数量上还是形状上均无较大变化,但能量上稍有降低。能带的变化主要在费米面附近,按照带隙取价带顶和导带低的原则,对于LiFe7/8Ni1/8PO4,取第160和第163条能带计算带隙,得到2.146 eV,比纯LiFePO4的带隙(2.127 eV)稍微有所上升,但由于价带顶和导带低之间的禁带中产生了两条新的杂质导带(第161~162条),在一定程度上有利于电子电导;对于Li7/8Ni1/8Fe- PO4,取第159和第165条能带计算带隙,得到2.080 eV,带隙降低,而且禁带中有5条中间带 (第160~164条),因此,Li位掺杂将会有利于材料电子电导率的增加。相对而言,Ni掺杂在Li位比在Fe位将使材料的导电性能提高更多,同时提高充放电速率。
研究表明[13],对于Ni2+掺杂的LiFePO4,掺杂发生在Li位,在最佳掺杂量(3%)下,充放电电流密度为20 mA/g时,未掺杂和掺杂Ni的LiFePO4的首次放电比容量分别为116.34和145.80 mA·h/g;循环20次后,相应的放电比容量分别为102.26和138.66 mA·h/g,定义容量保持率为第20次放电比容量与首次放电比容量之比,则未掺杂和掺杂Ni的LiFePO4的容量保持率分别为87.90%和95.10%;当充放电电流密度增加到320 mA/g时,掺杂Ni的LiFePO4的容量保持率仍为84.41%。
2.2 Mg掺杂
由Mg掺杂的LiFePO4偏态密度图(见图4)可以看出,Mg掺杂后,无论掺杂发生在是Fe位还是Li位,由于Mg的核外成键轨道中无d轨道电子,Mg-s轨道的作用很小,Mg-p轨道也仅对低轨道起作用,对费米面附近能带无作用。
对Mg掺杂前后的能带图(见图5)分析:无论掺杂发生在Fe位还是Li位,禁带中无新的导带,带形基本变化不大。Fe位掺杂Mg使带隙增加,不利于电子电导。Li位掺杂Mg有利于带隙的降低,同时半导体类型由p型变成n型,能级也进一步降低,因此,Li位掺杂Mg将会有利于材料电子电导率的增加。
表1 掺杂LiFePO4中各元素的基本性能
Table 1 Basic properties of elements in doped LiFePO4
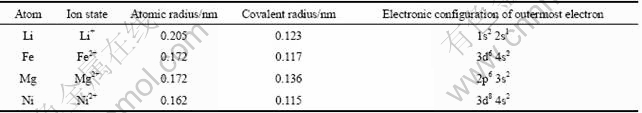
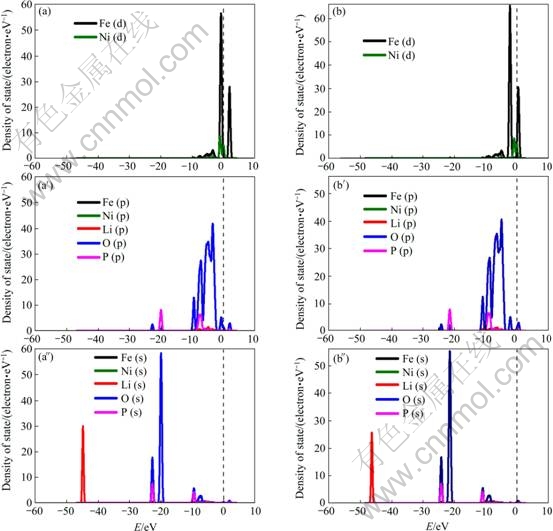
图2 Ni掺杂LiFePO4的偏态密度图
Fig. 2 Partial density of states of Ni-doped LiFePO4: (a), (a′), (a″) LiFe7/8Ni1/8PO4; (b), (b′), (b″) Li7/8Ni1/8FePO4
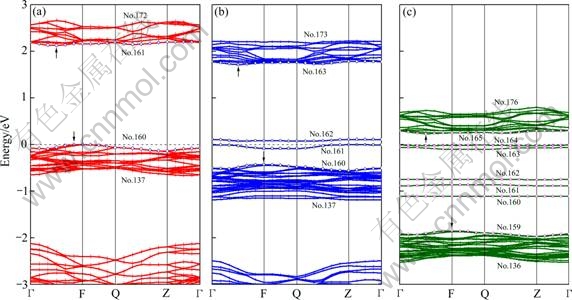
图3 Ni掺杂LiFePO4的费米面能带图
Fig. 3 Band structure of Ni-doped LiFePO4 at Fermi level: (a) LiFePO4, band gap 2.127eV; (b) LiFe7/8Ni1/8PO4, band gap 2.146 eV; (c) Li7/8Ni1/8FePO4, band gap 2.080 eV
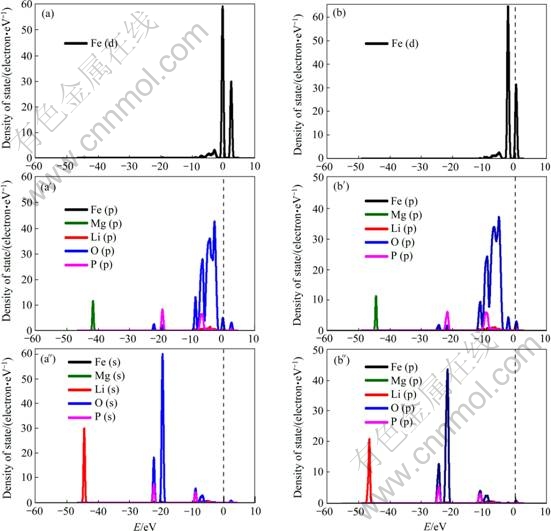
图4 Mg掺杂LiFePO4的偏态密度图
Fig. 4 Partial density of states of Mg-doped LiFePO4: (a), (a′), (a″) LiFe7/8Mg1/8PO4; (b), (b′), (b″) Li7/8Mg1/8FePO4
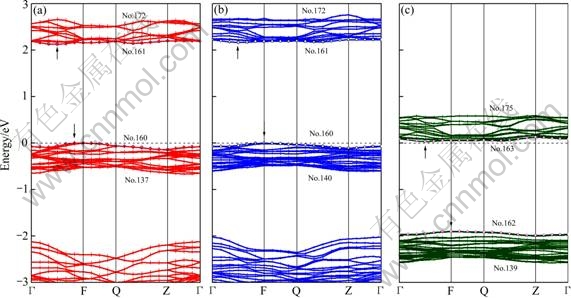
图5 Mg掺杂LiFePO4的费米面能带图
Fig. 5 Band structure of Mg-doped LiFePO4 at Fermi level: (a) LiFePO4, band gap 2.127eV; (b) LiFe7/8Mg1/8PO4, band gap 2.166 eV; (c) Li7/8Mg1/8FePO4, band gap 1.932 eV
张培新等[27]研究表明,对于Mg2+掺杂的磷酸铁锂,掺杂发生在Li位,在最佳掺杂量(5%)下,充放电电流密度为20 mA/g时,首次放电比容量为134.24 mA·h/g,循环20次后相应的放电比容量为138.66 mA·h/g,容量保持率为91.63%,大于未掺杂的LiFePO4的;当充放电电流密度增加到320 mA/g时,掺杂Mg的LiFePO4的容量保持率为66.20%。
表2和3所列为不同位置掺杂Mg和Ni的计算结果比较,包括总能、晶胞参数、带隙、键布居分析,其中原子间距离(rM—O)为平均值。差分电荷密度能表示体系在成键前后因原子轨道组合而引起的电子密度分布的变化,从而反应成键过程中电子的转移情况。根据原子来计算差分电荷密度(![]() ):
):
![]() (1)
(1)
式中:![]() 为总的电子密度分布;
为总的电子密度分布;![]() 为各原子的亚晶格电子密度分布。
为各原子的亚晶格电子密度分布。
图6所示为不同位置不同元素掺杂引起的差分电荷密度变化比较图,蓝色表示电子缺失,红色表示电子富集(参见电子版),可以看出由于掺杂引起了差分电荷密度的变化,不同元素、不同位置掺杂的影响各不相同,Ni掺杂在Li位引起电子密度的变化非常大,而Mg掺杂在Li位引起的变化不大。Ni掺杂在Fe位引起电子密度的变化不大,Ni附近电子缺失变弱;而Mg掺杂在Li位引起的电子密度变化明显,原Fe—O间的Fe附近是电子缺失,而Mg掺杂取代Fe后,Mg—O间Mg附近是电子富集。
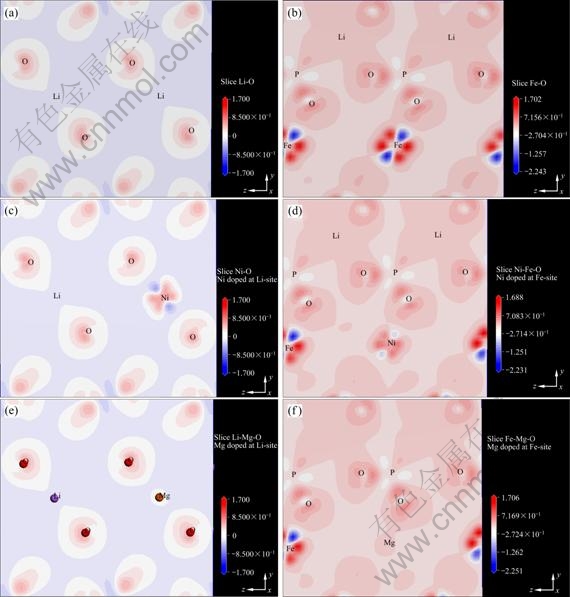
图6 不同位置不同元素掺杂引起的差分电荷密度变化图
Fig. 6 Electron density difference maps at different positions with different elements: (a) Slice Li—O of undoped LiFePO4; (b) Slice Fe—O of undoped LiFePO4; (c) Slice Li—O of doped Li7/8Ni1/8FePO4; (d) Slice Fe—O of doped LiFe7/8Ni1/8PO4; (e) Slice Li—O of doped Li7/8Mg1/8FePO4; (f) Slice Fe—O of doped LiFe7/8Mg1/8PO4
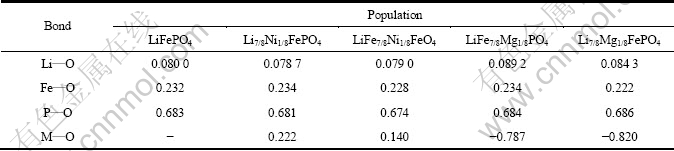
布居是指电子在各原子轨道上的分布,分析布居数,可以了解分子中原子的成键情况,通常分别按原子布居和键布居来进行讨论。键布居包含同一轨道的总布居,不同轨道的重叠布居,通过键布居分析可以得到原子及键的具体数据,从而判定成键的强弱,并可估计键的共价性和离子性大小,一般高的布居值表明键呈共价性,而低的布居值表明键之间为离子相互作用。表3中键布居(Population)分析表明,Ni掺杂在Li位时,Ni—O布居值为0.140,大于Li—O的布居值(0.080);Ni掺杂在Fe位,布居值为0.222,小于 Fe—O的布居值(0.232)。Mg无论掺杂在Li位还是Fe位,Mg—O布居值均为负(-0.820和-0.787),小于被取代原子的,表明离子性加强,共价性减弱,根据锂离子电池的工作原理,Li位离子性的加强有利于Li扩散,因此Mg掺杂在Li位有利于电化学性能的提高。布居分析和差分电荷密度变化相一致。
一些研究者认为[21],由于掺杂离子的半径比Fe2+的小,而导致晶胞收缩。事实上,在离子晶体中,正负离子间的核间距为正负离子半径之和,而正负离子的界线在何处难以判定。此外不同类型的晶体中,同种离子表现出来的半径不一样。按离子理论,Li+的1s轨道全满,2s轨道全空,形成s杂化轨道;Fe2+的3d轨道中有4个价电子;Ni2+的3d轨道中有2个价电子;Mg2+的3s轨道全空,2p轨道全满,形成sp3杂化轨道。在本模拟中,赝势计算选取的价电子与各原子的最外电子排布相一致。表2中掺杂后的晶胞体积均比掺杂前增加,主要是由于晶胞参数的改变。虽然体积增加,但从表中总能数据值可以看出,掺杂后系统的能量均低于掺杂前,说明掺杂后的体系更稳定,可以使材料的充放电循环性能更好。掺杂后体系的晶胞参数均变大。
表2中原子间平均距离(r)的实验数据均为本课题组测试结果,由于模拟的掺杂量大于实验掺杂量,以及实验及测试等因素的影响,两者间存在一定的差 别。Fe—O共价键的强度由于Fe—O—P的诱导效 应,以及Fe和P之间的静电排斥作用而减弱。同时也使Fe3+/Fe2+氧化还原电对对于Li的费米能级开路循环电压(OCV)很高,OCV主要受聚阴离子团PO43-的影响[28],聚阴离子团PO4使LiFePO4结构稳定,并降低了Fe3+/Fe2+氧化还原电对的费米能级,从而增加电极电位,少量的掺杂并不影响OCV。Fe位掺杂 时,P—O间距不变或变小(仅0.000 1 nm),Li位掺杂时,P—O间距也仅增加0.000 1或0.000 2 nm,说明结构很紧凑。
实验与计算结果均表明掺杂后Li—O原子间的平均距离较未掺杂的增加。因此,掺杂少量的金属离子后,Li—O键间距增加,使锂与氧之间的结合力减弱,更有利于锂离子的脱嵌(扩散运动),从而掺杂磷酸铁锂具有比较好的大电流放电性能。此外,理论上说,金属离子掺杂在Li位上时,由于金属离子不会扩散,可能会对Li离子的扩散起一定的阻碍作用。由表2可知,Ni掺杂在Li位时,M—O之间距离分别为0.217 3和0.218 3 nm,而Li—O之间距离为0.212 8和0.211 5 nm,即rM—O>rLi—O,不利于Li离子的扩散运动。但Mg掺杂在Li位时,情况则相反,M—O和Li—O之间距离分别为0.210 1和0.211 6 nm,即rLi—O>rM—O,相对于Ni掺杂更有利于Li+的扩散运动。因此,当掺杂发生在Li位时,必须严格控制掺杂量。
表2 不同掺杂元素的计算结果比较
Table 2 Comparison of calculation results of different doped LiFePO4
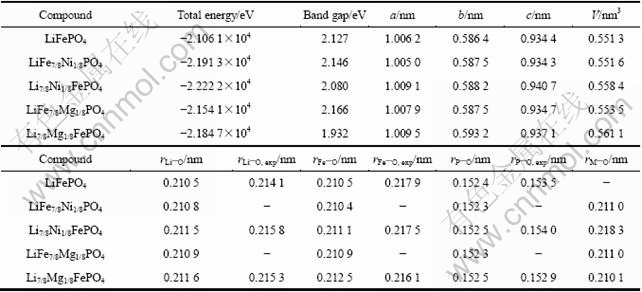
表3 不同掺杂元素键的布居值
Table 3 Bond population of different doped element bands
材料的充放电速率受电子传递的影响,缺陷的产生使材料的电子结构,包括带隙、半导体类型、杂质带的产生、共价性等发生巨大变化,从而影响充放电性能。结合以上分析可以得到以下结论:Ni的电子结构和能量性质由于受d轨道中电子相关运动影响显著,因此在改性过程中所产生的影响远大于Mg等非过渡金属元素的,Ni无论是掺杂在Li位还是Fe位均有利于电子电导率的增大,充放电速率的增加。Mg掺杂在Li位时不仅带隙、总能降低,也有利于提高Li离子的扩散运动;而Mg掺杂在Fe位时无论是电子电导还是Li离子扩散均没有提高,对材料导电性能和充放电速率的没有改善。因此,只要能使电子电导率增加,或使锂离子的扩散运动增加,均有利于其作为锂电池正极材料的使用。模拟计算与实验研究均表明,掺杂少量的金属离子可以有效地提高磷酸铁锂的比容量、循环性能和大电流放电性能,且过渡金属离子掺杂具有较好的大电流放电性能。
3 结论
1) Ni氧化物的电子结构和能量性质由于受d轨道中电子相关运动影响显著,当其用于掺杂改性时,结构稳定,带隙降低使电子电导率增加,充放电速率提高。
2) Mg掺杂改性时,若掺杂在Li位,带隙和总能均降低,同时Li+的扩散运动也提高,有利于改性,而在Fe位掺杂时,费米面附近Fe-d轨道中电子影响能带,使带隙增加,不利于电子电导,键的布居分析也表明Li—O共价性增强,不利于离子扩散,即不利于改性。
3) 无论何种掺杂缺陷,只要能使LiFePO4中d轨道的电子发生变化,从而对材料的微观结构产生影响,进而影响其电化学性能。这种微观结构主要是费米面附近的能带,特别是受d轨道中电子相关运动的影响。
致谢:
湖南大学化学与化工学院为本论文提供软件支持。广西大学陈建华教授为本论文数据分析提供非常重要的讨论和建议。本工作得到了上海超级计算中心的支持。
REFERENCES
[1] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4): 1188-1194.
[2] CHUNG S Y, BLOCKING J T, CHIANG Y M. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nat Mater, 2002, 1: 123-128.
[3] NAKAMURA T, SAKUMOTO K, OKAMOTO M, SEKI S, KOBAYASHI Y, TAKEUCHI T, TABUCHI M, YAMADA Y. Electrochemical study on Mn2+-substitution in LiFePO4 olivine compound[J]. J Power Sources, 2007, 174(2): 435-441.
[4] NAKAMURA T, MIWA Y, TABUCHI M, YAMADA Y. Structural and surface modifications of LiFePO4 olivine particles and their electrochemical properties[J]. J Electrochem Soc, 2006, 153(6): A1108-A1114.
[5] ZHOU F, KANG K, MAXISCH T, CEDER G, MORGAN D. The electronic structure and band gap of LiFePO4 and LiMnPO4[J]. Solid State Commun, 2004, 132(3/4): 181-186.
[6] ZHOU F, COCOCCIONI M, MARIANETTI C A, MORGAN D, CEDER G. First-principles prediction of redox potentials in transition-metal compounds with LDA+U[J]. Phys Rev B: Condens Matter, 2004, 70(23): 235121.
[7] MORGAN D, VAN DER VEN A, CEDER G. Li conductivity in LixMPO4 (M=Mn, Fe, Co, Ni) olivine materials[J]. Electrochem Solid-State Lett, 2004, 7(2): A30-A32.
[8] WANG C S, HONG J. Ionic/electronic conducting characteristics of LiFePO4 cathode materials[J]. Electrochem Solid-State Lett, 2007, 10(3): A65-A69.
[9] 倪江锋, 周恒辉, 陈继涛, 苏光耀. 铬离子掺杂对LiFePO4的影响[J]. 物理化学学报, 2004, 20(6): 582-586.
NI Jiang-feng, ZHOU Heng-hui, CHEN Ji-tao, SU Guang-yao. Effect on the electrochemical performance of lithium iron phosphate by Cr3+ ion doping[J]. Acta Phys-Chim Sin, 2004, 20(6): 582-586.
[10] 倪江锋, 周恒辉, 陈继涛, 张新祥. 金属氧化物掺杂改善LiFePO4电化学性能[J]. 无机化学学报, 2005, 21(4): 472-476.
NI Jiang-feng, ZHOU Heng-hui, CHEN Ji-tao, ZHANG Xin-xiang. Improvement of LiFePO4 electrochenmical performance by doping metal oxides[J]. Chinese Journal of Inorganic Chemistry, 2005, 21 (4): 472-476.
[11] 陈 宇, 王忠丽, 于春洋, 夏定国, 吴自玉. 掺杂Mo的LiFePO4正极材料的电化学性能[J]. 物理化学学报, 2008, 24(8): 1498-1502.
CHEN Yu, WANG Zhong-li, YU Chun-yang, XIA Ding-guo, WU Zi-yu. Electrochemical properties of Mo-doped LiFePO4 cathode material[J]. Acta Phys-Chim Sin, 2008, 24(8): 1498-1502.
[12] TENG T H, YANG M R, WU S H, CHIANG Y P. Electrochemical properties of LiFe0.9Mg0.1PO4/carbon cathode materials prepared by ultrasonic spray pyrolysis[J]. Solid State Commun, 2007, 142(7): 389-392.
[13] 张培新, 文衍宣, 刘剑洪, 许启明, 任祥忠, 张黔玲, 罗仲宽. 化学沉淀法制备掺杂磷酸铁锂的结构和性能研究[J]. 稀有金属材料与工程, 2007, 36(6): 954-958.
ZHANG Pei-xin, WEN Yan-xuan, LIU Jian-hong, XU Qi-ming, REN Xiang-zhong, ZHANG Qian-ling, LUO Zhong-kuan. Structure and performance of doped lithium iron phosphate by chemical precipitation[J]. Rare Metal Materials and Engineering, 2007, 36(6): 954-958.
[14] CEDER G, CHIANG Y M, SADOWAY D R, AYDINOL M K, JANG Y I, HUANG B. Identification of cathode materials for lithium batteries guided by first-principles calculations[J]. Nature, 1998, 392: 694-696.
[15] MAXISCH T, CEDER G. Elastic properties of olivine LixFePO4 from first principles[J]. Phys Rev B: Condens Matter, 2006, 73: 174112.
[16] WANG L, ZHOU F, MENG Y S, CEDER G. First-principles study of surface properties of LiFePO4: Surface energy, structure, Wulff shape, and surface redox potential[J]. Phys Rev B: Condens Matter, 2007, 76: 165435.
[17] 顾惠敏, 王东来, 翟玉春, 刘丽影, 李德发. LiNiO2及掺杂化合物的结构与稳定性的第一性原理研究[J]. 分子科学学报, 2007, 23(2): 99-103.
GU Hui-min, WANG Dong-lai, ZHAI Yu-chun, LIU Li-ying, LI De-fa. The first-principle study on the structures and stabilities of LiNiO2 and its doping compounds[J]. Journal of Molecular Science, 2007, 23(2): 99-103.
[18] 刘丽影, 沈洪涛, 顾惠敏, 翟玉春. 采用第一原理方法研究Al3+掺杂LiMn2O4的电子结构[J]. 分子科学学报, 2008, 24(3): 207-209.
LIU Li-ying, SHEN Hong-tao, GU Hui-min, ZHAI Yu-chun. The first principle investigation of the electronic structure of Al3+ doped LiMn2O4[J]. Journal of Molecular Science, 2008, 24(3): 207-209.
[19] OUYANG C Y, SHI S Q, WANG Z X, HUANG X J, CHEN L Q. First-principles study of Li ion diffusion in LiFePO4[J]. Phys Rev B: Condens Matter, 2004, 69: 104303.
[20] OUYANG C Y, SHI S Q, WANG Z X, LI H, HUANG X J, CHEN L Q. The effect of Cr doping on Li ion diffusion in LiFePO4 from first principles investigations and Monte Carlo simulations[J]. J Phys: Condens Matter, 2004, 16: 2265-2272.
[21] WANG Z L, SUN S R, XIA D G, CHU W S, ZHANG S, WU Z Y. Investigation of electronic conductivity and occupancy sites of Mo doped into LiFePO4 by ab initio calculation and X-ray absorption spectroscopy[J]. J Phys Chem C, 2008, 112(44): 17450-17455.
[22] MOMMA K, IZUMI F. VESTA: A three-dimensional visualization system for electronic and structural analysis[J]. J Appl Crystallogr, 2008, 41(3): 653-658.
[23] ANDERSSON A S, KALSKA B, H GGSTR M L, THOMAS J O. Lithium extraction/insertion in LiFePO4: An X-ray diffraction and M?ssbauer spectroscopy study[J]. Solid State Ionics, 2000, 130(1/2): 41-52.
[24] PARAGUASSU W, FREIRE P T C, LEMOS V, LALA S M, MONTORO L A, ROSOLEN J M. Phonon calculation on olivine-like LiMPO4 (M=Ni, Co, Fe) and Raman scattering of the iron-containing compound[J]. J Raman Spectrosc, 2005, 36(3): 213-220.
[25] LU Y, SHI J, GUO Z, TONG Q, HUANG W, LI B. Synthesis of LiFe1-xNixPO4/C composites and their electrochemical performance[J]. J Power Sources, 2009, 194(2): 786-793.
[26] FISHER C A J, PRIETO V M H, ISLAM M S. Lithium battery materials LiMPO4 (M=Mn, Fe, Co, and Ni): Insights into defect association, transport mechanisms, and doping behavior[J]. Chem Mater, 2008, 20: 5907-5915.
[27] 张培新, 文衍宣, 刘剑洪, 许启明, 任祥忠, 张黔玲. 镁离子掺杂对磷酸铁锂结构和性能的影响[J]. 功能材料, 2006, 37(12): 1942-1945.
ZHANG Pei-xin, WEN Yan-xuan, LIU Jian-hong, XU Qi-ming, REN Xiang-zhong, ZHANG Qian-ling. Performance and structure of Mg2+ doped lithium iron phosphate prepared by chemical precipitation method[J]. J Func Mater, 2006, 37(12): 1942-1945.
[28] WANG G X, BEWLAY S, NEEDHAM S A, LIU H K, LIU R S, DROZD V A, LEE J F, CHEND J M. Synthesis and characterization of LiFePO4 and LiTi0.01Fe0.99PO4 cathode materials[J]. J Electrochem Soc, 2006, 153(1): A25-A31.
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(50874074,50474092);广东省自然科学基金资助项目(8151806001000028);深圳市科技计划资助项目 (ZYC200903250150A,200505);深圳市功能高分子重点实验室开放基金资助项目(FP20110004)
收稿日期:2011-08-21;修订日期:2011-11-20
通信作者:张培新,教授,博士;电话:0755-26558134;E-mail: pxzhang2000@163.com
摘 要:采用基于密度泛函理论的第一性原理研究锂离子电池正极材料LiFePO4掺杂Ni和Mg的电子结构。结果表明:Ni氧化物的电子结构和能量性质受d轨道中电子影响,用于掺杂改性时,结构稳定,带隙降低使电子电导率增加,充放电速率提高;Mg掺杂改性时,当掺杂在Li位时,带隙和总能均降低,同时Li离子的扩散运动也提高,有利于改性,而在Fe位掺杂时,费米面附近Fe-d轨道中电子影响能带,使带隙增加,不利于电子电导,键的布居分析也表明Li—O共价性增强,不利于离子扩散,即不利于改性。因此,通过掺杂可对LiFePO4的微观结构产生影响,从而影响其电化学性能,但这种微观结构主要受d轨道中电子运动对费米面附近能带的影响,而与掺杂离子的化合价和半径无关。


