次磷酸盐体系电镀镍磷合金镀层的耐蚀性能
刘应科1 , 程英亮1 , 张 昭2 , 王慧敏1, 陈振华1 , 吴有伍1
(1. 湖南大学 材料科学与工程学院, 长沙 410082; 2. 浙江大学 化学系, 杭州 310027)
摘 要:
通过改变次磷酸盐体系的工艺参数制得不同的镍磷合金镀层。 采用电化学阻抗谱技术(简称EIS技术)和动电位扫描极化曲线技术, 研究了不同工艺参数时镍磷镀层在0.5mol/L NaCl中性介质中的耐蚀性规律和耐蚀机理。 结果表明: 电镀镍磷合金镀层耐蚀性随镀液pH值的降低而升高, 并随镀液中次磷酸盐浓度的升高而升高, 并在次磷酸盐浓度为110g/L时到最大值; 而继续增大次磷酸盐浓度镀层的耐蚀性又降低; 低温(40℃)制得的镀层比高温(60℃)下制得的镀层更耐蚀。
关键词: 次亚磷酸盐; 镍磷合金; 镀层; 耐蚀性 中图分类号: TQ153.1
文献标识码: A
Anti-corrosion properties of Ni-P alloy deposits prepared from electrolytes containing NaH2PO2·H2O
LIU Ying-ke1, CHENG Ying-liang1, ZHANG Zhao2, WANG Hui-min1,CHEN Zhen-hua1, WU You-wu1
(1. College of Materials Science and Engineering,Hunan University, Changsha 410082, China;
2. Department of Chemistry, Zhejiang University, Hangzhou 310027, China)
Abstract: The different Ni-P deposits was prepared through electrolyte systems with different NaH2PO2·H2O concentration. The anti-corrosion mechanism of these deposits in 0.5mol/L NaCl neutral solutions was studied by electrochemical impedance spectroscopy (EIS) and potentiodynamic polarization method. The results show that the corrosion resistance of Ni-P deposits increases with the decrease of pH, and increases first with the increase concentration of NaH2PO2·H2O in electrolyte, while it reaches a maximum at 110g/L NaH2PO2·H2O, then decreases with the further increase of NaH2PO2·H2O concentration. The corrsion resistance of the deposits acquired at low temperature is better.
Key words: NaH2PO2·H2O; Ni-P alloy; electroplated deposit; anti-corrosion properties
镍磷合金具有抗还原性腐蚀介质的特性, 尤其是当镍磷合金中磷的质量分数达到0.08以上时, 其组织结构呈非晶态, 具有高耐蚀性及优异的磁学、 力学和电学特性[1-6], 而且经热处理后, 其硬度和耐磨性可与电镀硬铬相媲美[7], 因此在其他金属表面镀镍磷合金的意义不言而喻。 目前在金属表面获得镍磷合金镀层的途径主要有化学镀和电镀。 电镀具有沉积速度快, 镀液温度相对较低, 镀液可重复使用等优点。 电镀镍磷合金的体系有亚磷酸体系和次磷酸盐体系。 其中亚磷酸体系的研究较多, 次磷酸盐体系研究相对较少, 其原因是认为次磷酸盐体系的镀层质量不稳定。 但是, 以H3PO3进行电镀, 在电沉积生成P的过程中, 生成中间产物H2PO-2(次亚磷酸根), 因此用次亚磷酸盐进行电镀, 可以提高镀层中磷的含量, 由于H2PO-2(次亚磷酸根)还原为P原子只需得到一个电子, 从而镀层中的磷含量更加容易控制[1]。 目前已有一些研究探讨了次磷酸盐体系中电镀镍磷合金过程各种工艺参数对镀层耐蚀性的影响, 但还不够系统深入[8-10]。
本文作者通过改变次磷酸盐体系的工艺参数制得稳定的镀层, 对次磷酸盐体系的电镀进行了进一步的研究, 并详细探讨了各种工艺参数对镀层耐蚀性的影响。 耐蚀性研究采用电化学阻抗谱技术(简称EIS技术)和动电位扫描极化曲线技术[8, 11-13]研究了不同工艺参数的镍磷镀层在0.5mol/L NaCl中性介质中的耐蚀性规律和耐蚀机理。
1 实验
电镀基材为d8mm圆柱型黄铜, 一端通过螺丝与导线连接, 只暴露一个柱面为工作面。 电镀之前, 将试样逐级打磨, 最后用3#金相砂纸打磨。 经过蒸馏水冲洗、 丙酮除油后置于干燥器中待用。 电镀之后的试样经蒸馏水冲洗、 丙酮除油、 吹干后进行电化学测试。
实验采用的工艺条件为: NiSO4·6H2O 100g/L, NiCl2·6 H2O 40g/L, H3BO3 40g/L, 添加剂适量, NaH2PO2·H2O 10~160g/L, 电流密度Jk=1~2A/dm2, 采用Pt片作阳极, 温度为40℃和60℃。
电镀电源采用SMD-30型数控双脉冲电源。 镀层的电化学测试在CHI660B(CH Instruments, Inc. 3700 Tennison Hill Drive Austin, TX 78738-5012 USA)测试仪上进行。 测试装置采用三电极体系, 参比电极为饱和甘汞电极, 辅助电极为铂电极, 镀件作为工作电极, 腐蚀介质为蒸馏水和分析纯NaCl配制而成的0.5mol/L NaCl溶液。 试样浸泡入腐蚀介质的同时监测腐蚀电位, 当开路电位基本接近稳定后(约15min), 进行电化学阻抗谱测试, 扰动信号的幅度为5mV, 测量频率范围为105 Hz~5mHz。 由于电化学阻抗谱实验是准稳态实验, 实验前后电极表面状态改变极小, 在电化学阻抗谱实验结束后对试样进行极化曲线的测试, 扫描速率为1mV/s。 所有电化学实验在25℃下进行。
2 结果及讨论
2.1 pH值对镀层耐蚀性能的影响
2.1.1 电化学阻抗谱测试结果
温度60℃, 电流密度为2A/dm2时, 在不同次磷酸钠浓度(分别为50、 80和110g/L)的镀液中进行电镀, 电镀时间为20min。 实验中用盐酸调整镀液的pH值, 不同pH时制得的镀层在0.5mol/L NaCl溶液中的电化学阻抗谱实验结果如图1所示。

图1 不同pH值和次亚磷酸钠浓度时制得的镀层在0.5mol/L NaCl溶液中的Nyquist图(a)和Bode图(b)
Fig.1 Nyquist plots(a) and Bode plots(b) of Ni-P deposits prepared from electrolytes with different pH values and NaH2PO2·H2O concentration in 0.5mol/L NaCl solution
从图1可以发现: 各种次磷酸盐含量镀液制取的镍磷镀层的电化学阻抗谱图非常类似, 故镍磷镀层的腐蚀机理应该也基本相似。 从图1(b)可以看出, 电极过程至少包含两个时间常数。 图1中Nyquist图的低频部分基本上都出现实部收缩现象, 表明低频部分有感抗成分。 从图可以看出, 当镀液的pH值下降时, Nyquist图的半椭圆弧明显增大。
根据分析认为, 0.5mol/L NaCl溶液中镍磷镀层的腐蚀行为对应的等效电路如图2所示。 图中Rs为溶液电阻; CPE1为与镍磷镀层表面膜层电容相关的常相位角元件; Rf为镍磷表面膜层的电阻; CPE2为与氧化膜/金属界面的电容相关的常相位角元件; Rct为反应电阻。

图2 0.5mol/L NaCl溶液中镍磷合金腐蚀过程的等效电路
Fig.2 Equivalent circuit of corrosion of Ni-P alloy in 0.5mol/L NaCl solution
其中CPE代表常相位角元件, Y为CPE元件的导纳, YCPE=Y0(jω)n, 0〈n〈1。 因此, 等效元件CPE有两个常数: 一个参数是Y0, 单位为Ω-1·cm-2·s-n; 另一个是弥散系数n。 当n=1时, CPE相当于一个纯电容, n=0时相当于一个纯电阻, n=-1时相当于一个电感[14]。
镍磷合金在氯离子介质中, 其表面存在氧化物膜层。 当镍磷镀层浸入NaCl溶液中后, 在穿蚀性强的Cl-进攻下, 在镍磷镀层表面的氧化物或氯化物开始溶解, 如: ![]() ; 而且Ni2+可以进一步反应: Ni2++2H2O→Ni(OH)2+2H+, 形成疏松多孔Ni(OH)2覆盖层[10], 这层膜对应第一个时间常数。 表面膜层在Cl-离子的进攻下, 膜被穿透, 膜层下面的镍磷合金暴露在溶液中会产生活性溶解, 在氧化膜的下面可以认为是金属镍的氧化, Ni→Ni2++2e; 故可认为是由膜/金属界面电容CPE2和反应电阻Rct并联成的法拉第阻抗, 在Bode图上对应第二个时间常数。 图1中Nyquist图的低频部分出现了感抗成分, 这是由于镍磷合金是自钝化金属, 表面为钝化膜所覆盖, 当溶液中存在引起局部破坏的活性Cl-时, 引起孔蚀, 当孔蚀处于诱导期时, 阻抗平面上的低频区出现明显的感抗。 这种低频的感抗弧随着时间逐渐萎缩, 当真正的蚀孔出现时, 感抗完全消失[15]。
; 而且Ni2+可以进一步反应: Ni2++2H2O→Ni(OH)2+2H+, 形成疏松多孔Ni(OH)2覆盖层[10], 这层膜对应第一个时间常数。 表面膜层在Cl-离子的进攻下, 膜被穿透, 膜层下面的镍磷合金暴露在溶液中会产生活性溶解, 在氧化膜的下面可以认为是金属镍的氧化, Ni→Ni2++2e; 故可认为是由膜/金属界面电容CPE2和反应电阻Rct并联成的法拉第阻抗, 在Bode图上对应第二个时间常数。 图1中Nyquist图的低频部分出现了感抗成分, 这是由于镍磷合金是自钝化金属, 表面为钝化膜所覆盖, 当溶液中存在引起局部破坏的活性Cl-时, 引起孔蚀, 当孔蚀处于诱导期时, 阻抗平面上的低频区出现明显的感抗。 这种低频的感抗弧随着时间逐渐萎缩, 当真正的蚀孔出现时, 感抗完全消失[15]。
实验中采用软件Zview对图形进行拟合, 拟合结果列于表1。
Rct直接对应合金中的镍在氯化钠溶液中的溶解, 其大小直接反应镀层耐蚀性。 由表中可明显看到, pH值越低, 镀层阻抗越大, 说明镀层越耐蚀。
2.1.2 极化曲线测试结果
镀层的极化曲线如图3~5所示。 从图中可以看到, 随着pH值降低, 镀层的自腐蚀电位明显提高, 如图3中电位从-0.65V上升到-0.41V, 其余均有不同程度的提高, 如图4和5所示; 而且, 当电位进入钝化区后, 镀层的钝态溶解电流减小, 表明耐蚀性增强。
镀液在相同次磷酸钠浓度下, pH值越低, 镀液里次磷酸根越易被还原成磷原子而沉积在镀层里(H2PO-2+2H++e→P+2H2O)[3], 即镀层磷含量随着pH值的降低而升高。 而在发生电化学腐蚀时, 镍优先溶解, 磷在表面富集。 在酸性介质中, 磷能强烈地发生水解反应, 生成H2PO-2并吸附在镍磷合金表面; H2PO-2 具有很强的还原能力, 能将Ni2+还原成镍, 吸附在镍质点上, 阻碍了镍的水化过程, 起到化学钝化的作用[16]。 因此, 本实验中低pH值时制得的镍磷镀层, 在阻抗谱实验中电荷转移电阻大, 且极化曲线实验中钝态溶解电流小。
2.2 镀液中次磷酸盐浓度对镀层耐蚀性的影响
pH值为3.50、 温度为60℃时, 在不同浓度次
表1 不同溶液pH和次磷酸钠浓度时制得的镍磷镀层对应的等效电路拟合数据
Table 1 Values of equivalent-circuit elements of Ni-P deposits with different parameters
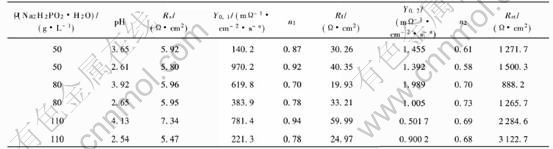

图3 不同pH时50g/L次磷酸钠镀液中制得的镀层在0.5mol/L NaCl中的极化曲线
Fig.3 Potentiodynamic polarization curves of Ni-P deposits prepared from electrolytes with 50g/L NaH2PO2·H2O and different pH values

图4 不同镀液pH时80g/L次磷酸钠镀液中制得的镀层在0.5mol/L NaCl中的极化曲线
Fig.4 Potentiodynamic polarization curves of Ni-P deposits prepared from electrolytes with 80g/L NaH2PO2·H2O and different pH values
磷酸盐溶液中制取了镍磷镀层。 采用电化学分析方法(电化学阻抗谱图), 对各镀层的耐蚀性进行了研究, 结果图6所示。
对图6的不同镍磷合金镀层, 选用前面相同的拟合电路, 对其阻抗谱图进行了数据拟合, 结果列于表2。
从表2可知: 不同次磷酸盐浓度镀液中制得的镀层反应电阻 Rct的大小排序为: 110g/L>160g/L>80g/L>50g/L>20g/L。 这表明, 当pH值为3.5左右, 温度为60℃时, 镀液次磷酸钠含量为110g/L时, 制取的镍磷镀层耐蚀性最强。 在镀液次磷酸钠含量按如上增加时, 镀层耐蚀性出现一个
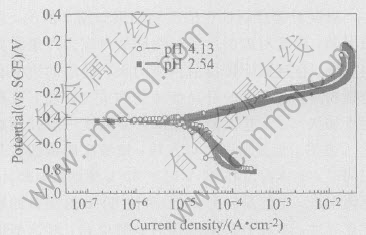
图5 不同镀液pH时110g/L次磷酸钠镀液中制得的镀层在0.5mol/L NaCl中的极化曲线
Fig.5 Potentiodynamic polarization curves of Ni-P deposits prepared from electrolytes with 110g/L NaH2PO2·H2O and different pH values

图6 pH 3.50、 温度60℃时在不同次磷酸盐镀液中制得镀层的Nyquist图
Fig.6 Nyquist plots of Ni-P deposits prepared from electrolytes with pH 3.50, and 60℃,and different contentration of NaH2PO2·H2O
高峰点, 即从20~110g/L时, 随着镀液次磷酸钠的增加, 镀层的磷含量随着增加, 到110g/L时出现高峰; 此时, 如果继续增加次磷酸钠含量, 镀层磷含量反而降低。 可以认为, 这是由于次磷酸钠(呈弱碱性)含量过高, 水解导致镀液pH值升高的原因。 文献[3]认为: 镀液的pH值升高到4.0以上, 次磷酸盐的溶解度降低, 易氧化产生NiHPO3 (亚磷酸镍)的沉淀析出, 并有触发镀液自然分解的危险。 如果pH值继续升高, 副反应(H2PO-2+OH-→HPO2-3+H2)的发生几率进一步增大, 不利于磷的沉积(H2PO-2+2H++e→P+2H2O), 引起镀层磷含量降低, 镀层耐蚀性也随之下降。
2.3 温度对镀层耐蚀性的影响
温度对镀层耐蚀性的实验结果如图7所示, 由图可知, 温度对镀层质量的特别是内应力产生重要的影响。 在室温下镀层的内应力大, 镀层的边缘会龟裂剥落, 随温度的升高镀层的内应力降低, 沉积速度加快[3] 。 工艺上电镀镍磷合金温度一般控制在60℃左右, 但是由图可以发现: 镀液次磷酸盐含量相同时, 电镀温度在40℃时比60℃更耐蚀; 而且, 总体来看, 电镀温度为40℃时比60℃时制备的镀层更耐蚀。 实验中采用前叙的等效电路, 对这些图形进行拟合, 其数据列于表3。
由表3可看到: 镀液次磷酸盐含量为80g/L时, 反应电阻Rct在40℃时大于60℃, 说明40℃时制得的镍磷镀层耐蚀性比60℃时的镀层耐蚀性更好。
对两种不同次磷酸盐浓度制得镀层的极化曲线进行了对比, 结果如图7(b)所示。 由图可知, 40℃时, 镍磷镀层钝态溶解电流小; 阳极溶解电流小; 自腐蚀电位已有一定程度的提高。 其原因可能是由于温度降低, 镀层沉积速度放慢, 镀层结晶更细密, 导致耐蚀性提高。
3 结论
1) 镀液pH值降低, 镀层磷含量随着pH值的降低而升高。 由于合金表面磷的水解产生的H2PO-2 起到化学钝化的作用, 因此, 低pH下制得的镍磷镀层电荷转移电阻大并且钝态溶解电流小, 耐蚀性增强。
2) 在都能形成致密的镍磷镀层的前提下, 镀
表2 图6中不同曲线对应的等效电路元件数值
Table 2 Parameters of equivalent elements in Fig.10

表3 图7(a)中不同曲线对应的等效电路元件数值
Table 3 Parameters for the equivalent elements in Fig.7(a)


图7 不同温度下NaH2PO2·H2O浓度为80g/L时制得镀层的Nyquist图(a)和极化曲线图(b)
Fig.7 Nyquist plots (a) and potentiodynamic polarization curves (b) of Ni-P dcposits prepared from electrolytes at different temperatures and NaH2PO2·H2O 80g/L
液次亚磷酸钠含量越高, 镀层越耐蚀, 到110g/L时, 达到最大值。 这是因为随着镀液次磷酸钠的增加, 镀层的磷含量随着增加, 但过高的次亚磷酸钠含量, 引起pH值升高, 导致副反应所占比率增大, 不利于磷的沉积, 引起镀层磷含量降低, 镀层耐蚀性也随之下降。
3) 相同次磷酸钠浓度的镀液, 温度越低, 制备的镍磷镀层越耐蚀, 这可能是温度较低时制得的镀层结晶较为细密的原因。
REFERENCES
[1]Hu C C, Bai A. Composition control of electroplated nickel-phosphorus deposits[J]. Surface and Coatings Technology, 2001, 137: 181-187.
[2]ZENG Yue, ZHOU Shao-min. In-situ surface raman study of the phosphorus incorporation mechanism during electrodeposition of Ni-P alloys[J]. Journal of Electroanalytical Chemistry, 1999, 469: 79-83.
[3]张允诚, 胡如南, 向荣. 电镀手册(第2版)[M]. 北京: 国防工业出版社, 1997. 574-577.
ZHANG Yun-cheng, HU Ru-nan, XIANG Rong. Handbook of Electroplating(2nd ed)[M]. Beijing: National Defence Industry Press, 1997. 574-577.
[4]FANG Jing-li, YE Xiang-rong, FANG Jing. Factors influencing solderability of electroless Ni-P deposits[J]. Plating & Surface Finishing, 1992, 7: 44-47.
[5]Zangeneh-Madar K, Monir-Vaghefi S M. The effect of thermochemical treatment on the structure and hardness of electroless Ni-P coated low alloy steel[J]. Surface and Coatings Technology, 2004, 182: 65-71.
[6]XIE Hao-wen, ZHANG Bang-wei. Effects of preparation technology on the structure and amorphous forming region for electroless Ni-P alloys[J]. Journal of Materials Processing Technology, 2002, 124: 8-13.
[7]吴玉程, 邓宗钢. 非晶态镍磷合金的组织结构与性能[J]. 中国有色金属学报, 1998, 8(3): 415-418.
WU Yu-cheng, DENG Zong-gang. Microstructure and properties of amorphous Ni-P alloys[J]. The ChineseJournal of Nonferrous Metals, 1998, 8(3): 415-418.
[8]Lo P H, Tsai W T, Lee J T, et al. The electrochemical behvior of electroless plated Ni-P alloy in concentrated NaOH solution[J]. Journal of the Electrochemical Society, 1995, 142: 91-96.
[9]Well R, Lee J H, Kim I, et al. Comparison of some mechanical and corrosion properties of electroless and electroplated Nickel-Phosphorus alloys[J]. Plating and Surface Finishing, 1989, 2: 62-66.
[10]Bai A, Chuang P Y, Hu C C. The corrosion behavior of Ni-p deposits with high phosphorous contents in brine media[J]. Materials Chemistry and Physics, 2003, 82: 93-100.
[11]Zeller III R L, Salvati L Jr. Effects of phosphorus on corrosion resistance of electroless nickel in 50% sodium hydroxide[J]. Corrosion Science, 1994, 50: 457-467.
[12]Angelo A C D, Lasia A. Surface effects in the hydrogen evolution reaction on Ni-Zn alloy electrodes in alkaline solutions[J]. Journal of the Electrochemical Society, 1995, 142: 3313-3319.
[13]García-Alonso M C, Escudero M L, López V, et al. The corrosion behaviour of laser treated Ni-P alloy coatings on mild steel[J]. Corrosion Science, 1996, 38: 515-530.
[14]CHENG Ying-liang, ZHANG Zhao, CAO Fa-he, et al. A study of the corrosion of aluminum alloy 2024-T3 under thin electrolyte layers[J]. Corrosion Science, 2004, 46: 1649-1667.
[15]曹楚南. 腐蚀电化学原理[M]. 北京: 化学工业出版社, 1985. 323-344.
CAO Chu-nan. The Electrochemical Principles of Corrosion[M]. Beijing: Chemical Industry Press, 1985 . 323-344.
[16]卢燕平. 镍磷合金镀层在盐酸中的耐蚀性[J]. 材料保护, 1991, 24(1): 17-20.
LU Yan-ping, The corrosion behavior of Ni-P alloy deposits in hydrochloric acid[J]. Materials Protection, 1991, 24(1): 17-20.
基金项目: 国家自然科学基金资助项目(20203015)
收稿日期: 2005-03-25; 修订日期: 2005-07-14
作者简介: 刘应科(1974-), 男, 硕士
通讯作者: 程英亮, 副教授; 电话: 0731-6892587; E-mail: deepblacksea@163.com


