文章编号:1004-0609(2011)08-1980-08
基于TEA和EDTA·2Na双络合体系的
酸性镀铜工艺及镀层特性
张 震,李 俊
(华南理工大学 化学与化工学院 广东省高等学校新能源技术重点实验室, 广州 510640)
摘 要:
锂离子电池用负极集流体铜箔材料目前主要采用电沉积法制备。为制备良好的电解铜箔,采用不同电镀工艺参数,在基于三乙醇胺(TEA)和乙二胺四乙酸二钠(EDTA·2Na)双络合体系的CuSO4/H2SO4溶液中进行镀铜工艺研究。通过线性扫描、循环伏安、SEM 和XRD手段对镀液性质、镀层微观形貌和结构进行测定和表征,并进行镀层质量重复性实验。结果表明:选择含P 0.1%的磷铜作为阳极,采取机械搅拌镀液的方式,在CuSO4·5H2O为300 g/L、H2SO4为90 g/L、Cl-为40~80 mg/L、TEA为3.5 g/L和EDTA·2Na为5 g/L中适量添加剂P的镀液中,以电流密度为490 mA/cm2,镀液温度为40~60 ℃,施镀5~10 min能得到良好镀层;添加剂明显降低循环伏安阴极峰电流,Cu2+的还原速度减慢;添加剂提高镀层表面的结晶细化程度,使晶体颗粒变小,致密性提高,镀层质量变好,整平作用明显,Cu镀层呈现(111)晶面择优取向;镀速可达19.4 mg/min,镀层质量有很好的重现性。
关键词:
电解铜箔;TEA;EDTA·2Na;镀速;槽电压;择优取向;
中图分类号:TQ153.1 文献标志码:A
Acid copper electrodepositing process and
coating properties based on system of TEA and EDTA·2Na
ZHANG Zhen, LI Jun
(Key Laboratory of New Energy Technology for Guangdong Universities, School of Chemistry and Chemical Engineering,
South China University of Technology, Guangzhou 510640, China)
Abstract: The copper foils for the anode current collectors of lithium-ion battery were prepared by electrodeposition. In order to obtain better electrodeposited copper foils, considering different electroplating technology parameters, the copper electrodepositing process based on the system of TEA and EDTA·2Na was studied in CuSO4/H2SO4 electrolytes. The morphology and structure of coating were characterized by SEM and XRD, and the property of electrolyte was tested by linear sweep voltammetry and cyclic voltammetry. The reproducibility of coating was also tested. The results show that a good coating can be got in the better condition that is as follows: 0.1% phosphor bronze as the anode, mechanical stirring, CuSO4·5H2O (300 g/L), H2SO4(90 g/L), Cl-(40-80 mg/L), TEA(3.5 g/L), EDTA·2Na (5 g/L), appropriate amount of additive P, current density (490 mA/cm2), bath temperature(40-60 ℃) and deposition time(5-10 min). The additives remarkably decrease the cathode peak current of cyclic voltammetry and slow down the reduction rate of copper ions. The additives can improve the crystallization refinement of the coating, reduce crystal particles and raise the compactness, owing to its significantly leveling effect. The copper coating has an orientation along (111) crystal plane. The deposition rate reaches up 19.4 mg/min, and the coating quality has good reproducibility.
Key words: electrodeposited copper foil; TEA; EDTA·2Na; deposition rate; bath voltage; preferred orientation
在锂离子电池中,负极铜箔集流体性能的重要性在整个电池中仅次于正极材料。在铜箔厚度一定的条件下,如何提高其抗拉强度、伸长率、致密性、改善表面粗糙度、厚度均匀性及外观质量等对于获得高性能的锂离子电池至关重要。目前,电解铜箔行业最发达的是日本和美国,而我国的研发基础薄弱,国内企业技术进步缓慢,使得我国高档铜箔技术严重依赖于国外[1-2]。因此,开展高质量、高附加值的锂离子电池专用电解铜箔集流体材料的研究,对降低我国锂电池制造成本、提高电池综合性能和产业技术水平具有重要意义。
众所周知,电解铜箔的生产是酸性镀铜的电沉积过程,影响其性能的因素有很多,如添加剂的种类与浓度、镀液的组成、电沉积的各种参数等[3]。一般来说,如何在镀速较快的前提下获得良好的铜镀层,且保持镀液具有较好的稳定性,添加剂的作用尤为明显。近年来,国内有学者[4-7]研究在化学镀铜液中添加络合剂TEA和EDTA·2Na时发现,一定浓度的TEA能提高镀速,但过量会降低镀速;EDTA·2Na则能提高镀液的稳定性。国外研究者[8-9]也从电化学角度就TEA和EDTA·2Na对化学镀铜过程中电极反应的影响进行研究。国内外这些研究认为,TEA和EDTA·2Na对化学镀铜过程及镀层性能有着显著影响。但目前将其作为双络合体系进行酸性电镀铜工艺的研究则鲜见报道。因此,本文作者采用直流电沉积技术,在基于TEA和EDTA·2Na双络合体系的CuSO4/H2SO4溶液中进行镀铜工艺及镀层特性研究,通过研究镀液组成、电流密度、镀液温度、TEA和EDTA·2Na浓度等因素对镀速和镀层质量以及槽电压的影响,优化工艺参数,确定基于TEA和EDTA·2Na双络合体系的较佳工艺条件和镀液组成,得到沉积速度较快、质量较好的镀层,最后对所得镀层进行择优取向分析,初步探讨Cu电结晶的机理,这对研究电解铜箔添加剂有一定的借鉴作用。
1 实验
CuSO4·5H2O,台山市粤侨试剂塑料有限公司;H2SO4,广东光华化学试剂厂有限公司;NaCl,台山化工厂;三乙醇胺(TEA),广东光华化学试剂厂有限公司;乙二胺四乙酸二钠(EDTA·2Na),广州化学试剂厂。
用工业纯钛作阴极,工作面积为1 cm2,经2000#砂纸打磨→水洗→无水乙醇除油→清洗→稀硝酸腐蚀液去除表面氧化膜→蒸馏水冲洗→干燥处理。以含磷量为0.1%的磷铜为阳极,采用直流电沉积技术,在一定电流密度、镀液温度和机械搅拌镀液条件下镀铜,镀层经蒸馏水冲洗、干燥,制得铜箔样品。选择工艺条件范围:镀液温度为30~70 ℃,电流密度为25~490 mA/cm2。制样选择的镀液组成及浓度范围见表1。CuSO4/H2SO4溶液预先经活性炭过滤。
按质量增加称量法测定沉积速率。计算公式如下:v=Δm/t。式中:v为沉积速率,即镀速(mg/min);Δm为镀后质量增加(mg);t为施镀时间(min)。
1) 电化学测试:采用上海辰华仪器公司生产的CHI660C电化学工作站,对研究电极为Cu电极(d= 2 mm),辅助电极为Pt电极,参比电极为饱和甘汞电极的三电极体系进行测试。研究电极依次在金相砂纸和撒有氧化铝粉末的潮湿细绒布上抛光至镜亮。极化曲线电势扫描范围 -0.75~0 V;循环伏安测试电势扫描范围-0.75~0.8 V,扫描速率均为10 mV/s。
2) 重复性实验:在较佳镀液组成和工艺条件下,进行重复镀铜实验,测定镀速并目测镀层质量,镀层平整光亮且基本无缺陷为好,平整但有极少许缺陷为较好,有较多缺陷为差。
1) 扫描电镜(SEM)分析:采用日立S-3000H型扫描电子显微镜对铜镀层表面形貌进行观察,考察样品表面的致密程度、微观缺陷以及晶粒大小等特征。
2) X射线衍射(XRD)分析:实验仪器为日本岛津XD-3A型X射线衍射仪,Cu靶,Ni片滤波,管电压35 kV,管电流30 mA,扫描速度为8 (°)/min。以晶面(hkl)的织构系数TC(Texture coefficient)来表征铜镀层晶面的择优程度[10]:
 (1)
(1)
式中:I(hkl)和I0(hkl)分别表示镀层试样和标准Cu粉末的(hkl)晶面的衍射线强度;n为衍射峰个数,为避免平行面的影响,n取值为4,即取(111)、(200)、(220)和(311)晶面进行计算。
表1 制样镀液组成及浓度范围
Table 1 Composition of bath for electrodeposition of copper

3) 镀层耐腐蚀性实验:将在较佳条件下制得的镀层试样分别浸入25% NH3·H2O、3% HCl和3.5% NaCl溶液3 h,测定试样腐蚀前后质量变化,以此说明镀层的耐蚀性。
2 结果与讨论
2.1.1 主盐和酸浓度对镀速和槽电压的影响
在50 ℃、490 mA/cm2、80 mg/L Cl-、90 g/L H2SO4条件下,当CuSO4·5H2O浓度从100 g/L逐渐增至400 g/L时,槽电压由1.8 V逐渐降至0.7 V,镀速由17.8 mg/min逐渐增至19.5 mg/min;在相同温度、电流密度、Cl-浓度及300 g/L CuSO4·H2O条件下,当H2SO4浓度从30 g/L逐渐增至120 g/L时,槽电压从1.8 V逐渐降至0.7 V,镀速从17.8 mg/min逐渐增至19.5 mg/min,表明随着CuSO4·5H2O和H2SO4浓度的增加,槽电压变小,镀速增加。当CuSO4·5H2O和H2SO4浓度超过一定范围时,铜的沉积速度增加趋缓。由图1所示的电解液阴极极化曲线可见,随CuSO4·5H2O和H2SO4浓度的增大Cu2+极限扩散电流升高。表明主盐CuSO4和H2SO4浓度增高有利于提高镀速,但Cu2+浓度过高,副反应加强,镀液中易产生铜粉,造成镀层疏松粗糙。H2SO4是强电解质,适当提高硫酸浓度可以提高镀液的导电能力和分散能力,使阴极上的电流分布均匀,但过高的硫酸浓度会降低CuSO4在镀液中的溶解度,并增大对镀槽的腐蚀性。另外,随着氢离子浓度的增加,阴极析氢趋势增大,严重时将导致氢脆,所以硫酸浓度不宜太高。实验表明,镀液为CuSO4·5H2O 300 g/L以及H2SO4 90 g/L时,镀速较快,槽压较低,不易析氢,且镀层均匀,外观较好。
2.1.2 Cl-对镀速和槽电压的影响
在镀液为CuSO4·5H2O 300 g/L、H2SO4 90 g/L、电流密度为490 mA/cm2、施镀温度为50 ℃情况下,Cl-浓度由20 mg/L逐渐增至80 mg/L时,槽电压由1.3 V逐渐减至1.1 V,镀速由18.7 mg/min逐渐增至19.4 mg/min。因为Cl-起促进剂的作用,加快了铜的沉积速度[11]。当Cl-浓度增至100 mg/L时,镀速减小为18.8 mg/min,铜镀层表面质量变差,这是因为适量的Cl-能提高镀层的光亮度和整平性[11-12],使镀层结晶细化降低镀层的应力,而过多的Cl-会使镀层失去光泽,产生树枝状的条纹。因此,控制Cl-浓度在40~80 mg/L范围为宜。
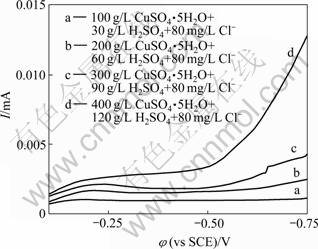
图1 不同主盐浓度电解液的阴极极化曲线
Fig.1 Cathode polarization curves of different concentrations of main salt for electrolyte
2.1.3 镀液温度对镀速的影响
在镀液为Cl- 80 mg/L,H2SO4 90 g/L,CuSO4·H2O 300 g/L,电流密度为490 mA/cm2条件下,镀液温度从30 ℃逐渐升高至60 ℃时,镀速从17.8 mg/min逐渐增至19.4 mg/min。因为粒子运动速率随温度升高逐渐加快,阴极表面催化活性点数量增多,从而促进金属离子的沉积速率加快。若温度继续升高至70 ℃,镀速变为19.6 mg/min时,粒子运动速率进一步加快,粒子在表面停留时间缩短,不利于镀层的形成及与基体的结合,导致镀层易从基体表面脱落,镀层的结合力变差,镀层质量下降。实验表明,施镀温度较佳范围为40~60 ℃。
2.1.4 电流密度对镀速和槽电压的影响
在镀液为Cl- 80 mg/L、H2SO4 90 g/L、CuSO4·H2O 300 g/L、施镀温度为50 ℃情况下,电流密度从25 mA/cm2逐渐增至490 mA/cm2时,槽电压从0.1 V逐渐增至1.2 V,镀速也从0.9 mg/min逐渐增至19.2 mg/min。这是因为一方面电流密度越大,阴极超电势越大,成核速度就越大,电沉积层晶粒越细,孔隙率、缺陷和裂纹减少,因而镀层表面会变光滑;另一方面,较高的镀速可提高生产效率。虽然较大电流密度能够细化电沉积铜晶粒,但是,过高的电流密度会使镀层烧焦变暗。综合考虑,选择电流密度为490 mA/cm2。
2.1.5 TEA和EDTA·2Na对镀速和槽电压的影响
图2所示为镀液为Cl- 80 mg/L、CuSO4·5H2O 300 g/L、H2SO4 90 g/L、电流密度为490 mA/cm2、施镀温度为50 ℃时TEA和EDTA·2Na对镀速和槽电压的影响。由图2(a)知,镀速随TEA浓度增大而升高。这可能是当TEA浓度较大时,其可作为镀铜的加速剂所产生的结果[8-9]。但TEA浓度过大,会因镀速过快造成镀液不稳定。由图2(b)知,镀速和槽电压随EDTA·2Na浓度的增大而降低,其主要原因可能是由于Cu2+与EDTA形成络合物之后,体积变大,阻碍了Cu2+接近电极表面具有反应能力的活性点,使镀速降低;也可能是由于络合剂浓度增加,较多的Cu2+被紧密络合,镀液中游离的Cu2+减少,从而降低铜的沉积速率。另外,当EDTA·2Na为1 g/L时,镀层外观较差,表面粗糙不光亮;当EDTA·2Na为2 g/L时,镀层外观变好,表面较平整但不够光亮;当EDTA·2Na为5 g/L和7.5 g/L时,镀层外观较好,表面平整。根据实验结果,确定TEA的适宜浓度为3.5 g/L,EDTA·2Na的适宜浓度为5 g/L。
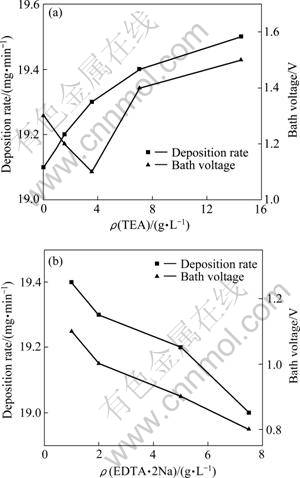
图2 TEA和EDTA·2Na对镀速和槽电压的影响
Fig.2 Effects of TEA (a) and EDTA·2Na (b) concentrations on deposition rate and bath voltage
2.1.6 搅拌对镀速和槽电压的影响
表2所列为CuSO4·5H2O 300 g/L、H2SO4 90 g/L、Cl- 80 mg/L镀液中搅拌与镀速和槽压的关系。由表2可知,搅拌对镀层质量影响较大,因为搅拌具有以下几种作用:1) 使接触阴极表面的溶液浓度尽可能与本体浓度一致,以保证有足够的Cu2+离子发生反应,从而提高沉铜速度;2) 使停留在阴极表面的气泡迅速脱离逸出液面,以减少镀层针孔,提高镀层质量。此外,搅拌还可以使镀层厚度均匀。因此,搅拌能够降低镀液的浓差极化,降低槽电压,提高电流密度,加快沉积速度,细化电沉积金属晶粒,减少孔隙率、缺陷和裂纹,提高镀层的均匀性,从而改善镀层表面质量。
表2 搅拌对镀速和槽电压的影响
Table 2 Effect of stirring on deposition rate and bath voltage

2.1.7 阳极对镀速和镀层质量的影响
由表3可知,在镀液为CuSO4·5H2O 300 g/L、H2SO4 90 g/L、Cl- 80 mg/L、TEA 3.5 g/L、EDTA·2Na 5 g/L,适量添加剂P,电流密度为490 mA/cm2,施镀温度为50 ℃情况下,使用含少量磷的铜阳极对镀速影响较小,但使镀层变好。只要进行搅拌并控制硫酸浓度不至于过低,电流密度略高些,镀层片区的不光亮和麻砂状即可克服,从而得到较好的镀层。使用磷铜能形成致密黑色磷膜,防止Cu+溶入槽液形成沉淀,同时催化Cu+转化为Cu2+。因此,选择含磷0.1%的磷铜作为阳极效果较好。
2.1.8 沉积时间对镀速和槽电压的影响
在与表3相同实验条件下,沉积时间对镀速和槽压的影响如见图3所示。由图3可看出,随着施镀时间的延长,镀速下降,槽电压略有升高,这可能是由于施镀时间的延长,阳极黑色磷膜变厚,导致钝化加强,因此,适宜沉积时间为5~10 min。
表3 阳极对镀速和镀层质量的影响
Table 3 Effect of anode on deposition rate and coating quality
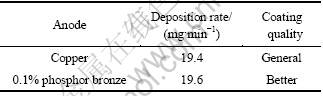
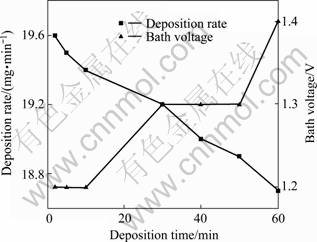
图3 沉积时间对镀速和槽电压的影响
Fig.3 Effect of deposition time on deposition rate and bath voltage
2.1.9 较佳工艺条件及镀液组成的确定
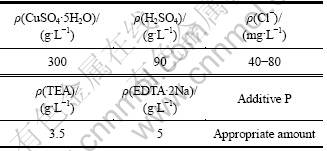
通过对TEA和EDTA·2Na双络合体系的酸性镀铜工艺进行优化,综合考虑上述因素确定较佳工艺条件:镀液温度为40~60 ℃,电流密度为490 mA/cm2,以含P量为0.1%的磷铜作阳极,机械搅拌镀液。较佳镀液组成见表4。
表4 较佳镀液组成
Table 4 Better composition of bath
2.1.10 重复性实验
为了进一步验证上述较佳工艺条件及镀液组成的可行性,按较佳工艺条件和镀液组成,对镀速和镀层质量进行重复性实验,其结果见表5,表明镀层质量和镀速重现性好,镀液较为稳定。
2.1.11 镀层耐腐蚀性实验
将在较佳工艺条件及镀液组成下得到的镀层试样分别浸入25% NH3.H2O、3% HCl和3.5% NaCl溶液 3 h进行耐腐蚀性实验,并与不加任何添加剂得到的试样进行对比,其结果如表6所列,表中m1为腐蚀前质量;m2为腐蚀后质量,Δm=m1-m2。
表5 重复性实验数据
Table 5 Experimental data of reproducibility
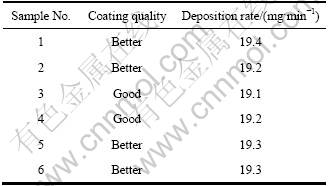
表6 镀层在不同介质的耐腐蚀性测试实验
Table 6 Testing results of coating corrosion resistance in different media
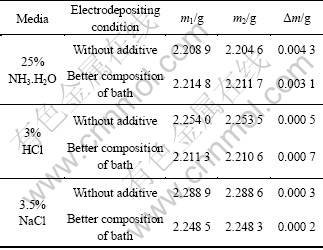
由表6可知,样品腐蚀前后质量变化均较小,说明在较佳工艺条件及镀液组成下,添加剂在3 h内不会对所得镀层在上述腐蚀介质中的腐蚀速度产生较大影响。
2.2.1 镀液循环伏安曲线分析
对表4较佳组成的镀液进行循环伏安扫描,并与无添加剂时进行对比,其结果如图4所示。曲线a和b分别表示无任何添加剂的和较佳组成镀液的循环伏安曲线。由曲线b可知,其阳极峰和阴极峰电流值相对较低。阳极峰电流降低可能是添加剂的吸附引起的,阴极则可能是添加剂络合和吸附共同引起的。有机添加剂吸附在电极表面,对金属离子的还原起到阻滞作用,金属还原过程受到一定程度抑制,此时镀层结晶细化并达到光亮的效果。由此可推断铜的沉积可分两步,分别为金属的结晶成核与成长,其反应式如下:
Cu2++e→Cu+ (2)
Cu++e→Cu (3)
当加入有机添加剂以后,式(2)进行较慢,控制整个阴极的进行速度,此时金属结晶的成核数增加而成长速度减缓,就可以得到结晶细化并光亮的镀层[13-14]。曲线a在较负电势处出现锯齿波动可能是由于电极表面析氢引起的。
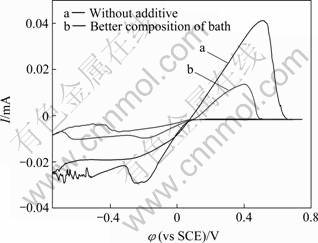
图4 镀液循环伏安曲线
Fig.4 Cyclic voltammetry curves of bath
2.2.2 镀层SEM分析
图5(a)所示为无添加剂时所得镀层的SEM像。由图5(a)可见,镀层表面凹凸不平,晶粒较大,且颗粒分布不均匀,致密性较低,晶粒之间存在大量的缝隙。图5(b)和(c)所示则分别为3.5 g/L TEA和5 g/L EDTA·2Na单独作为添加剂成分时镀层的表面情况,TEA明显改善镀层质量,镀层表面颗粒分布较均匀,晶粒较细,EDTA·2Na对晶粒细化有一定作用,但均匀性均不及TEA。图5(d)所示为较佳组成镀液时所得镀层的SEM像。镀层质量有显著的改善,颗粒结晶细化程度有较大提高,晶粒间距进一步缩小,致密性有所改善,且颗粒分布更加均匀,晶粒大小比较均一。由此可知,基于TEA和EDTA·2Na双络合体系的较佳组成镀液中的添加剂对镀层表面质量起着积极性影响,具有一定的光亮和整平作用,TEA和EDTA·2Na作为双络合体系对铜镀层具有较好的协同作用。但镀层的光亮度仍然不够理想,因为真正光亮的镀层,并没有明显的结晶颗粒,而是非常细微的结晶镀层。光亮剂的作用在于金属离子获得电子还原时,不按结晶成长的程序长大,而是可以连续不断地还原为金属原子并组成光亮的金属镀层[15]。
2.2.3 镀层XRD分析
图6所示分别为钛基体、无添加剂、较佳组成镀液时所得镀层的XRD谱。表7所列为对应于图6铜镀层XRD晶面分析结果。当各衍射面的TC值相同时,晶面取向是无序的,如果某个(hkl)面TC值大于平均值(25%),则该晶面呈现择优取向。TC值越大,说明择优取向程度越高。由表7知,样品的晶面生长情况发生了明显变化,无添加剂时,(220)晶面择优取向程度最大,TC(220)值达31.9%;但在较佳组成镀液下,(111)晶面呈现最大择优取向,TC(111)值高达39.5%。目前,解释电沉积层形成晶面择优取向的理论主要有两种,即二维晶核理论和几何选择理论[16]。在Cu的电沉积过程中,因为氢在Cu上的吸附热很低,所以可不考虑氢原子在其上的吸附[17],结果Cu的电结晶过程将采取“自由生长”。按照这两个理论预测,如果面心立方晶格Cu采取侧向生长,亦即最紧密堆积的原子平面平行于基体,Cu镀层呈现(111)晶面择优取向,镀层会平整;若采取向上生长,亦即最紧密堆积的原子平面垂直于基体,Cu镀层呈现(220)晶面择优取向,镀层结晶颗粒相对较大,不平整。无添加剂的TC(220)= 31.9%,而含添加剂时,TC(220)=22.8%,TC(111)=39.5%,(220)晶面无择优取向,(111)晶面呈现较大择优取向,从而说明在较佳组成镀液下所得镀层表面会比较平整,与SEM实验结果相符。

图5 镀层的SEM像
Fig.5 SEM images of copper electrodeposits: (a) Without additive; (b) 3.5 g/L TEA; (c) 5 g/L EDTA·2Na; (d) Better composition of bath
另外,在硫酸盐体系中得到的Cu沉积层的特征择优取向是(220)和(111),很少观察到其它择优取向晶面[18-20]。这可能是因为添加剂一般都是吸附于电极表面,且在不同晶粒的不同晶面上进行选择性吸附,抑制原先优先结晶的晶面[21]。而在基于TEA和EDTA·2Na双络合体系的较佳组成镀液中添加剂的联合作用下,由于络合物的形成和络合物在铜电极表面较强的吸附作用,改变Cu电结晶的机理,导致了图6中(111)、(200)、(220)和(311) 4个晶面衍射峰不同程度的增强。
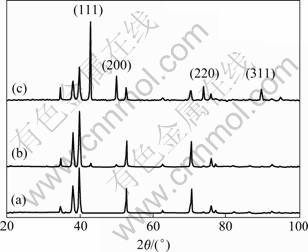
图6 不同镀层的XRD谱
Fig.6 XRD patterns of different electrodeposits: (a) Titanium matrix; (b) Without additive; (c) Better composition of bath
表7 对应于图6铜镀层XRD结果
Table 7 XRD results of Cu electrodeposits corresponding to Fig.6

3 结论
1) 选择含P 0.1%的磷铜作为阳极,采取机械搅拌镀液的方式,在CuSO4·5H2O为300 g/L、H2SO4为90 g/L、Cl-为40~80 mg/L、TEA为3.5 g/L、EDTA·2Na为5 g/L,含适量添加剂P的镀液中,以电流密度为490 mA/cm2、镀液温度为40~60 ℃、施镀5~10 min能得到良好镀层。镀速可达19.4 mg/min,镀速和镀层质量均具有很好的重现性。
2) 添加剂明显降低循环伏安阴极峰电流,Cu2+的还原速度减慢。
3) 基于TEA和EDTA·2Na双络合体系的较佳组成镀液中的添加剂能使镀层表面结晶细化程度提高,使晶体颗粒变小,致密性提高,镀层质量变好,整平作用明显,Cu镀层呈现(111)晶面择优取向。
REFERENCES
[1] 李玉萍. 坚持技术优先, 大力发展我国高档电解铜箔[J]. 世界有色金属, 2002(4): 8-11.
LI Yu-ping. Persisting in advanced tech preference and strenuously developing domestic high-class electrolytic copper foils[J]. World Nonferrous Metals, 2002(4): 8-11.
[2] 黄 洁. 铜箔的生产技术及发展趋向[J]. 铜业工程, 2003(2): 83-84.
HUANG Jie. Technology of copper foil manufacturing and its development tendency[J]. Copper Engineering, 2003(2): 83-84.
[3] 张世超, 叶 凡, 蒋 涛. 电解铜箔力学性能的主要影响因素[J]. 中国有色金属学报, 2005, 15(S1): 167-173.
ZHANG Shi-chao, YE Fan, JIANG Tao. Influential factors for main mechanical properties of electrolytic copper foil[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(S1): 167-173.
[4] WANG X, LI N, YANG Z F, WANG Z L. Effects of triethanolamine and K4[Fe(CN)6] upon electroless copper plating[J]. Journal of The Electrochemical Society, 2010, 157(9): D500-D502.
[5] 郑雅杰, 李春华, 邹伟红. 三乙醇胺和EDTA·2Na盐双络合体系快速化学镀铜工艺研究[J]. 材料导报, 2006, 20(10): 159-162.
ZHENG Ya-jie, LI Chun-hua, ZOU Wei-hong. Study on electroless copper plating technology of high plating rate in triethanolamine and EDTA·2Na dual-chelating-agent system[J]. Materials Review, 2006, 20(10): 159-162.
[6] 郑雅杰, 邹伟红, 易丹青, 龚竹青, 李新海. 四羟丙基乙二胺和EDTA·2Na盐化学镀铜体系研究[J]. 材料保护, 2006, 39(2): 20-24.
ZHENG Ya-jie, ZOU Wei-hong, YI Dan-qing, GONG Zhu-qing, LI Xin-hai. Electroless copper plating in the presence of THPED and EDTA·2Na as the dual-chelating agent[J]. Materials Protection, 2006, 39(2): 20-24.
[7] 李春华. 三乙醇胺和EDTA?2Na双配合体系快速化学镀铜研究[D]. 长沙: 中南大学, 2007.
LI Chun-hua. Study on electroless copper plating technology of high plating rate in triethanolamine and EDTA·2Na dual-chelating-agent system[D]. Changsha: Central South University, 2007.
[8] KONDO K, MURAKAWA K, ISHIDA N, ISHIKAWA J, NOMOTO K, ISHIKAWA F. Process for electrolessly plating copper and plating solution therefor: US4935267[P]. 1990-06-19.
[9] KONDO K, AMAKUSA S, MURAKAWA K, KOJIMA K, ISHIDA N, ISHIKAWA J, ISHIKAWA F. Electroless copper plating solution and process for formation of copper film: US 5039338[P]. 1991-08-13.
[10] 郑精武, 蒋梅燕, 乔 梁, 姜力强, 盛嘉伟, 张 诚. CO32-对羟基乙叉二膦酸镀铜液的影响[J]. 物理化学学报, 2008, 24(9): 1733-1738.
ZHENG Jing-wu, JIANG Mei-yan, QIAO Liang, JIANG Li-qiang, SHENG Jia-wei, ZHANG Cheng. Influence of CO32- on copper electrodeposition from 1-Hydroxyethylidene-1,1- diphosphonic acid baths[J]. Acta Physical Chimica Sinica, 2008, 24(9): 1733-1738.
[11] 辜 敏, 李 强, 鲜晓红, 卿胜兰, 刘克万. PEG-Cl-添加剂存在下的铜电结晶过程研究[J]. 化学学报, 2006, 65(10): 881-886.
GU Min, LI Qiang, XIAN Xiao-hong, QING Sheng-lan, LIU Ke-wan. Electrocrystallization of copper in the presence of PEG-Cl- additive[J]. Acta Chimica Sinica, 2006, 65(10): 881-886.
[12] YOKOI M, KONISHI S. Interaction of Cl- and brightener components in copper plating from an acid sulphate bath[J]. Metal Finishing, 1983, 34(8): 434-439.
[13] 冯立明. 电镀工艺与设备[M]. 北京: 化学工业出版社, 2005.
FENG Li-ming. Electroplating technology and equipment[M]. Beijing: Chemical Industry Press, 2005.
[14] YU R L, LIU Q M, QIU G Z, FANG Z , TAN J X, YANG P. Inhibition behavior of some new mixed additives upon copper electrowinning[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(5): 1280-1284.
[15] 刘仁志. 电镀添加剂技术问答[M]. 北京: 化学工业出版社, 2009.
LIU Ren-zhi. Technology question and answer of electroplating additives[M]. Beijing: Chemical Industry Press, 2009.
[16] 周绍民. 金属电沉积-原理与研究方法[M]. 上海: 上海科学技术出版社, 1987: 242.
ZHOU Shao-min. Metal electrodeposition-principle and research method[M]. Shanghai: Shanghai Science and Technology Press, 1987: 242.
[17] 辜 敏, 杨防祖, 黄 令, 姚士冰, 周邵民. 高择优取向铜镀层的电化学形成及其表面形貌[J]. 物理化学学报, 2002, 18(11): 973-978.
GU Min, YANG Fang-zu, HUANG Ling, YAO Shi-bing, ZHOU Shao-min. The formation of copper electrodeposits with highly preferred orientation and their surface morphology[J]. Acta Physical Chimica Sinica, 2002, 18(11): 973-978.
[18] ZHU Z W, ZHU D, QU N S. Synthesis of smooth copper deposits by simultaneous electroforming and polishing process[J]. Materials Letters, 2008, 62(8/9): 1283-1286.
[19] ZHAO H J , LIU L, WU Y T, HU W B. Investigation on wear and corrosion behavior of Cu-graphite composites prepared by electroforming[J]. Composites Science and Technology, 2007, 67(6): 1210-1217.
[20] DUDIN P V, REVA O V, VOROBYOVA T N. High rate of copper electrodeposition from the hexafluorosilicate bath[J]. Surface and Coatings Technology, 2010, 204(20): 3141-3146.
[21] 辜 敏, 鲜晓红. (110)晶面全择优取向Cu镀层的制备及其条件优化[J]. 物理化学学报, 2006, 22(3): 378-382.
GU Min, XIAN Xiao-hong. The preparation of copper electrodeposits with (110) lattice plane fully preferred orientation[J]. Acta Physical Chimica Sinica, 2006, 22(3): 378-382.
(编辑 李艳红)
基金项目:广东省教育部产学研合作项目(2009B090200036);广东省科技计划高新技术产业化项目(2009A010100009)
收稿日期:2010-08-12;修订日期:2011-03-28
通信作者:张 震,教授;电话:13533408053;E-mail: chzzhang@scut.edu.cn
[5] 郑雅杰, 李春华, 邹伟红. 三乙醇胺和EDTA·2Na盐双络合体系快速化学镀铜工艺研究[J]. 材料导报, 2006, 20(10): 159-162.
[7] 李春华. 三乙醇胺和EDTA?2Na双配合体系快速化学镀铜研究[D]. 长沙: 中南大学, 2007.
[10] 郑精武, 蒋梅燕, 乔 梁, 姜力强, 盛嘉伟, 张 诚. CO32-对羟基乙叉二膦酸镀铜液的影响[J]. 物理化学学报, 2008, 24(9): 1733-1738.
[17] 辜 敏, 杨防祖, 黄 令, 姚士冰, 周邵民. 高择优取向铜镀层的电化学形成及其表面形貌[J]. 物理化学学报, 2002, 18(11): 973-978.


