Ni-金刚石复合镀层的制备
王美娟,王日初,彭超群,冯艳,张纯,邓黎洁
(中南大学 材料科学与工程学院,湖南 长沙,410083)
摘 要:
法,在镀镍液中加入粒径为40 μm的金刚石粉体制备Ni-金刚石复合镀层。采用阴极动电位极化方法、扫描电镜和显微硬度计探讨镀液温度、pH、镍离子浓度、电流密度和金刚石粉体质量浓度对镀层质量的影响,优化Ni-金刚石复合镀的工艺参数;采用X线衍射分析仪表征优化后复合镀层的结构。研究结果表明:优化的镀液组成和工艺参数为:NiSO4·6H2O 132 g/L,NiCl2 15 g/L,H3BO3 30 g/L,镀液温度(50±1) ℃,pH 3~4,阴极电流密度4 A/dm2,金刚石粉体质量浓度30 g/L;优化后的复合镀层表面平整,晶粒细小均匀,且金刚石粉体的质量分数为62.7%;与纯Ni镀层的晶粒相比,Ni-金刚石复合镀层的晶粒明显细化。
关键词:
复合电沉积;温度;pH;镍离子浓度;阴极电流密度;金刚石粉体;镀层表面形貌;
中图分类号:TQ153 文献标志码:A 文章编号:1672-7207(2013)07-2688-08
Preparation of Ni-diamond composite coating by composite electroplating
Wang Meijuan, Wang Richu, Peng Chaoqun, Feng Yan, Zhang Chun, DENG Lijie
(School of Materials Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The Ni-diamond composite electrodeposition was prepared by composite electroplating when diamond particles with a diameter of 40 μm were put into the solution of Ni electroplating. The effects of temperature, pH value of solution, concentration of Ni2+, cathode current density and concentration of diamond particles on the quality of Ni-diamond composite coatings were investigated by the cathodic potentiodynamic polarization, SEM and microhardness tester. The optimized technological conditions of Ni-diamond composite electrodeposition were obtained. The structure of optimized Ni-diamond composite coating was tested by XRD. The experimental results show that the optimized technological conditions are: NiSO4·6H2O, 132 g/L; NiCl2, 15 g/L; H3BO3, 30 g/L; temperature, (50±1) ℃; pH, 3-4; cathode current density, 4 A/dm2; concentration of diamond particles, 30 g/L. The results of SEM indicate that the surface of the Ni-diamond composite coating containing 62.7% diamond particles is neat, and small homogeneous grains are obtained. In comparison with pure Ni coating, the grains of the Ni-diamond composite coating are obviously refined.
Key words: composite electroplating; temperature; pH; concentration of Ni2+; cathode current density; diamond powder; coating surface morphology
复合电沉积是指向普通镀液中加入不溶性固体颗粒,当镀液金属离子阴极还原时,将微粒包覆进入镀层的一种重要表面改性方法[1]。通过该方法制得的复合镀层具有高硬度和耐磨耐蚀等优良性能,主要应用于高技术产业(电子元器件、计算机)、传统产业和其他产业,如造纸、纺织和食品等。均匀分散的第二相硬质粒子可以提高复合镀层的力学性能、耐蚀性和耐氧化性等,金刚石属于硬质材料,由金刚石合成的镍基复合镀层具有高耐磨性,是一种优良的磨削和切割工具。近年来,关于复合电沉积的研究有大量报道[2-3]。复合镀层的性能主要取决于基质金属与共沉积粒子的分布和复合量,而共沉积粒子的分布和复合量受工艺参数的影响,如粒子的特性(粒子形状、尺寸、浓度和表面电荷)、镀液组成(镀液浓度、添加剂、活性剂种类和浓度)和电流(电流种类和电流密度)等[4]。粒径较小的惰性粒子具有较高的表面自由能,在镀液中容易团聚,且镀液中高的离子浓度和惰性粒子浓度加剧惰性粒子的团聚[5],同时,惰性粒子粒径越小,其复合量也越低[6],从而影响复合镀层的性能。Wang等[7]发现粒径超细的SiC粒子比粗大的SiC粒子更难沉积,其沉积速度主要受粒子从弱吸附转变为强吸附这一过程控制。可见,复合镀层的工艺参数至关重要。目前,Ni-金刚石复合镀工艺研究所用的金刚石粉体主要为纳米粉[8],且关于镀液镍离子浓度的研究鲜有报道;电镀金刚石线锯采用的金刚石粉体主要为微米粉,且Ni-金刚石复合镀工艺是最关键的部分[9]。因此,本实验所用的金刚石粉体为微米粉,通过阴极动电位极化方法研究温度和pH对镀液性能的影响,采用扫描电镜和显微硬度计分别观察和测试不同镍离子浓度、电流密度和金刚石浓度下的复合镀层表面形貌和显微硬度,优化Ni-金刚石复合镀的工艺参数,并采用X线衍射分析仪表征优化后复合镀层的结构,以便为电镀金刚石线锯生产提供理论参数。
1 实验
1.1 Ni-金刚石复合镀层的制备方法
镀液采用基础瓦特镀液,镀液组成为:NiSO4·6H2O 57.6~428.4 g/L,NiCl2 15 g/L,H3BO3 30 g/L,均为分析纯。镀液的pH为1.5~5,镀液温度为20~60 ℃。实验基体采用工作面直径为10 mm的不锈钢,其余部分用环氧树脂固封。将研究电极的工作面依次经400号、600号、800号、1000号和1200号的砂纸打磨光亮,放入10% NaOH溶液超声除油,二次蒸馏水中超声去酸,再放入10% H2SO4溶液中超声去除氧化皮和锈蚀并活化金属表面,最后在二次蒸馏水中超声,超声时间均为2 min,风干待用。施镀前,金刚石粉体(粒径40 μm)须进行前处理,步骤主要为:在10% NaOH溶液中煮沸10 min除油后,用去离子水漂洗至中性,再在10% HNO3中煮沸10 min活化粉体表面,并用去离子水漂洗至中性,最后烘干待用。施镀时,金刚石粉体加入量为10~80 g/L。以200 mL的烧杯为镀槽,内置搅拌磁子,镀槽放在CJJ-6六联磁力搅拌机上,固定搅拌速度后以不锈钢为阴极、光亮的镍板为阳极,选择适当的电流密度,保持恒定的镀液温度,待接通直流稳压电源后即可施镀。施镀后,将镀层超声5 min。
1.2 Ni-金刚石复合镀层质量和结构的检测
以232型饱和甘汞电极为参比电极、4 cm2的光亮铂片为辅助电极,采用CHI660D电化学工作站测阴极动电位极化曲线,测量时镀液温度保持恒定;采用Quanta-200扫描电镜观察镀层表面形貌;采用HVS-1000型自动显微硬度计测试电镀21 min后复合镀层的显微硬度,载荷为2.94 N,每个样品测试6个点,取值相近的3个点求平均值;通过 D/MAX-RBX衍射分析仪表征纯镍镀层和Ni-金刚石复合镀层的结构,计算晶粒尺寸和金刚石粉体的质量分数。
2 结果与讨论
2.1 温度对Ni-金刚石复合镀层质量的影响
图1所示为不同温度下的阴极极化曲线。从图1可以看出:在电压为-0.5~-1.0 V区间内,不同温度下的镍沉积电流均较小,且温度越低,沉积电流越小;当电压负于-1.0 V时,随着温度升高,镍的沉积电流增大。这表明在低过电位下,镀液主要受浓差极化控制,且温度越低,浓差极化越大;在高过电位下,提高温度可以降低镀液黏度,加剧镀液中离子的热运动,有利于离子向阴极表面输送,加快镍的沉积速度。然而,当升高温度至50 ℃时,镀层的延展性提高,镀层的内应力降低;当温度超过50 ℃时,内应力反而升高[10],粒子团聚现象明显,复合量下降[11],且镀液蒸发速度较快,镀液成分和浓度不稳定。因此,选用(50±1) ℃为本实验的电镀温度。
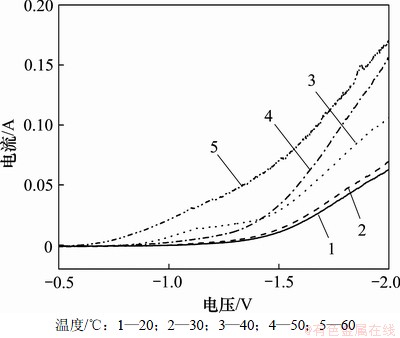
图1 不同温度下的阴极极化曲线
Fig.1 Cathodic polarization curves at different temperatures
2.2 pH对Ni-金刚石复合镀层质量的影响
图2所示为不同pH下的阴极极化曲线。从图2可以看出:当pH为1.5或5.0时,镍的沉积电流较大,极化曲线均不稳定。这表明当pH过低时,镀液过电位较小,电流密度较大,但过多氢离子吸附在阴极表面上发生还原,使大量氢气析出,易产生针孔,导致内应力加剧,削弱基体和镀层之间的结合力,从而影响镀层质量;当pH过高时,阴极表面局部碱化而形成氢氧化镍[12],使镀液浑浊,不利于共沉积。从图2还可以看出:当pH为3.0和4.0时,阴极极化曲线比较稳定,电压越负,两极化曲线的镍沉积电流越接近。考虑原始镀液本身pH在3.0~4.0区间内,选用3.0~4.0为本实验镀液的pH。
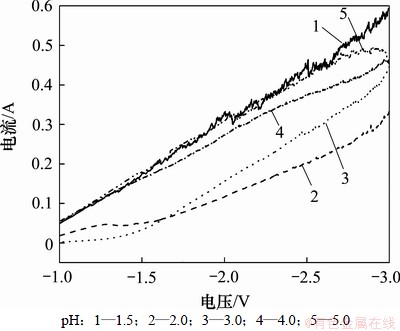
图2 不同pH下的阴极极化曲线
Fig.2 Cathodic polarization curves at different pH values
2.3 镍离子浓度对Ni-金刚石复合镀层质量的影响
图3所示为不同镍离子浓度下的阴极极化曲线。从图3可以看出:当镀液镍离子浓度越高时,在低的过电位下,浓差极化现象越不明显;在高的过电位下,镍沉积电流越大,镍沉积速度越快,当镍离子浓度为1.692 mol/L时,镍沉积电流高达268 mA。然而,当镍离子浓度过高时,镀液的深镀能力和分散能力将降低。因此,在本实验中镀液不宜选用过高的镍离子浓度。
图4所示为镍离子浓度对Ni-金刚石复合镀层表面形貌的影响。从图4可以看出:当镍离子浓度小于1.128 mol/L时,随着镍离子浓度增大,镀层表面变得更加平整细密;当镍离子浓度大于0.564 mol/L时,随着镍离子浓度增大,镀层表面变得更粗糙,且存在微小裂纹,特别是当镍离子浓度为1.692 mol/L时,晶粒呈粗大球状,镀层表面存在明显裂纹,镀液微观分散能力较差。这是由于镍离子云吸附在镀液的金刚石粉体表面,而离子云是粒子永久嵌入镀层的一个重要因素[13];当镍离子浓度较低时,吸附在金刚石粉体表面的镍离子云随镀液中镍离子浓度升高而增大,金刚石粉体表面所带正电荷更多,这促进了金刚石粉体向阴极表面迁移,并随着其表面镍离子云逐渐还原而被嵌入镀层中,金刚石复合量逐渐增大。而之前研究工作发现金刚石粉体为镍电结晶提供形核活性点,促进镍电结晶形核,因此,镀层表面随着镀液镍离子浓度增大而更加平整、致密。当镍离子浓度较高时,一方面,镍电沉积速度加快,而金刚石粉体表面面积有限,吸附的镍离子云随镍离子浓度增大而不发生明显变化,这相对降低了金刚石粉体嵌入镀层的量,使镀层中金刚石复合量相对降低,镍电结晶形核缓慢;另一方面,当镍原子分布在原子云表面时,为减小表面能,原子相互聚集,而原子聚集需要消耗较多的能量,为节省能量,镍原子之间只能以最近的距离相互聚集,在镀液中高浓度镍离子条件下,镍原子和镍原子之间的距离较近,在单位面积内相距最近的镍原子数量比镀液中低浓度镍离子下的数量多,使镍原子之间聚集数量较多,从而产生粗大的晶核,表面较粗糙;反之,在低浓度镍离子下的镀层有较多细小的晶核,表面较为平整、细密[14]。
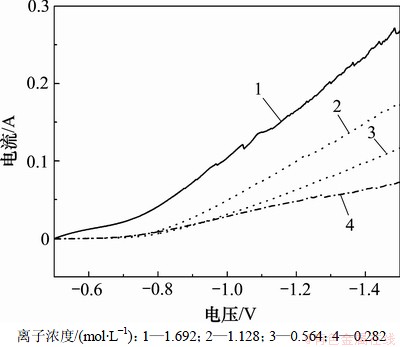
图3 不同镍离子浓度下的阴极极化曲线
Fig.3 Cathodic polarization curves at different Ni2+ concentrations

图4 镍离子浓度对Ni-金刚石复合镀层表面形貌的影响
Fig.4 Surface morphologies of Ni-diamond composite coatings at different Ni2+ concentrations
当镍离子浓度为1.692 mol/L时,电镀21 min后镀层出现明显的裂纹。这是由于当镍离子浓度过高时,镀液分散能力较差,镀层厚度很不均匀,导致镀层内应力增大而出现镀层局部开裂现象。当镍离子浓度为1.128,0.564和0.282 mol/L时,电镀21 min后镀层所对应的显微维氏硬度分别为261.7,303.0和281.0。结合图4可知:这可能与细晶强化有关,晶粒细化能明显提高镀层的显微硬度[13]。因此,选用0.564 mol/L为本实验镍离子浓度,即NiSO4·6H2O质量浓度为132 g/L。
2.4 电流密度对Ni-金刚石复合镀层质量的影响
图5所示为电流密度对Ni-金刚石复合镀层表面形貌的影响。从图5可以看出:当阴极电流密度为4 A/dm2时,镀层最平整、致密,且晶粒大小均匀;随着电流密度增大,镀层变得更粗糙,且晶粒更粗大;当阴极电流密度为3 A/dm2时,镀层晶粒虽较小,但很不均匀。同时,在低倍扫描电镜下观察复合镀层表面形貌时,发现随着电流密度增大,镀层表面嵌入的金刚石量相应增大,镀层更厚。根据Walter等[15]提出的两步吸附机理可知:惰性粒子主要通过前期弱物理吸附和后续化学吸附嵌入复合镀层中,此过程非电化学反应,受阴极电流密度影响较小[16]。在本实验中,当阴极电流密度小于5 A/dm2时,电流密度越大,镍电沉积越快,在单位时间内金刚石粉体嵌入量越多,促进镍电结晶形核,细化镀层晶粒;当阴极电流密度大于4 A/dm2时,金刚石粉体受电流密度影响较小,被嵌入镀层速度远远小于镍电沉积速度,且金刚石粉体吸附在阴极表面,减小阴极实际面积,增大真实阴极电流密度,提高过电位,增加H2析出量,不利于金刚石粉体吸附,从而进一步降低镀层金刚石粉体复合量,使镀层晶粒粗大,表面不平整。
图6所示为阴极电流密度对Ni-金刚石复合镀层显微硬度的影响。从图6可以看出:复合镀层的显微硬度随阴极电流密度增大先增加后逐渐减小,复合镀层的显微硬度最大值和最小值对应的阴极电流密度值分别为4 A/dm2和6 A/dm2。事实上,复合镀层的显微硬度主要取决于2个因素,分别为嵌入镀层微粒的复合量和沉积金属基质的显微硬度[17],可见,嵌入镀层的微粒复合量越高,沉积金属基质表面越平整,复合镀层的显微硬度较高。结合图5可知:当阴极电流密度为4 A/dm2时,镀层表面较平整,金刚石复合量较高,使镀层显微硬度最高。阴极电流密度越大,镀层表面越粗糙,金刚石复合量越低,使镀层显微硬度逐渐降低;因此,选用4 A/dm2为本实验的阴极电流密度。

图5 阴极电流密度对Ni-金刚石复合镀层表面形貌的影响
Fig.5 Surface morphologies of Ni-diamond composite coatings at different cathodic current densities
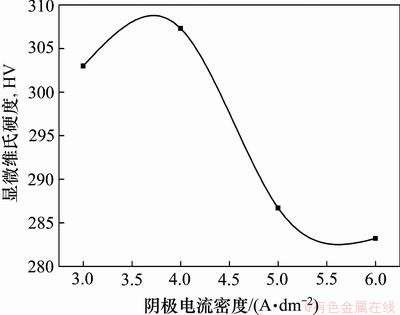
图6 阴极电流密度对Ni-金刚石复合镀层显微硬度的影响
Fig.6 Micro-hardness of Ni-diamond composite coatings at different cathodic current densities
2.5 金刚石质量浓度对Ni-金刚石复合镀层质量的影响
图7所示为不同金刚石粉体浓度下的阴极极化曲线。从图7可以看出:当金刚石粉体质量浓度低于50 g/L时,随着粉体浓度升高,阴极还原电位较正,还原电流较高,极化较小;当金刚石粉体质量浓度高于30 g/L时,阴极还原电位反而更负,还原电流更小。镀液中的部分离子物理或化学吸附在粉体表面,使粉体表面处于带电状态[18]。同理,大量的镍离子也吸附在金刚石粉体表面,随着金刚石粉体吸附阴极表面而发生还原,金刚石粉体质量浓度越高,吸附的镍离子越多,镍沉积越快,使还原电流升高;当金刚石粉体质量浓度过高时,镀液中的惰性粒子为降低表面自由能而发生团聚,且高浓度下的惰性粒子很难均匀混合并保持悬浮状态[5],吸附阴极表面的金刚石粉体量降低,被输送至阴极表面的镍离子量减小,镍沉积较慢,使还原电流降低。
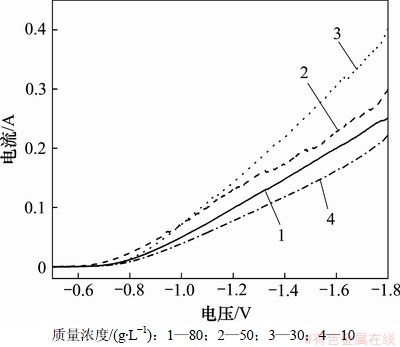
图7 不同金刚石质量浓度的阴极极化曲线
Fig.7 Cathodic polarization curves at different diamond concentrations
图8所示为金刚石粉体浓度对Ni-金刚石复合镀层表面形貌的影响。从图8可以看出:当金刚石粉体质量浓度低于50 g/L时,镀层表面平整,晶粒细小均匀;当金刚石粉体质量浓度高于30 g/L时,随着金刚石粉体质量浓度增大,镀层较粗且呈锥状。在低倍扫描电镜下观察复合镀层表面时,发现金刚石粉体复合量随镀液金刚石粉体质量浓度升高而明显增大,直至当粉体质量浓度为50 g/L时,其复合量没有明显增大,且分布不均匀;当粉体质量浓度为80 g/L时,金刚石粉体复合量反而降低。这符合Guglielmi的两步吸附理论:在镀液中,粉体质量浓度越高,被输送至阴极表面并被嵌入镀层的粉体越多,使复合镀层中粉体复合量增大,而过高质量浓度下的粉体由于团聚作用反而降低粉体复合量[19]。在本实验中,当金刚石粉体质量浓度大于50 g/L时发生团聚现象,粉体复合量降低,阴极表面形核活性点减少,镍电结晶形核缓慢,使镀层晶粒粗化。
图9所示为金刚石粉体浓度对Ni-金刚石复合镀层显微硬度的影响。从图9可以看出:复合镀层的显微硬度随金刚石粉体浓度增大先增加后逐渐减小,复合镀层的显微硬度最大值和最小值对应的金刚石粉体质量浓度分别为30 g/L和10 g/L。可见:当金刚石粉体质量浓度过高或过低时,金刚石复合量均较小,复合镀层的显微硬度较低。因此,选用30 g/L为本实验的金刚石粉体质量浓度。
2.6 镀层结构分析
图10所示为纯Ni镀层和Ni-金刚石复合镀层的XRD图谱。工艺条件为:电镀温度(50±1) ℃, 镀液pH 3~4, 镍离子浓度0.564 mol/L,电流密度4 A/dm2,金刚石粉体质量浓度30 g/L。从图10可以看出:纯Ni镀层中仅含有镍金属基质,且在(111)和(200)晶面上有强烈的衍射峰;在Ni-金刚石复合镀层中,金刚石粉体主要沉积在(111)晶面上,镍在(200)晶面上衍射峰强度明显下降,(111)和(200)晶面上的衍射峰强比明显大于纯Ni镀层中这两晶面上的衍射峰强比,表明金刚石粉体改变镍的生长方向,镍主要在(111)晶面上择优生长。根据Scherrer公式[20]:

图8 金刚石质量浓度对Ni-金刚石复合镀层表面形貌的影响
Fig.8 Surface morphologies of Ni-diamond composite coatings at different diamond concentrations
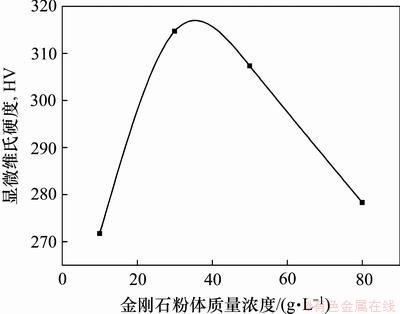
图9 金刚石粉体浓度对Ni-金刚石复合镀层显微硬度的影响
Fig.9 Micro-hardness of Ni-diamond composite coatings at different diamond concentrations
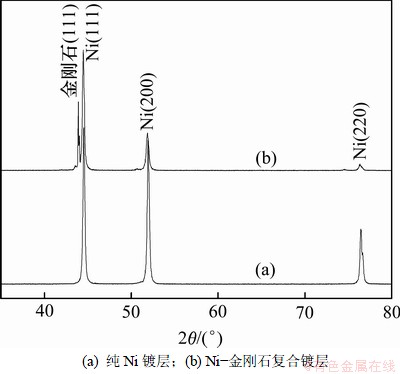
图10 纯Ni镀层和Ni-金刚石复合镀层的XRD谱
Fig.10 XRD patterns of pure Ni coating and Ni-diamond composite coating
 (1)
(1)
式中:D为晶粒尺寸,nm;K为Scherrer常数,其值为0.9;l为X线(Cu Kα1)波长,其值为0.154 18 nm;b为衍射峰的半峰高宽,rad;q为布拉格衍射角,(°)。计算得到纯Ni镀层和Ni-金刚石复合镀层的晶粒尺寸分别为30.606 nm和24.502 nm,表明金刚石粉体为镍的电沉积提供了更多的形核点,阻碍晶粒生长,使Ni-金刚石复合镀层的晶粒明显细化。同时,Ni-金刚石复合镀层中金刚石粉体的质量分数为62.7%。
3 结论
(1) 对Ni-diamond复合镀的各影响因素进行研究,获得了表面平整、晶粒细小均匀且金刚石粉体质量分数为62.7%的Ni-diamond复合镀层,优化的工艺条件如下:NiSO4·6H2O 132 g/L,NiCl2 15 g/L,H3BO3 30 g/L,镀液温度(50±1) ℃,pH 3~4,阴极电流密度4 A/dm2,金刚石粉体质量浓度30 g/L。
(2) 金刚石粉体为镍的电沉积提供了更多的形核点,阻碍晶粒生长,改变了镍电结晶生长方向。与纯Ni镀层相比,Ni-金刚石复合镀层的晶粒明显细化,晶粒粒径为24.502 nm。
参考文献:
[1] 郭鹤桐, 张三元. 复合电镀技术[M]. 北京: 化学工业出版社, 2007: 94-119.
GUO Hetong, ZHANG Sanyuan. Composite plating technology[M]. Beijing: Chemical Industry Press, 2007: 94-119.
[2] Kang M, Kim J M, Kim J W, et al. Simple and fast micro wave-enhanced wet etching of SiC particles for electroless Ni-P plating[J]. Surface and Coatings Technology, 2002, 161(1): 79-85.
[3] Zhao Q, Liu Y, Muller-Steinhagen H, et al. Graded Ni-P-PTFE coatings and their potential applications[J]. Surface and Coatings Technology, 2002, 155(2/3): 279-284.
[4] Low C T J, Wills R G A, Walsh F C. Electrodeposition of composite coatings containing nanoparticles in a metal deposit[J]. Surface & Coatings Technology, 2006, 201(1/2): 371-383.
[5] Ger M D. Electrochemical deposition of nickel/SiC composites in the presence of surfactants[J]. Materials Chemistry and Physics, 2004, 87(1): 67-74.
[6] Garcia I, Fransaer J, Celis J P. Electrodeposition and sliding wear resistance of nickel composite coatings containing micron and submicron SiC particles[J]. Surface and Coatings Technology, 2001, 148(2/3): 171-178.
[7] Wang S C, Wei W C J. Kinetics of electroplating process of nano-sized ceramic particle/Ni composite[J]. Materials Chemistry and Physics, 2003, 78(3): 574-580.
[8] Burkat G K , Fujimura T , Dolmatov V Y , et al. Preparation of composite electrochemical nickel-diamond and iron-diamond coatings in the presence of detonation synthesis nanodiamonds [J]. Diamond & Related Materials, 2005, 14(11/12): 1761-1764.
[9] 向波, 贺跃辉, 谢志刚, 等. 电镀金刚石线锯的研究现状[J]. 材料导报, 2007, 21(8): 25-29.
XIANG Bo, HE Yuehui, XIE Zhigang, et al. Research progress in electroplated diamond wire saw[J]. Materials Reviews, 2007, 21(8): 25-29.
[10] WANG Ping, CHENG Yingliang, ZHANG Zhao. A study on the electrocodeposition processes and properties of Ni-SiC nanocomposite coatings[J]. Journal of Coatings Technology, 2011, 8(3): 409-417.
[11] Surrender M, Balasubramania R, Basu B. Electrochemical behavior of electrodeposited Ni-WC composite coatings[J]. Surface & Coatings Technology, 2004, 187(1): 93-97.
[12] 楚广, 刘生长. 新型Ni-Cu复合镀层的制备[J]. 中南大学学报: 自然科学版, 2007, 38(3): 474-479.
CHU Guang, LIU Shengzhang. Preparation of Ni-Cu composite coating by composite electroplating[J]. Journal of Central South University: Science and Technology, 2007, 38(3): 474-479.
[13] Rudnik E, Burzynska L, Gut M. The effect of Cs+ ions on codeposition of SiC particles with nickel[J]. Materials Chemistry and Physics, 2011, 126(3): 573-579.
[14] Grujicic D, Pesic B. Electrodeposition of copper: The nucleation mechanisms[J]. Electrochimica Acta, 2002, 47(18): 2901-2912.
[15] Walter E C, Zach M P, Favier F, et al. Metal nanowire arrays by electrodeposition[J]. Chem Phys Chem, 2003, 4(2): 131-138.
[16] NIU Zhaoxia, CAO Fahe, WANG Wei, et al. Electrodeposition of Ni-SiC nanocomposite film[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(1): 9-15.
[17] Chen Li, Wang Liping, Zeng Zhixiang, et al. Effect of surfactant on the electrodeposition and wear resistance of Ni-Al2O3 composite coatings[J]. Materials Science and Engineering, 2006, 434(1/2): 319-325.
[18] Lee H K, Lee H Y, Jeon J M. Codeposition of micro- and nano-sized SiC particles in the nickel matrix composite coatings obtained by electroplating[J]. Surface & Coatings Technology, 2007, 201(8): 4711-4717.
[19] Vaezi M R, Sadrnezhaad S K, Nikzad L. Electrodeposition of Ni-SiC nano-composite coatings and evaluation wear and corrosion resistance and electroplating characteristics[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 315(1/2/3): 176-182.
[20] 范雄. X射线金属学[M]. 北京: 机械工业出版社, 1989: 103.
FAN Xiong. X-ray diffraction of metals[M]. Beijing: Press of Mechanical Industry, 1989: 103.
(编辑 何运斌)
收稿日期:2012-06-04;修回日期:2012-09-14
基金项目:国家军品配套项目(JPPT-125-GH-039)
通信作者:王日初(1965-),男,广东河源人,博士,教授,从事海水电池和复合镀材料等研究;电话:0731-88836638;E-mail: wrc910103@163.com
摘要:通过复合电镀方法,在镀镍液中加入粒径为40 μm的金刚石粉体制备Ni-金刚石复合镀层。采用阴极动电位极化方法、扫描电镜和显微硬度计探讨镀液温度、pH、镍离子浓度、电流密度和金刚石粉体质量浓度对镀层质量的影响,优化Ni-金刚石复合镀的工艺参数;采用X线衍射分析仪表征优化后复合镀层的结构。研究结果表明:优化的镀液组成和工艺参数为:NiSO4·6H2O 132 g/L,NiCl2 15 g/L,H3BO3 30 g/L,镀液温度(50±1) ℃,pH 3~4,阴极电流密度4 A/dm2,金刚石粉体质量浓度30 g/L;优化后的复合镀层表面平整,晶粒细小均匀,且金刚石粉体的质量分数为62.7%;与纯Ni镀层的晶粒相比,Ni-金刚石复合镀层的晶粒明显细化。


