骨炭去除水中砷(Ⅴ)的试验研究
陈云嫩,柴立元,舒余德
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
摘 要:采用骨炭作吸附剂,通过静态和动态吸附试验,研究饮用水中砷(Ⅴ)去除的效果及其影响因素,以及骨炭反复吸附—解吸—再生—再吸附后骨炭性能的稳定性。研究结果表明:在pH=10,吸附时间为30 min和骨炭加入量为0.6 g/L,饮用水砷初始质量浓度为0.5 mg/L时其砷去除率可达95.2%;骨炭吸附砷的行为同时符合Langmuir和Freundlich等温吸附模型;其吸附机理可能是Ca—OH官能团结合![]() 阴离子,并产生砷酸氢钙和羟基磷灰石的共沉淀,另外还存在离子交换作用;吸附柱的饱和吸附容量为4.688 mg/g;出水砷浓度符合世界卫生组织(WHO)规定饮水砷标准(0.01 mg/L)。
阴离子,并产生砷酸氢钙和羟基磷灰石的共沉淀,另外还存在离子交换作用;吸附柱的饱和吸附容量为4.688 mg/g;出水砷浓度符合世界卫生组织(WHO)规定饮水砷标准(0.01 mg/L)。
关键词:
中图分类号:X703 文献标识码:A 文章编号:1672-7207(2008)02-0279-05
Arsenic(V) removal from drinking water by bone har
CHEN Yun-nen, CHAI Li-yuan, SHU Yu-de
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The affecting factors of removal of arsenate (As(Ⅴ)) by bone char were studied in batch and column experiments. The results show that the performance of bone char adsorbing As(Ⅴ) from drinking water is stable after adsorption—desorption—regeneration—re-adsorption cycles. When pH is 10, adsorption time is 30 min, dosage of bone char is 0.6 g/L, the original concentration of As(Ⅴ) in drinking water is 0.5 mg/L, As(Ⅴ) removal can reach 95.2%. The adsorption behavior is fitted both with Langmuir and Freundlich isotherm. The adsorption mechanism is supposed to be Ca—OH functional groups combined with ![]() anion. And there may occur the co-precipitation between calcium hydrogen arsenate and hydroxylapatite in the aqueous solution, and ions also exchange. The saturation adsorption capacity of As(Ⅴ) reaches 4.688 mg/g. Indexes of effluent are in good agreement with the WHO stringent drinking water standards (0.01 mg/L).
anion. And there may occur the co-precipitation between calcium hydrogen arsenate and hydroxylapatite in the aqueous solution, and ions also exchange. The saturation adsorption capacity of As(Ⅴ) reaches 4.688 mg/g. Indexes of effluent are in good agreement with the WHO stringent drinking water standards (0.01 mg/L).
Key words: arsenic; adsorption; bone char; drinking water; ion exchange
砷的化合物是一种具有类金属特性的原生质毒物,具有广泛的生物效应,已被美国疾病控制中心和国际防癌研究机构确定为第1类致癌物[1]。近年来,随着矿冶、陶瓷、皮革、农药等行业的快速发展,地下水环境中砷的污染日益严重。据调查,国外如智利、阿根廷、墨西哥、德国、印度、日本、匈牙利、罗马尼亚、美国等均有地砷病的报道[2]。我国饮用高砷 水的地区除了台湾西南沿海以外,还有新疆、内蒙古、山西等10个省(自治区),且多数分布在农村贫困地 区[3]。为了改善饮用水的水质,防止饮水型砷中 毒,开发高砷水的廉价高效处理技术显得非常重要。
一般采用离子交换、吸附[4]以及共沉淀等技术用于高砷水的处理。其中采用共沉淀技术时,其工艺简单且成本较低,但难以达到越来越严格的饮水砷标准,同时还产生大量污泥[5]。而吸附技术以其易于操作、无污泥产生、可再生等优势而越来越受到重视。活性炭是传统的有机物和重金属吸附剂[6-7],但是,其成本较高,且对高砷水的处理效果欠佳[8]。骨炭广泛用于蔗糖的脱色[9]和脱氟剂[10]的研究,而用于高砷水的处理的研究较少。在此,本文作者对用骨炭处理高砷水的优化条件以及机理进行研究。
1 材料和方法
1.1 试验材料及分析方法
试验所用骨炭由中国四川某生化有限公司提供。分别以海藻酸钠和聚乙烯醇(PVA)为包埋材料, 饱和硼酸和氯化钙为交联剂,并加入少量氧化硅和碳酸钙,将骨炭制成粒径为3 mm 左右的骨炭小球[11]。
试验所用试剂均为分析纯。将1 g/L砷酸三钠储备液置于聚乙烯瓶中保存,高砷饮用水由自来水加一定砷酸三钠标准溶液配制而成。
试验采用0.1 mol/L H2SO4溶液或饱和Ca(OH)2 溶液调整pH值。
采用国家标准分析方法即二乙基二硫代氨基甲酸银分光光度法[12]测定As5+浓度。
1.2 静态试验
在容量为1 L的烧杯中加入调整好 pH值的一定浓度含砷溶液500 mL及一定量的骨炭小球,在磁力搅拌器上搅拌一定时间后静置,过滤,在上清液取样分析。每1个试验均平行做3次,并取平均值。试验均在室温((28±2) ℃))完成。
1.3 动态试验
将骨炭小球填充于内径为40 mm、高度为480 mm的玻璃柱中,调整好pH值并且有一定浓度的含砷溶液以一定流速由上而下连续通过玻璃柱。间隔一定时间采样分析溶液含砷量。待溶液穿透后,分别采用H3PO4 溶液和Ca(OH)2溶液进行解吸、再生。
2 结果与讨论
2.1 吸附时间对As(Ⅴ)去除率的影响
吸附时间对骨炭吸附As(Ⅴ)的影响见图1。在骨炭加入量为0.6 g/L时,对于初始浓度不同的As(Ⅴ),在反应前30 min,吸附速度都比较快,而后随着时间延长,其吸附速度变小。在pH 值为10,以及在吸附过程前30 min,As(Ⅴ)初始浓度ρ0为0.5,1.0和1.5 mg/L时,As(Ⅴ)去除率分别达到95.20%,86.74%和83.80%。
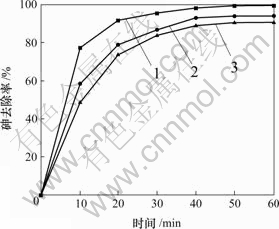
ρ0/(mg?L-1): 1—0.5; 2—1.0; 3—1.5
图 1 吸附时间对骨炭吸附砷的影响
Fig.1 Effect of contact time on adsorption of As(Ⅴ) on bone char
运用试验结果研究吸附速率控制步骤。吸附速率常数(kad)由一级反应决定[13]:

其中:qe和qt分别为骨炭对As(Ⅴ)的平衡吸附容量和吸附容量,mg/g;kad为速率常数,min-1。由lg(qe-qt) 对时间的直线斜率(见图2)可以计算出kad为0.14 min-1,而且该值与As(Ⅴ)初始质量浓度无关。
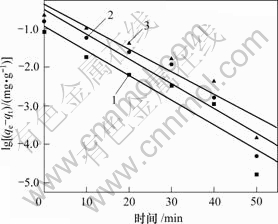
ρ0/(mg?L-1): 1—0.5; 2—1.0; 3—1.5
图 2 骨炭吸附砷的吸附速率常数
Fig.2 Velocity constant plot for adsorption of As(Ⅴ) on bone char
2.2 pH值对As(V)去除率的影响
图3所示为初始pH值对骨炭吸附As(Ⅴ)的影响。可见,在骨炭加入量为0.6 g/L时,随着pH值的升高,不同初始浓度的As(Ⅴ)去除率都快速增大。且当pH值达到10以后,去除率达到最大,再增大pH值,其去除率基本保持不变,那是由于初始pH值决定了As(Ⅴ)在溶液中的存在形态。而且在吸附反应结束后,溶液pH值稍微提高,说明可能存在离子交换作用,导致OH-被置换。在pH值相同时,随着As(Ⅴ)初始浓度的增大,其去除率下降。
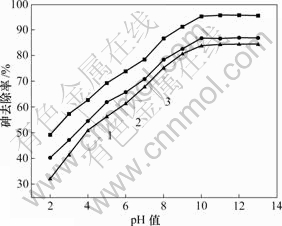
ρ0/(mg?L-1): 1—0.5; 2—1.0; 3—1.5
图 3 初始 pH 值对骨炭吸附砷的影响
Fig.3 Effect of pH value on adsorption of As(Ⅴ) on bone char
2.3 吸附等温线
根据吸附等温线确定骨炭对As(Ⅴ)最大吸附容量。在常温、溶液初始pH值为10、骨炭加入量为0.6 g/L时,分别吸附初始质量浓度为0.1~5 mg/L 的含As(Ⅴ)
溶液,结果如图4所示。可见,随着As(Ⅴ) 初始浓度的升高,骨炭对As(Ⅴ)的吸附容量增加。但As(Ⅴ)的去除率随着As(Ⅴ)初始浓度的升高而降低,这主要是由于:在较高As(Ⅴ)初始质量浓度下,骨炭对As(Ⅴ)的吸附位点达到饱和而无法进一步吸附As(Ⅴ)。
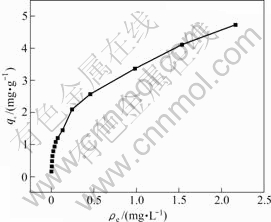
图 4 骨炭对砷吸附容量的影响
Fig.4 Effect of adsorption capacity of As(Ⅴ) on bone char
通常采用Langmuir 和 Freundlich 等温吸附模型分析吸附容量。其中Langmuir用于评估As(Ⅴ)不同初始浓度下的最大吸附量:

它反映了骨炭对As(Ⅴ)的亲和力。由图5可以看出,ρe/qe对ρe的直线相关系数R2=0.983,表明骨炭对As(Ⅴ)的吸附符合Langmuir等温吸附模型。据直线的斜率以及截距可以得到qm和k分别为4.709 7 mg/g和0.181 L/mg。
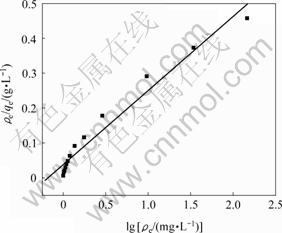
图 5 骨炭吸附As(Ⅴ)的Langmuir模型
Fig.5 Langmuir model for As(Ⅴ) adsorption on bone char
另一方面,Freundlich 等温模型可以描述为:
![]() 。 (3)
。 (3)
式中:Kf和n都是与影响吸附过程各因素有关的经验常数。lg qe对lg ρe的直线(图6)相关系数R2=0.995,表明骨炭对As(Ⅴ)吸附的同时还符合Freundlich等温吸附模型。从直线的截距以及斜率可以得到Kf和1/n分别为3.61和0.43。
2.4 吸附机理
傅里叶变换红外光谱(FTIR)分析是鉴定物质官能团的一个重要工具。官能团的分类、相互作用甚至官能团的方向定位,其相关信息都可以从图谱上得到反映[14]。图7显示了吸附剂骨炭吸附As(Ⅴ)前后的光谱变化情况。骨炭吸附As(Ⅴ)前后的谱线中都有3 570 cm-1的吸附带,那是氢键缔合O—H的伸缩振动区域, 也是羟基磷灰石的典型吸收带[15-16]。
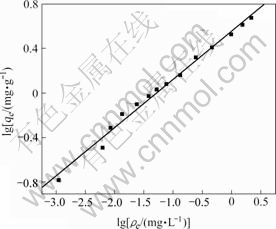
图 6 骨炭吸附砷的Freundlich模型
Fig.6 Freundlich model for adsorption of As(Ⅴ) on bone char
另外,pH值为8~11时砷的主要存在形态[17]为![]() ,正好与附着于骨炭的阳离子Ca—OH相互结合。从光谱图(图7)可以看出,骨炭吸附砷后在876 cm-1处的峰值明显高于吸附砷前的峰值。此时,骨炭作为一个框架固定了Ca—OH,进而固定
,正好与附着于骨炭的阳离子Ca—OH相互结合。从光谱图(图7)可以看出,骨炭吸附砷后在876 cm-1处的峰值明显高于吸附砷前的峰值。此时,骨炭作为一个框架固定了Ca—OH,进而固定![]() ,从而产生砷酸氢钙及羟基磷灰石的共沉淀作用,以去除溶液中的砷。
,从而产生砷酸氢钙及羟基磷灰石的共沉淀作用,以去除溶液中的砷。
图7所示的2条光谱线中,波数从3 650~3 584 cm-1的吸附窄峰是游离的O—H[18]。骨炭吸附As(Ⅴ) 之后,光谱线从3 650 cm-1向3 640 cm-1位移,而且吸附带强度增加,其原因是出现了阴离子交换作用,使Ca—OH中的OH被游离出来,从而导致溶液pH值升高。而且氢氧化钙水溶液的pH值在9~13范围内会产生Ca—OH等水溶性官能团,而这种官能团对磷灰石的成核作用非常关键,它有利于使磷灰石附着于骨炭表面。
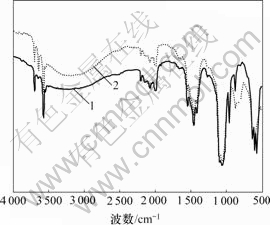
1—骨炭;2—骨炭-砷
图 7 骨炭吸附砷前后的傅里叶红外变换光谱图
Fig.7 FTIR spectra of bone char adsorbent before and after As(Ⅴ) adsorption
吸附反应为:
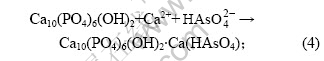
离子交换反应为:
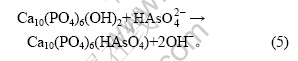
2.5 动态吸附试验结果
初始质量浓度为0.5 mg/L的含砷溶液以30 mL/min的流速自上而下连续流入装有480 g骨炭小球的玻璃柱中。从图8所示的穿透曲线可以看到,开始时,溶液砷的去除率几乎达到100%,直至穿透点(溶液含砷0.01 mg/L)时经过柱子的含砷溶液量为176.4 L。经计算得骨炭对砷的饱和吸附容量为4.688 mg/g。
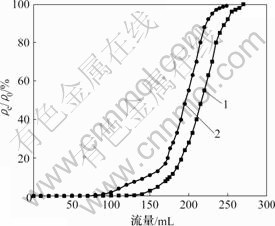
1—原始骨炭小球;
2—经过3次吸附-解吸-再生循环的骨炭小球
图 8 下流式骨炭吸附砷及解吸-再生试验
Fig.8 Column experiment for removal of As(V) by bone char
达到完全饱和状态(ρe/ρ0=1,总体积为270 L) 后,采用0.1 mol/L H3PO4溶液以50 mL/min 流速流经柱子进行解吸,然后,用自来水洗涤玻璃柱。而后加入饱和Ca(OH)2 溶液以0.5 mL/min流速流经玻璃柱使骨炭小球再生。再生骨炭小球再按照上述工艺吸附含砷溶液。经过3次吸附—解吸—再生循环后,得到第4次穿透曲线(见图8)。经过3次循环后,骨炭对砷的吸附容量为4.03 mg/g。
3 结 论
a. 采用骨炭作为饮用水砷的吸附剂,在pH=10,吸附时间为30 min,骨炭加入量为0.6 g/L时,砷初始质量浓度为0.5 mg/L的饮用水其砷去除率可达95.2%。而且骨炭吸附砷的行为同时符合Langmuir 和 Freundlich等温吸附模型。
b. 动态吸附—解吸—再生—再吸附试验结果表明,骨炭对砷的饱和吸附容量为4.688 mg/g,3次循环后其吸附容量为饱和吸附容量的86%。说明骨炭是一种快速、高效、稳定的饮用水除砷剂。
参考文献:
[1] Jeffer A L, Robert F S, Christopher T D. Environmental toxicants[M]. New York: National Academics Press, 1993: 77.
[2] Norwood W P, Borgmann U, Dixon D G. Chronic toxicity of arsenic, cobalt, chromium and manganese to Hyalella azteca in relation to exposure and bioaccumulation[J]. Environmental Pollution,2007, 147(1): 262-272.
[3] Guo X J, Fujino Y, Kaneko S, et al. Arsenic contamination of groundwater and prevalence of arsenical dermatosis in the Hetao plain area, Inner Mongolia, China[J]. Molecular and Cellular Biochemistry, 2001, 222(2): 137-140.
[4] Ghurye G L, Clifford D A, Tripp A R. Combined arsenic and nitrate removal by ion exchange[J]. Am Water Works Assoc, 1999, 91(10): 85-96.
[5] Gregor J. Arsenic removal during conventional aluminium-based drinking water treatment[J]. Water Res, 2001, 35(7): 1659-1664.
[6] Wu F C, Tseng R L, Juang R S. Comparisons of porous and adsorption properties of carbons activated by steam and KOH[J]. Colloid Interface Sci, 2005, 283(2): 49-56.
[7] Nasiruddin K M, Farooq W M. Characterization of chemically modified corncobs and its application in the removal of metal ions from aqueous solution[J].Hazardous Materials, 2007, 141(1): 237-244.
[8] Pattanayak J, Mondal K, Mathew S, et al. A parametric evaluation of the removal of As(Ⅴ) and As(Ⅲ) by carbon-based adsorbents[J]. Carbon, 2000, 38(4): 589-596.
[9] Abdel K A, Aly A N H, Girgis B S. Bone char decolorization efficiency: A laboratory study over four consecutive cycles[J]. Int Sugar, 1996, 98: 546-548.
[10] 王云波, 谭万春, 王晓昌, 等. 沸石、骨炭、活性氧化铝除氟效果研究[J]. 西安建筑科技大学学报: 自然科学版, 2002, 34(4): 325-328.
WANG Yun-bo, TAN Wan-chun, WANG Xiao-chang, et al. A study on the effect of fluoride removal by activated zeolite, activated alumina and bone char[J]. Xi’an Univ of Arch and Tech: Natural Science Edition, 2002, 34(4): 325-328.
[11] 夏金兰, 申 丽, 何 环, 等. 游离和固定化Synechococcus sp.细胞对铬(Ⅵ)生物吸附性能的比较研究[J]. 中南大学学报: 自然科学版, 2006, 37(2): 241-246.
XIA Jin-lan, SHEN Li, HE Huan, et al. Comparative study on biosorption of Cr(Ⅵ) by free and immobilized cells of Synechococcus sp. [J]. Journal of Central South University: Science and Technology, 2006, 37(2): 241-246.
[12] GB 7485—87, 水质—总砷的测定—二乙基二硫代氨基甲酸银分光光度法[S].
GB 7485—87, Water quality—determination of total arsenic—silver diethyldithiocarbamate spectrophotometric method[S].
[13] Weng C H, Tsai C Z, Chu S H, et al. Adsorption characteristics of copper(Ⅱ) onto spent activated clay[J].Separation and Purification Technology,2007, 54(2): 187-197.
[14] Sun X H, Doner H E. An investigation of arsenate and arsenite bonding structures on goethite by FTIR[J]. Soil Sci, 1996, 161(12): 865-872.
[15] 吴瑾光. 近代傅里叶变换红外光谱技术及应用: 上卷[M]. 北京: 科学技术文献出版社, 1994: 35.
WU Jin-guang. Modern FTIR technology and application: 1st Volume[M]. Beijing: Science and Technology Literature Press, 1994: 35.
[16] Mikhaylova Y, Adam G, H?ussler L, et al. Temperature- dependent FTIR spectroscopic and thermoanalytic studies of hydrogen bonding of hydroxyl (phenolic group) terminated hyperbranched aromatic polyesters[J]. Molecular Structure,2006, 788(1/3): 80-88.
[17] de Souza S V C, Pinto C T, Junqueira R G. In-house method validation: Application in arsenic analysis[J].Food Composition and Analysis, 2007, 20(3/4): 241-247.
[18] Takadama H, Kim H M, Miyaji F, et al. Mechanism of apatite formation induced by silanol groups: TEM observation[J]. Ceram Soc Jpn, 2000, 108(3): 118-121.
收稿日期:2007-06-21;修回日期:2007-08-29
基金项目:国家自然科学基金资助项目(50508044)
通信作者:陈云嫩(1970-),女,江西泰和人,博士研究生,副教授,从事重金属废水处理研究;电话:0797-8312140;E-mail: cyn70yellow@yahoo.com.cn


