文章编号:1004-0609(2010)07-1412-06
硅纳米颗粒的表面改性及生物应用
赵颜忠1, 2,余智萍2,朱晒红2,周建大2,黄艳艳2,王国慧2,黄 东2,周科朝1
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;
2. 中南大学 湘雅三医院,长沙 410013)
摘 要:
以正硅酸乙酯为原料,通过添加氨基化试剂和钌吡啶配合物水溶液,采用油包水制备硅纳米颗粒、表面改性的硅纳米颗粒和荧光硅纳米颗粒。通过电镜检测到纳米颗粒的粒径约为40 nm;在中性pH条件下,Zeta电位仪检测表面改性的硅纳米颗粒的净正电荷约为16 mV;细胞内吞实验和体外毒性实验表明,荧光颗粒可被细胞吞噬,对细胞的生长无明显影响;与DNA的结合试验发现,氨基化硅纳米颗粒能与质粒DNA有效结合,复合后能有效地抵抗血清或DNase I的降解;细胞转染实验表明,颗粒有效地将绿色荧光蛋白(GFP)基因转染到HT1080细胞和Hela细胞内,并高效表达。
关键词:
中图分类号:TB 39 文献标志码:A
Surface modification and biomedical application of silica nanoparticles
ZHAO Yan-zhong1,2, YU Zhi-ping2, ZHU Shai-hong2, ZHOU Jian-da2, HUANG Yan-yan2,
WANG Guo-hui2, HUANG Dong2, ZHOU Ke-chao1
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;
2. The Third Xiangya Hospital, Central South University, Changsha 410013, China)
Abstract: Silica nanoparticles, amino-terminated silica nanoparticles and fluorescent silica nanoparticles were prepared respectively via the formation of hydrolysis of tetraethyl orthosilicate (TEOS) with the synchronous modification of amino functional group in water-in-oil microemulsion. The diameter of the prepared nanoparticles was tested to be 40 nm through TEM analysis, and Zeta potential of the silica nanoparticles surface modified was tested to be 16 mV with zeta potentioneter under the condition of neutral pH value. Agarose gel electrophoresis photos indicate that the amino- terminated silica nanoparticles can bind effectively with DNA molecule, and moreover, nanoparticles-DNA complexes formed could resist digestion of DNase in the serum. The tests of cell by microscopy show that the most of nanoparticles can enter the cells when fluorescence nanoparticles are cultured with live HT1080 cells. Toxicity experiments in vitro indicate that there is no significant influence silica nanoparticles when they are cultured with normal cells. Finally, transfection tests of silica nanoparticles in the cultured cells reveal that plasmid DNA (pEGFP-N1_green fluorescence protein) can obtain expression with certain efficiency when the complexes formed with silica nanoparticles modified and DNA (pEGFP-N1) are cultured with Hela cells.
Key words: silica nanoparticle; gene vector; cell transfection; gene therapy; surface modification
目前,限制基因治疗的关键技术是基因治疗的载体和转移基因的受控表达[1],其中基因治疗新载体的研究和发现是研究基因治疗的核心问题[2]。随着近几年来纳米生物技术的出现和不断发展,因纳米颗粒本身特有的性质(如表面效应、小尺寸效应、宏观量子隧道效应等),以纳米颗粒(如硅纳米颗粒)作为非病毒型的基因转移载体已成为目前的研究热点[3-5],提高纳米颗粒的DNA转化效率是其研究重点。DAN和MARK[6]使用生物相容性良好的硅纳米颗粒和脂质体混和与DNA一起进行基因转移,发现其转染效率比单纯用脂质体转染高8倍;CARSTEN等[7]用二价阳离子修饰硅纳米颗粒表面,发现其能与DNA结合,结合在颗粒上的DNA能抵抗DNase的作用[7];CHEN等[8]用NaI、NaCL修饰硅纳米颗粒后其也有一定的转移DNA的能力。这些研究显示,硅纳米颗粒具有作为基因转移载体的能力。但硅纳米颗粒作为基因转移载体仍存在转染效率低、无细胞特异性和体内靶向性等非病毒型载体共同的缺点。
本文作者利用化学方法制备表面富含氨基的改性硅纳米颗粒(SiNP)和荧光硅纳米颗粒,并将其与DNA结合形成复合体,对体外转染HT1080细胞和Hela细胞的可行性进行研究。
1 实验
正硅酸乙酯、N-(β-氨乙基)-γ-氨丙基三乙氧基硅烷、钌吡啶配合物、琼脂糖,购自Sigma 公司;分析纯的环已烷、正己醇、丙酮、浓氨水,均为国产;纯小牛血清、胎牛血清,为杭州四季青公司产品;其它试剂,均为市购。细胞株HT1080 和Hela,购自中国典型培养物保藏中心(中国武汉)。昆明种小白鼠,由中南大学实验动物学部提供(湖南省医学实验动物管理委员会颁发的医学实验动物合格证书:小白鼠昆明种,医动字第024号)。
按比例将环己烷、水及正硅酸乙酯混合,添加适量的氨水,室温反应24 h,反应产物以10 000 r/min离心10 min,用丙酮洗脱,真空抽干。取适量纳米颗粒,用去离子水重悬、超声分散、高压蒸气灭菌。
采用文献[9-10]报道的油包水的微乳液方法将环己烷、表面活性剂TritonX-100和正己醇按一定的体积比混合均匀, 以适量的水作为分散剂,磁力搅拌 1 h,然后以一定比例加入正硅酸乙酯、N-(β-氨乙基)-γ-氨丙基三乙氧基硅烷(氨基化试剂)和适量的氨水(催化剂),磁力搅拌下室温反应24 h,反应产物以10 000 r/min离心分离10 min,分别用丙酮、75%酒精和去离
子双蒸水洗脱,用超声波分散,最后真空抽干,测量质量。
采用文献[8]报道的油包水的微乳液方法以钌吡啶配合物[Ru(II)(bpy)3]2+为核材料,以氧化硅为壳材料,制备核壳型结构的荧光硅纳米颗粒,即在不改变以上各成分比的情况下,加入钌吡啶配合物水溶液,制备包裹有[Ru(Ⅱ)(bpy)3]2+荧光氨基化的硅纳米颗粒。
将单纯的硅纳米颗粒和氨基化的硅纳米颗粒悬液样品超声分散10 min后滴样于制膜的铜网上,自然干燥;用透射电镜对制备的纳米颗粒的形态、大小、均匀度进行观察。在测定纳米颗粒Zeta 电位前,调整纳米颗粒悬液pH值为6~7,样品体积为1 mL,用超声探头进行超声处理,频率为22.5 kHz,每超声处理30 s,停留30 s,反复6次。系统以-50 mV为标准进行校正,10 mL样品在30 s内测6次,取平均值,计算标准方差。
用含10%小牛血清的DMEM培养基常规培养HT1080细胞,接种细胞(1.0×105/mL)于6孔板上,37 ℃、5% CO2条件下培养24 h,加入0.05 mL/孔的荧光硅纳米颗粒悬液,继续培养24 h,用1×PBS洗脱2次,用0.25%的胰酶消化细胞脱壁。部分细胞低速离心,用1×PBS洗脱2次后,用活细胞核酸染料二氨基苯基吲哚染色20 min,在荧光显微镜下观察纳米颗粒在细胞内的分布情况。
1) 细胞毒性测定。将1×105 /mL Hela细胞接种于96孔组织培养板中,每孔100 μL,置37 ℃、5% CO2的培养箱预培养,使细胞汇合度达60%~70%;然后。加入50 μL不同浓度的氨基化硅纳米颗粒混悬液,震荡混均,继续培养24、48、96 h后进行MTT测定。每孔加入5 mg/mL MTT(保存液)20 μL,培养4 h,弃上清液,每孔加入乙醇和二甲基亚砜(DMSO)混合液 (1?1) 100 μL,振荡5 min,每孔取100 μL置于OD测定板,测量不同时间后的OD值,波长为595 nm。采用比色法确定有活力的细胞数,采用SPSS 10.0统计软件进行方差分析。
2) 生长曲线的绘制。取生长状态良好的HT1080细胞,采用一般传代方法进行消化,细胞计数,稀释成3.0×104 mL-1的细胞悬液接种于6孔培养板,每孔接种0.5 mL,于37℃、5% CO2、90%湿度的条件下培养6 h。换新鲜的含10%小牛血清的DMEM培养液,并加入低剂量(50 mg)、中剂量(150 mg)、高剂量(200 mg) 3种剂量组的氨基化硅纳米颗粒悬液继续培养,每隔 24 h每组随机取3孔,0.25%胰酶消化细胞制成细胞悬液,血球计数板盲法计数,取平均值。细胞每3 d换液一次。连续计数细胞8 d后,以培养时间为横轴,细胞数(对数)为纵轴,绘制生长曲线。
将单纯的硅纳米颗粒和改性后的硅纳米颗粒与绿色荧光蛋白表达载体pEGFP-N1质粒分别按质量比10?1,30?1,50?1,70?1混合(其中质粒的质量是固定的),然后在室温静置20 min,13 000 r/min离心处理10 min,离心处理后取上清液10 mL,用0.7%的琼脂糖凝胶电泳(80 V) 45 min,用EB染色10 min,在分子成像仪下观察并照相。离心后的沉淀用洗脱液(20 mmol/L Tris.CL pH 7.4,1 mmol/L EDTA,100 mmol/L NaCL,50%的乙醇,室温保存)或0.1 mol/L NaOH溶液洗脱10 min,13 000 r/min离心10 min,取上清液按以上条件处理,采用琼脂糖凝胶电泳或紫外分光光度计测定260 nm处的吸光度,确定纳米颗粒与DNA 复合体的形成及其与DNA的结合率。
改性后的硅纳米颗粒与DNA以上述最佳条件结合形成复合体后,将其放入5%小牛血清和5%胎牛血清(血清中存在大量的可降解DNA的成分)中重悬,37℃温育8 h,或者将纳米颗粒-DNA复合体与1mU DNase I/mgDNA 混合,37 ℃温育1 h;同时,也将寡质粒DNA作对照。10 000 r/min离心10 min,离心处理后放弃上清液,取沉淀按上述洗脱条件洗脱,离心处理后取上清液,采用琼脂糖凝胶电泳检测;对照寡质粒DNA组直接用琼脂糖凝胶电泳检测。
1.10 纳米颗粒装载绿色荧光蛋白表达载体pEGFP质粒进行体外细胞的转染
将按常规培养的HT1080细胞和Hela 2种细胞分别按2×105接种于12孔板中,37 ℃、5% CO2培养24 h后,用1×PBS洗脱细胞2次,转染pEGFP-N1 质粒DNA。转染程序如下:氨基化的硅纳米颗粒超声分散后,按30?1(质量比)与DNA 混合,加入无血清DMEM 后在室温静置20 min;用1×DMEM 洗脱细胞2次后, 加入氨基化的硅纳米颗粒悬液与DNA
(pEGFP-N1)结合后形成的复合体,按每孔转染pEGFP- N1表达质粒DNA 1 ?g,6 h后更换含10%小牛血清的DMEM培养基继续培养。同时,以阳离子脂质体转染组作对照,48 h后倒置荧光显微镜下观察结果并照相。
2 实验结果
所制备的单纯硅纳米颗粒和表面改性的氨基化硅纳米颗粒,产品外观为白色的悬浮液或白色粉末,优化超声处理后,电镜检测结果如图1所示,纳米颗粒形态规则,粒径为40~50 nm。此外,荧光氨基化的硅纳米颗粒,在冷冻抽干后呈淡红色粉末,在荧光显微镜下颗粒呈红色,并且用紫外照射1 h后,颗粒的荧光强度没有明显的衰退。采用Zeta电位仪对纳米颗粒进行Zeta电位检测,在检测之前用精密pH试纸测得氨基化的硅纳米颗粒悬液的pH值为中性,该纳米颗粒的Zeta电位为净正电,在16 mV左右(见图2),但单纯的硅纳米颗粒在中性条件下为净负电。

图1 表面改性硅纳米颗粒的电镜照片
Fig.1 Electron microscopic image of surface modified silica nanoparticles
将荧光氨基化硅纳米颗粒加入培养的HT1080细胞后,倒置在荧光显微镜下观察,发现在所有的细胞内有红色的纳米颗粒,而正常对照细胞在荧光显微镜下没有红色颗粒。包裹有荧光试剂[Ru(II)(bpy)3]2+的氨基化的硅纳米颗粒在与HT1080细胞共培养24 h后,用核酸染料二氨基苯基吲哚染色,在荧光显微镜下观察,细胞核已经染成蓝色,并有大量的淡红色颗粒分布在细胞核旁(见图3)。

图2 表面改性硅纳米颗粒表面的Zeta电位
Fig.2 Zeta potentials of surface modified silica nanoparticles

图3 Si纳米颗粒转染HT1080细胞后的荧光照片
Fig.3 Image of [Ru(Ⅱ)(bpy)3]2+-labeled surface of modified silica nanoparticles in HT1080 cells
细胞毒性测定:以MTT显色法检测96孔板Hela细胞在不同时间的吸光度(OD值),根据存活细胞数量与吸光值呈正比的原理,按公式计算得知高、中、低剂量组和非处理对照组的细胞存活率分别为80%、85%、78%和82%。说明各剂量组对细胞的正常生长无明显影响。
生长曲线的绘制:将HT1080细胞以4.0×104 cell/mL接种于6孔培养板,对照组的细胞最大增殖数约为1.5×105 cell/mL,对数生长期在1~3 d,细胞倍增时间为2 d。 高、中、低剂量组的细胞最大增殖数分别为1.8×105,1.3×105,1.6×105,对数生长期均在1~3 d,细胞群体倍增时间依次为2、1.8、2 d。可见,各实验组与对照组的数据无明显差异,生长曲线结果如图4所示。
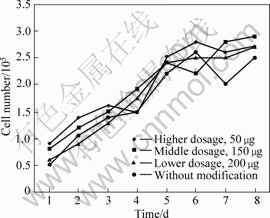
图4 各剂量组细胞的生长曲线图
Fig.4 Growth curves of cells with different dosages
在氨基化的硅纳米颗粒与pEGFP-N1质粒按质量比分别为30?1,50?1,70?1的反应上清液中,在琼脂糖胶电泳照片中未发现有DNA条带,表明DNA已完全与氨基化的硅纳米颗粒结合,并且30 mg纳米颗粒至少结合1 mg的DNA。当氨基化的硅纳米颗粒与DNA结合形成的复合体经洗脱液或碱性NaOH溶液重悬洗脱后,可见明显的DNA条带,表明DNA已从纳米颗粒上释放出来(见图5)。用紫外分光光度计测得在260 nm处吸光度也有同样的结果。

图 5 表面改性硅纳米颗粒对基因的结合与释放的凝胶电泳照片
Fig.5 Electrophoresis photos showing DNA binding efficiency of surface modified silica nanoparticles (SiNP): 1—Positive control; 2—Negative control; 3, 4, 5—Silica nanoparticles mixed with DNA, centrifuged and supernatant electrophoresed; 6, 7, 8—SiNP-pDNA complexes washed, resuspended in wash buffer, centrifuged and supernatant assayed
血清中存在可降解DNA的成分,将单纯的寡质粒DNA与血清在37 ℃条件下温育8 h后,发现DNA已被完全降解;而DNA在与氨基化的硅纳米颗粒结合后形成了复合体,与5%胎牛血清或5%小牛血清在37 ℃条件下温育8 h后,产物琼脂糖胶电泳结果显示DNA条带大小与对照DNA一样,没有脱尾现象(见图6);DNase I消化实验也证明了此结果表明氨基化的硅颗粒在与DNA结合后,能有效保护DNA被血清中的核酸酶的降解。

图 6 表面改性硅纳米颗粒对外源基因保护的凝胶电泳照片
Fig.6 Electrophoresis photos showing protection of surface modified silica nanoparticles (SiNP) to DNA: 1—Control; 2—pDNA mixed with SiNP in Dulbecco MEM (DMEM) supplemented with 5% fetal bovine serum, then mixture was centrifuged, and the supernatant was electrophoresed; 3, 4—Single pDNA in 5% fetal bovine serum and 5% bovine serum
用表面改性的硅纳米颗粒与DNA(pEGFP-N1)结合形成的复合体,转染Hela细胞和HT1080细胞,48 h后在倒置荧光显微镜下观察到带绿色荧光的细胞,并计数转染效率。在细胞密度相同的条件下转染,转染 8 h后换液,48 h后在荧光显微镜下观察结果。图7(a)所示为用阳离子脂质体转染的Hela细胞,图7(b)所示为用氨基化的硅颗粒-DNA复合体转染的HT1080细胞,图7(c)所示为用氨基化的硅颗粒-DNA复合体转染的Hela细胞。研究还发现当氨基化的硅纳米颗粒的分散程度以及与质粒DNA比例不同时,氨基化的硅纳米颗粒-DNA复合体转染效率也不同(结果未附图)。
3 讨论
载体一直是基因治疗研究领域中最重要的问题之一。目前被普遍用于基因治疗临床试验的载体仍以病毒载体为主。基因治疗临床试验中所发生的杰西·哥尔辛格死亡事件, 使人们对病毒载体的担忧成为了现实,同时揭示了10余年前困扰医学界的基因治疗载体问题依然存在[11]。如何选择合适的载体,使目的基因稳定、有效地表达,是基因治疗成功的关键因素之一。鉴于病毒载体的诸多缺陷,非病毒载体已成为基因治疗研究中的热点课题,也是基因治疗今后临床应用的发展方向之一。目前常用的非病毒载体包括脂质体及多聚阳离子聚合物介导的基因转移缺乏组织特异性和靶向性、转染效率低且易被网状内皮系统吞噬,基因表达时间短,因而在临床的广泛应用受到限制。随着近几年纳米生物技术的开展和深入,人们开始认识到一些纳米材料的生物学特性[12-13]。利用纳米颗粒的特殊性质可方便在其表面结合生物大分子,成为最有应用前景的非病毒基因高效载体[14-15]。

图7 表面改性硅纳米颗粒的细胞转染实验
Fig.7 In vivo transfection efficiency of surface modified silica nanoparticles (SiNP) and Lipsome: (a) Lipsome transfection in Hela cells; (b) SiNP transfection in HT1080 cells; (c) SiNP transfection in Hela cells (GFP signals for transferred DNA are seen in cells)
在本研究体系中,采用油包水形成微胶囊与正硅酸乙酯水解的方法制备粒径为50 nm左右的单纯的硅纳米颗粒,但该单纯的硅纳米颗粒在中性条件下为净负电荷。因此,根据文献[9-10]报道进一步研究和分析其制备原理和工艺过程及其可能作为DNA转移载体的条件,采用正硅酸乙酯和N-(β-氨乙基)-γ-氨丙基三乙氧基硅烷(氨基化试剂)在微乳液体系环境中一步水解法直接制得表面富有氨基的硅纳米颗粒。采用一步水解法制备表面改性的氨基化硅纳米颗粒,操作简便、成本低,无需特殊的条件和设备,并且制备过程中通过改变有关实验反应参数,可很容易控制纳米颗粒的粒径,粒径分布也较均匀,最小粒径仅20 nm左右,可被细胞吞噬,对细胞的正常生长也无明显影响;其次,在中性pH条件下,表面改性的氨基化硅纳米颗粒表面净正电荷约为16 mV,能够通过静电作用有效地与DNA结合形成复合体,并能够有效保护DNA,避免血清中核酸酶的降解;另外,改性后的硅纳米颗粒表面富含氨基,能够有效地进行表面修饰,连接具有生物活性的物质,提高其介导基因转移的靶向性,对寻找和研究新的基因治疗载体具有一定的参考价值。
能与质粒DNA 高效结合、体积小,能通过细胞膜进入细胞是基因载体的必要条件。经体外转染实验证实,本实验制备的表面改性的氨基化硅纳米颗粒可将外源的DNA 转染至HT1080细胞和Hela细胞内并得到高效的表达。影响纳米颗粒介导的体外基因转染的转染效率因素很多,如纳米颗粒本身的分散度、纳米颗粒装载DNA的量、纳米颗粒与质粒DNA的质量比/细胞基因转染的时间、细胞表面的DNA浓度、纳米颗粒与DNA结合形成复合体的形态等。对于体内的基因转运,转染条件将会更复杂,如外周血中的核酸酶、补体系统以及白细胞的非特异性吞噬等将大大影响基因的转染效率。因此,进一步优化硅纳米颗粒的制备与改性和转染条件,选用合适的治疗基因,进行临床前动物实验,以考察其生物有效性和安全性,将是我们的下一步的研究目标。
4 结论
1) 硅纳米颗粒的表面改性简便,无需特殊的条件和设备,并可控制纳米颗粒的粒径。
2) 制备的硅纳米颗粒粒径分布均匀,大小为40 nm左右,可被细胞吞噬。在中性pH条件下,表面改性的硅纳米颗粒表面净正电荷电压为16 mV。
3) 硅纳米颗粒具有良好的生物相容性,对细胞的生长无明显影响,表面富含氨基的纳米颗粒,可有效地与DNA结合,复合后能有效抵抗血清或DNase I的降解。
REFERENCES
[1] AL-DOSARI M S, GAO X. Nonviral gene delivery: Principle, limitations, and recent progress[J]. The AAPS Journal, 2009, 11(4): 671-681.
[2] MASHALL E. Gene therapy. NIH picks three gene vector centers[J]. Science, 1995, 269(5225): 751-253.
[3] ZHU S H, HUANG B Y, ZHOU K C, HUANG S P, LIU F, LI Y M, XUE Z G, LONG Z G. Hydroxyapatite nanoparticles as a novel of gene carrier[J]. Journal of Nanoparticle Research, 2004, 6: 311-317.
[4] DITTO A J, SHAH P N, YUN Y H. Non-viral gene delivery using nanoparticles[J]. Expert Opin Drug Deliv, 2009, 6(11): 1149-1160.
[5] TAIRA S, MORITAKE S, HATANAKA T. Functionalized magnetic nanoparticles as an in vivo delivery system[J]. Methods Mol Biol, 2009, 544: 571-587.
[6] DAN Luo, MARK S. Enhancement of transfection by physical concentration of DNA at the cell surface[J]. Nat Biot, 2000, 13: 893-895.
[7] CARSTEN K, MOHAMMAD S, ELENORE G. Silica nanoparticle modified with aminosilanes as carriers for plasmid DNA[J]. Intern J Pharmac, 2000,196: 257-261.
[8] CHEN Y, XUE Z, ZHENG D, XIA K, ZHAO Y, LIU T, XIA J. Sodium chloride modified silica nanoparticles as a non-viral vector with a high efficiency of DNA transfer into cells [J]. Curr Gene Ther, 2003, 3(3): 273-279.
[9] ARRIAGADA F J, OSSEO-ASARE K. Synthesis of nanosize silica in a nonionic water-in-oil microemulsion: Effects of the water/surfactant molar ratio and ammonia concentration [J]. J Colloid Interface Sci, 1999, 211(2): 210-220.
[10] OSSEO-ASARE K, ARRIAGADA F J. Growth kinetics of nanosize silica in a nonionic water-in-oil microemulsion: A reverse micellar pseudophase reaction model[J]. J Colloid Interface Sci, 1999, 218(1): 68-76.
[11] MARSHALL E. Gene therapy death prompts review of adenovirus vector[J]. Science, 1999, 286(5448): 2244-2245.
[12] 黄德欢. 纳米技术与应用[M]. 上海:中国纺织大学出版社, 2001.
HUANG De-huan. Nanoparticle technology and its application [M]. Shanghai: China Textile University Press, 2001.
[13] QHOBOSHEANE M, SANTRA S, ZHANG P, TAN W. Biochemically functionalized silica nanoparticles[J]. Analyst, 2001, 126(8): 1274-1278.
[14] 赵颜忠, 黄艳艳, 陈玉祥, 朱晒红, 周建大, 黄 东, 周科朝. 用于基因治疗的硅纳米颗粒的制备及生物安全性评价[J]. 中国有色金属学报, 2008, 18(5): 879-883.
ZHAO Yan-zhong, HUANG Yan-yan, CHEN Yu-xaing, ZHU Shai-hong, ZHOU Jian-da, HUANG Dong, ZHOU Ke-chao. Preparation and biological savety evaluation of silicon nanoparticles for gene therapy[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(5): 879-883.
[15] PARK J, LU W. Interaction of nanoparticles with lipid layers [J]. Phys Rev E Stat Nonlin Soft Matter Phys, 2009, 80(2): 021607.
(编辑 杨 华)
基金项目:湖南省自然科学基金资助项目(06JJ50072);湖南省科学计划资助项目(05FJ3015)
收稿日期:2010-01-21;修订日期:2010-05-20
通信作者:周科朝,教授,博士;电话:0731-88830464;E-mail: zhoukechao@mail.csu.edu.cn


