文章编号:1004-0609(2009)07-1322-10
NaOH分解含铟铁矾渣新工艺
陈永明,唐谟堂,杨声海,何 静,唐朝波,杨建广,鲁君乐
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
提出NaOH分解含铟铁矾渣新工艺,考察NaOH用量、液固比、温度和时间对铁矾渣分解率的影响,并讨论铁矾渣中杂质金属,如Zn、In、Cu、Cd、Pb、As、Sb、Sn和Ag等在NaOH分解过程中的行为。结果表明:在m(NaOH)?m(铁矾渣)=0.381 4?1、温度60 ℃、液固比2?1、反应时间2 h的最优条件下,铁矾渣的分解率达到98.03%,而原料中的杂质金属,如Sn、Sb、Zn、In、Cu、Cd、Pb和Ag等绝大部分留在分解渣中,As则以AsO43?的形态大部分进入溶液,浸出率达到83.36%。DSC-TGA热分析和X射线衍射分析结果表明:在NaOH分解过程中,铁矾渣中的铁主要以Fe3O4形式沉淀入渣;分解渣中Fe、In和Zn的含量分别为38.81%、0.23%和12.89%;经稀盐酸选择性浸出铟和锌后,进一步磁选富集可作为炼铁原料。
关键词:
中图分类号:TF 803.2 文献标识码:A
Novel technique of decomposition of ammonium jarosite bearing indium in NaOH medium
CHEN Yong-ming, TANG Mo-tang, YANG Sheng-hai, HE Jing, TANG Chao-bo, YANG Jian-guang, LU Jun-yue
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The decomposition of ammonium jarosite bearing indium in NaOH medium were studied. The effects of NaOH addition, liquid-solid ratio, decomposition temperature and time on the decomposition ratio of ammonium jarosite were investigated, respectively, and the behavior of impurity elements, such as Zn, In, Cu, Cd, Pb, As, Sb, Sn and Ag in jarosite residues was also discussed. The results show that the decomposition rate of ammonium jarosite can reach 98.03% under the following optimum conditions, which are m(NaOH)?m(jarosite)=0.381 4?1, temperature 60 ℃, liquid-solid ratio 2?1, reaction time 2 h. During the alkaline decomposition, the impurity elements, such as Zn, In, Cu, Cd, Pb, Sb, Sn and Ag are left in the residue, while As is leached into the pregnant solution as AsO43? with leaching rate of 83.36%. DSC-TGA thermal analysis and XRD characterization results demonstrate that Fe is precipitated as Fe3O4 during alkaline decomposition of jarosite. The contents of Fe, In and Zn in decomposition residue are 38.81%, 0.23% and 12.89%, respectively. After selective leaching of In and Zn with dilute HCl solution, the iron concentrates obtained from magnetic separation can be used as raw material for iron smelting.
Key words: ammonium jarosite; In; zinc hydrometallurgy; decomposition
目前,世界金属锌年产量的80%以上采用“焙 烧—浸出—电积”的湿法工艺生产。在焙烧过程中,闪锌矿中的锌大部分生成ZnO,采用废电解液即可溶解,浸出液净化除杂后进行电积产出电锌并再生硫酸,但还有相当部分锌与精矿中的铁结合生成铁酸锌,必须在高温高酸的条件下才能浸出其中的锌,铁也同时进入浸出液。为了实现铁锌分离,先后提出了黄钾铁矾法、针铁矿法和赤铁矿法等除铁工艺[1?3]。较之于针铁矿法和赤铁矿法,黄钾铁矾法具有操作简单、试剂消耗少和生产成本低等优点,且较易实现整个锌系统的酸平衡,但其主要缺点是渣量大,铁矾渣稳定性差,堆存性不好。对于年产10万t的电锌厂,若锌精矿含铁以8%计,则每年产出的铁矾渣约为5.3万t。一般就近建设渣场堆存,不但占用宝贵的土地资源,而且铁矾渣中的重金属,如Zn、Cu、Cd、Pb、As和Sb等,在自然堆存条件下会不断溶出从而污染地下水和土壤[4]。由此,如何经济环保地处理数量巨大的湿法炼锌铁矾渣,成为当今有色冶金工业面临的严峻挑 战。目前,铁矾渣的处理主要集中于无害化固定处理和回收有价金属两方面。铁矾渣无害化固定技术可分为高温烧结法[5?8]、还原焙烧?磁选法[9]、高温水解 法[10?13]和溶剂浸出法等,铁矾渣中的铁资源分别以硅酸盐、铁酸盐或Fe2O3等形态在炼铁、微晶玻璃、陶瓷材料、颜料或建材等领域得到增值利用,而重金属元素则得到有效回收或固化处理。但由于运营成本 高,这些工艺都未推广应用。对于铁矾渣中有价金属的回收,从经济性上考虑,主要着眼于稀散金属铟的回收。铁矾法沉铁时,浸出液中的铟以类质同相的形式生成铟铁矾而进一步富集于矾渣,一般采用“高温还原挥发[14?21]—硫酸浸出—D2EHPA萃铟—锌板置换”工艺回收铟。该工艺存在的主要问题是铟总回收率低,能耗大,生产成本高,挥发工序产生的低浓度SO2烟气严重污染环境。基于上述原因,有必要开发一种环境友好、流程简单、成本低廉、有价金属回收率高的含铟铁矾渣湿法处理工艺,不但高效回收铁矾渣中的In和Zn等有价金属,还可实现锌精矿铁资源的增值利用,避免铁渣堆存所带来的环境污染。据文献[22?26]报道,NaOH和Ca(OH)2均可在常温常压下有效分解银铁矾和铅铁矾,且整个反应过程符合未反应收缩核模型。由此,本文作者提出“NaOH分解—盐酸还原浸出—TBP萃取铟锌”的含铟铁矾渣湿法处理流程,即首先在NaOH体系中分解铁矾渣,分别产出Na2SO4浸液和含In和Zn的铁渣。前者经浓缩结晶回收芒硝,后者则纳入盐酸体系无铁渣湿法炼锌提铟流程[27?29],稀盐酸选择性浸出和TBP萃取In和Zn后,所得浸出渣经磁选富集后作为炼铁原料。本文作者进行了NaOH分解含铟铁矾渣的工艺研究,考察NaOH用量、液固比、温度和时间对铁矾渣分解率的影响,并讨论了杂质金属Zn、In、Cu、Cd、Pb、As、Sb、Sn和Ag等在铁矾渣分解过程中的行为。
1 实验
1.1 原料
实验所用铁矾渣取自柳州来宾冶炼厂湿法炼锌除铁工序,其化学成分列于表1。
表1 铁矾渣的化学成分
Table 1 Chemical composition of ammonium jarosite residue (mass fraction, %)
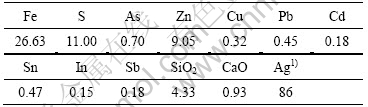
1) g/t.
铁矾渣的XRD分析结果如图1所示。
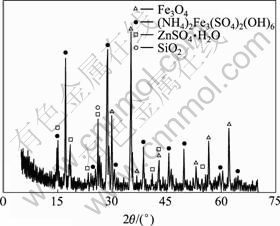
图1 铁矾渣的XRD谱
Fig.1 XRD pattern of ammonium jarosite residue
由表1可知,铁矾渣的主要化学组成为Fe (26.63%)、S(11%)、Zn(9.05%)和SiO2(4.33%)。根据XRD谱,原料中的Fe绝大部分以铵矾[(NH4)Fe3- (SO4)2(OH)6]形态存在,还有一部分呈Fe3O4相;而铁矾渣中的Zn主要为水溶性的硫酸盐[ZnSO4?H2O]。铁矾渣中的杂质金属来源主要如下:1) 由沉矾过程中加入的锌焙砂中和剂带入;2) 低酸浸出液中的杂质金属在沉矾过程中与铁共沉淀而进入矾渣。Ag+、Pb2+与Na+、K+、NH4+一样,各自以银铁矾[AgFe3(SO4)2- (OH)6][30]和铅铁矾[Pb0.5Fe3(SO4)2(OH)6]形式沉淀,In3+、Cu2+ [31]、Cd2+ [32]和Zn2+ [33]则分别取代铁矾晶格中的Fe3+而进入铁渣;而Sb5+ [34]、Sn4+、As5+ [35?36]除少部分以SbO43?、SnO32?和AsO43?形态取代铁矾晶格中的SO42?外,大部分以独立的FeSbO4、FeSnO3和FeASO4相存在于铁渣中。
1.2 实验装置及方法
NaOH分解铁矾渣实验在1 L的单口烧瓶中进行,温度由恒温水浴槽控制。称取一定量的工业级NaOH,将其加入盛有一定体积蒸馏水的单口烧瓶中进行溶解,待浸液温度恒定于预定值后,加入100 g铁矾渣在一定的搅拌速度下进行分解反应。达到预定时间后,停止反应并进行液固分离和洗涤,量取滤液体积,采用ICP-AES方法取样分析其中的S、Zn、In、Cu、Cd、Pb、Sb和Sn等元素的含量。浸出渣在空气干燥箱中干燥脱水后,称取质量取样分析。
铁矾渣的分解率用S的浸出率进行表征,其表达式如下:
![]()
式中:η为铁矾渣的分解率,%;ρ(S)为分解液中S的含量,g/L;V为分解液的体积,L;w(S)为铁矾渣中S的含量,%;m为铁矾渣的加入量,g。
NaOH分解铁矾渣的实验装置示意图如图2所示。
图2 铁矾渣分解试验装置示意图
Fig.2 Schematic diagram of experimental set-up for ammonium jarosite residue decomposition
2 工艺流程及原理
2.1 工艺流程
铁矾渣湿法提铟的原则流程如图3所示。
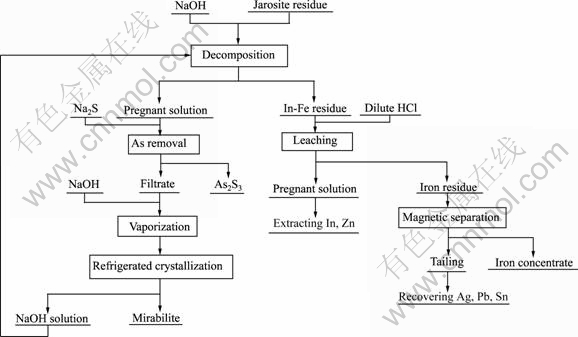
图3 铁矾渣湿法提铟原则流程
Fig.3 Principle flow sheet of In hydrometallurgical extraction from jarosite residue
2.2 NaOH分解铁矾渣机理
50和200 ℃时Fe2O3-SO3-H2O三元体系相平衡如图4所示。按照平衡固相分类,图4(a)大致可以划分为以下3个区域。
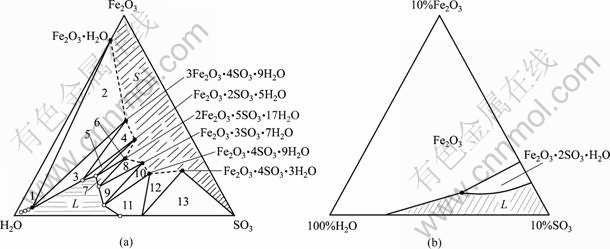
图4 Fe2O3-SO3-H2O三元体系相平衡
Fig.4 Phase equilibrium of Fe2O3-SO3-H2O ternary system: (a) 50 ℃; (b) 200 ℃
1) 平衡固相是氧化铁的水合物,即三角形区域1。
2) 平衡固相是碱式盐(三角形区域3、5和7)或碱式盐和氧化铁水合物的混合物(三角形区域2、4和6)。在此区域内除三角形区域7外,随着体系中SO3含量的增加,平衡母液相的铁含量均随之不断增加,一直达到液相线顶点为止。
3) 平衡固相是正盐(三角形区域9)、酸式盐(三角形11、13)或两者的混合物(三角形区域10和12)。本区域内的平衡液相具有很高的SO3含量,且随着体系中SO3含量的增加,平衡母液中含铁量急剧下降。
比较图4(a)与(b)可知:由于温度较高,200 ℃平衡固相为结晶水很小的Fe2O3·2SO3·H2O和不含结晶水的硫酸高铁[Fe2O3·3SO3、Fe2O3·4SO3]以及无水氧化铁Fe2O3;200 ℃未饱和液相区的面积大为缩小,平衡液相的含铁量很低。
湿法炼锌工业中,黄钾铁矾法除铁的操作条件主要位于图4(a)的三角形区域3,其平衡固相草黄铁矾([H3O]2O·3Fe2O3·4SO3·6H2O)不论在成分上还是物理化学性质上都和黄钾铁矾([K2O·3Fe2O3·4SO3·6H2O]非常相近。在此区域内,随着溶液酸度的减小,草黄铁矾趋于不稳定,并将转化为含水氧化铁。因此,由图4可知,铁矾渣的湿法处理工艺不外乎两种:一是高温水解法;另一种则为NaOH或Ca(OH)2的碱分解法。
NaOH分解黄铵铁矾渣的反应如式(2)和(3)所示:
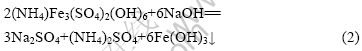
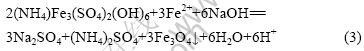
2.3 杂质金属在铁矾渣分解过程中的行为
NaOH分解铁矾渣过程中,随着黄铵铁矾晶格的瓦解,铁矾晶格中的Zn2+、In3+、Cu2+、Cd2+、Pb2+、Ag+和包裹态的As3+、Sb3+、Sn4+等杂质离子均析出,并按式(4)与OH?反应生成相应的氢氧化物沉淀而留在分解渣中:
Men++nOH?=Me(OH)n↓ (4)
式中:Me分别代表Zn2+、In3+、Cu2+、Cd2+、Pb2+、As3+、Sb3+、Sn4+和Ag+。
当碱浓度达到一定值后,两性氢氧化物,如Zn(OH)2、Cu(OH)2、In(OH)3、Pb(OH)2、As(OH)3、Sb(OH)3和Sn(OH)4等分别按照式(5)和(6)重新溶解:
Ma(OH)n+iOH?=Ma(OH)(n+i)?i (5)
式中:Ma分别代表Zn2+、In3+、Cu2+、Pb2+和Sn4+。
Mc(OH)n+OH?=McO(n?1)(n?2)?+2H2O+(n?3)H+ (6)
式中:Mc分别代表As3+和Sb3+。
铁矾渣中的砷酸铁和锡酸铁在碱浓度较高时,也会被碱分解形成砷酸钠和锡酸钠而进入溶液:
FeAsO4+3OH?=Fe(OH)3↓ +AsO43? (7)
FeSnO3+2OH?=Fe(OH)2↓ +SnO32? (8)
3 结果与讨论
3.1 NaOH用量的影响
在温度50 ℃、反应时间2 h、液固比3?1的固定条件下,改变NaOH加入量以考察其对铁矾渣分解过程的影响,结果如图5和6所示。由图5和6可看 出,随着NaOH用量的增加,S的浸出率随之快速上升,铁矾渣的分解愈加彻底。NaOH加入量由矾渣量
的19.07%增至38.14%时,S的浸出率则由65.91%上升至97.68%;在20%~40%碱量范围内,原料中的杂质金属,如In、Cu、Pb、Ag和Cd等在浸出液中含量均小于1 mg/L,在铁矾渣分解过程中,它们基本以氢氧化物沉淀的形式入渣;Zn、As、Sb和Sn等杂质在NaOH加入量小于30%时,其浸出率小于0.1%,基本进入分解渣;但当NaOH加入量大于30%后,其浸出率随NaOH加入量的增加而显著上升,这主要是因为Zn、As、Sb和Sn等分别形成羟基配合物(如Zni(OH)j2i?j)或含氧酸根(如AsO43?、SbO2?、SbO33?和SnO32?)而溶解进入浸液。NaOH用量为38.14%时,Zn、As、Sb和Sn的浸出率分别为1.17%、68.51%、0.75%和4.37%。从铁矾渣的分解率和As的溶出率两方面综合考虑,选择最佳NaOH用量为铁矾渣量的38.14%。
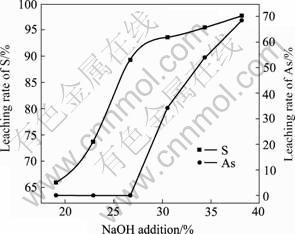
图5 NaOH用量对S和As浸出率的影响
Fig.5 Effect of NaOH addition on leaching rates of S and As
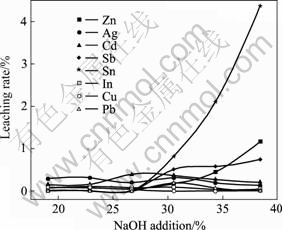
图6 NaOH用量对Zn、In、Ag、Cd、Sb、Sn、Cu和Pb浸出率的影响
Fig 6 Effect of NaOH addition on leaching rates of Zn, In, Ag, Cd, Sb, Sn, Cu and Pb
3.2 分解温度的影响
在NaOH用量为矾渣量的38.14%、反应时间2 h、液固比3?1的固定条件下,改变温度以考察其对铁矾渣分解过程的影响,结果如图7和8所示。由图7和8可知,温度的提高有利于铁矾渣的分解。当温度由30 ℃提高至60 ℃时,S的浸出率随之由95.41%上升至101.63%,铁矾渣已完全分解;此后继续提高浸出温度,S的浸出率基本保持恒定。温度对杂质金属浸出率的影响可分为3类:温度对As、Sb和Sn浸出率的影响规律与温度对S的影响规律基本一致,开始随着温度的升高而增大,但温度高于60 ℃后,其基本保持不变;Zn的浸出率随着温度的提高而减小;而In、Pb、Cu、Cd和Ag等杂质在30~90 ℃温度范围内基本不被浸出。从铁矾渣的分解率、As的浸出率以及节能降耗等方面综合考虑,选择最佳分解温度为60 ℃。
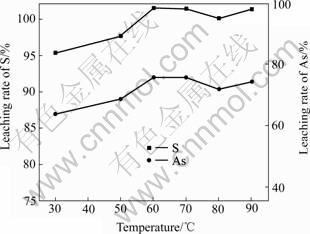
图7 温度对S和As浸出率的影响
Fig.7 Effect of temperature on leaching rates of S and As
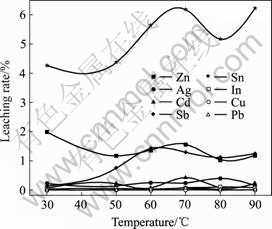
图8 温度对Zn、In、Ag、Cd、Sb、Sn、Cu和Pb浸出率的影响
Fig.8 Effect of temperature on leaching rates of Zn, In, Ag, Cd, Sb, Sn, Cu and Pb
3.3 液固比的影响
在NaOH用量为矾渣量的38.14%、反应时间2 h、温度60 ℃的固定条件下,改变液固比以考察其对铁矾渣分解过程的影响,结果如图9和10所示。
液固比对分解过程的影响,主要体现于分解剂浓度、分解设备的作业率以及机械搅拌效果等方面。液固比愈大,分解剂浓度和分解设备的作业率随之下降,但较大的液固比有利于机械搅拌效果的改善。由图9和10可知,液固比由2?1提高至4?1时,S的浸出率随之由98.58%下降至94.71%,这主要是由于NaOH浓度随液固比增大而减小的缘故;此后,继续增大液固比,S的浸出率在95%~96%范围内保持微变;在2?1~6?1的液固比范围内,In、Ag、Cd、Cu和Pb等杂质基本不被浸出,Sn、As和Zn的浸出率随着液固比的增大而下降,而Sb的浸出率却由1.12%增加至2.17%。从铁矾渣的分解率、As的溶出率以及生产能力等方面综合考虑,选择最佳液固比为2?1。
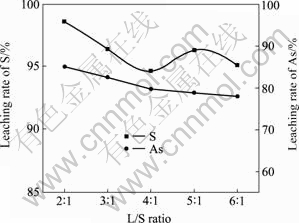
图9 液固比对S和As浸出率的影响
Fig.9 Effect of L/S ratio on leaching rates of S and As

图10 液固比对Zn、In、Ag、Cd、Sb、Sn、Cu和Pb浸出率的影响
Fig.10 Effect of L/S ratio on leaching rates of Zn, In, Ag, Cd, Sb, Sn, Cu and Pb
3.4 反应时间的影响
在NaOH用量为铁矾渣量的38.14%、温度60 ℃、液固比2?1的固定条件下,改变反应时间以考察其对铁矾渣分解过程的影响,其结果如图11和12所示。由图11和12可知,铁矾渣的分解反应进行得非常迅速,反应时间仅为0.5 h时,S的浸出率即已达到94.21%;将反应时间由0.5 h延长至2.0 h时,S的浸出率则由94.21%缓慢增加至95.30%;此后继续延长反应时间,其基本保持恒定。在0.5~3.0 h反应时间内,铁矾渣中的In、Cu、Cd、Pb和Ag等杂质基本不被浸出,As、Sb和Sn等随着反应时间的延长而缓慢增加,但Zn却随之而降低。从铁矾渣的分解、As的溶出率以及生产效率等方面综合考虑,确定最优反应时间为2 h。
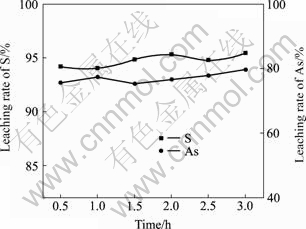
图11 反应时间对S和As浸出率的影响
Fig.11 Effect of reaction time on leaching rates of S and As
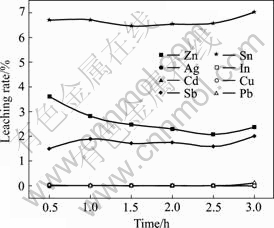
图 12 反应时间对Zn、In、Ag、Cd、Sb、Sn、Cu和Pb浸出率的影响
Fig.12 Effect of reaction time on leaching rates of Zn, In, Ag, Cd, Sb, Sn, Cu and Pb
3.5 综合扩大实验
依据单因素条件试验结果,确定NaOH分解铁矾渣的最佳工艺条件为:m(NaOH)?m(铁矾渣)=0.381 4?1、分解温度60 ℃、液固比2?1、反应时间2 h。在此最优条件下,进行6次铁矾渣碱分解的综合扩大试验,每次铁矾渣投料量为1 000 g。所得滤液的总体积为31.86 L,其化学组成如表2所列。分解渣总质量为4 167.75 g,平均渣率为69.46%,其化学组成列于表3。铁矾渣分解过程中,主要金属元素的平衡如表4所列。
表2 分解液的化学组成
Table 2 Chemical composition of pregnant solution (mg/L)
![]()
表3 分解渣的化学成分
Table 3 Chemical composition of decomposition residue (mass fraction, %)
![]()
1) g/t.
表4 NaOH铁矾渣分解过程中金属平衡
Table 4 Metal balance during alkaline decomposition of ammonium jarosite residue
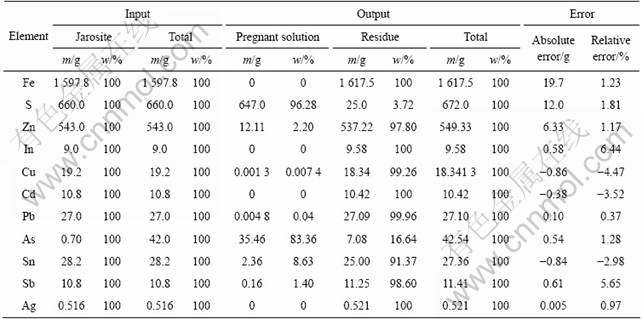
由表2和3可知,铁矾渣基本被NaOH分解完全,分解渣中S含量仅为0.60%,渣计铁矾渣分解率为96.21%;而分解液中S含量则高达20.31 g/L,即Na2SO4含量达到90 g/L,液计铁矾渣分解率为98.03%。依据分解液中Na2SO4含量,按处理1 t铁矾渣计算,通过冷冻结晶工艺可副产无水芒硝2.93 t。如表2~4所列,在最佳工艺条件下,As的浸出率为83.36%,其在分解液中的含量高达1.113 g/L;Sn、Sb和Zn也有一定程度的溶出,但绝大部分还是留在分解渣中,入渣率分别为91.37%、98.60%和97.80%;分解液中In、Cu、Cd、Pb、Ag等金属浓度均小于1 mg/L,铁矾渣分解过程中这些金属均进入分解渣而得到富集。
由表4可看出,在铁矾渣分解过程中,铁依然留于分解渣中,含量高达38.81%,进一步富集和除杂后可作为炼铁原料。为了确定铁矾渣分解过程中铁以何种形态沉淀,在100 mL/min的氩气保护气氛中,对分解渣进行了DSC-TGA热分析如图13所示,升温速度为10 K/min。对热处理前后的铁渣进行XRD衍射分析,所得结果如图14所示。
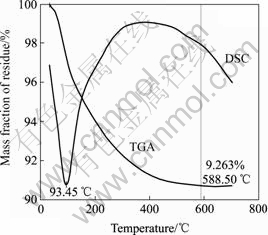
图13 分解渣的DSC-TGA热分析曲线
Fig.13 DSC-TGA curves of decomposition residue
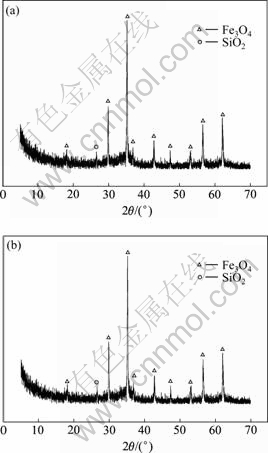
图14 分解渣的XRD谱
Fig.14 XRD patterns of decomposition residue: (a) Without thermal treatment; (b) After thermal treatment
对比图1和14(a)可知,NaOH可有效分解铁矾渣,XRD谱中铵矾相[(NH4)Fe3(SO4)2(OH)6]消失,[ZnSO4?H2O]也溶解并与NaOH反应生成Zn(OH)2沉淀,分解渣中仅存在Fe3O4和石英相。
由图13可知,当温度由室温匀速升高至588.50 ℃时,分解渣的质量损失约为9.263%,此后继续升高温度,分解渣质量基本保持恒定。而差热图中仅在 93.45 ℃时出现一个吸热峰,这说明分解渣的质量损失主要由物理吸附态的水分挥发所致,并无其它化合物分解反应发生。由图14可知,热处理前后分解渣的XRD衍射谱完全一致,主要为Fe3O4和SiO2相,并无相变反应发生。由此可以确定,铁矾渣分解过程中,铁主要以Fe3O4形态沉淀,而不是其它氧化铁水合物如FeOOH、Fe(OH)3或Fe2O3。但根据文献[21?25]报道,在NaOH浸出银铁矾过程中,所得铁渣主要为Fe(OH)3。这一差异主要是由于所用的原料不同所致。文献[21?25]所用的银铁矾系由相关化学试剂合成所得,并不存在其它杂质元素。而本研究所用的铁矾渣为湿法炼锌厂产出,原料含有一定量的亚铁,使得黄铵铁矾渣按照式(3)进行分解,从而生成Fe3O4沉淀。
4 结论
1) NaOH用量、温度和液固比对铁矾渣的分解过程影响显著。在m(NaOH)?m(铁矾渣)=0.381 4?1、温度60 ℃、液固比2?1、反应时间2 h的最优条件下,铁矾渣的分解率达到98.03%,As的浸出率为83.36%。分解液中S含量高达20.31 g/L,脱砷净化除杂后即可浓缩结晶回收芒硝,而NaOH母液则返回铁矾渣分解工序。以处理1 t铁矾渣计算,可副产无水芒硝约2.93 t。
2) 在铁矾渣分解过程中,原料中的In、Cu、Pb、Cd和Ag等杂质主要以氢氧化物沉淀形式进入分解渣;而Zn、As、Sb和Sn等杂质在NaOH用量较小时基本留在分解渣中,但当NaOH加入量高于一定值后,它们就分别以羟基配合物或含氧酸盐的形式溶解进入溶液。
3) DSC-TGA热分析和X射线衍射分析结果表明,在铁矾渣分解过程中,因为Fe2+的存在,铁主要以的Fe3O4形式沉淀进入分解渣,并不是常见的Fe(OH)3。
4) 分解渣中Fe、In和Zn的含量由矾渣的26.63%、0.15%和9.05%进一步富集到38.81%、0.23%和12.89%,稀盐酸选择性浸出In和Zn后,所得铁渣经磁选富集即可作为炼铁原料。
[1] 梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001.
MEI Guang-gui, WANG De-run, ZHOU Jin-yuan, WANG Hui. Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001.
[2] 徐采栋, 林 蓉, 汪大成. 锌冶金物理化学[M]. 上海: 上海科学技术出版社, 1979.
XU Cai-dong, LIN Rong, WANG Da-cheng. Physical chemistry of zinc metallurgy[M]. Shanghai: Shanghai Scientific & Technical Press, 1979.
[3] 陈家镛. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991.
CHEN Jia-yong. Separation and utilization of iron in hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991.
[4] KENDALL D S. Toxicity characteristic leaching procedure and iron treatment of brass foundry waste[J]. Environmental Science and Technology, 2003, 37(2): 361?371.
[5] ASOKAN P, SAXENA M, ASOLEKER S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J]. Journal of Hazardous Materials, 2006, 137(3): 1589?1599.
[6] MOUTANARO L, BIANCHINI N, MA R J, ROMERO M. Sintering behavior of pressed red mud wastes from zinc hydrometallurgy[J]. Ceramics International, 2001, 27(1): 29?37.
[7] SEYER S, CHEN T T, DUTRIZAC J E. Jarofix: Addressing iron disposal in the zinc industry[J]. JOM, 2001, 53(12): 32?35.
[8] ASOKAN P, MOHINI S, SHYAM A. Jarosite characteristics and its utilization potentials[J]. Science of the Total Environment, 2006, 359(2): 232?243.
[9] PAOLO P, DANTE M. Recovering metals from red mud by thermal treatment and magnetic separation[J]. JOM, 1996, 48(1): 25?28.
[10] HAGE J L T, SCHUILING R D, VRIEND S P. Production of magnetite from sodiumjarosite under reducing hydrothermal conditions: The reduction of FeIII to FeII with cellulose[J]. Canadian Metallurgical Quarterly, 1999, 38(4): 267?276.
[11] HAGE J L T, SCHUILING R D. Comparative column elution of jarosite waste and its autoclaved product—Evidence for the immobilization of deleterious elements in jarosite[J]. Minerals Engineering, 2000, 13(3): 287?296.
[12] DUTRIZAC J E. Converting jarosite residues into compact hematite products[J]. JOM, 1990, 42(1): 36?39.
[13] DAS G K, ANAND S, ACHARYA S, DAS R P. Preparation and decomposition of ammoniojarosite at elevated temperature in H2O-(NH4)2SO4-H2SO4 media[J]. Hydrometallurgy, 1995, 38(3): 263?276.
[14] FROST R L, WAIN D L, RACHAEL-ANNE W, ANTHONY M, WAYDE M. A thermogravimetric study of the alunites of sodium, potassium and ammonium[J]. Thermochemical Acta, 2006, 443(1): 56?61.
[15] RISTIC M, MUSIC S, OREHOVEC Z. Thermal decomposition of synthetic ammonium jarosite[J]. Journal of Molecular Structure, 2005, 744(3): 295?300.
[16] FROST R L, RACHAEL-ANNE W, THEO K J, WAYDE M. Thermal decomposition of ammonium jarosite (NH4)Fe3- (SO4)2(OH)6 [J]. Journal of Thermal Analysis and Calorimetry, 2006, 84(2): 489?496.
[17] FROST R L, WILLS R A, MATT L W, MARTENS W. Thermal decomposition of synthetic argentojarosite: Implications for silver production in medieval times[J]. Thermochemical Acta, 2005, 437(1): 30?33.
[18] FROST R L, WILLS R A, MATT L W, MARTENS W. Thermal decomposition of synthetic plumbojarosite: Importance in archeochemisty[J]. Thermochemical Acta, 2005, 432(1): 30?35.
[19] FROST R L, LOCKE A J, MARTENS W. Thermal analysis of beaverite in comparison with plumbojarosite[J]. Journal of Thermal Analysis and Calorimetry, 2008, 92(3): 887?892.
[20] 宁顺明, 陈志飞. 从黄钾铁矾渣中回收锌铟[J].中国有色金属学报, 1997, 7(3): 56?58.
NING Shun-ming, CHEN Zhi-fei. Recovery of zinc and indium from jarosite residues[J]. The Chinese Journal of Nonferrous Metals Society, 1997, 7(3): 56?58.
[21] 陈阜东. 某厂提铟工艺技改浅议[J]. 湖南有色金属, 2001, 17(6): 15?17.
CHEN Fu-dong. Analysis of technical innovation of indium extraction in a smelter[J]. Hunan Nonferrous Metals, 2001, 17(6): 15?17.
[22] PATINO F, SALINAS E, CRUELLS M, ROCA A. Alkaline decomposition-cyanidation kinetics of argentian natrojarosite[J]. Hydrometallurgy, 1998, 49(3): 323?336.
[23] ROLA A, VINALS J, ARRANZ M, CALERO J. Characterization and alkaline decomposition-cyanidation of beudantite-jarosite materials from Rio Tinto ores[J]. Canadian Metallurgical Quarterly, 1999, 38(2): 93?103.
[24] SALINAS E, ROCA A, CRUELLS M, PATINO F, CORDOBA D A. Characterization and alkaline decomposition - cyanidation kinetics of industrial ammonium jarosite in NaOH media[J]. Hydrometallurgy, 2001, 60(3): 237?246.
[25] ROLA A, CRUELLS M, PATINO F, RIVERA I, PLATA M. Kinetics model for the cyanidation of silver ammonium jarosite in NaOH medium[J]. Hydrometallurgy, 2006, 81(1): 15?23.
[26] PATINO F, CRUELLS M, ROLA A, SALINAS E, PEREZ M. Kinetics of alkaline decomposition and cyanidation of argentian ammonium jarosite in lime medium[J]. Hydrometallurgy, 2003, 70(1): 153?161.
[27] 陈永明, 唐谟堂, 李诚国, 唐朝波, 杨声海, 何 静. 铟锌精矿铁资源制取铁酸锌新工艺[J]. 材料与冶金学报, 2007, 6(3): 196?203.
CHEN Yong-ming, TANG Mo-tang, LI Cheng-guo, TANG Chao-bo, YANG Shang-hai, HE Jing. Preparation of zinc ferrite using ferrite resource in Zn-In concentrate[J]. Journal of Materials and Metallurgy, 2007, 6(3): 196?203.
[28] 李诚国, 唐谟堂, 唐朝波, 杨声海, 李鸿飞, 巨少华, 陈永明. 氯盐体系中锌焙砂中浸渣高温高酸还原浸出研究[J]. 湿法冶金, 2005, 24(4): 203?207.
LI Cheng-guo, TANG Mo-tang, TANG Chao-bo, YANG Sheng-hai, LI Hong-fei, JU Shao-hua, CHEN Yong-ming. Study on reductive leaching of neutral leached residue in chloride system by high concentration acid and reductive agent at high temperature[J]. Hydrometallurgy of China, 2005, 24(4): 203?207.
[29] 王亦男, 杨声海, 唐谟堂. 盐酸体系浸出含铟高浸渣工艺研究[J]. 湿法冶金, 2008, 27(1): 41?44.
WANG Yi-nan, YANG Sheng-hai, TANG Mo-tang. Study on leaching of indium from hot-acid leaching residues in hydrochloric acid system[J]. Hydrometallurgy of China, 2008, 27(1): 41?44.
[30] 沈湘黔, 陈志飞. 提高黄钾铁钒法炼锌中银回收率的探讨[J]. 矿冶工程, 1988, 8(4): 35?38.
SHEN Xiang-qian, CHEN Zhi-fei. Discussion on silver recovery ratio improvement in jarosite precipitation process for zinc hydrometallurgy[J]. Mining and Metallurgical Engineering, 1988, 8(4): 35?38.
[31] DUTRIZAC J E, DINARDO O. The co-precipitation of copper and zinc with lead jarosite[J]. Hydrometallurgy, 1983, 11(1): 61?78.
[32] DUTRIZAC J E, HARDY D J, CHEN T T. The behavior of cadmium during jarosite precipitation[J]. Hydrometallurgy, 1996, 41(3): 269?285.
[33] ELGERSMA F, WITKAMP G J, van ROSMALEN G M. Incorporation of zinc in continuous jarosite precipitation[J]. Hydrometallurgy, 1993, 33(3): 313?339.
[34] 谢美求, 陈志飞. 锑在沉矾过程中的行为[J]. 矿冶工程, 2003, 23(2): 56?58.
XIE Mei-qiu, CHEN Zhi-fei. Behavior of antimony in jarosite precipitation[J]. Mining and Metallurgical Engineering, 2003, 23(2): 56?58.
[35] DUTRIZAC J E, JAMBOR J L. The behavior of arsenic during jarosite precipitation: Arsenic precipitation at 97 ℃ from sulphate or chloride media[J]. Canadian Metallurgical Quarterly, 1987, 26(2): 91?101.
[36] DUTRIZAC J E, JAMBOR J L, CHEN T T. The behavior of arsenic during jarosite precipitation: Reactions at 150 ℃ and the mechanism of arsenic precipitation[J]. Canadian Metallurgical Quarterly, 1987, 26(2): 103?105.
收稿日期:2008-09-27;修订日期:2009-02-26
通讯作者:唐谟堂,教授,博士;电话:0731-88830470;E-mail: mttang@mail.csu.edu.cn
(编辑 李艳红)
摘 要:提出NaOH分解含铟铁矾渣新工艺,考察NaOH用量、液固比、温度和时间对铁矾渣分解率的影响,并讨论铁矾渣中杂质金属,如Zn、In、Cu、Cd、Pb、As、Sb、Sn和Ag等在NaOH分解过程中的行为。结果表明:在m(NaOH)?m(铁矾渣)=0.381 4?1、温度60 ℃、液固比2?1、反应时间2 h的最优条件下,铁矾渣的分解率达到98.03%,而原料中的杂质金属,如Sn、Sb、Zn、In、Cu、Cd、Pb和Ag等绝大部分留在分解渣中,As则以AsO43?的形态大部分进入溶液,浸出率达到83.36%。DSC-TGA热分析和X射线衍射分析结果表明:在NaOH分解过程中,铁矾渣中的铁主要以Fe3O4形式沉淀入渣;分解渣中Fe、In和Zn的含量分别为38.81%、0.23%和12.89%;经稀盐酸选择性浸出铟和锌后,进一步磁选富集可作为炼铁原料。
[2] 徐采栋, 林 蓉, 汪大成. 锌冶金物理化学[M]. 上海: 上海科学技术出版社, 1979.
[3] 陈家镛. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991.
[20] 宁顺明, 陈志飞. 从黄钾铁矾渣中回收锌铟[J].中国有色金属学报, 1997, 7(3): 56?58.
[21] 陈阜东. 某厂提铟工艺技改浅议[J]. 湖南有色金属, 2001, 17(6): 15?17.
[27] 陈永明, 唐谟堂, 李诚国, 唐朝波, 杨声海, 何 静. 铟锌精矿铁资源制取铁酸锌新工艺[J]. 材料与冶金学报, 2007, 6(3): 196?203.
[28] 李诚国, 唐谟堂, 唐朝波, 杨声海, 李鸿飞, 巨少华, 陈永明. 氯盐体系中锌焙砂中浸渣高温高酸还原浸出研究[J]. 湿法冶金, 2005, 24(4): 203?207.
[29] 王亦男, 杨声海, 唐谟堂. 盐酸体系浸出含铟高浸渣工艺研究[J]. 湿法冶金, 2008, 27(1): 41?44.
[30] 沈湘黔, 陈志飞. 提高黄钾铁钒法炼锌中银回收率的探讨[J]. 矿冶工程, 1988, 8(4): 35?38.


