中国有色金属学报
中国有色金属学报 2004,(02),311-316 DOI:10.19476/j.ysxb.1004.0609.2004.02.029
铝酸钠溶液中离子溶剂化作用
张牧群 尹周澜 陈启元 李洁 胡慧萍 张平民
中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院,中南大学化学化工学院 长沙410083 ,长沙410083 ,长沙410083 ,长沙410083 ,长沙410083 ,长沙410083
摘 要:
应用量子化学从头算密度泛函理论以及DFT/COSMO溶剂模型,基于UHF/BLYP/DNP水平对高苛性比中等浓度铝酸钠溶液中各类离子(分子)的溶剂化作用进行研究。根据离子(分子)的几何构型、总能量、振动频率、相关热力学数据以及相应的水合自由能,对溶液中离子(分子)的存在形式以及不同离子(分子)间的平衡转化关系进行分析。结果表明,在高苛性比中等浓度铝酸钠溶液中,铝主要是以水合Al(OH)-4离子和Na(H2O)+4离子对形式存在,同时还存在有中性水合分子Al(OH)3H2O。6Al(OH)-
关键词:
铝酸钠溶液 ;密度泛函 ;溶剂化作用 ;水合自由能 ;
中图分类号: TF821
作者简介: 张牧群(1975),男,硕士研究生.;
收稿日期: 2003-05-22
基金: 国家重点基础研究发展规划资助项目(G19990649922);
Solvent effect of species in sodium aluminate solution
Abstract:
There is a higher Na/Al mole ratio for sodium aluminate solution of medium concentration during the ended crystallized process of gibbsite. In order to elucidate the solvent effect of species and their relevant microcosmic properties in the solution, DFT quantum mechanical calculations were firstly performed on various species of aluminate ions and ion pairs at the UHF/BLYP/DNP level. Energies, geometries, vibrational frequencies of the probable species were calculated respectively in vacuum and in solution, and their relevant hydrated free energies were also obtained by DFT/COSMO. By analyzing the calculated results, it is concluded that hydrated (Al(OH)- 4 ) is the major ingredient in sodium aluminate solutions of medium concentration with a high Na/Al mole ratio, neutral hydrate (Al(OH)3 H2 O) can exist and the major hydrated form of ion pair is solvent-separated Na(H2 O)+ 6 Al(OH)- 4 in the solution.
Keyword:
sodium aluminate solution; DFT; solvent effect; hydrated free energy;
Received: 2003-05-22
铝酸钠溶液是拜耳法生产氧化铝工艺中重要的中间物质, 揭示铝酸钠溶液的结构性质是强化铝酸钠溶液分解的关键
[1 ]
。 在分析与探求铝酸钠溶液微观结构方面, 众多的研究工作表明
[2 ,3 ,4 ,5 ]
, 量子化学理论计算是一种有效的工具。 李洁
[2 ]
曾利用量子化学理论计算对中等浓度过饱和铝酸钠溶液的结构性质进行了研究。 但在氧化铝生产种分后期, 形成的高苛性比中等浓度铝酸钠溶液的结构性质鲜有文献报道。 尽管四面体Al(OH)- 4 离子是该溶液的主要成分, 已被大量实验所证实, 但是溶液中还存在有其它类型的离子(分子), 因其相对含量低且容易发生转化
[2 ,3 ]
, 用常规检测手段很难区分。 同时在该铝酸钠溶液中, 存在着钠离子、铝酸根离子等的强水合作用, 使离子(分子)在溶液中有较强的溶剂化作用
[2 ,3 ,6 ]
。
由于大多数溶液中的化学反应及化学特性与在真空状态下有很大差别, 为此人们提出了许多理论计算模型来探求溶质的溶剂化作用, 如polarizable continuum model(PCM), self-consistent reaction field (SCRF) model, conductor-like screening model (COSMO) 等
[7 ,8 ,9 ]
。 本文作者采用Dmol3 中DFT/COSMO模型程序包, 从理论上研究高苛性比中等浓度铝酸钠溶液中水合离子(分子)的特性, 并分析其在溶液中的存在形式和彼此之间的平衡转化关系。 本工作采用的DFT/COSMO溶剂模型处理溶质的溶剂化作用具有精确、节省机时的特点
[10 ,11 ,12 ]
, 计算结果将对氧化铝工业生产具有一定的理论指导意义。
1 计算方法
选取UHF/BLYP/DNP水平的从头算密度泛函方法, 对高苛性比中等浓度铝酸钠溶液中可能存在的各类离子(分子)的总能量、几何构型、振动频率进行精确计算
[6 ]
。 几何优化梯度小于2 kJ/mol , 本征值与本征函数收敛精度为10-3 kJ/mol。 对于溶液中离子(分子)水合自由能的计算, 选用DFT/COSMO模型
[10 ,11 ,12 ,13 ]
, 水的介电常数ε 取78.4, COSMO溶剂半径为1.30 ?, 每个原子的COSMO片段值为92, 而其格点数选1082, 为了修正COSMO模型中的“电荷外漏”现象, 选用修正半径增量为0.15 ?
[13 ]
。 所有的计算工作均在中南大学化学化工学院量化工作站Cerius2 程序中完成。
2 结果与讨论
2.1几何构型及水合自由能的计算
依据文献
[
2 ,
3 ,
14 ]
, 在铝酸钠溶液成核结晶过程中存在如下3个实验事实: 聚合离子通过缩合结晶释放出自由水; 随溶液中铝酸根离子的浓度下降, 溶液中聚合离子消失; 单体铝酸根离子是主要成分, 溶液保持相对稳定。 因此, 本研究选取高苛性比中等浓度铝酸钠溶液中可能存在的离子(分子)种类: Al(OH)3 H2 O, Al(OH)3 , Al(OH)- 4 , Al(OH)2- 5 , Al(OH)3- 6 , Al(H2 O)3+ 6 , Na(H2 O)+ 6 , Na(H2 O)5 (OH), Na(H2 O)4 Al(OH)4 , Na(H2 O)+ 6 Al(OH)- 4 , 进行理论计算
[2 ]
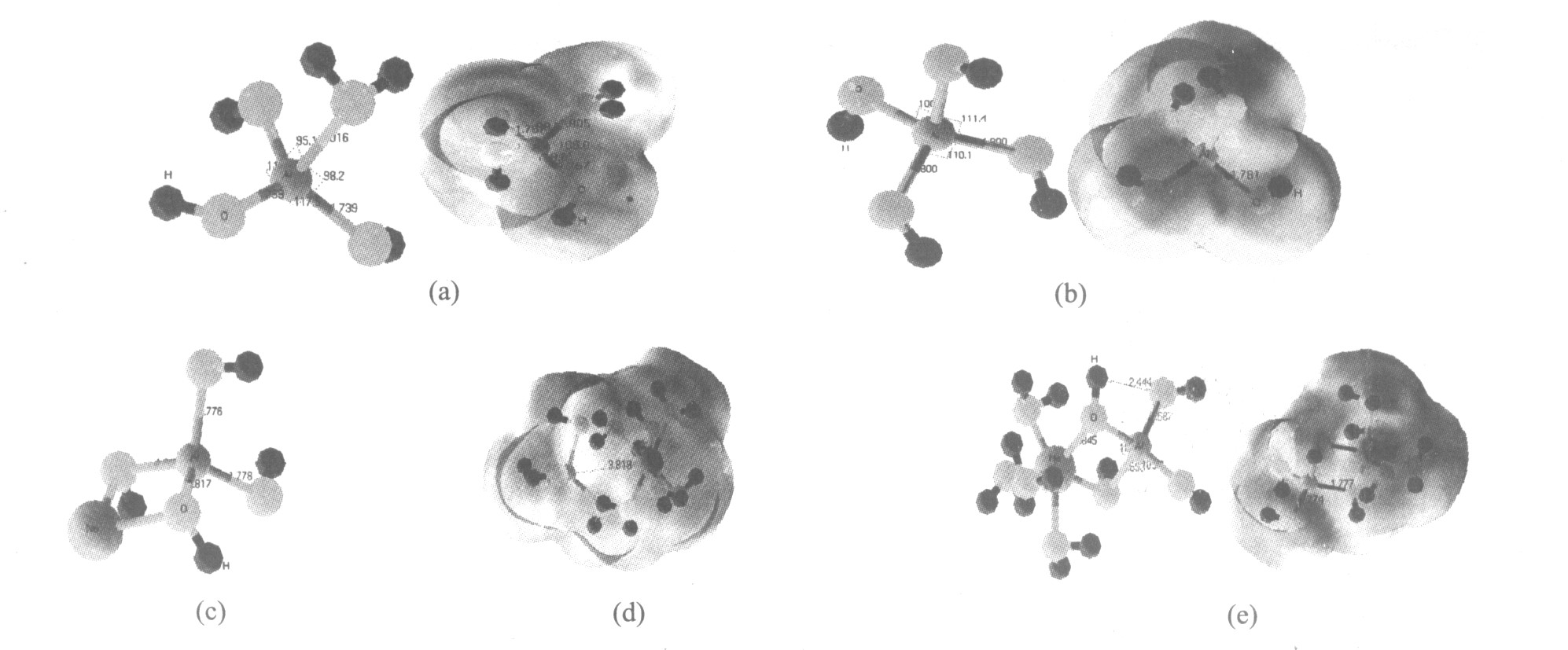
, 计算理论模型见图1。 通过计算得到其真空下Al—O键长R (Al—O)(vacu)、溶液中Al—O键长R (Al—O)(sol)、真空下总能量E vacu 以及相应的水合自由能G hydr , 计算结果见表1和表2。
从表1中Al(OH)- 4 , Al(OH)
2 ? 5
5
2
-
, Al(OH)
3 ? 6
6
3
-
的几何构型来看, 由于溶质的溶剂化作用, Al—O键长均有所减少。 但中性分子Al(OH)3 H2 O从真空到溶液中的Al—O键长稍微变大, Al—O(H2 ) 键长却明显缩短。 在Na(H2 O)+ 6 Al(OH)- 4 中与钠原子相邻的两个Al—O键长从真空状态的1.817 ?减少到水溶液中的1.778 ?, 另2个的Al—O键长则缩小了0.01 ?左右。 Na(H2 O)4 Al(OH)4 离子对中Al—O键长变化与Na(H2 O)+ 6 Al(OH)- 4 离子对相类似。 Al(OH)3 H2 O, Al(OH)- 4 , Na(H2 O)4 Al(OH)4 , Na(H2 O)+ 6 Al(OH)- 4 在COSMO模型中计算的Al—O键长值与李洁
[2 ]
、 Radnai
[15 ]
通过X射线衍射得到的高苛性比中等浓度铝酸钠溶液结构参数中Al—O键长值(1.75~1.80 ?)具有很好的一致性。
图1 部分优化的离子及相应的COSMO模型的几何构型(UHF/BLYP/DNP水平)
Fig.1 Equilibrium geometries and relevant hydrated models calculated at DFT/BLYP/DNP level for partial species
(a)—Al(OH)3 H2 O;(b)—Al(OH)- 4 ;(c)—NaAl(OH)4 ;(d)—Na(H2 O)+ 6 Al(OH)- 4 ;(e)—Na(H2 O)4 Al(OH)4
表1 各类离子(分子)的Al—O键长及真空下的总能量
Table 1 Calculated distances of nearest-neighbor Al—O andtotal energies(in vacuum)for various species
R (Al—O)(vacu)/?R (Al—O)(sol)/?E vacu /(kJ·mol-1 )
3 1.718
1.748
-1.233×106
3 H2 O1.739; 2.1061)
1.767; 1.8051)
-1.434×106
- 4 1.800
1.781
-1.432×106
2- 5 1.849
1.819
-1.631×106
3- 6 2.015
1.918
-1.828×106
2 O)3+ 6 1.7991)
1.8181)
-1.837×106
2 O)4 Al(OH)4 1.817×22) ; 1.776×2
1.777×22) ; 1.764×2
-1.858×106
2 O)+ 6 Al(OH)- 4 1.817×22) ; 1.776×2
1.778×2; 1.768×2
-1.858×106
1) Distance of Al—O(H2 ); 2) distance of Al—O(Na).
表2 离子(或分子)的水合自由能
Table 2 Hydrated free energies of species
(E sol -E vacu )/(kJ·mol-1 )
G diel (corr)/(kJ·mol-1 )G non-elec /(kJ·mol-1 )G hydr /(kJ·mol-1 )
3 -132.146
-1.356
12.061
-121.441
3 H2 O-100.933
-4.695
12.951
-92.676
- 4 -295.348
-21.986
12.832
-304.502
2- 5 -943.752
-54.726
13.229
-985.337
3- 6 -1379.431
-105.575
12.883
-1472.123
2 O)3+ 6 -59.017
32.215
13.495
-13.334
2 O)4 Al(OH)4 -66.598
-5.5397
15.998
-56.139
2 O)+ 6 Al(OH)- 4 -127.126
-7.745
17.888
-137.269
2 O)+ 6 -340.801
11.098
14.442
-315.261
2 O)5 OH-199.985
-3.363
14.363
-188.984
依据量子化学计算处理溶剂化作用的有关原理
[11 ]
, 溶质的水合自由能包含3个部分: 溶质从真空中溶入溶剂中的能量(E sol -E vacu ); 溶剂形成空穴所需的能量(G non-elec ); 溶质对溶剂的极化作用(G diel )。 考虑到“电荷外漏”, 对G diel 进行修正为G diel (corr)
[13 ]
。
由表2可知, 在铝酸根离子Al(OH)- 4 , Al(OH)2- 5 和Al(OH)
3 ? 6
6
3
-
中离子所带负电荷越多, 获得的水合自由能越大。 为了了解溶液中离子(分子)之间的转化关系以及相对稳定性, 分别利用各类离子(分子)的E vacu , E sol -E vacu 值, 分析它们可能反应的能量变化情况, 计算结果见表3。 从表3看出, Al(OH)3 H2 O转化为Al(OH)- 4 的反应(1), 在真空下能量变化为-262.09 kJ/mol, 而在溶液中是-147.55 kJ/mol。 同样, 可以看出对反应(3)、 (4)和(5), Al(OH)- 4 最具有能量优势, 应为铝酸根阴离子的主要成分。 反应(7)中Na(H2 O)+ 6 与Al(OH)- 4 通过质子交换形成Na(H2 O)6 OH和Al(OH)3 H2 O的能量变化为10.45 kJ/mol, 但高苛性比中等浓度铝酸钠溶液中水合钠离子含量相对很大, 所以中性分子Al(OH)3 H2 O很可能稳定存在于该溶液中。 由反应(8)可知, Na(H2 O)+ 6 , Al(OH)- 4 比Na(H2 O)4 Al(OH)4 更具有能量优势, 因此可以认为随溶液中自由水增多, Na(H2 O)4 Al(OH)4 中钠与铝原子共享的配位体羟基分开, 水分子配位到钠离子形成Na(H2 O)+ 6 Al(OH)- 4 。
2.2Al(OH)3H2O与Al(OH)-4的Al—O键伸缩振动分析
李洁
[2 ]
曾利用Raman光谱以及红外光谱对中等浓度过饱和铝酸钠溶液自发成核进行在线分析时发现, 随苛性比的增大在低频区出现新的弱的振动峰。 实验测得高苛性比中等浓度铝酸钠溶液的Raman光谱与红外光谱值在625 cm-1 处有一吸收峰, 并证实为Al(OH)- 4 离子的特征伸缩振动
[2 ,4 ]
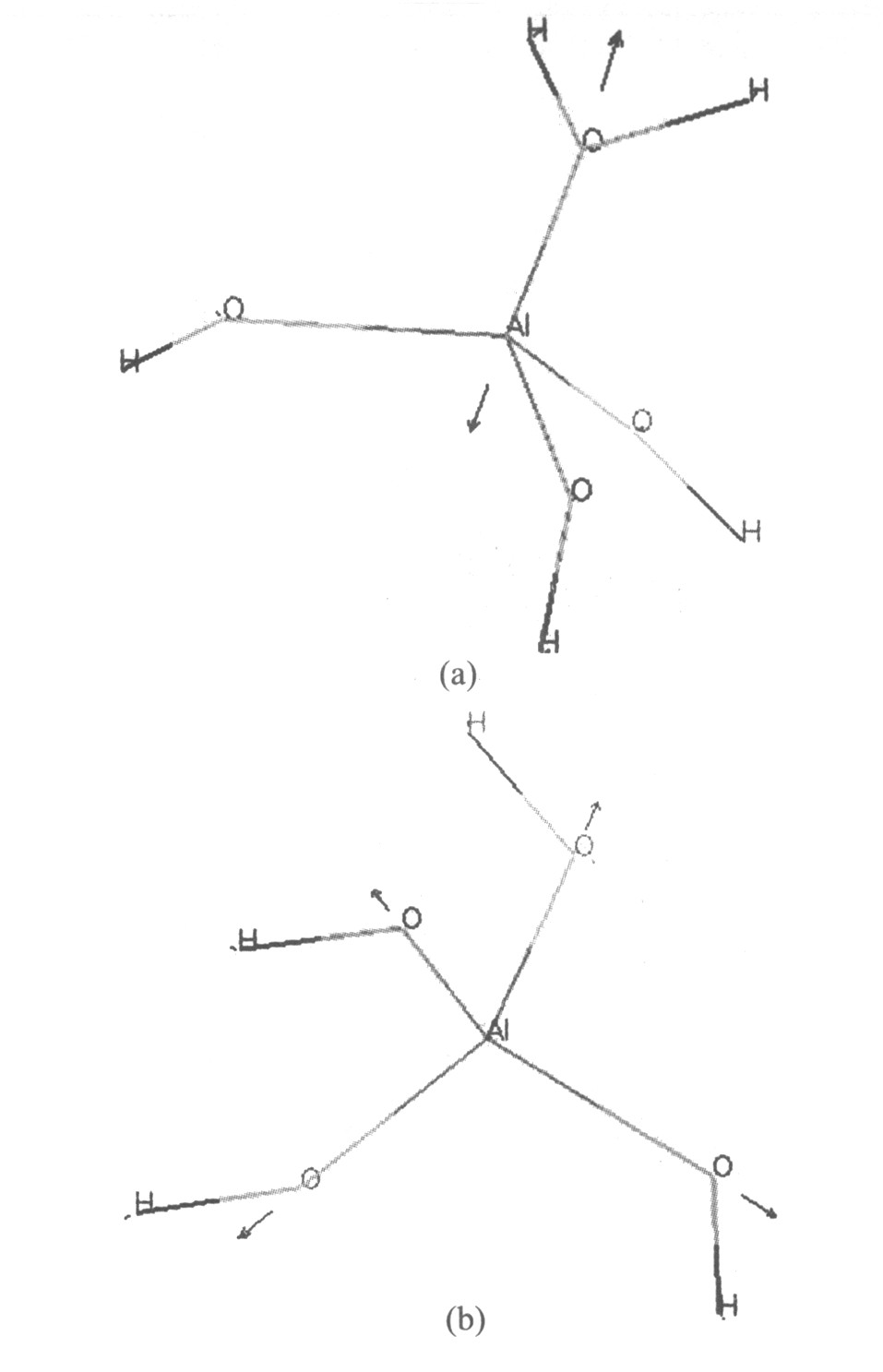
。 利用BLYP/DNP计算真空下和溶液中Al(OH)3 H2 O、 Al(OH)- 4 的Al—O对称伸缩振动频率发现(如图2), 真空下Al(OH)3 H2 O中Al—O对称伸缩振动频率为428 cm-1 , 而在水溶液中则是423 cm-1 ; Al(OH)- 4 离子则分别是610 cm-1 和628 cm-1 。 可知Al(OH)- 4 在溶液中的振动频率理论计算值能较好地与实验测定值吻合。 但水合Al(OH)3 H2 O在423 cm-1 的对称伸缩振动特征光谱不能从谱图上显示出来, 可能是因为Al(OH)3 H2 O的存在量相对少而被其它峰所掩盖。
表3 在真空状态下与在溶液中离子之间各类可能反应的能量变化
Table 3 Calculated energy changes of various probable reactions in vacuum and in solution
Reaction
ΔE (vacu)/(kJ·mol-1 )
ΔE (sol)/(kJ·mol-1 )
Al(OH)3 H2 O+OH- →Al(OH)- 4 +H2 O
-262.09
-147.55
Al(OH)3 +H2 O→Al(OH)3 H2 O
-59.36
-15.47
Al(OH)- 4 +OH- →Al(OH)
2 ? 5
5
2
-
2 96.7896.30
Al(OH)- 4 +2OH- →Al(OH)
3 ? 6
6
3
-
2 001.38328.55
Al(OH)- 4 +6H2 O→Al(H2 O)
3 + 6
6
3
+
+ 4OH-
6 358.19
2 107.97
Na(H2 O)+ 6 +Al(OH)- 4 →Na(H2 O)+ 6 Al(OH)- 4
-238.69
-11.16
Na(H2 O)+ 6 +Al(OH)- 4 →Al(OH)3 H2 O+Na(H2 O)5 (OH)
-
10.45
Na(H2 O)4 Al(OH)4 +2H2 O→Na(H2 O)+ 6 Al(OH)- 4
-
-20.822
2.3 平衡反应的热力学分析
利用BLYP/DNP计算了真空下各类离子(分子)的振动频率, 并确保所有振动频率均为正值, 对Na(H2 O)4 Al(OH)4 和Na(H2 O)+ 6 Al(OH)- 4 在真空状态下则计算NaAl(OH)4 的振动频率
[9 ]
。 得到标准状态下各类物质的零点振动能(ZPE)、热容(c p S )、焓(H 0 -H T )等一系列离子(分子)的热力学数据。 由于在该水平下频率校正系数f 约为0.98
[16 ]
, 所以热力学分析可忽略频率校正, 部分计算结果见表4。
根据量子化学计算原理及有关热力学理论
[16 ,17 ]
, 反应焓变:
ΔH T =ΔE 0 +ΔZPE+Δ(H 0 -H T ) (1)
反应熵变:
ΔS T =∑S back, T -∑S for, T (2)
真空下反应吉布斯自由能:
G T, vacu =H T -TS T (3)
对于溶液中反应吉布斯函数(G sol )则利用水合自由能(G hydr )进行修正:
图2 Al(OH)3H2O与Al(OH)-4的振动计算模型
Fig.2 Calculated normal modes of vibration for Al(OH)3 H2 O(a) and Al(OH)- 4 (b)
G T, hydr =T T, diel +G T, np +(E sol -E vacu ) (4)
G T, sol =G T, vacu +G T, hydr (5)
从表3可知, 溶液中反应(2), (6), (7), (8)的能量值比较小。 但是由于高苛性比铝酸钠溶液中钠离子、氢氧根离子的相对含量大, 且存在钠离子的水合作用、氢氧根离子的极化作用
[18 ]
, 所以选出有Al(OH)- 4 参加的(6)、 (7)反应作进一步热力学分析。 利用表4中的有关热力学数据以及公式(1)~(5)计算出标准状态下反应(7)的ΔH T =-82.23 kJ/mol,-T ΔS T =8.36 kJ·mol-1 , ΔG T, hydr =78.08 kJ/mol。 利用水合自由能校正则为ΔG T, sol =4.21 kJ/mol=-2.303 RT lgK a 。 因此, 可以求得溶液中该反应的lgK a =-0.22。 同理, 可求得溶液中反应(8)的lgK a =0.01。 因此在高苛性比中等浓度铝酸钠溶液中, 很可能存在如下平衡转化关系:
表4 298.15 K、1.01×105 Pa下部分离子的热力学性质
Table 4 Thermodynamics data of partial species at 298.15 K and 1.01×105 Pa
ZPE/(kJ·mol-1 )
c p /(J·mol-1 ·K-1 )S /(J·mol-1 ·K-1 )H 0 -H T /(kJ·mol-1 )
3 H2 O160.27
123.79
366.91
26.57
- 4 131.03
106.58
335.59
20.51
4 149.32
119.91
342.60
21.10
2 O)+ 6 383.95
183.42
384.41
28.91
2 O)5 (OH)339.04
172.05
381.13
28.04
Al(OH)- 4 (aq)+Na(H2 O)+ 6 (aq)
Al(OH)3 H2 O(aq)+Na(H2 O)5 OH(aq)
Na(H2 O)+ 6 (aq)+Al(OH)- 4 (aq)
Na(H2 O)+ 6 Al(OH)- 4 (aq)
3 结论
1) 对于高苛性比中等浓度铝酸钠溶液, 由于大量自由水的存在, 采用COSMO溶剂模型处理离子(分子)能较好地表征溶液中离子(分子)的溶剂化作用。
2) 从Al(OH)3 H2 O与Al(OH)- 4 的计算振动频率分析可知, 利用红外、拉曼光谱理论上可以明显地区分这两类物质的存在。 但实验光谱分析在423 cm-1 处没有发现明显吸收峰, 可能是因为Al(OH)3 H2 O含量不高而被其它峰值所掩盖。
3) Al(OH)3 H2 O, Al(OH)- 4 , Na(H2 O)+ 6 Al(OH)- 4 在COSMO模型中优化的Al—O键长与溶液X射线衍射分析结果一致, 热力学分析同样说明了这些离子(分子)或离子对存在的可能性。
参考文献
[1] 陈念贻.氧化铝生产的物理化学[M].上海:上海科技出版社,1962.1230.CHENNian yi.PhysicalChemistryofProducingAlumina[M].Shanghai:ShanghaiScienceandTechnologyPress,1960.1230.
[2] 李 洁.过饱和铝酸钠溶液结构及分解机理的研究[D].长沙:中南大学.2001.LIEJie.TheoreticalStudyoftheStructureandAnalyzingMechanismofSupersaturationSodiumAlumianteSolution[D].Changsha:CentralSouthUniversity,2001.
[3] PuchkovLV,Chakhal yanKHO.Thermodynamicassessmentofvarioushypothesesofthestructureofaluminatesolutions[J].JAppliedChemoftheUSSR,1976,49(9):14151419.
[4] 刘洪霖,黄世萍,陈念贻,等.铝酸钠溶液阴离子的量子化学研究[J].中国有色金属学报,1992,2(3):3033.LIUHong lin,HUANGShi ping,CHENNian yi,etal.Quantumchemistrystudyonthenegativeionsinsodiumaluminatesolution[J].TheChineseJournalofNonferrousMetals,1992,2(3):3033.
[5] 刘洪霖,曹益林,陈念贻,等.铝酸钠溶液的紫外吸收峰[J].物理化学学报,1992,8(4):441444.LIUHong lin,CAOYi lin,CHENNian yi,etal.TheUV absorptionpeaksofsodiumaluminatesolution[J].ActaPhysChimSin,1992,8(4):441444.
[6] TossellJA.Theoreticalstudiesonaluminateandsodiumaluminatespeciesinmodelsforaqueoussolution:Al(OH)3,Al(OH)-4,NaAl(OH)4[J].AmericanMineralogist,1999,84(3):16411649.
[7] 汤俊明,轩小朋,王键吉,等.高氯酸锂在有机溶剂中离子溶剂化和离子缔合的红外光谱研究[J].光谱学与光谱分析,2001,21(4):472474.TANGJun ming,XUANXiao peng,WANGJian ji,etal.AnIRstudyofionsolvationandassociationoflithiumperchlorateinsomeorganicsolvents[J].SpectroscopyandSpectralAnalysis,2001,21(4):472474.
[8] 李芝芬,钱 泓,黄忆宁,等.35Cl的核磁共振法研究高氯酸钙的离子缔合和离子溶剂化[J].高等学校化学学报,1989,10(7):738742.LIZhi fen,QIANHong,HUANGYin ling,etal.AstudyonionpairandionicsolvationofCa(ClO4)2insome
solventsandtheirmixturesby35ClNMR[J].ChemicalJournalofChineseUniversities,1989,10(7):738742.
[9] 蒋华良,陈凯先.溶剂效应量子化学研究进展[J].化学通报,1995,4(1):2729.JIANGHua liang,CHENKai xian.Advanceofquantumchemistrystudyonsolventeffect[J].ChemistryOnline,1995,4(1):2729.
[10] KlantA ,CosmoSG .Anewapproachtodielectricscreeninginsolventswithexplicitexpressionsforthescreeningenergyandits gradient[J].JChemSoc(PerkinTrans),1993,2:799.
[11] AndzelmJ ,KolmelC ,KlamtA .Incorporationofsol venteffectsintodensityfunctionalcalculationsofmolec ularenergiesandgeometries[J].JChemPhys,1995,103(21):93129319.
[12] CatlowRA ,CoraF ,SokolA ,etal.Electronspinlo calisationandcorrelationeffectsforpointdefectsinse mi ionicsolids[J].ComputMaterialsSci,2000,17(5):312318.
[13] KlamtA ,JonasV .Treatmentoftheoutlyingcharge incontinuumsolvationmodels[J].JChemPhys,1996,105(22):99729980.
[14] GersonAR ,RalstonJ,SmartRC ,etal.Aninvesti gationofthemechanismofgibbsitenucleationusingmolecularmodeling[J].ColloidsandSurfacesA ,1996,110(4):105117.
[15] RadnaiT ,MayPM .Structureofaqueoussodiumalu minatesolutions:asolutionX raydiffractionstudy[J].JPhysChemA ,1998,102(4):78417850.
[16] H啨bantP,PicardGS .EquilibriumreactionsbetweenmolecularandionicspeciesinpuremoltenLiClandLiCl+MCl(M =Na,K ,Rb)meltsinvestigated[J].JMoleStru,1995,358(14):3950.
[17] MartinH ,MarglPM ,SchmidR ,etal.Abinitiomoleculardynamicswithacontinuumsolvationmodel[J].JChemPhys,2003,118(3):10891100.
[18] LubinMI ,BylaskaEJ ,WeareJH ,etal.Abinitiomoleculardynamicssimulationsofaluminumionsolva tioninwaterclusters[J].ChemPhysLetters,2000,322(6):447453.