文章编号:1004-0609(2008)05-0867-06
制备过程pH值对FePO4?xH2O及LiFePO4性能的影响
郑俊超,李新海,王志兴,郭华军,王丹琴
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
以FeSO4·7H2O,H3PO4,H2O2和NH3·H2O为原料合成FePO4·xH2O前驱体,考察制备过程溶液pH值对合成FePO4·xH2O前驱体性能的影响;将Li2CO3,FePO4·xH2O和乙炔黑球磨混合,通过低温固相反应合成LiFePO4。用X射线衍射和扫描电镜对FePO4·xH2O和LiFePO4进行结构和表面形貌表征,研究不同pH值条件下合成的FePO4·xH2O前驱体为原料对制备的LiFePO4电化学性能的影响。结果表明:溶液pH值1.5时制备的FePO4·xH2O中含有少量Fe(PO4)2(OH)2杂质,当pH分别为2、3、4和5时,合成的FePO4·xH2O均为纯相。pH值为2左右合成的FePO4·xH2O前驱体制备出的LiFePO4具有良好的电化学性能;其振实密度达1.11 g/cm3。
关键词:
中图分类号:TM 912.9 文献标识码:A
Effect of pH value on performance of FePO4?xH2O
and LiFePO4 in synthesis process
ZHENG Jun-chao, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, WANG Dan-qin
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: FePO4·xH2O precursor was synthesized from FeSO4·7H2O, H3PO4, H2O2 and NH3·H2O under various pH value. LiFePO4 cathode material was then synthesized by low temperature sintering of the homogeneous mixture of Li2CO3,acetylene black and FePO4·xH2O. The effect of the solution pH on the performance of FePO4·xH2O was characterized. The structures of FePO4·xH2O and LiFePO4 were characterized by XRD and SEM. The effect of the solution pH on the electrochemical performance of LiFePO4 was discussed. The results show that no impurities exist in the FePO4·xH2O synthesized at pH value ranging in 2 and 5. LiFePO4 made from FePO4·xH2O precursor synthesized under the condition that the solution pH is about 2 show excellent electrochemical performance, and the tap density reaches 1.11 g/cm3.
Key words: lithium ion batteries; LiFePO4; FePO4·xH2O; electrochemical performance
橄榄石型锂离子电池正极材料LiFePO4具有资源丰富、环境友好以及优越的安全性[1],被认为是新一代锂离子电池的首选正极材料[2-3]。
合成LiFePO4的方法众多,如高温固相反应[4],水热合成[5],溶胶-凝胶法[6],共沉淀法[7-8],微波烧结法[9],碳热还原法[10]。其中最常用的是高温固相法,一般采用FeC2O4·2H2O或Fe(CH3COO)2,(NH4)H2PO4或 (NH4)2HPO4,Li2CO3或LiOH为反应物,均匀混合后在惰性气氛或还原性气氛下经高温煅烧一段时间合成LiFePO4。
DELACOURT[11]在低温合成磷酸盐系列锂离子电池材料时,探讨过制备过程中pH值对合成的FePO4·xH2O晶体结构的影响;朱柄权等[12]曾用共沉淀法制备FePO4·xH2O前驱体,然后与乙炔黑混合,在惰性气氛保护下,利用碳热还原反应法制备LiFePO4。然而,他们并没有考虑溶液pH值对合成FePO4·xH2O前驱体的性能的影响,以及对合成LiFePO4的电化学性能的研究。
1 实验
1.1 FePO4·xH2O的制备
配制浓度均为0.1 mol/L的FeSO4溶液和H3PO4溶液,以一定的流速同时加入烧杯中,并强烈搅 拌,将烧杯置于恒温水浴中,温度保持60 ℃。反应 5 min后,加入过量H2O2(浓度为30%),用氨水(浓度为30%)调节pH值,溶液中立即出现大量白色沉 淀。搅拌15 min,过滤洗涤,在120 ℃烘12 h,得到浅黄色粉末。
1.2 LiFePO4/C的制备
将烘干后的FePO4·xH2O与Li2CO3按摩尔比1?0.5混合,并加入过量的10%乙炔黑,充分球磨后,装入管式炉中。在氩气保护下,于650 ℃煅烧12 h,得 到LiFePO4/C。采用碳硫分析法测得其碳含量为10%左右。
1.3 材料表征
采用CS800红外碳硫检测仪(Eltar公司,德国)对合成材料中的碳含量进行分析。用X射线衍射仪(Rint-2000, Rigaku)和扫描电镜(JEOL,JSM-5612LV)研究样品的晶体结构和表面形貌。粒度分析仪由Malvern Instruments Ltd生产。比表面采用北京汇海宏纳米科技有限公司生产的3H-2000全自动氮吸附比表面积测试仪测试。振实密度的测定:将20 g样品置入50 mL量筒中并振实至体积不再有明显变化,则 其振实密度ρ=20/V (g/cm3),其中V为样品振实后的体积(cm3)。
1.4 电池组装和测试
实验电池正极片由合成的LiFePO4、导电剂乙炔黑与粘结剂PVDF按质量比8?1?1混合,加入N-甲基吡咯烷酮(NMP),均匀涂覆在铝箔上,于60 ℃的真空干燥箱中干燥4 h。负极为金属锂,电解液为1 mol/L LiPF6 的EC+DEC(1?1)溶液,隔膜为Celgard2400膜,在氩气保护的手套箱内装配成CR2025型扣式电池。充放电测试在Neware公司生产的充放电测试仪上完成,测试的温度为常温,充放电电压范围为2.5~4.1 V。
2 结果讨论
2.1 pH值对FePO4·xH2O性能的影响
2.1.1 pH值对FePO4·xH2O物相的影响
根据DELACOUR[11]建立的溶解性曲线可以看出,当溶液pH值为2~8之间时,FePO4·xH2O可以稳定存在。为了研究不同pH值对合成FePO4·xH2O的性能的影响,本研究控制pH值分别为1.5,2,3,4和5进行研究。图1所示为不同pH值条件下合成的FePO4·xH2O经过620 ℃,20 h热处理后转化为晶态的FePO4的XRD谱。从图1可以看出,除pH=1.5时XRD谱中有明显的Fe(PO4)2(OH)2杂质峰外,其他pH值如2,3,4和5时的衍射峰与纯相FePO4 (JCPDS29-715)谱吻合,说明合成的FePO4均为纯相,并且为六方层状结构[13]。
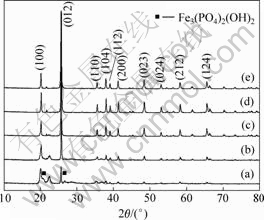
图1 pH值不同时合成的FePO4的XRD谱
Fig.1 XRD patterns of FePO4 prepared at different pH values: (a) pH=1.5; (b) pH=2; (c) pH=3; (d) pH=4; (e) pH=5
2.1.2 pH值 对FePO4·xH2O形貌的影响
图2所示为不同pH条件下合成的FePO4·xH2O的扫描电镜图。由图2可知, 所合成的FePO4·xH2O颗粒细小,粒径分布较均匀,且随着pH值的升高,合成的FePO4·xH2O的颗粒粒径呈减小的趋势。
FePO4·xH2O的具体形成反应过程如下:

图2 不同pH值条件下合成的FePO4·xH2O的SEM像
Fig.2 SEM images of FePO4·xH2O prepared at different pH values: (a) pH=1.5; (b) pH=2; (c) pH=3; (d) pH=4; (e) pH=5
随着氨水的加入,反应(1)生成的H2SO4被迅速中和,溶液pH值升高,反应迅速向右移动,并生成更多的Fe3(PO4)2,这势必会增加Fe3(PO4)2的过饱和度,同样也会增加FePO4·xH2O的过饱和度。根据胶体理论,胶体的生成过程是新相的生成及其增长的过程,过程的推动力可以近似用自由能差值来描述[14]。由简化的Van’t Hoff方程式进行计算[14]:

可以看出,过饱和度?c越大,引起?G越负,核化速率越快。即随着溶液pH值的升高,FePO4·xH2O的成核速率加快,在调pH值后的一瞬间会形成大量晶核(即爆发式成核),晶核的生长速率相对减慢[14],从而最后形成粒径较小的颗粒。所以,随着溶液pH值的上升,合成的FePO4·xH2O的颗粒呈逐渐减小的趋势。
2.1.3 pH值对FePO4·xH2O性能参数的影响
LiFePO4的振实密度低是限制其大规模应用的一个很大的问题。前驱体颗粒粒径、比表面积及振实密度势必对合成的LiFeO4的振实密度有影响。不同pH条件下制备的FePO4·xH2O前驱体的比表面积和振实密度如表1所示。可见,随着pH值的上升,样品的粒度减小,比表面有所增加,振实密度则逐渐变小。从LiFePO4/C材料合成的方面来说,前驱体的粒径小、
表1 不同样品的性能参数
Table 1 Performance parameters of samples with different pH values
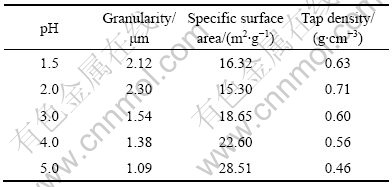
比表面积大,反应的活性也越大,反应所需要的温度就越低,合成效率就越高;然而,从电池的制作工艺来说,颗粒小、比表面积大会引起材料的振实密度低,将会导致材料的体积能量密度低,难以得到应用。从上面2个方面来考虑,前驱体制备过程中pH值不宜过高。
2.2 pH值对LiFePO4/C性能的影响
A1,A2,A3和A4表示pH值分别为2,3,4和5时制备出的FePO4·xH2O为前驱体,在氩气气氛下经650 ℃碳热还原12 h后得到的LiFePO4/C,其碳含量分别为10.5%,10.32%,10.2%和10.9%。图3所示为所得到的LiFePO4物相分析图谱。从图3可以看出,在以pH值分别为2,3,4和5时合成的FePO4·xH2O为前驱体合成的LiFePO4中的衍射峰位置与纯的正交橄榄石结构LiFePO4(JCPDS40-1499)的衍射峰位置几乎相同,说明合成的LiFePO4为纯相[15]。过量的碳以无定型态存在,对LiFePO4晶体结构没有影响。
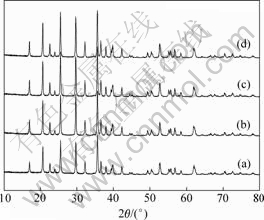
图3 不同pH值条件下合成的LiFePO4的XRD谱
Fig.3 XRD patterns of LiFePO4 prepared at different pH values: (a) pH = 2; (b) pH = 3; (c) pH = 4; (d) pH = 5
图4所示为以不同pH条件下合成的FePO4·xH2O为前驱体,在氩气气氛下经650 ℃碳热还原12 h后得到的LiFePO4的SEM像。图中大颗粒为LiFePO4,絮状物为无定型碳。根据PROSINI等的研究,加碳量为10%时,LiFePO4/C材料的电导率为1.7×10-3 S/cm,比纯相的电导率(10-10 S/cm)提高7个数量级[16]。也就是说,碳均匀地分布在LiFePO4之间,能显著提高LiFePO4的电导率。比较图4与图2还可以看出,合成的LiFePO4颗粒粒径随pH值的变化趋势与前驱体颗粒粒径变化趋势一致,即随着pH值的升高,合成出的LiFePO4的颗粒逐渐变小。图4(b)所示的颗粒团聚比较明显,图4(c)和图4(d)所示的颗粒虽然粒子比较小,有利于锂离子的扩散,然而,由于比表面能较高,颗粒间的引力比较大,导致颗粒团聚,并且碳包覆也不明显,不利于提高材料的电子导电性;另一方面,颗粒粒径太小也容易导致材料的振实密度低。图4(a)所示为pH值为2时合成的LiFePO4的SEM像,可以看出粒子呈类球形,其颗粒粒径分布均匀,一次粒子粒径为0.5~1.0 μm,并且粒子被絮状的无定型碳包围,絮状碳颗粒在LiFePO4颗粒之间形成碳桥,增强LiFePO4的导电性,提高活性物质的利用率[16],从而有利于提高LiFePO4的比容量。

图4 不同pH值条件下合成的LiFePO4的SEM像
Fig.4 SEM images of LiFePO4 prepared at different pH values: (a) pH = 2; (b) pH = 3; (c) pH = 4; (d) pH = 5
图5所示为以不同pH值条件下合成的 FePO4·xH2O为前驱体,在氩气气氛下650 ℃碳热还原12 h得到的LiFePO4在0.1C倍率下的首次放电曲线。其中pH值为2,3,4和5时的首次放电曲线分别用符号S1,S2,S3和S4表示。
从图5可以看出,S1、S2、S3和S4的放电比容量分别为145.4、137、117.2和115.3 mA·h/g。其中S1的放电比容量最高,S4放电比容量最低,即当溶液pH=2时,由合成的FePO4·xH2O前驱体制备出的LiFePO4/C复合材料的首次放电性能最优良。图6所示为pH=2条件下合成的LiFePO4/C在不同倍率下的放电曲线和循环曲线。可以看出,随着放电电流的增大,电池的放电比容量逐渐减小,在0.2C,0.5C和1C放电时,首次放电容量分别为139,131和126 mA·h/g。从图6(b)所示的不同倍率放电的循环曲线可以看出,在该条件下合成的LiFePO4/C材料在中等倍率放电条件下具有良好的循环性能。在0.1C,0.2C,0.5C和1C倍率下经50次循环后,容量的保持率分别为98%,97.8%,97.7%和97.6%。此外,该样的振实密度高达1.11 g/cm3。
综上所述,制备过程中pH值对FePO4·xH2O及LiFePO4/C性能的影响很大,经研究发现,pH值应该控制在2左右。
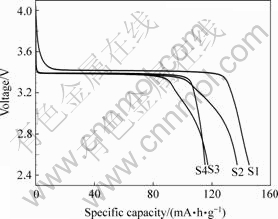
图5 不同pH值条件下合成LiFePO4/C的放电曲线
Fig.5 Discharge curves of LiFePO4/C prepared at different pH values: S1—pH = 2; S2—pH = 3; S3—pH = 4; S4—pH = 5
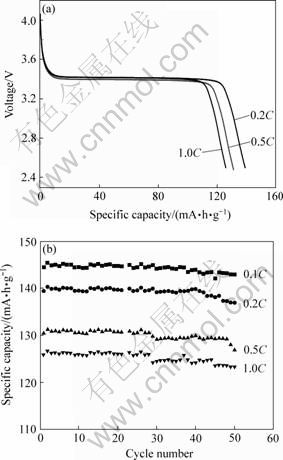
图6 pH=2时合成的LiFePO4/C的不同倍率放电曲线和循环图
Fig.6 Discharge curves(a) and cycling performance(b) of LiFePO4/C prepared at pH=2
3 结论
1) 以FeSO4·7H2O,H3PO4,H2O2和NH3·H2O为原料,通过共沉淀法在不同pH值条件下合成了FePO4·xH2O前驱体, 结果表明:pH值在1.5时制备出的FePO4·xH2O中含有少量Fe(PO4)2(OH)2杂质,当pH值分别为2,3,4和5时合成的FePO4·xH2O均为纯相。
2) 可以通过控制制备过程中pH值来定性控制FePO4·xH2O及LiFePO4粒径;制备出的FePO4·xH2O和LiFePO4颗粒粒径随制备过程pH值的变化趋势是一致的,即都随着pH值的升高,颗粒粒径逐渐变小。
3) 以pH=2条件下合成的FePO4·xH2O为原料制备出的LiFePO4/C复合材料电化学性能优于其他pH值下合成的LiFePO4/C,该样于0.1C倍率下的首次放电比容量达到145 mA·h/g,50次循环后容量保持率高达98%;并且其振实密度高达1.11 g/cm3。
REFERENCES
[1] PANHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4): 1188-1194.
[2] YAMADA A, CHUNG S C, HINOKUMAK. Optimized LiFePO4 for lithium battery cathodes[J]. J Electrochem Soc, 2001, 148(3): A224-A229.
[3] HUANG H,YIN S C, NAZAR L F. Approaching theoretical capacity of LiFePO4 at room temperature at high rates[J]. Electrochemical and Solid-State Letters, 2001, 4(10): A170-A172.
[4] MI C H, CAO G S, ZHAO X B. Low-cost, one-step process for synthesis of carbon-coated LiFePO4 [J]. Material Letters, 2005, 59(1): 127-130.
[5] MELIGRANA G, GERBALDI C, TUEL A, BODOARDO S, PENAZZI N. Hydrothermal synthesis of high suiface LiFePO4[J]. J Power Sour, 2006, 160(1): 516-522.
[6] HU Yao-qin, DOEFF M M, KOSTECHI R, FINONES R. Electrochemical performance of sol-gel synthesized LiFePO4[J]. J Electrochemical Soc, 2004, 151(12): 1279-1285.
[7] PARK K S, SON J T, CHUNG H T, KIM S J, LEE C H, KIM H G. Synthesis of LiFePO4 by co-precipitation and microwave heating[J]. Electrochemistry Communications, 2003, 5(10): 839-842.
[8] ARNODE G, GARCHE J, HEMMER R, STROBELE S. Fine-particle iron phosphate LiFePO4 synthesized by a new low-cost aqueous precipitation technique[J]. J Power Sour, 2003, 119/121: 247-251.
[9] HIGUCHI M, KATAYAMA K, AZUMA Y. Synthesis of LiFePO4 cathode material by microwave processing[J]. J Power Sour, 2003, 119/121: 258-261.
[10] BAKER J, SAIDI M Y, SWOYER J L. Lithium iron (Ⅱ) phosphate olivines prepared by a novel carbonthermal reduction method[J]. Electrochem Solid-State Lett, 2003, 6(3): A53-A55.
[11] DELACOURT C, WURM C, REALE P. Low temperature preparation of optimized phosphates for Li-battery applications[J]. Solid State Ionics, 2004, 173(1/4): 113-118.
[12] 朱炳权, 李新海, 张 宝, 王志兴, 郭华军. 改进的碳热还原法制备正极材料LiFePO4/C[J]. 电池, 2005, 35(6): 445-447.
ZHU Bing-quan, LI Xin-hai, ZHANG Bao, WANG Zhi-xing, GUO Hua-jun. Synthesis of LiFePO4/C cathode material by modified carbonthermal method[J]. Battery Bimonthly, 2005, 35(6): 445-447.
[13] 雷 敏, 应皆荣, 姜长印, 万春荣. 高密度球形LiFePO4的合成及性能[J]. 电源技术, 2006, 30(1): 11-13.
LEI Min, YING Jie-rong, JIANG Chang-yin, WANG Chun-rong. Preparation and characteristic of high-density spherical LiFePO4[J].Chinese Journal of Power Sour, 2006, 30(1): 11-13.
[14] 郑 忠. 胶体科学导论[M]. 北京: 高等教育出版社, 1989: 17-18.
ZHENG Zhong. Introduction to colloid science[M]. Beijing: High Education Press of China, 1989: 17-18.
[15] HUANG H, YIN S C, NAZAR L F. Approaching theoretical capacity of LiFePO4 at room temperature at high rate[J]. Electrochemical and Solid-State Letters, 2001, 4(10): A170-173.
[16] PROSINI P P, ZANE D, PASQUALI M. Improved electrochemical performance of a LiFePO4 based composite cathode[J]. Electrochimica Acta, 2001, 46(23): 3517-3523.
基金项目:国家重点基础研究发展计划资助项目(2007CB613607)
收稿日期:2007-08-30;修订日期:2008-02-26
通讯作者:李新海,教授,博士;电话:0731-8836633;E-mail: tonyson_011@163.com
(编辑 龙怀中)
摘 要:以FeSO4·7H2O,H3PO4,H2O2和NH3·H2O为原料合成FePO4·xH2O前驱体,考察制备过程溶液pH值对合成FePO4·xH2O前驱体性能的影响;将Li2CO3,FePO4·xH2O和乙炔黑球磨混合,通过低温固相反应合成LiFePO4。用X射线衍射和扫描电镜对FePO4·xH2O和LiFePO4进行结构和表面形貌表征,研究不同pH值条件下合成的FePO4·xH2O前驱体为原料对制备的LiFePO4电化学性能的影响。结果表明:溶液pH值1.5时制备的FePO4·xH2O中含有少量Fe(PO4)2(OH)2杂质,当pH分别为2、3、4和5时,合成的FePO4·xH2O均为纯相。pH值为2左右合成的FePO4·xH2O前驱体制备出的LiFePO4具有良好的电化学性能;其振实密度达1.11 g/cm3。


