文章编号:1004-0609(2008)01-0171-06
Nb5+掺杂r-TiO2的光催化分解水析氧活性
吴道新1, 2,陈启元1,李 洁1,尹周澜1
(1. 中南大学 化学化工学院,长沙 410083;
2. 长沙理工大学 化学与环境工程学院,长沙 410077)
摘 要:
用钛酸丁酯低温水解方法合成不同掺杂Nb5+浓度的金红石型TiO2(r-TiO2)光催化剂,采用XRD、PL、DRS和BET等技术进行了催化剂表征。在光源为高压汞灯和氙灯、Fe3+为电子受体、悬浮液的pH值为2.0的条件下,考察Nb5+的掺杂量对r-TiO2粒子的光催化分解水析氧活性的影响,并探讨了掺杂催化剂的DRS,PL光谱与光催化活性的关系。结果表明:Nb5+的掺杂量在0.5%~3.0%范围时,Nb5+掺杂没有引起r-TiO2的晶型改变,表面形成氧空位,在导带底附近形成施主能级,有利于光生电子和空穴的分离,掺杂催化剂光催化活性增强;掺杂催化剂光致发光强度与其光催化析氧活性的变化趋势一致,Nb5+掺杂量在1.0%(摩尔分数)时,PL光谱强度最大,光催化析氧活性最高,紫外光源和可见光源析氧速率分别达480 μmol/(L?h)和78 μmol/(L?h);Fe3+的初始浓度为8.0 mmol/L时,催化剂析氧活性最高。
关键词:
中图分类号:O 643.32 文献标识码:A
Photocatalytic oxidation of water to O2 over Nb5+-dopant of r-TiO2
WU Dao-xin1, 2, CHEN Qi-yuan1, LI Jie1, YIN Zhou-lan1
(1. College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. Changsha University of Science and Technology, College of Chemistry and Environmental Engineering,
Changsha 410076, China)
Abstract: Photo-catalyst of rutile TiO2 with different Nb5+ doping concentrations were prepared by low temperature hydrolysis using Tetrabutyl titanate(C16H36O4Ti) as raw material. Powders were characterized by XRD, PL, DRS and BET. Using Fe3+ as electron acceptor at pH 2.0 under UV irradiation and visible radiation, the effects of various Nb5+ doping concentration on the photocatalytic oxidation activity of Nb5+ doped rutile TiO2 particles were investigated. The relationships between the DRS, PL spectra with the photaocatalytic activity were also discussed. The results show that with appropriate concentration in 0.5%?3.0%, Nb5+ is doped into rutile TiO2 lattice without causing any change in rutile TiO2 crystal structure. Therefore, surface oxygen vacancies and the donor energy level near the bottom of the conduction band lead to easier separation of photoinduced electrons from holes to achieve stronger photocatalytic activity. The highest photocatalytic oxygen evolution and PL spectra intensity are achieved with the O2 evolution speed of 480 μmol/(L?h) and 78 μmol/(L?h) under UV irradiation and visible radiation respectively when the Nb5+ concentration was 1.0 mol%, which demonstrated certain relationship between photoluminescence performance affected by Nb5+ concentration and the photocatalytic activity. The photocatalytic oxidation activity also corresponds to the concentration of Fe3+ as electron acceptor, the best initial concentration of Fe3+ is 8.0 mmol/L
Key words: Nb5+-doped; rutile titania; photocatalytic; O2 evolution
1972年日本科学家FUJISHIMA[1]等通过TiO2光电转换将水分解为氢气, 推动了光催化的发展。近几年来, 利用半导体催化剂光解水制取氢气成为能源再生和存储的理想途径, 光分解水制取氢气的研究[2]引起了人们极大的兴趣。光解水的光催化量子化效率较低,效率难提高,而光催化分解水析氧是一个难以实现的半反应。BAMWENDA等[3?5]研究CeO2、WO3、TiO2光催化分解水析氧活性,金红石型二氧化钛(r-TiO2)析氧活性较其他氧化物高,但其在紫外光和可见光的析氧速率较低,可见光的析氧速率为41.8 μmol/(L?h)。SAYAMA和ARAKAWA[6]研究负载Pt对TiO2分解水催化活性的影响,LEE[7]等研究了NiO对TiO2负载的光催化效果,在可见光下光催化活性不高。金红石型二氧化钛(r-TiO2)虽然在光催化分解水方面被用催化剂,但其存在光利用率低、析氧速率不高。WONG等[8?13]通过掺杂金属离子能够改善催化剂光催化性能。但掺杂Nb5+对r-TiO2光解水析氧研究尚未见报道,Nb2O5导带、价带位置与TiO2的导带、价带基本相近,符合掺杂的基本规律。本文作者用钛酸丁酯低温水解方法合成不同掺杂Nb5+浓度的r-TiO2光催化剂,采用X射线衍射(XRD),光致发光光谱(PL),漫反射光谱(DRS)等技术进行了催化剂形貌和结构表征。在光源为250 W高压汞灯(或氙灯)、Fe3+为电子受体、反应体系pH值为2.0的条件下,研究Nb5+掺杂对r-TiO2粒子光催化分解水析氧活性的影响。
1 实验
1.1 仪器与试剂
采用日本理学D/max 2250全自动转靶X 射线衍射分析仪进行XRD分析,根据晶体学Scherrer方程计算晶粒大小;采用美国Micromeritics Instrument Corporation公司ASAP2020 Surface Area and Porosity Analyzer进行BET分析,测定比表面积;采用瑞士梅特勒-托力多公司TGA/SDTA851热重差热同步分析仪进行TG-DTA分析;采用北京普析通用仪器有限责任公司的TU?1901型紫外?可见分光光度计(带IS19?1积分球,BaSO4为参比标准白板)进行DRS分析;采用美国PE公司 LS?45型原子荧光分光光度计进行PL分析(扫描波段为200~700 nm,激发波长225 nm);采用长沙华信合金机电有限公司SK2?6?13型程序控温高温管式电阻炉制备样品;采用上海天普分析仪器有限公司SP?2305型气相色谱仪(热导池检测器、氩气为载气、固定相为5 A的分子筛) 进行光催化反应气相产物的检测。
钛酸丁酯、无水乙醇、Nb2O5等试剂均为分析纯。
1.2 催化剂的制备
室温下,将10.0 mL钛酸丁酯缓慢加入到装有100.0 mL无水乙醇分液漏斗中,在45 min内将混合物滴加到装有0.5 mL浓硝酸酸和125.0 mL蒸馏水的烧杯中,冰水冷却,磁力搅拌3 h,然后减压浓缩至粘稠,分别加入含Nb5+为0.5%、1.0%、1.5%、2.0%和3.0%的Nb2O5(以Ti摩尔比计),继续搅拌90 min。然后将水解产物物静置陈化12 h后在70 ℃真空干燥箱中干燥,得到系列掺杂催化剂前驱物。再将前驱物放入石英舟中,于高温管式炉中加热,程序控温,在850 ℃进行热处理3 h(晶相转变温度由前驱物TG?DSC测定曲线得到),样品冷却后取出,用玛瑙研钵反复研磨,得到系列Nb5+掺杂r-TiO2催化剂。
1.3 光催化反应
反应装置采用自制的内置光源中空夹套式石英反应器(约560 mL)。光源是250 W高压汞灯(或者氙灯)。反应前将560 mL 的蒸馏水煮沸10 min以尽量除去反应体系中的气体, 待其冷却至室温后加入到反应装置中, 同时加入1.0 g的催化剂和电子受体Fe3+。采用磁力搅拌器使催化剂保持悬浮, 恒温水浴温度控制在32 ℃,溶液pH值为2.0。光催化分解水产生的氧气通过气相色谱分析。
2 结果与讨论
2.1 催化剂的XRD分析
图1所示为不同量掺杂Nb5+的TiO2催化剂的XRD分析结果。从图1可知所制得的掺杂TiO2催化剂晶型均为金红石型(2θ=27.38?)。2θ=23.68?为Nb2O5的特征峰,Nb5+的掺入并没有引起TiO2的晶型改变。由表1所示的不同Nb5+掺杂浓度改性后r-TiO2的晶格参数变化的结果可知,催化剂的晶格参数随Nb5+的掺杂浓度增加而减小。Nb5+离子半径0.070 nm和Ti4+离子半径0.068 nm接近,Nb5+可能以取代方式掺入到r-TiO2的晶格中。图2所示为光催化反应前后催化剂1.0%Nb5+-r-TiO2的XRD谱。由图2可知,催化剂在光催化反应前后结构没有发生改变,没有发生光氧化或光溶解现象,催化剂具有良好的稳定性。
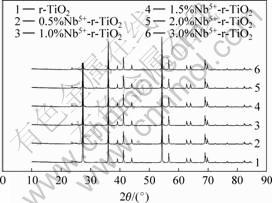
图1 不同掺杂Nb5+浓度改性后r-TiO2的XRD谱
Fig.1 Influences of Nb5+-dopant concentration on XRD patterns of r-TiO2 photocatalyst
表1 不同的Nb5+掺杂浓度改性后r-TiO2的晶格参数变化
Table 1 Influence of Nb5+-dopant concentration on lattice parameter of r-TiO2 photocatalyst
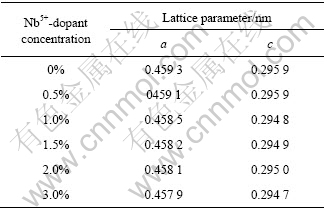
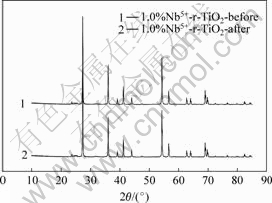
图2 光催化反应前后催化剂(1.0%Nb5+-r-TiO2)的XRD谱
Fig.2 XRD patterns of 1.0%Nb5+-r-TiO2 photocatalyst before and after photocatalytic reaction
2.2 催化剂的DRS分析
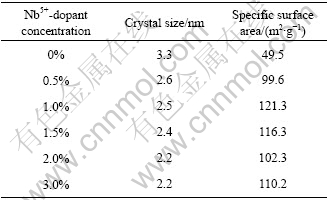
图3所示为催化剂的紫外?可见漫反射光谱。由图3可知,在波长为200~400 nm 范围内,各催化剂的反射率基本相同,表明它们在紫外区的光吸收性能差别不大。在波长为400~700 nm范围内,没有掺杂Nb5+的TiO2的反射率较大,说明其在可见光区域对光的吸收性能较差,而随着掺杂Nb5+的浓度增加,掺杂催化剂的反射率降低,光吸收性能最强的掺杂Nb5+的浓度为3.0%。催化剂的光吸收性能得到明显改善,在可见光区表现出较强的吸收。原因可能为随着Nb5+掺杂浓度的增加,粒径减小(见表2),颗粒内部的内应力会增加,内应力的增加会导致能带结构的变化,掺杂物质形成掺杂能级,使能量较小的光子能激发掺杂能级上捕获的电子,即能吸收波长较长的光,提高对光吸收的利用率[14]。
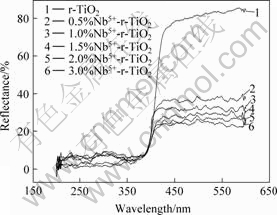
图3 Nb5+的掺杂浓度对r-TiO2光吸收性能的影响
Fig.3 Influences of Nb5+dopant concentration on diffuse reflection spectra of r-TiO2 photocatalyst
表2 不同的Nb5+掺杂浓度改性后r-TiO2的特性变化
Table 2 Influences of Nb5+-dopant concentration on morphology parameter of r-TiO2 photocatalyst
2.3 催化剂的PL分析
图4所示为催化剂 的PL光谱分析结果。由图4可知,在激发波长225 nm条件下,波长为400~550 nm范围内,催化剂表现出强而宽的发光信号且分别在 420 nm和480 nm处出现明显的PL峰,前者可能归属于带边自由激子发光,而后者可能为束缚激子发光[15]。掺杂Nb5+的r-TiO2的PL峰强度高于未掺杂r-TiO2的强度,PL峰强度顺序为1.0%>1.5%>2.0%>3.0%>0.5%>0%,1.0%为Nb5+的最佳掺杂浓度。由表2可知,掺杂离子Nb5+的浓度增加时,催化剂颗粒变小,光生电子运动的平均自由程短,以至于催化剂表面氧空位束缚电子形成激子的几率越高,从而在带隙中靠近导带底的位置形成激子能级,产生激子发光,发光强度增加。然而颗粒变得更小时,催化剂表面氧空位过多, 可能会在其周围束缚了较多的电子,光生电子与空穴的分离效果降低,光生电子与空穴容易复合,导致光致发光性能减弱。
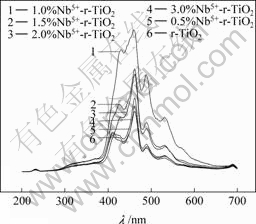
图4 Nb5+的掺杂浓度对r-TiO2光致发光性能的影响
Fig.4 Influences of Nb5+dopant concentration on PL of r-TiO2 photocatalyst
2.4 光催化分解水析氧活性
在Fe3+的浓度为8.0 mmol/L、在高压汞灯和氙灯照射下,掺杂浓度对催化剂光催化活性的影响见图5和图6。由图5和图6可知,掺杂Nb5+的r-TiO2的析氧量高于未掺杂r-TiO2的析氧量,析氧量与Nb5+掺杂量存在一定的关系,在低浓度掺杂量范围内,析氧量随掺杂Nb5+的浓度增加而增多,存在最佳掺杂浓度。析氧量顺序为1.0%>1.5%>2.0%>3.0%>0.5%>0%,1.0%Nb5+- r-TiO2催化析氧的活性最高,紫外和可见光源照射下析氧速率分别达480 μmol/(L?h)和78 μmol/(L?h)。
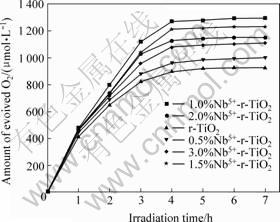
图5 紫外光辐射下Nb5+的掺杂浓度对r-TiO2光催化活性的影响
Fig.5 Influences of Nb5+-dopant concentration on photo- catalytic reactivity of r-TiO2 for O2 evolution under ultraviolet radiation
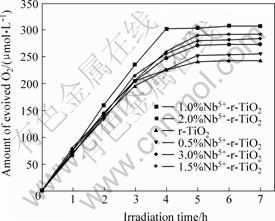
图6 可见光辐射下Nb5+的掺杂浓度对r-TiO2光催化活性的影响
Fig.6 Influences of Nb5+-dopant concentration on photo- catalytic reactivity of r-TiO2 for O2 evolution under visible radiation
可见,Nb5+掺杂对r-TiO2光催化分解水反应有促进作用,但光催化析氧与掺杂Nb5+的量有关,高浓度掺杂反而活性降低。掺杂催化剂的光催化活性与其PL光谱变化趋势一致,即发光性能好的掺杂催化剂析氧活性高,发光性能差的掺杂催化剂析氧活性低。掺杂Nb5+后,Nb5+进入晶格,以取代方式掺入到r-TiO2的晶格中,由于Nb5+的电荷比Ti4+高,在r-TiO2的禁带中形成施主能级,该能级位于半导体导带底附近[12],见图7。电子受激发可以很容易转移到杂质能级上,光生电子的数目就会增加,同时延长了空穴的寿命,有利于光催化;另一方面,由于Nb5+的电荷比Ti4+高,催化剂表面会出现氧空位[16],氧空位能俘获光生电子,一定程度上使得光生电子与空穴分离,提高光催化性能。但是,高浓度掺杂导致氧空位过多,可能会在其周围束缚了较多的电子,降低光生电子与空穴的分离效果,降低光催化活性。

图7 具有施主能级的r-TiO2的能带结构
Fig.7 Energy band structure of r-TiO2 photocatalyst with donor doping
2.5 Fe3+作为电子受体对催化剂析氧活性的影响
Fe3+在悬浮液体系中是一种性能较好的电子受体,在光源为250 W高压汞灯时,选择不同初始浓度的Fe3+来研究对1.0% Nb5+-r-TiO2析氧量的影响,结果见图8。从图8可知,析氧量与电子受体的初始浓度有关,当体系中没有加入Fe3+,没有氧气产生,随着Fe3+的浓度由4.0 mmol/L增加到8.0 mmol/L,析氧量也随之增加。但Fe3+的浓度也不能过大,否则会引起析氧量的下降,Fe3+的浓度为16.0 mmol/L时,析氧量明显降低。Fe3+作为电子受体,不断地被光生电子所消耗,随着反应的进行,Fe3+逐渐减少,产氧量趋于平坦,光催化析氧活性降低。Fe3+初始浓度过大时,会影响光照射的密度,使析氧速率降低。本文光催化反应体系催化剂在Fe3+的初始浓度为8.0 mmol/L时,光催化析氧活性最高。Fe3+的初始浓度对其他掺杂量的样品呈现同样的活性规律。
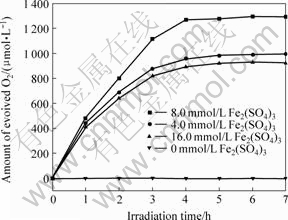
图8 Fe3+作为电子受体对催化剂(1.0%Nb5+- r-TiO2)析氧活性的影响
Fig.8 Effects of Fe3+ on photocatalytic activity of 1.0%Nb5+- r-TiO2 for O2 evolution
3 结论
1) Nb5+的掺杂量在一定的范围时,有利于光生电子和空穴的分离,低浓度Nb5+掺杂光催化活性增强,高浓度掺杂反而活性降低,但掺杂Nb5+的r-TiO2的光催化活性均高于未掺杂r-TiO2的光催化活性。
2) 掺杂催化剂的光催化活性与其PL光谱变化趋势一致。Nb5+掺杂量在1.0%时,PL光谱强度最大,光催化析氧活性最高,紫外光源和可见光源析氧速率分别达480 μmol/(L?h)和78 μmol/(L?h)。
3) 光催化析氧活性与Fe3+的浓度有关,Fe3+的初始浓度为8.0 mmol/L时,催化剂析氧活性最高。
[1] HONDA K, FUJISHIMA A. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238: 37?38.
[2] 杨亚辉, 陈启元, 尹周澜, 李 洁, 梁 胜. Fe3+和Cr3+掺杂对K4Nb6O17光催化活性的影响[J]. 中国稀土学报, 2004, 22(5): 647?650.
YANG Ya-hui, CHEN Qi-yuan, YIN Zhou-lan, LI Jie, LIANG Sheng. Photocatalytic activity of K4Nb6O17 doped with Fe3+ and Cr3+[J]. Journal of Rareearth, 2004, 22(5): 647?650.
[3] BAMWENDA G R, UESIGI T, ABE Y. The photocatalytic oxidation of water to O2 over pure CeO2, WO3, and TiO2 using Fe3+ and Ce4+ as electron acceptors[J]. Applied Catalysis A: General, 2001, 205(1/2): 117?128.
[4] BAMWENDA G R, ARAKAWA H. Cerium dioxide as a photocatalyst for water decomposition to O2 in the presence of Ceaq4+ and Feaq3+ species[J]. Journal of Molecular Catalysis A: Chemical, 2000, 161(1/2): 105?113.
[5] BAMWENDA G R, ARAKAWA H. The photoinduced evolution of O2 and H2 from a WO3 aqueous suspension in the presence of Ce4+/Ce3+[J]. Solar Energy Materials and Cells, 2001, 70(1): 1?14.
[6] SAYAMA K, ARAKAWA H. Effect of carbonate salt addition on the photocatalytic decomposition of liquid water over Pt-TiO2 catalyst[J]. The Journal of Chemical Society: Faraday Transactions, 1997, 93(8): 1647?1654.
[7] LEE S G, LEE S, LEE H I. Photocatalytic production of hydrogen from aqueous solution containing CN? as a hole scavenger[J]. Applied Catalysis A: General, 2001, 207(1/2): 173?181.
[8] WONG W K, MALA M A. Doped TiO2 for solar energy applications[J]. Solar Energy, 1986, 36: 163?166.
[9] CHOI W, TERMIN A, MICHAEL R H. The role of metal ion dopants in quantumsized TiO2 co rrelation between photo reactivity and charge carrier recombination dynamics[J]. J Phys Chem, 1994, 98: 13669?13672.
[10] CUI H, DWIGHT K, WOLD A. Surface acidityand photocatalytic activity of Nb2O5/TiO2 photocatalysts[J]. Journal of Solid State Chemistry, 1995, 115: 187?191.
[11] ISHIBASHI K I, FUJISHIMA A, WATANABE T, HASHIMOTO K. Quantum yields of active oxidative species formed on TiO2 photocatalyst[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2000, 134: 139?142.
[12] HOFFMANN M R, MARTIN S T, CHOI W. Environmental applications of semiconductor photocatalysis[J]. Chemical Reviews, 1995, 95: 69?76.
[13] PICHAT P, HERRMANN V H, DISDIER J. Modification of the TiO2 Electron density by ion doping or metal deposit and consequences for photoassisded reactions[J]. Studies in Surface Science and Catalysis, 1984: 319?326.
[14] SERPONE N, LAW LESS D, KHAIRUTDINOV R. Size effects on the photophysical properties of colloidal anatase TiO2 particles: size quantization or direct transitions in this indrect semiconductor[J]. J Phys Chem, 1995, 99: 16646?16650.
[15] JING Li-qiang, SUN Xiao-jun, XIN Bai-fu, WANG Bai-qi, CAI Wei-min, FU Hong-gang. The preparation and characterization of La doped TiO2 nanoparticles and their photocatalytic activity[J]. Journal of Solid State Chemistry, 2004, 177: 3375?3382.
[16] 徐毓龙. 氧化物与化合物半导体基础[M]. 西安电子科技大学出版社, 1991.
XU Yu-long. Semiconductor basis on oxides and compounds[M]. Xi’an: Xi’an University of Electronic Sciencs and Techenology Press, 1991.
[17] 高友良, 陈启元, 尹周澜, 胡慧萍, 李 洁. 氧空位对WO3 光催化析氧活性影响的研究[J]. 无机化学学报, 2005, 21(10): 1510?1514.
GAO You-liang, CHEN Qi-yuan ,YIN Zhou-lan, HU Hui-ping, LI Jie. Influence of oxygen vacancies of WO3 on photocatalytic activity for O2 evolution[J]. Chinese Journal of Inorganic Chemistry, 2005, 21: 1510?1514.
基金项目:国家高技术研究发展计划资助项目(2002AA327140)
收稿日期:2007-04-03;修订日期:2007-09-24
通讯作者:吴道新,高级实验师;电话:0731-8877364;E-mail: daoxinwu@126.com
摘 要:用钛酸丁酯低温水解方法合成不同掺杂Nb5+浓度的金红石型TiO2(r-TiO2)光催化剂,采用XRD、PL、DRS和BET等技术进行了催化剂表征。在光源为高压汞灯和氙灯、Fe3+为电子受体、悬浮液的pH值为2.0的条件下,考察Nb5+的掺杂量对r-TiO2粒子的光催化分解水析氧活性的影响,并探讨了掺杂催化剂的DRS,PL光谱与光催化活性的关系。结果表明:Nb5+的掺杂量在0.5%~3.0%范围时,Nb5+掺杂没有引起r-TiO2的晶型改变,表面形成氧空位,在导带底附近形成施主能级,有利于光生电子和空穴的分离,掺杂催化剂光催化活性增强;掺杂催化剂光致发光强度与其光催化析氧活性的变化趋势一致,Nb5+掺杂量在1.0%(摩尔分数)时,PL光谱强度最大,光催化析氧活性最高,紫外光源和可见光源析氧速率分别达480 μmol/(L?h)和78 μmol/(L?h);Fe3+的初始浓度为8.0 mmol/L时,催化剂析氧活性最高。


