DOI: 10.11817/j.ysxb.1004.0609.2020-39111
过渡金属V、Ti及Y的添加对Mg-Al合金储氢性能的影响
黄显吞1,卿培林1,覃昌生1,谢政专2
(1. 百色学院 材料科学与工程学院,百色 533000;
2. 广西大学 物理科学与工程技术学院,南宁 530004)
摘 要:
摘 要:采用热处理工艺并结合机械合金化制备Mg-Al合金,同时利用XRD、SEM以及吸放氢测试对其性能进行表征,研究过渡金属V、Ti及Y的添加对Mg-Al合金储氢性能的影响。结果表明:材料主要由Mg17Al12相组成,Mg17Al12的氢化产物为MgH2和Al,且该过程是可逆的,并在过渡金属的催化作用下,Mg-Al合金的综合储氢性能明显提高;Mg-Al合金的初始放氢温度为577 K,添加V、Ti以及Y后,合金材料的初始放氢温度分别下降了80、46和60 K。此外,Mg-Al合金材料脱氢反应的表观活化能为175.1 kJ/mol,掺杂V、Ti及Y后合金材料脱氢反应的表观活化能从175.1 kJ/mol分别下降到134.6、134.9和131.4 kJ/mol,进一步证实了过渡金属元素V、Ti以及Y的添加能有效提高材料的综合储氢性能。
关键词:
文章编号:1004-0609(2020)-02-0333-08 中图分类号:TG139 文献标志码:A
轻质金属Mg、Al的理论储氢容量(质量分数)分别达7.6%和10.5%,是一种高能量密度的氢能存储材料,且储量丰富,价格低廉,是理想的储氢材料候选之一[1-3]。但由于MgH2热力学性能过于稳定不易分解,AlH3易分解但不易合成,导致它们在实际推广应用中受到极大限制并阻碍其发展[4-6]。基于MgH2和AlH3的热力学稳定性较差,可从热力学角度出发,利用Mg和Al彼此间的热力学性能具有可调和互补的特性,采用机械合金化制备及元素添加的方法可在一定程度上提高合金材料的综合储氢性能[6-7]。而且,由于过渡族金属具有未充满的价电轨道,其性质与其他元素性质具有明显区别,为此研究者们在往Mg-Al合金中掺杂少量过渡金属改善其储氢性能方面取得了一定进展。
例如,在镁中加入稀土等元素作为催化剂通过增加镁的表面积比来增加氢气和镁的接触通道从而提高其吸放氢动力学性能[8-10]。GASAN等[11]将MgH2和5%(质量分数)不同添加剂(V,Nb,Ti)混合分别进行机械球磨后发现脱氢温度比未添加的MgH2降低了40~50 K。ZHOU等[12]将Ti或Ti合金以5%的比例添加到MgH2粉末中并球磨,发现Ti及其合金的掺杂有利于降低MgH2的初始放氢温度。另据报道[13],Mg-Al之间容易形成Mg17Al12和Mg2Al3,Mg17Al12在氢化过程须向Mg2Al3中间相转变,然后才再进一步放氢,因此储氢容量也相应降低。因此,本研究直接选取Mg2Al3合金作为研究对象,且鉴于过渡族金属具有较好的催化效果,选取V、Ti以及Y过渡金属作为掺杂剂,系统研究了这3种过渡金属掺杂后对Mg-Al合金吸放氢动力学性能的影响,并就过渡金属掺杂后对Mg-Al合金储氢热力学性能的改性机理进行了分析,期望为进一步改善Mg-Al合金储氢性能提供依据与参考。
1 实验
实验中所用的粉末材料Mg粉(65 μm)、Al粉(45 μm)、V粉(75 μm)、Ti粉(75 μm)和Y粉(75 μm)的纯度均大于99.6%。首先将Mg粉和Al粉按n(Mg):n(Al)= 2:3均匀混合,均分为4份,然后在其中3份样品中分别添加质量分数为5%的V粉、Ti粉和Y粉,接着利用压片机在2.0 MPa下把混合粉末冷压成片状样品;随后在氩气保护下,在873 K下烧结2 h,经破碎后再利用行星式球磨机进行机械球磨,球磨时球料比为40:1,转速为300 r/min,总的球磨时间为50 h。将制备所得样品标分别记为Mg-Al-M(M=0, V, Ti, Y)合金样品。
将制备所得样品在MINIFLEX 600型X射线衍射仪中进行X射线衍射(XRD)测试,采用Cu靶Kα辐射,扫描步长为10 (°)/min,扫描范围为10°~90°。材料的吸放氢动力学测试在自制的高压吸放氢测试系统中进行,吸氢时最高氢压为7.0 MPa,放氢时最低氢压为1.1 kPa。利用Linseis STA PT-1000型同步热分析仪对合金材料进行DTA热分析测试,测试过程中用纯度为99.999%的氩气加以保护,氩气流量为30 mL/min。用JSM-6510型隧道扫描电子显微镜观察合金的表面形貌。
2 结果与讨论
2.1 合金的表面形态
图1所示为Mg-Al-M(M=0, V, Ti, Y)合金样品球磨50 h后的SEM像。从图1可观察到,所有合金样品经球磨后材料颗粒尺寸变得比较细小,有许多小颗粒附着在大颗粒上,形状也不规则,颗粒大小不均匀,而且材料颗粒表面都比较光滑。M=0合金样品有许多大小和形状都不规则的小颗粒,大颗粒尺寸约为20 μm;M=V合金样品中小颗粒较多,并有部分团聚成大颗粒,形状不规则,颗粒大小不均匀,大颗粒尺寸约为25 μm;M=Ti样品中小颗粒附着在大颗粒表面的情况相对较少,大颗粒尺寸约为20 μm;M=Y样品中也有许多小颗粒附着在大颗粒表面,颗粒大小也不均匀,大颗粒尺寸约为15 μm。这些合金样品颗粒存在的形貌和尺寸差异,会对储氢材料的吸放氢动力学及热力学性能产生一定影响。
2.2 合金的相结构分析

图1 Mg-Al-M(M=0, V, Ti, Y)合金样品球磨50 h后的SEM像
Fig. 1 SEM images of Mg-Al-M(M=0, V, Ti, Y) alloys

图2 Mg-Al-M(M=0, V, Ti, Y)合金材料球磨及吸放氢后的XRD谱
Fig. 2 XRD patterns of Mg-Al-M(M=0, V, Ti, Y) composites
图2所示为Mg-Al-M(M=0, V, Ti, Y)合金材料球磨及吸放氢后的XRD谱。如图2(a)所示,经过烧结并结合机械球磨后,Mg-Al合金材料中主要由Mg17Al12相组成,添加V、Ti或Y混合球磨后,并没有生成新的物相,也没有发现V、Ti或Y的单质相,这可能是由于添加量较少或者经过球磨后转变成纳米晶/非晶结构的缘故;或者是V、Ti、Y等单质固溶到Mg-Al合金晶格参数中,形成Mg-Al-M(M=V, Ti, Y)固溶体合金。Mg-Al-M(M=0, V, Ti, Y)合金吸氢后,二元合金相
Mg17Al12转化为MgH2和Al(见图2(b))。当Mg-Al合金放氢时,MgH2与Al结合再次生成Mg17Al12(见图2(c))。显然,Mg17Al12在吸放氢过程是可逆的,并可用式(1)表示:
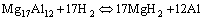
 (1)
(1)
通常情况下,Mg2Al3作为中间产物,经常伴随着Mg17Al12氢化产物出现[14-15],对合金的储氢性能产生影响,造成合金储氢容量降低。并据报道,改进制备工艺,可实现Mg17Al12→MgH2的直接转变,且能改善Mg-Al合金的可逆吸放氢性能[16]。而如上所述,经过烧结并结合机械合金化制备的Mg-Al合金,其在吸放氢过程中并未出现Mg2Al3相,这可能是采用以上材料成分配比及制备方法减少了中间产物(Mg2Al3)的出现。同时,这也说明采用上述材料成分配比及制备方法有利于Mg17Al12→MgH2的直接转变,这些改变将对Mg-Al合金的储氢性能产生影响。
2.3 合金的储氢性能
图3所示为Mg-Al-M(M=0, V, Ti, Y)合金样品在升温速率为2 K/min时的变温吸放氢曲线图。在吸氢过程中(见图3(a)),在氢压为7.0 MPa时,在Mg-Al合金中添加过渡金属后,材料的初始吸氢温度并未发生变化,但添加V和Y后,合金对应的吸氢曲线斜率变大,这表明V或Y的添加能提高Mg-Al合金的吸氢速率。在放氢过程中(见图3(b)),Mg-Al合金的初始放氢温度为577 K,而添加V、Ti以及Y后合金材料的初始放氢温度分别降低到497、531和517 K,即添加V、Ti以及Y后合金样品的初始放氢温度比Mg-Al合金的初始放氢温度分别降低了80、46和60 K,说明V、Ti以及Y的添加有效降低了Mg-Al合金材料的初始放氢温度,特别是Mg-Al-V合金样品的初始放氢温度降幅最大。
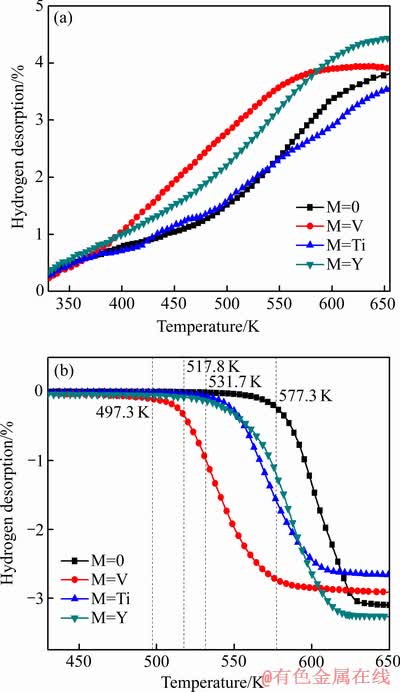
图3 Mg-Al-M(M=0, V, Ti, Y)合金材料变温吸放氢曲线
Fig. 3 Hydrogenation(a) and dehydrogenation(b) curves of samples with increasing temperature at 2 K/min
图4所示为Mg-Al-M(M=0, V, Ti, Y)合金材料在573 K温度下的吸放氢动力学曲线。从图4(a)吸氢曲线中可知,添加V或Y后合金材料的吸氢曲线斜率比Mg-Al合金的大,而添加Ti后合金材料的吸氢曲线斜率比Mg-Al合金材料的小。这与图3(a)所示的结果相符,说明掺杂V或Y能有效提高Mg-Al合金材料的吸氢速率。同时,从图4(b)放氢曲线中可知,添加过渡金属V、Ti或Y后合金材料的放氢曲线斜率都比Mg-Al合金材料的要大,说明掺杂过渡金属元素V、Ti或Y后都能提高Mg-Al合金材料的放氢速率,特别是掺杂V后合金材料的放氢速率提高效果特别明显。这可能是在氢化过程中,由于V与H2结合生成VH2,在V与H2结合的驱动作用下,其反应形成的氢泵驱动近邻Mg-Al合金吸氢;而在放氢过程,VH2的脱氢作用又诱导MgH2脱氢,因此如图4所示,添加V 的Mg-Al合金显示出良好的吸放氢动力学性能。这也与IWAKURA等[17]的研究结论相符,即V可以破坏MgH2表面的氧化层,从而可以增加MgH2的放氢量,并提高材料的储氢性能。
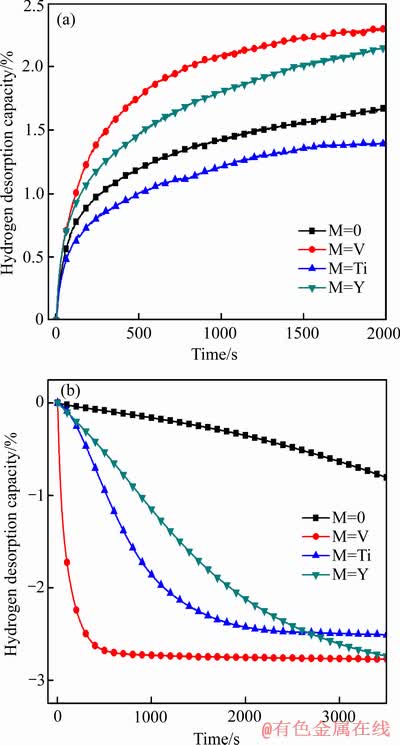
图4 Mg-Al-M(M=0, V, Ti, Y)合金材料在573 K温度下的吸/放氢动力学
Fig. 4 Hydrogen(a) and dehydrogen(b) absorption kinetics for Mg-Al-M(M=0, V, Ti, Y) composites at 573 K
由于添加V后Mg-Al合金样品具有较好的吸放氢动力学性能,因此,选取添加V的合金样品作为研究对象,进一步深入研究掺杂V后合金材料放氢产物的吸氢性能。图5(a)所示为Mg-Al-V合金材料在温度为523、573和623 K时的吸氢曲线。从图5(a)可知,随着吸氢温度的升高,合金材料的吸氢速率曲线斜率越大,合金吸氢速度加快且吸氢量也越大。根据分子运动理论,温度越高,分子所具有的内能越大,分子所具有的能量就越高。这也充分说明随着温度升高,合金材料中的氢原子所具有的能量越高,跨越扩散势垒能力增强,氢原子的扩散速率加快。同时,为了研究掺杂过渡族金属后合金材料在吸氢过程中的相变情况,实验中进一步以Mg-Al-V合金材料为研究对象,利用Johnson-Mehl-Avrami(JMA)方程对其吸氢动力学过程进行描述,如式(2)所示[18]:
 (2)
(2)
式中: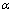 是相转变分数;
是相转变分数; 是为JMA方程的Avrami指数;t是反应时间;k为温度为T时的相变速度常数。根据图5(a)掺杂V后合金材料在523、573和623 K的实验数据,绘制
是为JMA方程的Avrami指数;t是反应时间;k为温度为T时的相变速度常数。根据图5(a)掺杂V后合金材料在523、573和623 K的实验数据,绘制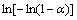 和
和 的关系曲线于图5(b)。如图5(b)所示,每一个温度对应一条直线,直线的斜率为
的关系曲线于图5(b)。如图5(b)所示,每一个温度对应一条直线,直线的斜率为 ,在纵轴上的截距为
,在纵轴上的截距为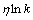 。根据图计算出斜率
。根据图计算出斜率 并依据截距的大小即可计算出相变反应常数k,那么Mg-Al-V合金在吸氢过程的表观活化能可用Arrhenius方程进行计算:
并依据截距的大小即可计算出相变反应常数k,那么Mg-Al-V合金在吸氢过程的表观活化能可用Arrhenius方程进行计算:
 (3)
(3)
式中:A为指前因子;Ea为表观活化能;R为摩尔气体常数(8.31 J/(mol·K));T为温度。Mg-Al-V合金材料在吸氢过程的 -T-1关系曲线如图6所示,根据图6可知,这条关系曲线的拟合度(
-T-1关系曲线如图6所示,根据图6可知,这条关系曲线的拟合度( )达到0.948,特别是计算出Mg-Al-V合金材料在吸氢过程的表观活化能为33.4 kJ/mol,这与 Mg在吸氢过程的表观活化能(95~130 kJ/mol)相比已经有大幅下降[19-20]。
)达到0.948,特别是计算出Mg-Al-V合金材料在吸氢过程的表观活化能为33.4 kJ/mol,这与 Mg在吸氢过程的表观活化能(95~130 kJ/mol)相比已经有大幅下降[19-20]。
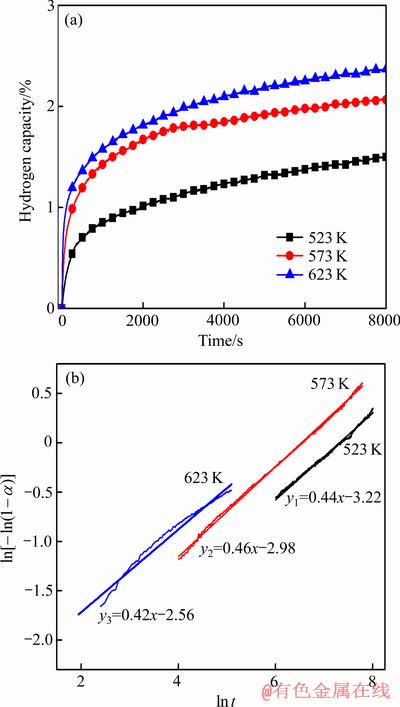
图5 Mg-Al-V合金材料在不同温度下的吸氢曲线以及在吸氢过程的 和
和 关系曲线
关系曲线
Fig. 5 Hydrogen absorption curves of Mg-Al-V composite at different temperatures(a) and plots of  vs
vs  for hydrogen absorption(b)
for hydrogen absorption(b)

图6 Mg-Al-V合金材料在吸氢过程的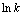 -
-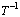 曲线
曲线
Fig. 6 Hydrogen absorption plots of 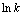 vs
vs 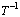 of Mg-Al-V alloy composite
of Mg-Al-V alloy composite
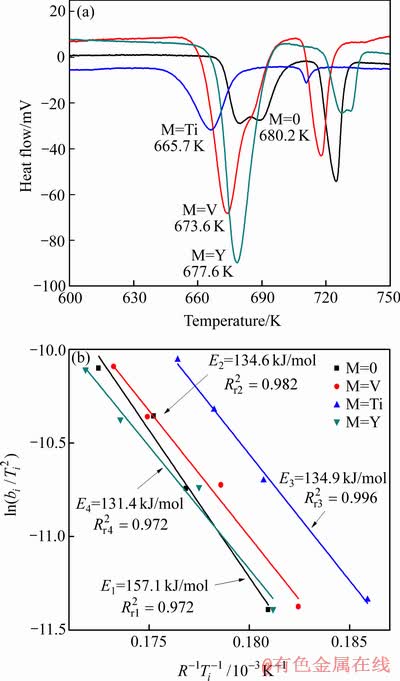
图7 Mg-Al-M(M=0, V, Ti, Y)合金材料的在升温速率为10 K/min 时的DTA曲线以及Kissinger方程曲线
Fig. 7 DTA curves for Mg-Al-M(M=0, V, Ti, Y) composites of 10 K/min(a) and Kissinger plot(b)
图7(a)所示为以10 K/min的升温速率加热所得Mg-Al-M(M=0, V, Ti, Y)合金材料氢化物的DTA曲线。从图7(a)可知,所有Mg-Al-M(M=0, V, Ti, Y)合金材料在脱氢反应过程都出现两个脱氢峰,这两个峰分别对应的是脱氢和熔化分解温度[21]。Mg-Al合金氢化物的脱氢峰值温度出现在680.2 K,添加V、Ti以及Y后,Mg-Al-M(M=0, V, Ti, Y)合金材料的脱氢峰值温度分别出现在673.6、665.7和677.6 K,脱氢峰值温度分别降低了6.6、14.5和2.6 K,说明掺杂V、Ti以及Y后都降低了合金材料氢化反应峰值温度。通常情况下,DTA曲线中峰值温度对应的是反应速率最快的温度。显然,Mg-Al合金在较高的温度下才能快速脱氢分解,而伴随着过渡金属V、Ti或Y的添加,脱氢分解温度降低,这可能是源于上述少量V、Ti以及Y原子固溶于MgH2晶格导致其晶格畸变、结构稳定性降低。这结果也与PENG等[22]用稀土元素添加对镁基合金性能影响的研究结果相符。特别是Mg-Al合金加入V、Ti或Y后,球磨过程有利于降低复合材料的颗粒尺寸,并在相同的条件下,氢原子在小颗粒体内向外扩散路径缩短,扩散过程所需克服的扩散势垒降低,从而提高了储氢材料的热力学性能。同时,Mg-Al-M(M=0, V, Ti, Y)合金的熔化分解温度都出现在710~740 K之间,这一实验结果与Mg-Al二元相图中Mg17Al12相熔点大致在730 K相接近,因此其可能是对应的Mg17Al12熔化时的相变潜热所致。
为了更进一步研究催化剂的添加对Mg-Al合金材料储氢性能的影响,分别以5、10、15和20 K/min的升温速率对Mg-Al-M(M=0, V, Ti, Y)合金材料氢化物进行加热,并绘制Kissinger方程曲线如图7(b)所示,然后根据Kissinger方程曲线的斜率计算合金材料放氢反应的表观活化能[23]。
 (4)
(4)
式中: 为恒定加热速率;Ti为在恒定加热速率为
为恒定加热速率;Ti为在恒定加热速率为 条件下的最大放氢速率,即DTA(差热)或者DSC(差式扫描热量)曲线所对应的峰值温度;Ek为表观活化能。由图7(b)可知,这4条曲线的拟合度(
条件下的最大放氢速率,即DTA(差热)或者DSC(差式扫描热量)曲线所对应的峰值温度;Ek为表观活化能。由图7(b)可知,这4条曲线的拟合度( )分别达到0.972、0.982、0.998和0.972,特别是Mg-Al合金材料放氢反应的表观活化能为175.1kJ/mol,掺杂V、Ti以及Y后合金材料放氢反应的表观活化能从175.1 kJ/mol分别降低到134.6、134.9和131.4kJ/mol,即添加过渡金属元素后合金材料放氢反应的表观活化能分别降低了40.5、40.1和43.7 kJ/mol。显然,添加过渡金属元素有利于降低Mg-Al合金材料的表观活化能,从而有利于促进Mg-Al合金氢化物的脱氢分解。通常,氢原子由合金内部或者合金表面向合金体外扩散需要克服一定的能量势垒高度;能量势垒高度越高,合金氢化物越稳定,合金脱氢分解越困难,合金的脱氢温度越高。这说明,在添加过渡金属元素的催化作用下,Mg-Al合金中氢原子的扩散势垒降低,这也与从图3(b)和4(b)观测到的结果一致。
)分别达到0.972、0.982、0.998和0.972,特别是Mg-Al合金材料放氢反应的表观活化能为175.1kJ/mol,掺杂V、Ti以及Y后合金材料放氢反应的表观活化能从175.1 kJ/mol分别降低到134.6、134.9和131.4kJ/mol,即添加过渡金属元素后合金材料放氢反应的表观活化能分别降低了40.5、40.1和43.7 kJ/mol。显然,添加过渡金属元素有利于降低Mg-Al合金材料的表观活化能,从而有利于促进Mg-Al合金氢化物的脱氢分解。通常,氢原子由合金内部或者合金表面向合金体外扩散需要克服一定的能量势垒高度;能量势垒高度越高,合金氢化物越稳定,合金脱氢分解越困难,合金的脱氢温度越高。这说明,在添加过渡金属元素的催化作用下,Mg-Al合金中氢原子的扩散势垒降低,这也与从图3(b)和4(b)观测到的结果一致。
3 结论
1) 添加V、Ti以及Y后使Mg-Al合金样品的初始放氢温度分别降低了80、46和60 K,说明过渡金属V、Ti或Y有效降低了Mg-Al合金的初始放氢温 度,特别是V使Mg-Al合金样品的初始放氢温度降幅最大。
2) 添加过渡金属V、Ti或Y后合金材料的放氢曲线斜率都比Mg-Al合金大,说明添加过渡金属元素V、Ti或Y后能提高Mg-Al合金材料的放氢动力学性能。
3) V、Ti以及Y的添加使Mg-Al合金样品放氢反应峰值温度分别降低了6.6、14.5和2.6 K,且能使Mg-Al合金材料放氢反应的表观活化能分别降低了40.5、40.1和43.7 kJ/mol,显然,过渡金属元素V、Ti以及Y能有效改善Mg-Al合金的综合储氢性能。
REFERENCES
[1] LI Yong-tao, ZHOU Guang-you, FANG Fang, CHEN Guo-rong, SANG Ge, SUN Da-lin. Hydrogen storage properties of complex hydrides loaded in porous materials[J]. Progress in Chemistry, 2010, 22(1): 241-247.
[2] 张 琦, 李双寿, 董占民, 汤 彬, 李 睿, 林万明. Mg65Ni10RE25(RE=La,Ce,Pr,Nd,Mm)非晶储氢合金电极的性能[J]. 中国有色金属学报, 2015, 25(6): 1538-1545.
ZHANG Qi, LI Shuang-shou, DONG Zhan-min, TANG Bin, LI Rui, LIN Wan-ming. Properties of amorphous Mg65Ni10RE25(RE=La,Ce,Pr,Nd,Mm) hydrogen storage alloys electrode[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(6): 1538-1545.
[3] KLER A M, TYURINA E A, POTANINA Y M. Estimation of efficiency of usinghydrogenand aluminum as environmentally-friendly energycarriers[J]. International Journal of Hydrogen Energy, 2015, 40: 14775-14783.
[4] CHENG Fang-yi, TAO Zhan-liang, LIANG Jing, CHEN Jun. Efficient hydrogen storage with the combination of lightweight Mg/MgH2 and nanostructures[J]. Chemical Communications, 2012, 48: 7334-7343.
[5] 李志宝, 孙立贤, 张莹洁, 徐 芬, 褚海亮, 邹勇进, 张焕芝, 周怀营, 张 箭. MgH2储氢热力学研究进展[J]. 中国科学(化学), 2014, 44(6): 964-972.
LI Zhi-bao, SUN Li-xian, ZHANG Ying-jie, XU Fen, CHU Hai-liang, ZOU Yong-jin, ZHANG Huan-zhi, ZHOU Huai-ying, ZHANG Jian. Progress on hydrogen storage thermodynamic of MgH2[J]. Scientia Sinica Chimica, 2014, 44(6): 964-972.
[6] 黄林军, 王彦欣, 唐建国, 吴东昌, 王 瑶, 刘继宪, 黄 震, 焦吉庆, 刘敬权. 非晶态 Mg-Ni-La贮氢合金电化学吸释氢过程中的贮氢机制[J]. 中国有色金属学报, 2014, 24(12): 3059-3064.
HUANG Lin-jun, WANG Yan-xin, TANG Jian-guo, WU Dong-chang, WANG Yao, LIU Ji-xian, HUANG Zhen, JIAO Ji-qing, LIU Jing-quan. Hydrogen-storage mechanism of amorphous Mg-Ni-La hydrogen-storage alloys in electrochemical absorbtion/desorbtion process[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(12): 3059-3064.
[7] WAN Qi, LI Ping, SHAN Jia-wei, ZHAI Fu-qiang, LI Zi-liang, QU Xuan-hui. Superior catalytic effect of nickel ferrite nanoparticles in improving hydrogen storage properties of MgH2[J]. The Journal of Physical Chemistry C, 2015, 119(6): 2925-2934.
[8] 丁向前, 朱云峰, 卫灵君, 宦清清, 李李泉. 催化剂对LiAlH4+MgH2体系放氢性能的影响及催化机理[J]. 中国有色金属学报, 2013, 23(5): 1356-1361.
DING Xiang-qian, ZHU Yun-feng, WEI Ling-jun, HUAN Qing-qing, LI Li-quan. Effect of catalysts on dehydrogenation of LiAlH4+MgH2 composite and catalytic mechanism[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1356-1361.
[9] JURCZYK M, SMARDZ L, OKONSKA I, JANKOWSKA E, NOWAK M, SMARDZ K. Nanoscale Mg-based materials for hydrogen storage[J]. International Journal of Hydrogen Energy, 2008, 33(1): 374-380.
[10] 张 健, 朱 璞, 毛 聪, 周惦武. 碳材料掺杂对镁基氢化物释氢性能的影响及其微观机理[J]. 中国有色金属学报, 2015, 25(9): 2464-2470.
ZHANG Jian, ZHU Pu, MAO Cong, ZHOU Dian-wu. Influence and micro-mechanism of carbon materials doping ondehydrogenation properties of magnesium based hydride[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(9): 2464-2470.
[11] GASAN H, CELIK O N, AYDINBEY L N, YAMAN Y M. Effect of V, Nb, Ti and graphite additions on the hydrogen desorption temperature of magnesium hydride[J]. International Journal of Hydrogen Energy, 2012, 37(2): 1912-1918.
[12] ZHOU Cheng-shang, FANG Zhi-gang Zak, REN Chai, LI Jing-zhu, LU Jun. Effect of Ti intermetallic catalysts on hydrogen storage properties of magnesium hydride[J]. Journal of Physical Chemistry C, 2013, 117(25): 12973-12980.
[13] TANNIRU M, SLATTERY D K, EBRAHIMI F. A study of phase transformations during the development of pressure- composition-isotherms for electrodeposited Mg-Al alloys[J]. International Journal of Hydrogen Energy, 2011, 36(1): 639-647.
[14] ZHONG H C, WANG H, OUYANG L Z. Improving the hydrogen storage properties of MgH2 by reversibly forming Mg-Al solid solution alloys[J]. International Journal of Hydrogen Energy, 2014, 39(7): 3320-3326.
[15] CRIVELLO J C, NOBUKI T, KATO S. Hydrogen absorption properties of the gamma-Mg17Al12 phase and its Al-richer domain[J]. Journal of Alloys and Compounds, 2007, 446(S1): 157-161.
[16] PENG Wen-qi, LAN Zhi-qiang, WEI Wen-lou, XU Li-qin, GUO Jin. Investigation on preparation and hydrogen storage performance of Mg17Al12 alloy[J]. International Journal of Hydrogen Energy, 2016, 43(3): 1759-1765.
[17] LIANG G, HUOT J, BOILY S, VAN Neste, SCHULZ R. Hydrogen storage properties of the mechanically milled MgH2-V nanocomposite[J]. Journal of Alloys and Compounds, 1999, 291(1/2): 295-299.
[18] MUTHUKUMAR P, SATHEESH A, LINDER M, MERTZ R, GROLL M. Studies on hydriding kinetics of some La-based metal hydride alloys[J]. International Journal of Hydrogen Energy, 2009, 34: 7253-7262.
[19] TAN X H, HARROWER C T, AMIRKHIZ B S, MITLIN D. Nano-scale bi-layer Pd/Ta, Pd/Nb, Pd/Ti and Pd/Fe catalysts for hydrogen sorption in magnesium thin films[J]. International Journal of Hydrogen Energy, 2009, 34: 7741-7748.
[20] ZHANG J, SUN L Q, ZHOU Y C, PENG P. Dehydrogenation thermodynamics of magnesium hydride doped with transition metals: Experimental and theoretical studies[J]. Computational Materials Science, 2015, 98(15): 211.
[21] WANG Yong-qing, LU Shao-xia, ZHOU Zhi-yan, ZHOU Wen-zheng, GUO Jin, LAN Zhi-qiang. Effect of transition metal on the hydrogen storage properties of Mg-Al alloy[J]. Mater Science, 2017, 52: 2392-2399.
[22] PENG Qiu-ming, DONG Han-wu, WU Yao-ming, WANG Li-min. Age hardening and mechanical properties of Mg-Gd-Er alloy[J]. Journal of Alloys and Compounds, 2008, 456(1/2): 395-399.
[23] KISSINGE H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706.
Influences of transition elements(V, Ti, Y) on hydrogen storage property of Mg-Al alloy
HUANG Xian-tun1, QING Pei-lin1, QIN Chang-sheng1, XIE Zheng-zhuan2
(1. Department of Materials Science and Engineering, Baise College, Baise 533000, China;
2. College of Physical Science and Technology, Guangxi University, Nanning 530004, China)
Abstract: The Mg-Al alloy was prepared by means of mechanical alloying combined with heat treatment, and the influences of transition elements(V, Ti, Y) on the hydrogen storage property of Mg-Al alloy were characterized by X-ray diffractometry(XRD), scanning electron microscopy(SEM) and hydrogenation/dehydrogenation testing. The results show that the alloy is mainly composed of Mg17Al12 and the hydrogenated products for Mg17Al12 alloy are MgH2 and Al. The integrated hydrogen storage performance for the Mg-Al alloy is improved obviously with the catalytic action of the transition metal(V, Ti, Y). For example, the initial desorption temperatures for Mg-Al-M(V, Ti, Y) alloy are 80, 46 and 60 K lower than that of Mg-Al alloy (577 K). In addition, with the addition of the transition elements(V, Ti, Y), the apparent activation energy for the Mg-Al alloy (328.9 kJ/mol) decreases to 260.3, 188.1 and 289.4 kJ/mol, respectively. These results further demonstrate that the addition of transition metal(V, Ti, Y) is benefit to improve the hydrogen storage performance of Mg-Al alloy.
Key words: Mg-Al alloy; mechanical alloying; transition element; hydrogen storage property
Foundation item: Project(2014GXNSFAA118346) supported by the Natural Science Foundation of Guangxi Province; Project(KS16ZD06) supported by the Key Disciplines in Guangxi Universities, China; Project (KY2015LX385) supported by the Guangxi University Scientific Research Funding Project, China
Received date: 2018-01-10; Accepted date: 2019-10-20
Corresponding author: HUANG Xian-tun; Tel: +86-776-2848131; E-mail: gxbahj008@163.com
(编辑 龙怀中)
基金项目:广西自然科学基金资助项目(2014GXNSFAA118346);广西高校重点学科(KS16ZD06);广西高校科学研究资助项目(KY2015LX385)
收稿日期:2018-01-10;修订日期:2019-10-20
通信作者:黄显吞,副教授;电话:0776-2848131;E-mail:gxbahj008@163.com


