离子交换法制备纳米CeO2晶体
南京理工大学化工学院,南京理工大学化工学院,南京理工大学化工学院,南京理工大学化工学院,南京理工大学化工学院 南京江苏210094,南京江苏210094,南京江苏210094,南京江苏210094,南京江苏210094
摘 要:
提出一种以99.995%Ce (NO3) 3为原料, 强碱性阴离子交换树脂为交换介质, 采用离子交换法制备高纯度的纳米CeO2晶体的新方法。就离子交换反应过程中的Ce3+浓度、树脂加入速度和离子交换温度及Ce (OH) 3的煅烧温度等条件对CeO2粒径的影响进行了探讨, 得出了离子交换法制备纳米CeO2晶体的最佳工艺条件。FT-IR, TEM和XRD分析表明, 离子交换法无需对合成的Ce (OH) 3溶胶进行洗涤即可去除NO3-, CO32-等阴离子杂质, 将该溶胶真空干燥后, 在空气中于100℃下焙烧4h得粒径分布均匀、平均晶粒尺寸约5nm, 高纯度的CeO2粉体。
关键词:
中图分类号: O614.332
作者简介:王连军 (E-mail:wanglj@mail.njust.edu.cn) ;
收稿日期:2005-06-30
基金:教育部博士点基金项目 (B20020288015) 资助;
Preparation of Nanometer CeO2 Crystal by Ion Exchange Process
Abstract:
A novel method to synthesize CeO2 crystal of high purity was developed by using 99.995% Ce (NO3) 3 as raw materials and strongly basic anion-exchange resins as exchange medium. The effects of concentration of Ce 3+, velocity of resins putted in, ion exchange temperature and calcination temperature on particle diameter of CeO2 were also discussed and the optimum conditions were obtained. The FT-IR, TEM and XRD show that Ce (OH) 3-sol without NO3-, CO3 2- can be prepared by ion exchange method without washing, then the CeO2 crystal of high purity is synthesized by vacuum drying and calcining the Ce (OH) 3-sol at 100 ℃ for 4 h, it has an average diameter of 5 nm and good dispersity.
Keyword:
ion exchange method; nanometer CeO2 crystal; strongly basic anion-exchange resins; impurity;
Received: 2005-06-30
纳米材料是介于体相材料与单个原子、 分子之间的一类新型材料。 与传统材料相比, 由于其量子尺寸效应、 小尺寸效应、 界面效应、 表面效应和宏观量子隧道效应, 使其在声、 光、 磁、 热、 催化及化学活性等方面具有优异的物理化学性能, 因而成为特殊功能材料发展的基础, 具有重要的应用前景。
二氧化铈是一种廉价而用途极广的材料, 目前已用于汽车尾气净化催化剂、 电子陶瓷、 抛光粉、 发光材料、 紫外吸收材料等
本研究以Ce (NO3) 3 (99.995%) 溶液中的NO3-交换强碱性阴离子交换树脂中的OH-, Ce3+与被交换下来的OH-发生反应生成Ce (OH) 3溶胶, 可不洗涤直接真空干燥, 并于较低温度下焙烧制取高纯度的纳米CeO2晶体, 并对其进行了表征。
1 实 验
1.1 纳米CeO2的制备
在烧杯中加入适量的Ce (NO3) 3 (99.995%) 溶液, 放入恒温水浴中, 于不断搅拌下在特定时间内均匀地加入一定量的强碱性阴离子交换树脂 (树脂用量: V=1.2×所需OH-的量/树脂交换容量) , 随着树脂中的OH-逐渐被NO3-交换而进入溶液, Ce3+与被交换下来的OH-发生反应生成Ce (OH) 3溶胶, 快速分离出树脂, 将溶胶真空干燥后, 并在空气中于100 ℃下焙烧4 h得黄色CeO2粉末。
1.2 纳米CeO2的表征
用红外光谱仪 (Tensor 27型, Bruker公司) 对CeO2样品进行红外分析; 用XRD (D/MAX-RA型, 日本理学株式会社) 和透射电镜 (JEM-2010型, 日本JEOL公司) 分析CeO2的物相组成、 形态和晶体粒径; 样品的BET比表面积在美国产Micromeritics ASAP2000型比表面及孔径分布测定仪上测试。
2 实验结果
离子交换法制备纳米CeO2分为Ce (NO3) 3溶液与强碱性阴离子交换树脂发生离子交换合成纳米Ce (OH) 3溶胶和焙烧Ce (OH) 3制备纳米CeO2两步。 为了合成超细的纳米CeO2粒子, 必须对合成纳米Ce (OH) 3溶胶的操作条件和Ce (OH) 3的焙烧温度进行优化。
2.1 合成Ce (OH) 3溶胶过程的影响因素
在合成Ce (OH) 3溶胶过程中, 成核和生长是制备过程中的两个关键步骤, 产物粒子的大小取决于成核速度与晶核生长速度。 反应过程中的Ce3+浓度、 强碱性阴离子交换树脂加入速度和离子交换的温度等条件对晶核生成及晶核生长速度都有影响。 因为随着树脂逐渐加入, 溶液中的Ce3+不断与从树脂上被NO3-交换下来的OH-反应生成Ce (OH) 3, 而OH-的给出速度是由树脂加入速度和离子交换的温度控制。 因而Ce3+浓度、 树脂加入速度和离子交换的温度是影响Ce (OH) 3溶胶粒径大小的关键因素。 其中树脂加入速度可以在确定树脂加入量以后通过调整所需树脂的加入时间来控制。 因此, 合适的Ce3+浓度、 树脂加入时间和离子交换温度是合成稳定的纳米Ce (OH) 3溶胶的重要条件。
以Ce3+浓度、 树脂加入时间和离子交换温度为三因素, 设计了L9 (34) 正交试验方案, 并将合成Ce (OH) 3在200 ℃焙烧得晶体CeO2, 以其粒径作为评价指标, 实验结果如表1所示。
结果表明, 离子交换法制备的晶体CeO2的粒径较小。 其中影响晶体CeO2粒径的因素依次是树脂加入时间、 Ce3+浓度、 离子交换温度。 最佳组合条件为树脂加入时间16 min, Ce3+浓度0.1 mol·L-1, 离子交换温度30 ℃。 这是因为当树脂加入速度较慢和离子交换温度较低时OH-的给出速
表1 Ce3+浓度、 树脂加入时间和离子交换温度对CeO2粒径的影响Table 1Effects of concentration of Ce3+, time of resin putted in and temperature of ion exchange on diameter of CeO2
| 编号 | Ce3+浓度/ (mol·L-1) |
树脂加入 时间/min |
离子交换 温度/℃ |
CeO2粒径/ nm |
| 1 | 0.05 | 8 | 20 | 18 |
| 2 | 0.05 | 16 | 30 | 8 |
| 3 | 0.05 | 32 | 40 | 15 |
| 4 | 0.1 | 8 | 30 | 10 |
| 5 | 0.1 | 16 | 40 | 6 |
| 6 | 0.1 | 32 | 20 | 14 |
| 7 | 0.2 | 8 | 40 | 20 |
| 8 | 0.2 | 16 | 20 | 13 |
| 9 | 0.2 | 32 | 30 | 16 |
| ∑X1j | 41 | 48 | 45 | |
| ∑X2j | 30 | 27 | 34 | |
| ∑X3j | 49 | 45 | 41 | |
| X1j | 13.7 | 16 | 15 | |
| X2j | 10 | 9 | 11.3 | |
| X3j | 16.3 | 15 | 13.7 | |
| Rj | 6.3 | 7 | 3.7 |
度较慢, 反之则OH-的给出速度较快。 较慢的OH-给出速度和较低的Ce3+浓度使得晶核生长速度高于成核速度, 粒子尺寸较大; 而当OH-的给出速度较快和Ce3+浓度较高时, 虽然晶核形成速度较快, 成核速度明显高于晶核生长速度, 使得粒子尺寸较小, 但由于粒子密度高, 布朗运动使得粒子由于相互碰撞而长大, 同时团聚现象加重
2.2 焙烧温度对晶体粒径的影响
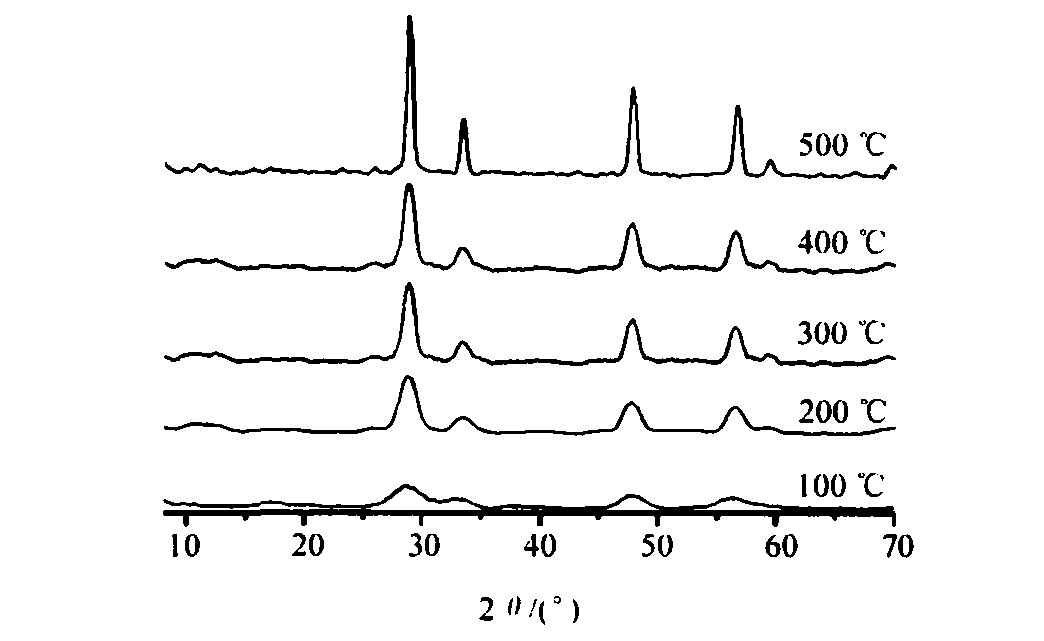
焙烧是超细粉末粒径产生微观变化的主要因素。 因为随着温度的升高, 沉淀物会发生脱水、 分解和相转变等一系列的变化, 微粒就有可能聚集或产生新颗粒。 因此, 研究Ce (OH) 3焙烧制备CeO2温度对微粒微观变化的影响, 对控制粉末粒径有重要意义。 为了研究温度对制备的纳米CeO2物相组成和晶体粒径的影响, 对其进行X射线和电子衍射分析。 图1, 2分别为上述Ce (OH) 3样品在100 ℃焙烧4 h后所得粉末的电子衍射图和在不同温度下4 h后所得粉末的XRD图。
图1的结果显示, Ce (OH) 3于100 ℃焙烧所得样品为多晶结构, 结合图2的结果可知, Ce (OH) 3于100, 200, 300, 400, 500 ℃等温度下焙烧所得样品均为立方晶相结构的CeO2粉体, 其d (晶面间距) 与JCPDS (4-0593) 所列值是一致的, 属于立方晶系
图2的结果还显示, 焙烧温度越高, 其衍射峰越窄, 晶体粒径越大。 在实验过程中还发现随着焙烧温度的升高, 样品颜色从深黄色到黄白色, 这可能是因为焙烧温度越高, 晶体CeO2粒径越大, 团聚越严重, 对光的吸收能力越弱所致。
因此, 在Ce (OH) 3焙烧制备CeO2的过程中为
图1 100 ℃焙烧样品的电子衍射图 (82000倍) Fig.1 Electron diffraction image of CeO2
了使合成的CeO2晶体粒径小, 团聚少, 应该在晶化反应得以完成的情况下尽可能地降低焙烧温度, 最终选择100 ℃作为Ce (OH) 3的焙烧温度。
2.3 样品的粒径及比表面积分析
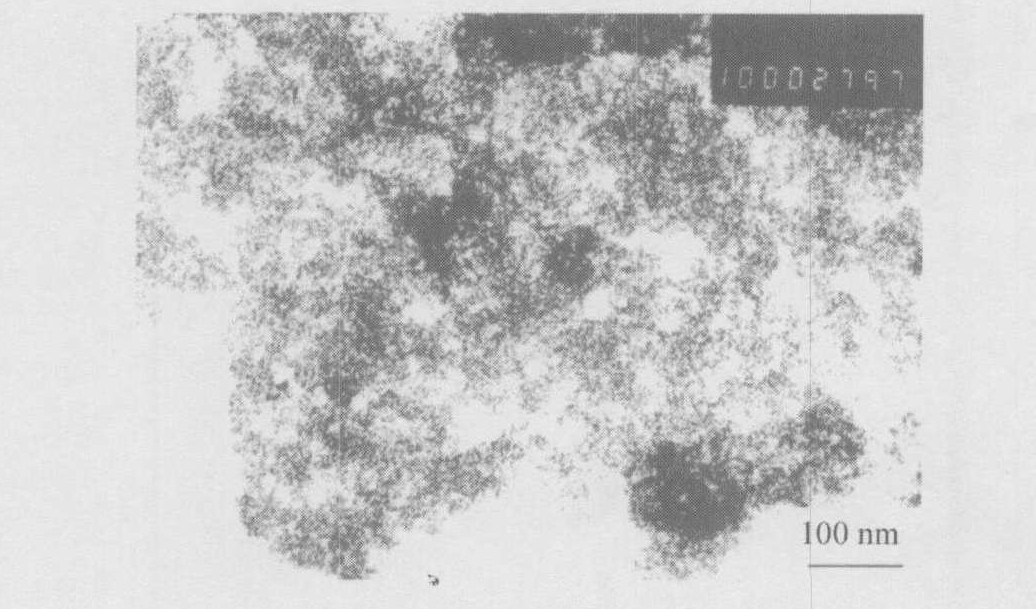
取适量的0.1 mol·L-1 Ce (NO3) 3溶液, 30 ℃恒温水浴, 于不断搅拌下在16 min内将所需树脂均匀地加入, 待反应完成后快速分离出树脂, 将溶胶真空干燥, 并在空气中于100 ℃温度下焙烧4 h得纳米CeO2晶体。 比表面及孔径分布测定结果表明所得CeO2的比表面积为132 m2·g-1。 对其进行透射电镜分析, 如图3所示。 结果表明, CeO2样品分布均匀, 平均晶粒尺寸约5 nm。
2.4 样品的纯度分析
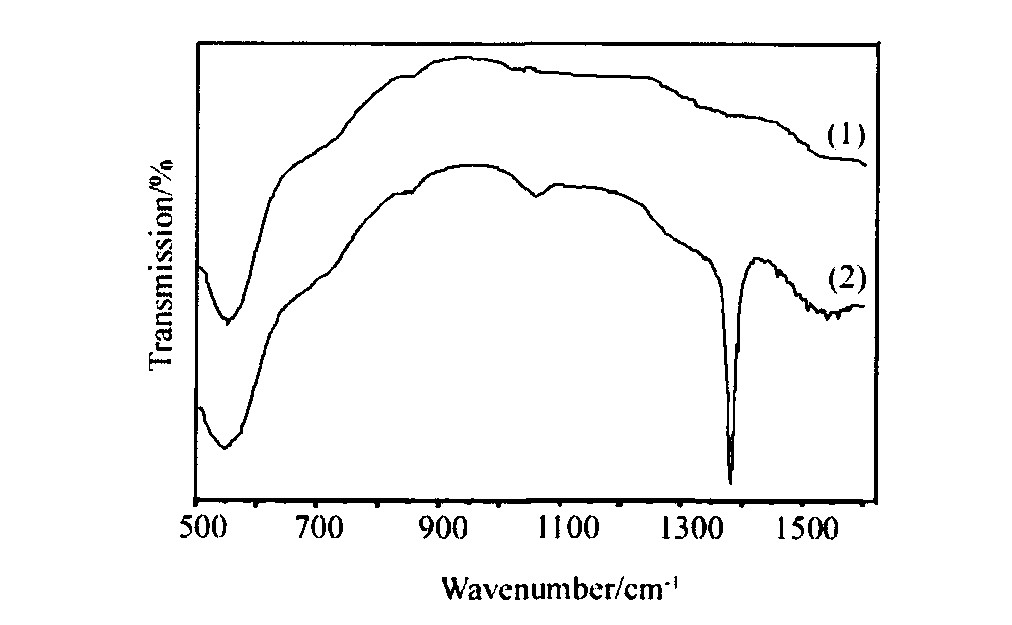
图4为离子交换法合成的CeO2样品和用NaOH代替离子交换树脂做沉淀剂合成的CeO2粉末的红外光谱图。
结果显示, 两种方法合成的CeO2样品在550 cm-1均出现吸收峰, 它们属于Ce-O的振动峰
图2 不同温度样品的XRD图 Fig.2 XRD image of CeO2
图3 100 ℃焙烧样品的透射电镜图 Fig.3 TEM image of CeO2
图4 不同方法合成的CeO2的红外光谱图 (1) 离子交换法合成的CeO2; (2) NaOH 法合成的CeO2 Fig.4 FT-IR spectra of different CeO2 samples
烈的吸收峰, 为NO3-的特征吸收峰, 而离子交换法合成的CeO2样品的红外光谱中未见NO3-的特征吸收谱带, 并且NaOH法合成的CeO2在1550和1056 cm-1附近有CO32-振动峰, 离子交换法合成的CeO2样品基本无CO32-吸收。 这是因为虽然NaOH法合成的Ce (OH) 3溶胶已被去离子水洗涤过3次, 但其中的NO3-和因NaOH吸收空气中CO2而带入的CO32-被溶胶包裹难以完全去除; 而离子交换法合成CeO2时, 由于溶液中的NO3-和CO32-等阴离子杂质已被强碱性阴离子交换树脂中的OH-交换完全。 因此无需对离子交换法合成的Ce (OH) 3溶胶进行洗涤即可去除NO3-, CO32-等阴离子杂质, 将该溶胶于100 ℃下焙烧可制得高纯度的纳米CeO2晶体。
3 结 论
以99.995% Ce (NO3) 3为原料, 用离子交换法合成了前驱体Ce (OH) 3溶胶, 由于溶液中的NO3-, CO32-等阴离子杂质在离子交换过程中已被完全去除, 所以无需对Ce (OH) 3溶胶进行洗涤, 可直接真空干燥后, 于100 ℃下焙烧可制得粒径分布均匀, 平均晶粒尺寸约5 nm, 且不含杂质的高纯度CeO2晶体。
参考文献
[1] 宋晓岚, 王海波, 吴雪兰, 等.纳米CeO的制备技术及应用[J].稀土, 2004, 25 (3) :55.
[4] 董相廷, 李铭, 张伟, 等.沉淀法制备CeO2纳米晶与表征[J].中国稀土学报, 2001, 19 (1) :24.
[5] 李梅, 柳召刚, 刘铃声, 等.氧化铈超细粉体的制备研究[J].中国稀土学报, 2003, 21 (4) :465.
[10] 李广社, 徐秀廷, 冯守华.含Ce的水热体系中结构稳定性及交价现象[J].高等学校化学学报, 1997, 18 (11) :1731.