DOI:10.19476/j.ysxb.1004.0609.2018.11.23
反溶对锌电解过程影响的数值模拟与分析
李 玺,李勇刚,阳春华,朱红求,黄 毅,邓仕钧
(中南大学 信息科学与工程学院,长沙 410083)
摘 要:
针对锌电解过程中阴极板上锌反溶对电解能耗、电流效率及析出锌产量影响难以确定的问题,基于有限元分析的方法,结合流体动力学方程及电极反应动力学方程,分别建立考虑锌反溶和不考虑锌反溶情况下的锌电解过程数学模型,利用多物理场仿真软件COMSOL建立锌电解槽的三维有限元模型,模拟计算锌电解槽中极板上的电解能耗、电流效率及析出锌产量变化的分布。结果表明:在给定实验条件下,与不考虑锌反溶反应的模型相比,锌电解过程电流效率的相对误差降低3%~4%,阴极板上析出锌产量的相对误差降低2%~5%;验证锌电解模型中考虑锌反溶的必要性。为进一步研究锌电解的优化奠定基础。
关键词:
文章编号:1004-0609(2018)-11-2366-10 中图分类号:TF813 文献标志码:A
在湿法炼锌过程中,电解作为主要的耗能工序,消耗整个生产过程中80%的电能[1],因此,降低锌电解能耗对湿法炼锌的节能降耗有重大意义。在锌的电解过程中,一方面,由于阴极板上电流的存在,阴极板上会发生氢气的析出和锌的析出,即电解液中锌离子和氢离子在阴极板上竞争获得电子进行析出反应;另一方面,由于电解液中杂质离子和H+的存在,使得析出的金属锌在H+的作用下不断溶解,这种现象常称为“反溶”。溶液中析出锌单质的反溶会抑制锌析出的速率,造成电流效率的下降,能耗的增加,降低析出锌的产量。在电解液中,锌的析出和反溶不仅取决于锌和锌离子的化学特性,还受电解槽中酸/锌离子浓度、阴极板上电流密度以及电解槽中流场的影响。因此,研究锌电解过程中各物理场的分布以及电解过程中锌反溶对电解能耗的影响,为将来从物理场和电极反应的角度对锌电解进行优化控制提供理论依据。
国内外专家学者在锌电解过程机理建模及电解槽数值模拟方面已经做了大量的研究工作。在锌电解过程机理建模方面,BARTON等[2]结合电解过程动力学方程、热力学方程、物料平衡方程和能量守恒方程等建立了锌析出反应速率与电流密度、温度等参数的稳态模型。MAHON等[3-4]在BARTON的稳态模型基础上,对锌电解过程进行了模拟仿真,并对锌电解工艺参数优化进行了初步研究。此外,文献[5]通过实验验证了有机添加剂会抑制锌电解过程中析出锌的反溶,提高电流效率。ARISE等[6]通过建立二维Zn/NiOOH电池模型,对碱性电解质溶液中离子的暂态传质速率进行了数值模拟,并对阳极上锌的溶解和钝化现象进行讨论。在电解槽数值模拟方面,文献[7-9]通过在Fluent软件中建立等比例的三维几何模型和计算流体力学模型,分别讨论入口位置、电流密度、入口流量和极板间距等因素对铜电解槽中的电解液流场以及浓度场分布的影响。针对锌电解过程,周萍等[10-12]利用Fluent软件对锌电解槽中电解液的流场和浓度场进行数值模拟,并基于仿真结果对电解槽的结构和部分工艺参数进行优化。
在实际过程中,除了电解槽中的流场和浓度场,还存在着电化学反应以及电场。针对锌电解槽中的电化学反应和电场,文献[13]假设锌电解槽中的离子是均匀分布,建立锌电解动态反应模型,将锌电解工况进行分类,实现对锌电解全流程酸锌离子浓度的预测。在实际情况中,电解槽是三维结构且槽中的离子浓度受流场和电场的影响,分布并不均匀。为了真实的模拟电解槽中多物理场的分布情况,邓亦梁等[14]在分析锌电解过程流场、浓度场的基础上,对锌电解过程中极板上的电化学反应进行建模,利用COMSOL仿真软件,建立电解槽的三维几何结构,对锌电解过程中的多物理场进行数值模拟,并对仿真结果加以分析和验证。此外,由于电解液中存在大量的H+和自由移动的电子,阴极板上还存在着析出锌的反溶反应。为此,本文作者主要在邓亦梁等[14]的研究基础上,通过建立锌电解过程的物理模型和锌沉积与反溶反应的电化学模型,采用数值模拟的方法分析阴极板上析出锌的反溶对电流效率、能耗以及析出锌产量的影响,并通过实验对软件仿真结果的准确性进行验证,为后续研究锌电解过程的优化控制提供坚实的理论基础。
1 数学模型
锌电解是在直流电作用下,硫酸锌溶液中的锌离子在阴极板上析出,并定期将阴极板上析出的锌剥离并获得高纯度的金属锌的过程。电解槽结构如图1所示。
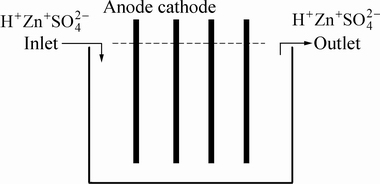
图1 电解槽示意图
Fig. 1 Schematic diagram of electrowinning cell
锌的电解过程涉及电解液在电解槽中的循环流动、物质传热、扩散和导电等多种物理场以及多种电化学反应和杂质间的化学反应,分别对电解过程中的电解液流动模型、电极反应动力学模型及能耗模型进行建模。
1.1 锌电解槽中电解液的流动模型
在锌电解槽中,流场、电场及浓度场之间相互影响。在锌电解过程中,一方面,氢离子和锌离子通过电解液的流动在极板间运动;另一方面,由于电极反应主要发生的极板的表面,会消耗部分的氢离子和锌离子,电解液的流动会对消耗的锌离子和氢离子进行补充。此外,阳极发生的氧气析出反应所产生的氢离子以及电解过程中产生的能量也是通过电解液的流动带出电解槽,从而保证电解槽内的酸锌离子浓度分布在允许范围内。因此,电解液的流动会对槽内的离子浓度分布、温度的均匀分布、极板上的电极反应速率以及节能降耗有很大的影响,研究电解槽中的流场是研究其他物理场的基础。
由于锌电解槽中的电解液运动对锌的电解过程有着显著的影响,因此,需要对锌电解槽内的流场进行研究,考虑到计算的复杂度,作出如下假设来简化电解槽中电解液的物理场模型:
1) 忽略阴极产生的氢气和阳极产生氧气在溶液中产生的气泡对电解液流场的影响;
2) 电解液的流动视为稳态不可压缩流;
3) 忽略电解液密度和温度等对流场的影响。
在电解液流动的过程中,电解液会出现回流和绕流现象,因此,本文采用JONES和LAUNDER提出的k-ε模型来描述电解槽中的湍流模型[15],且始终遵循着质量守恒、能量守恒和动量守恒定律。由于在电解液流动的过程中忽略了电解液密度和温度等对流场的影响,因此,锌电解槽中流场的模拟只需要满足连续性方程、能量守恒、动量守恒方程和湍流模型方程。
连续性方程表达式为
 (1)
(1)
式中:ρ为流体的密度,kg/m3;x为位移,m;i为三维直角坐标系下的坐标方向;vi为xi方向上的速度分量,m/s;t为时间,s。
动量守恒方程的表达式为
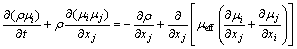 (2)
(2)
式中:i和j为三维直角坐标系下的坐标方向;μi、μj是xi、xj方向上速度分量,m/s;p是压强,Pa;μeff是有效黏度,μeff为μ和μt之和;μ是分子动力学黏度,Pa·S;μt是湍流动力黏度,Pa·S。
能量守恒方程表达式为
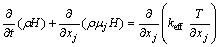 (3)
(3)
式中:keff为热导率,W/(m·k);H为显焓,J/mol。
湍流动能方程表达式为
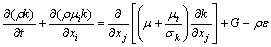 (4)
(4)
湍流耗散率方程表达式为
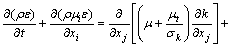
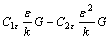 (5)
(5)
式中:G是由于平均速度梯度引起的湍动能k的产生项,表达式为:
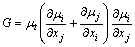 (6)
(6)
式中:k为湍动能,m2/s2;ε为湍流耗散率,m2/s3;σk和σε分别是k和ε湍流Prandtl数;C1ε、C2ε、σk和σε为模型常数,在标准k-ε模型中,根据LAUNDER 等[15]的推荐值及后来的实验验证,C1ε的值为1.44,C2ε的值为1.92,σk的值为1.0,σε的值为1.33。
1.2 锌沉积及气体产生反应的电化学模型
在锌电解槽中,电解液的主要成分是ZnSO4、H2SO4和H2O,因此,电解液中的主要包含的阳离子有锌离子、氢离子和铜、钴、镍等杂质离子,铜、钴、镍等杂质离子易在阴极板上析出,并与锌产生微弱电流,加速析出锌的反溶[16],为了保证锌电解的正常生产,在实际生产中,电解液的杂质离子浓度低于5 mg/L[17]。远低于电解液中的锌离子、氢离子浓度,因此,本文忽略杂质离子对锌电解的影响,在阴极上,主要发生的锌离子的沉积和氢气的析出反应:
Zn2++2e→Zn,φ0=-0.763 V (7)
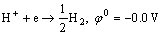 (8)
(8)
在阳极上,主要发生氧气析出反应:
 (9)
(9)
在电解过程中,电极表面的总电流是其表面发生的所有化学反应所产生电流之和。由于阴极上氢气析出反应和阳极上氧气析出反应的物质转移过程较慢,决定氢气析出反应和氧气析出反应的速率决定步骤是电极表面的电荷转移过程。因此,用于氧气析出反应的电流密度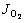 和氢气析出反应的电流密度JH的计算公式为:
和氢气析出反应的电流密度JH的计算公式为:
 (10)
(10)
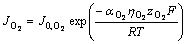 (11)
(11)
式中:JH、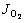 表示氢气析出反应和氧气析出反应的电流密度;J0,H、
表示氢气析出反应和氧气析出反应的电流密度;J0,H、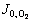 表示氢气析出反应和氧气析出反应的交换电流密度;αH、
表示氢气析出反应和氧气析出反应的交换电流密度;αH、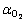 表示氢气析出反应和氧气析出反应的转移系数;ηH、
表示氢气析出反应和氧气析出反应的转移系数;ηH、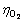 表示氢气析出反应和氧气析出反应的过电势;zH、
表示氢气析出反应和氧气析出反应的过电势;zH、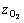 表示氢气析出反应和氧气析出反应的转移电子数;F表示法拉第常数;R为摩尔气体常数;T为电解液温度。
表示氢气析出反应和氧气析出反应的转移电子数;F表示法拉第常数;R为摩尔气体常数;T为电解液温度。
阴极板上锌的沉积反应没有气体的生产,物质转移过程较快,在计算锌沉积反应电流密度时要充分考虑物质转移的影响。因此,计算用于锌沉积反应电流密度JZn的公式为
 (12)
(12)
式中: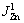 为锌沉积反应的极限电流密度;J0,Zn、αZn分别为锌沉积反应的交换电流密度和转移系数;c0、cS分别为极板间和阴极板表面锌离子的浓度;ηZn为锌沉积反应的过电压。
为锌沉积反应的极限电流密度;J0,Zn、αZn分别为锌沉积反应的交换电流密度和转移系数;c0、cS分别为极板间和阴极板表面锌离子的浓度;ηZn为锌沉积反应的过电压。
极限电流密度可以用下式进行计算[18]:
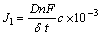 (13)
(13)
式中:D为减少离子的扩散系数;δ为电极表面电解质的滞流层厚度(在混合溶液中大概为0.05 cm);t为溶液中除转移离子外所有离子的转移数量;c为扩散离子的浓度,mol/L。
理论上,如果阴极和阳极的化学反应是完全可逆的热力学反应,在通过一个大电流时,电极电位不会偏离平衡电位。但在实际过程中,电极电位会偏离平衡电位,且这个现象称为极化。电势偏差的大小称为过电压,过电压定义为工作电极电位与平衡电位之间的差值。在锌电解槽中,过电压的计算公式为
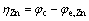 (14)
(14)
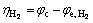 (15)
(15)
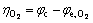 (16)
(16)
式中:φc、φa分别代表阴极和阳极的工作电势;φe,Zn代表锌沉积反应的平衡电位;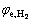 、
、 分别代表氢气析出反应和氧气析出反应的平衡电位。
分别代表氢气析出反应和氧气析出反应的平衡电位。
在电化学过程的热力学计算中,常用Nernst方程[19]来表示电极反应的平衡电极电位φe与标准平衡电极电位(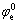 )、转移电子数(n)、氧化物活度(a0)及还原物活度(ar)之间的关系:
)、转移电子数(n)、氧化物活度(a0)及还原物活度(ar)之间的关系:
 (17)
(17)
式(17)表明了氧化物与还原物活度与平衡电位之间的关系,在电解液中,氢气、氧气和金属锌都被认为是处在标准状态,水的活性常被认为0.9,与1mol/L ZnSO4和1.5mol/L H2SO4混合溶液中的水的活度相同。溶液中物质的活度(aj)与浓度(cj)之间的关系为
 (18)
(18)
式中:γj表示物质的活度因子。HURLEN和BREIVIK[20]对锌离子的活度因子进行了研究。在锌电解过程中,物质的活度因子分别为: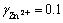 ,
,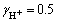 ,
,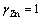 。
。
1.3 锌反溶的数学模型
由于电解液中含有大量的氢离子存在,会导致部分锌在电解液中溶解,且阳极上氧气的析出反应会产生大量随电解液移动电子,在一定程度上对锌的溶解有促进作用,因此,在阴极上,还存在着析出锌单质的溶解反应。在酸性和非复合溶液中,阴极锌溶解反应为两个连续电荷转移的步骤[21]:
Zn=Zn++e (19)
Zn+=Zn2++e(r.d.s) (20)
上述反应的标准平衡电极电位φ0为-0.763 V[18]。式(20)的电解槽中锌溶解反应是速度控制步骤(r.d.s),Zn+以中间产物的形式存在,在这种溶解机理下,Tafel斜率b一般为2.3×2RT/3F(30 mV)。
在电解过程中,由于阴极上主要进行的是锌的析出反应,对锌的反溶反应有很大的抑制作用;虽然氧气析出反应释放的电子对锌的反溶有促进作用,但锌的溶解反应过程总体比较缓慢,因此,采用Tafel方程计算用于锌反溶反应的电流密度Joccr:
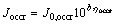 (21)
(21)
式中:Joccr为用于锌反溶反应的电流密度;J0,occr为锌反溶反应的交换电流密度;ηoccr为锌反溶反应的过电势;b为锌反溶反应的Tafel斜率。针对锌溶解反应的交换电流密度,BERKE等[22]经过实验得到的交换电流密度为1.2A/m2,由于在对锌电解过程进行数值模拟时,设置的环境较为理想,忽略了电解液中杂质离子对锌沉积反应的影响,导致模拟计算得到的析出锌的产量比实际值高,且在本文的实验情况下,H+的浓度比文献[22]的值高,导致析出锌的反溶反应速率更快,因此,数值模拟时,锌反溶反应的交换电流密度取值为2 A/m2。
锌反溶反应的过电压ηoccr计算公式为
ηoccr=φc-φe,occr (22)
式中:φc为阴极的工作电势;φe,occr为锌反溶反应的平衡电位,可以通过式(17)计算得到。
1.4 锌电解过程的能耗模型
在工业生产中,在保证锌产量的前提下,需要尽可能的减少锌电解过程中的能耗。工业生产中,衡量锌电解过程中能耗的指标为电流效率和电解能耗。
根据法拉第定量可知,当96500 C电量通过硫酸锌电解质溶液时,理论上在电极表明将析出1 mol锌。但在实际生产过程中,每当阴极上通过96500 C的电量时,由于氢气的析出、杂质的析出、氧气的析出和锌的溶解等造成的损失,析出的锌一般不足1 mol。因此,在工业生产中常把电解过程中实际析出锌的产量与和通过相同电量理论上应该析出的锌产量之比定义为电流效率,也用锌析出电流密度和极板总电流密度的比值来表示电流效率(ε),其计算公式如下:
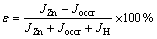 (23)
(23)
在锌电解生产中,常用电解直流单耗来表征电解能耗的高低,即每生产一吨锌电解所需要消耗的直流电能,直流单耗(W)与电流效率、槽电压(V)的关系为
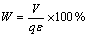 (24)
(24)
式中:q为锌的电化学当量,其值为常数,取值为:1.2198 g·A-1·h-1;V为槽电压,即相邻阴阳极板之间的电位差,其计算公式为[14]
 (25)
(25)
式中:φa、φc分别为阴极板和阳极板的电压;J为总电流密度;l为极板间距;σ为电解液的电导率。
2 锌电解过程的数值模拟实现
2.1 模型的建立
为了研究锌电解槽中多物理场以及锌溶解对锌电解过程中电解能耗的影响,从某锌冶炼厂采集工业生产中的电解液,根据实际工艺条件,利用小型电解槽对锌电解过程进行模拟。电解槽有限元模型如图2所示。
图2 电解槽的有限元模型
Fig. 2 Finite element analysis model of electrowinning cell
在锌电解槽中,电解液成电中性(主要成分为H+、Zn2+、SO42-和H2O),电解液通过进液管流入电解槽中,电解槽内包括两对交替放置的阴阳极板,阴阳极板的尺寸相同,均为3 mm×120 mm×157 mm,电解槽尺寸为320 mm×180 mm×220 mm。由于在实验过程中,靠近出口的阴极板面用胶带粘贴,因此,假设该面不发生锌的析出反应,在仿真平台上,设置该面无化学反应发生。在锌电解槽中,假设阴极板靠近进液管的一面为A1、B1,靠近出口面的一面为A2。在COMSOL软件中建立的有限元模型尺寸与实际试验中电解槽的几何结构尺寸完全相同,本文以阴极板A1面为例进行分析。
2.2 实验参数
在实际实验过程中,配置好的电解液通过4 L/min的流量从入口流向电解槽中,经过计算,电解液的流速为0.0566 m/s,因此,在仿真过程中,设置入口边界条件为速度入口,且入口速度为0.0566 m/s,其中,入口处电解液中的酸锌离子浓度分别为170 g/L和55 g/L;由于电解液是从出口溢流而出,因此,设置电解液出口边界条件为压力出口;在电解槽中,阴极板表面平均电流密度为500 A/m2;电解液的温度为313.15 K,即40 ℃;电解周期为12 h。
3 结果与分析
3.1 锌沉积与反溶反应的电流密度分布
在锌电解过程中,阴极板上主要发生氢气的析出反应、锌的析出反应和反溶反应。虽然锌的析出反应会在一定程度上抑制锌反溶反应的发生,但由于溶液中H+和自由移动电子的存在,阴极板上析出的锌会在电解液中反溶。图3所示为阴极板面A1上锌沉积反应和锌反溶反应电流密度分布的仿真结果。
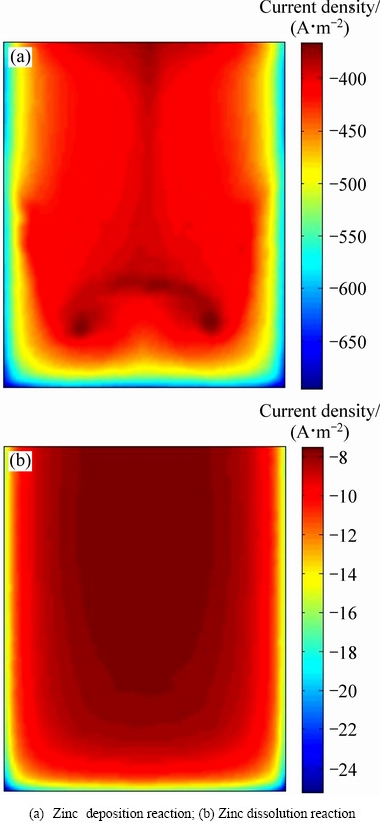
图3 阴极板A1面电流密度分布
Fig. 3 Current density on cathode surface A1
由图3可知,阴极板上锌析出反应的电流密度大部分在400~500 A/m2的范围内,锌反溶反应的电流密度大部分在8~14 A/m2的范围内,表面阴极板上虽然有锌的反溶反应存在,但是锌沉积反应是阴极板上主要的化学反应;在阴极板A1面上,锌沉积反应的电流密度呈现出中间低、两边高的分布趋势,这主要是受电解槽中电解液的流场和浓度场的影响;锌反溶反应的电流密度也呈现出中间低、两边高的分布趋势,反分布形态和锌沉积反应不一样,这主要是因为在阴极板中部,锌析出反应速率较慢,虽然对锌反溶反应的抑制作用较弱,但析出锌的质量较少,因此,锌反溶反应速率较慢;在阴极板的边缘区域,锌析出反应速率较大,对锌反溶反应的抑制作用较强,但析出锌的量会增加,会促进锌的反溶,因此,锌的反溶反应的电流密度分布呈现出图3(b)所示的形态。对比图3(a)和图3(b)可知,靠近阴极板边缘的区域锌沉积反应和锌反溶反应的电流密度较高,主要是由极板的边缘效应造成的。
3.2 阴极板上电流效率分布
在锌电解过程中,阴极板上主要存在锌的析出反应、氢气的析出反应和析出锌的反溶反应,在析出锌进行反溶的过程中,会消耗一部分电流,因此,阴极板上析出锌的反溶会对电解过程中的电流效率有一定的影响。图4所示为阴极板面A1在考虑反溶和不考虑反溶两种情况下电流效率分布的仿真结果和阴极板上垂直方向上的平均电流效率曲线图。
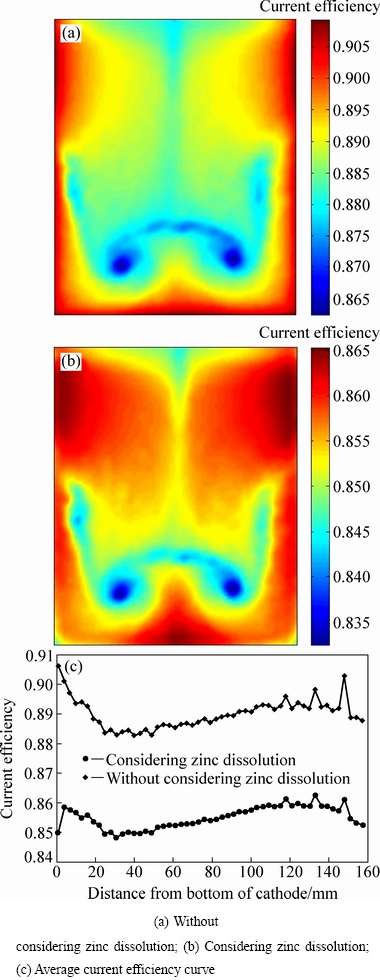
图4 阴极板A1面的电流效率分布
Fig. 4 Current efficiency on cathode surface A1
由图4(a)可知,当对锌电解过程进行数值模拟且不考虑析出锌的锌反溶时,阴极板A1面上的电流效率最大值为90.19%,最小值为86.26%;从电流效率分布情况来看,电流效率的分布关于极板中间左右对称,极板边缘的电流效率较高,中部区域电流效率较低,大部分区域的电流效率分布在87%~89%的范围内,且阴极板A1面上的平均电流效率为88.94%。由图4(b)可知,当对锌电解过程进行数值模拟且考虑析出锌的反溶时,阴极板上电流效率的最大值为86.519%,最小值为83.235%;从电流的分布情况来看,电流效率的分布关于极板中间左右对称,大部分区域的电流效率分布在83%~85%的范围内,且阴极板A1面上的平均电流效率为85.516%。因此,通过图4(a)与图4(b)对比可知,阴极板上析出锌的反溶会将电流效率降低3%~4%,但对极板上电流效率的分布形态影响不大。
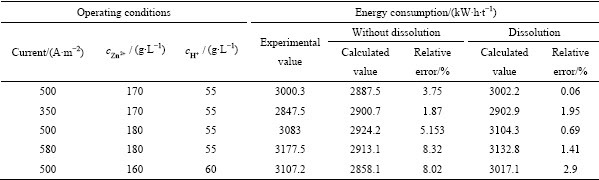
表1所列为不同电流密度和酸锌离子浓度条件下(40 ℃,周期为12 h)锌电解过程电流效率的实际值、考虑反溶情况下的计算值和不考虑反溶情况下计算值的对比,通过对比可以发现:当对锌电解过程进行模拟计算时,不考虑析出锌的反溶时,电流的计算值一般比实际值大,主要因为在实际过程中,电解液中的杂质和阴极板上锌的反溶会影响电流效率;当在模拟计算过程中考虑锌反溶的影响时,电流效率会降低且更接近实际值,符合理论分析。与不考虑锌反溶相比,计算值域实际值之间的相对误差大约降低4%,电流效率的计算值更精确。但由于没有考虑电解液中的杂质金属离子、电解液温度变化以及电解过程中阴极板厚度变化等因素对锌电解的影响,模拟计算得到电流效率与实际值之间仍存在一定的误差。
3.3 阴极板能耗分布
综上可知,阴极板上锌的反溶会造成电流效率的降低,在能耗模型中,槽电压和电流效率是影响锌电解能耗的主要因素,因此,阴极板上锌的反溶会对电解过程中的能耗产生的影响。图5所示为是阴极板面A1在考虑反溶和不考虑反溶两种情况下的能耗分布仿真结果和阴极板上垂直方向上的平均能耗曲线图。
表1 不同电解条件下电流效率的计算值和实验值
Table 1 Calculated value and experimental value of current efficiency under different electrolytic conditions
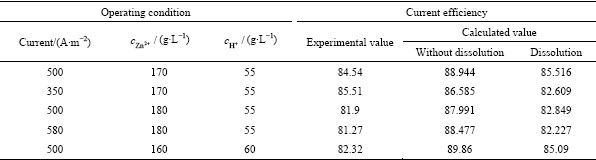
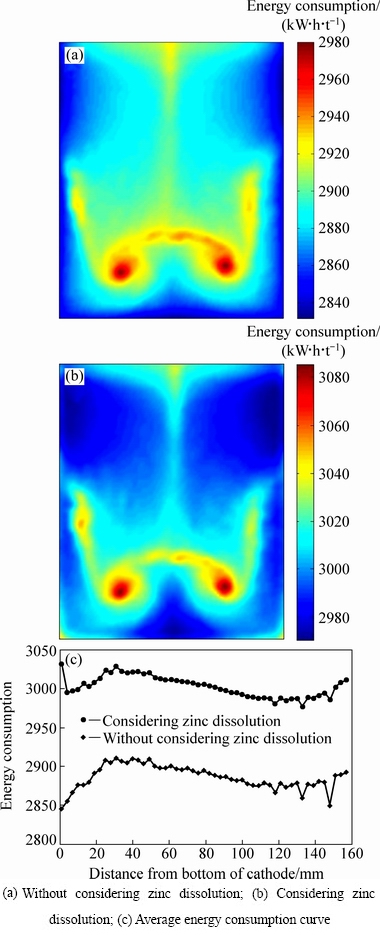
图5 阴极板A1面的能耗分布
Fig. 5 Energy consumption on cathode surface A1
由图5(a)可知,当对锌电解过程进行数值模拟且化学反应体系中不考虑锌反溶时,阴极板A1面上的能耗最大值为2979.4 W·h·t-1,最小值为2831.9 W·h·t-1;从电解能耗的分布来看,阴极板上的能耗呈现左右对称的分布形态,在极板下部区域中间,电解能耗比其它区域高,主要是因为该区域电解液的流动较慢,析出锌的电流密度较低,导致电流效率比其它区域低,因此,能耗较高;极板上大部分区域的能耗在2880~2900 W·h·t-1范围内,平均值为2887.5 W·h·t-1,在相同条件下,通过实验得到的电解能耗为3000.3 kW·h·t-1。从图5(b)可知,当对锌电解过程进行数值模拟且考虑析出锌的反溶时,阴极板A1面上的能耗最大值为3085.2 kW·h·t-1,最小值为2969.9 kW·h·t-1,且平均值为3002.2 kW·h·t-1,与锌电解槽中没有锌反溶反应仿真结果相对比,更接近实际实验结果的能耗;对比图5(a)和图5(b)可知,当对锌电解过程进行数值模拟且考虑锌的反溶时,阴极板A1面上的能耗分布与不考虑反溶时能耗分布的形态相似;由于阴极板上以锌沉积反应为主,阴极板A1面上的能耗分布与锌沉积反应的电流密度、电流效率的分布形态类似。从图5(c)中可知,在考虑阴极板上析出锌的反溶时,阴极板上的能耗平均值会增高100~120 kW·h·t-1左右。因此,阴极板上锌的反溶会增加锌电解过程中的能耗,但对极板上能耗的分布形态影响不大。
为了对不同条件下析出锌的反溶对锌电解过程中直流单耗的影响,分别在不同电流密度和酸锌离子浓度条件下(40 ℃,周期为12 h)对锌电解过程进行模拟计算,得到锌电解过程的直流单耗。表2所列为不同电解条件下能耗的计算值和实验值。从表2可以看出,考虑析出锌的反溶反应时,锌电解过程的能耗与不考虑析出锌反溶时相比约增加100~130 kW·h·t-1,且相对误差比不考虑锌反溶时降低3%~5%,更接近实验过程中直流单耗的实际值。
3.4 阴极板析出锌产量的分布
在实际工业生产中,对锌电解过程优化控制的前提是保证锌的产量。但阴极板上析出锌的反溶会降低锌的产量,因此,本文分别给出了阴极板面A1在考虑反溶和不考虑反溶两种情况下的析出锌产量变化分布的仿真结果及阴极板上垂直方向上的平均析出锌质量变化曲线图。
表2 不同电解条件下能耗的计算值和实验值
Table 2 Calculated value and experimental value of energy consumption under different electrolytic conditions
从图6(a)中可知,当对锌电解过程进行数值模拟且化学反应体系中不包括锌反溶反应时,阴极板A1面上的析出锌质量变化的最大值为10.746 kg/m2,最小值为5.2954 kg/m2,析出锌产量的平均值为6.5354 kg/m2;从图6(b)中可知,当对锌电解过程进行数值模拟且化学反应体系中包括锌反溶反应时,阴极板A1面上的析出锌质量变化的最大值为10.093 kg/m2,最小值为5.2720 kg/m2,析出锌产量的平均值为6.2716 kg/m2。从图6(c)中可知,由于阴极板上析出锌存在反溶,阴极板上析出锌的质量变化会降低0.2~0.5 kg/m2。通过将图6(a)和图6(b)对比可知,阴极板上锌的反溶会造成阴极板中间区域析出锌质量减少,析出锌的厚度变薄,且该区域能耗高,电流效率低,更容易发生“烧板”现象。因此,在实际生产过程中,对锌电解过程进行优化时,需要综合考虑能耗和电流效率。
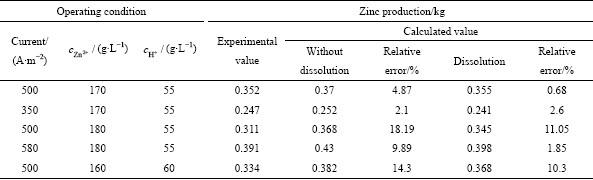
为了进一步验证不同反应条件下析出锌的反溶对析出锌产量的影响,表3所列为不同电流密度和酸锌离子浓度条件下(40 ℃,周期为12 h)析出产量的计算值和和实验值。从表3中可以发现,当不考虑锌反溶的影响时,阴极板析出锌产量的计算值比实际值高,主要是因为在实际锌电解实验过程中,随着反应的进行,阴极板上析出的锌会覆盖在阴极板表面,降低阴极板的有效电解面积,且析出的锌会与电解液发生化学反应,因此,阴极板析出锌产量的计算值比实际值高。通过与不考虑锌反溶的模型相对比,可以发现:当考虑阴极板析出锌的反溶反应时,阴极板析出锌的产量与实际值之间的相对误差会降低3%~5%,析出锌产量的计算值与实验值更接近,析出锌产量的计算值更加准确。
当考虑锌反溶时,析出锌产量的计算值与实际值之间仍存在误差,主要是因为在模型中并未考虑电解液中的杂质金属离子、电解液温度变化以及电解过程中阴极板厚度变化等因素对锌电解过程的影响,以及实验过程中,对析出锌质量的测量可能存在误差,导致模拟计算值与测量值之间存在误差;但在电解模型中考虑锌反溶时,与不考虑锌反溶时相比,计算值与测量值之间的相对误差减小,表明本文建立的数学模型更能准确地描述锌电解槽中的锌电解过程。在后续的实验中,可以充分考虑电解液中杂质金属离子和电解液温度变化等因素对锌电解过程中锌沉积反应和反溶反应的影响,以及电解过程中阴极板厚度变化对阴极板电流密度分布和析出锌产量的影响,对所建立的锌电解数学模型进行优化。
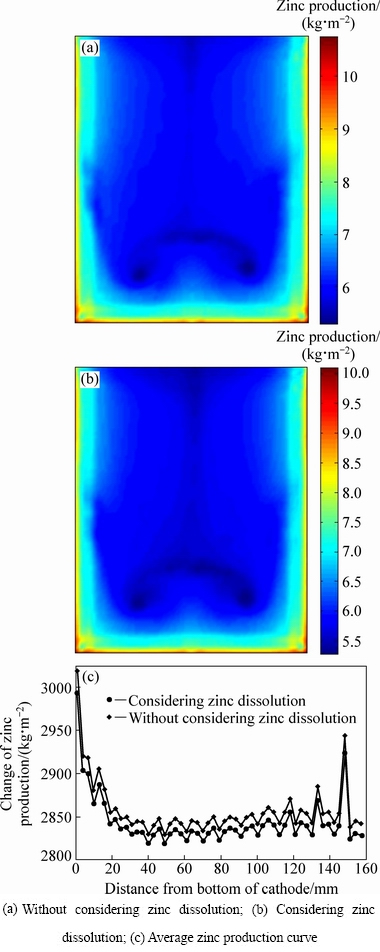
图6 阴极板A1面的锌析出质量变化分布
Fig. 6 Production of zinc deposited on cathode surface A1
表3 不同电解条件下析出锌产量的计算值和实验值
Table 3 Calculated value and experimental value of zinc production under different electrolytic conditions
4 结论
1) 基于有限元分析的方法,建立锌电解过程中电解液的流动和极板上电极反应的数学模型,对500 A/m2电流密度下的锌电解过程进行数值计算。
2) 锌电解过程中,锌的反溶反应和锌的沉积反应都会影响电流效率、直流单耗以及析出锌产量,锌的沉积反应是主要因素,但在锌电解模型中考虑析出锌的反溶时,模拟计算得到的电流效率、直流单耗以及析出锌产量与实验值之间的相对误差减小,因此,在对锌电解过程进行建模时,需要充分考虑阴极板上析出锌的反溶。
3) 锌电解过程中,阴极板上析出锌的反溶对阴极板中部区域析出锌质量和厚度影响明显,会导致该区域析出锌质量减少,厚度变薄,且该区域电流效率低,能耗高,容易发生“烧板”现象。
REFERENCES
[1] 梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001: 340-409.
MEI Guang-gui, WANG De-run, ZHOU Jing-yuan, WANG Hui. Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001: 340-409.
[2] BARTON G W, SCOTT A C. Industrial applications of a mathematical model for the zinc electrowinning process[J]. Journal of Applied Electrochemistry, 1994, 24(5): 377-383.
[3] MAHON M, WASIK L, ALFANTAZI A. Development and implementation of a zinc electrowinning process simulation[J]. Journal of the Electrochemical Society, 2012, 159(8): D486-D492.
[4] MAHON M, PENG S, ALFANTAZI A. Application and optimisation studies of a zinc electrowinning process simulation[J]. The Canadian Journal of Chemical Engineering, 2014, 92(4): 633-642.
[5] IVANOV I. Increased current efficiency of zinc electrowinning in the presence of metal impurities by addition of organic inhibitors[J]. Hydrometallurgy, 2004, 72(1): 73-78.
[6] ARISE I, KAWAI S, FUKUNAKA Y, MCLARNON F R. Numerical calculation of ionic mass-transfer rates accompanying anodic zinc dissolution in alkaline solution[J]. Journal of the Electrochemical Society, 2010, 157(2): A171-A178.
[7] 李明周, 黄金堤, 童长仁, 张文海, 周孑民, 李贺松, 张 鹏. 铜电解槽内电解液流场的数值模拟[J]. 中国有色金属学报, 2015, 25(8): 2259-2267.
LI Ming-zhou, HUANG Jin-di, TONG Chang-ren, ZHANG Wen-hai, ZHOU Jie-min, LI He-song, ZHANG Peng. Numerical simulation of electrolyte flow in copper electrolytic cell[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(8): 2259-2267.
[8] HEMMATI H, MOHEBBI A, SOLTANI A, DANESHPAJOUHB S. CFD modeling of the electrolyte flow in the copper electrorefining cell of Sarcheshmeh copper complex[J]. Hydrometallurgy, 2013, 139: 54-63.
[9] KIM K R, CHOI S Y, PAEK S, PARK J Y, HWANG I S, JUNG Y. Electrochemical hydrodynamics modeling approach for a copper electrowinning cell[J]. Int J Electrochem Sci, 2013, 8: 12333-12347.
[10] 苏寅彪. 锌电解槽流场数值模拟及其优化[D]. 长沙: 中南大学, 2012: 16-35.
SU Yin-biao. Numerical simulation and optimization for the flow field of the zinc electrowinning cell[D]. Changsha: Central South University, 2012: 16-35.
[11] LI H, JIE H U, PING Z, WEI W W, SU Y B. Optimization of operating conditions and structure parameters of zinc electrolytic cell based on numerical simulation for electrolyte flow[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(5): 1604-1609.
[12] SCHWARZ M P. Improving zinc processing using computational fluid dynamics modelling–Successes and opportunities[J]. Minerals Engineering, 2012, 30: 12-18.
[13] 邓仕钧, 阳春华, 李勇刚, 朱红求. 锌电解全流程酸锌离子浓度在线预测模型[J]. 化工学报, 2015(7): 2588-2594.
DENG Shi-jun, YANG Chun-hua, LI Yong-gang, ZHU Hong-qiu. On-line prediction model for concentrations of zinc ion and sulfuric acid in zinc electrowinning process[J]. CIESC Journal. 2015(7): 2588-2594.
[14] 邓亦梁, 谢永芳, 李勇刚, 阳春华. 基于液相传质的锌电解过程多物理场仿真分析[J]. 中南大学学报(自然科学版), 2017(1): 119-126.
DENG Yi-liang, XIE Yong-fang, LI Yong-gang, YANG Chun-hua. Multiphysics simulation analysis for zinc electrowinning based on liquid-phase mass transfer[J]. Journal of Central South University(Science and Technology), 2015(7): 2588-2594.
[15] JONES W P, LAUNDER B E. The prediction of laminarization with a two-equation model of turbulence[J]. International Journal of Heat and Mass Transfer, 1972, 15(2): 301-314.
[16] 沈 芳. 锌电解液中铜钴镍的电化学分析方法研究[D]. 长沙: 中南大学, 2012: 2-12.
SHEN Fang. Determination of copper, cobalt and nickel in zinc plant electrolyte by electrochemical methods[D]. Changsha: Central South University, 2012: 2-12.
[17] SABA A E, ELSHERIEF A E. Continuous electrowinning of zinc[J]. Hydrometallurgy, 2000, 54(2): 91-106.
[18] REVIE R W. Corrosion and corrosion control[M]. New York: John Wiley & Sons, 2008: 58-63.
[19] CHOI N S, KIM D W, CHO J, KIM D H. A fully optimized electrowinning cell for achieving a uniform current distribution at electrodes utilizing sampling-based sensitivity approach[J]. Journal of Electrical Engineering and Technology, 2015, 10(2): 641-646.
[20] HURLEN T, BREIVIK T R. Ion activities and zinc electrode reactions in aqueous sulfate solutions[J]. Acta Chemica Scandinavica Series A–Physical and in Organic Chemistry, 1978, 32(5): 447-453.
[21] ZHANG X G. Corrosion and electrochemistry of zinc[M]. Switzerland: Springer Science & Business Media, 2013: 29-36.
[22] BERKE N S, FRIEL J J. Applications of electrochemical techniques in screening metallic-coated steels for atmospheric use[M]//Laboratory Corrosion Tests and Standards. Philadelphia: ASTM International, 1985.
Numerical simulation and analysis of influence of reverse dissolution in zinc electrolysis process
LI Xi, LI Yong-gang, YANG Chun-hua, ZHU Hong-qiu, HUANG Yi, DENG Shi-jun
(School of Information Science and Engineering, Central South University, Changsha 410083, China)
Abstract: In order to determine the influence of reverse dissolution of zinc on energy consumption, current efficiency and the output of zinc in zinc electrolysis process, the mathematical models of considering the zinc dissolution and without considering zinc dissolution on zinc electrolysis process were established, respectively, based on finite element analysis and combining fluid dynamics and electrode kinetics equation. To calculate the model numerically and obtain the data of energy consumption, current efficiency and the output of zinc on cathode surface, a 3D model was built up in simulation software COMSOL. The results show that comparing with the model without considering reverse dissolution of zinc, the relative error of current efficiency and the output of zinc on cathode reduces 3%-4% and 2%-5%, respectively, which verifies the necessity of considering the reverse dissolution in zinc electrolysis model. Therefore, the work makes a fundamental for the further optimal control of zinc electrolysis process.
Key words: reverse dissolution; electrode kinetics; numerical simulation; COMSOL
Foundation item: Project(61673400) supported by the National Science Foundation of China; Project(61621062) supported by the Science Fund for Creative Research Groups of the National Natural Science Foundation of China; Project(2017zzts499) supported by the Fundamental Research Funds for the Central Universities of Central South University, China
Received date: 2017-05-12; Accepted date: 2018-08-29
Corresponding author: LI Yong-gang; Tel: +86-13397516091; E-mail: liyonggang@csu.edu.cn
(编辑 王 超)
基金项目:国家自然科学基金资助项目(61673400);国家自然科学基金创新研究群体项目(61621062);中南大学中央高校基本科研业务费专项资金资助项目(2017zzts499)
收稿日期:2017-05-12;修订日期:2018-08-29
通信作者:李勇刚,教授,博士;电话:13397516091;E-mail:liyonggang@csu.edu.cn
摘 要:针对锌电解过程中阴极板上锌反溶对电解能耗、电流效率及析出锌产量影响难以确定的问题,基于有限元分析的方法,结合流体动力学方程及电极反应动力学方程,分别建立考虑锌反溶和不考虑锌反溶情况下的锌电解过程数学模型,利用多物理场仿真软件COMSOL建立锌电解槽的三维有限元模型,模拟计算锌电解槽中极板上的电解能耗、电流效率及析出锌产量变化的分布。结果表明:在给定实验条件下,与不考虑锌反溶反应的模型相比,锌电解过程电流效率的相对误差降低3%~4%,阴极板上析出锌产量的相对误差降低2%~5%;验证锌电解模型中考虑锌反溶的必要性。为进一步研究锌电解的优化奠定基础。
[1] 梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001: 340-409.
[7] 李明周, 黄金堤, 童长仁, 张文海, 周孑民, 李贺松, 张 鹏. 铜电解槽内电解液流场的数值模拟[J]. 中国有色金属学报, 2015, 25(8): 2259-2267.
[10] 苏寅彪. 锌电解槽流场数值模拟及其优化[D]. 长沙: 中南大学, 2012: 16-35.
[13] 邓仕钧, 阳春华, 李勇刚, 朱红求. 锌电解全流程酸锌离子浓度在线预测模型[J]. 化工学报, 2015(7): 2588-2594.
[14] 邓亦梁, 谢永芳, 李勇刚, 阳春华. 基于液相传质的锌电解过程多物理场仿真分析[J]. 中南大学学报(自然科学版), 2017(1): 119-126.
[16] 沈 芳. 锌电解液中铜钴镍的电化学分析方法研究[D]. 长沙: 中南大学, 2012: 2-12.
[18] REVIE R W. Corrosion and corrosion control[M]. New York: John Wiley & Sons, 2008: 58-63.


