微生物治理碱性含铬废水的试验研究
柴立元, 龙腾发, 唐 宁, 庄明龙, 闵小波
(中南大学 冶金科学与工程学院, 湖南 长沙, 410083)
摘要: 用从铬渣堆埋场附近的污泥中分离到的无色杆菌属C-1菌株, 对碱性含铬废水进行生物处理, 研究了该菌的生长条件, 并探讨了温度、pH值、Cr(VI)初始浓度及作用时间等因素对Cr(VI)还原的影响。 研究结果表明: C-1菌株适应碱性环境, 对Cr(VI)具有较强的还原能力; 在有氧、pH=10.30和温度为32 ℃的条件下, 含Cr(VI)1570.0 mg/L的废水经微生物处理16 h后Cr(VI)质量浓度降为0.6 mg/L; 处理后的沉淀物中铬以非晶态存在, 其中总铬含量为21.44%, Cr(VI)为痕量。
关键词: 碱性含铬废水; 六价铬还原菌; 铬渣渗滤液; 生物还原
中图分类号:X172 文献标识码:A 文章编号: 1672-7207(2005)05-0816-05
Experimental study on microbial treatment of alkaline wastewater containing chromium(Cr(VI))
CHAI Li-yuan, LONG Teng-fa, TANG Ning, ZHUANG Ming-long, MIN Xiao-bo
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The alkaline wastewater containing chromium(Cr(VI)) was treated with C-1 strain identified as achromobacter isolated from sludge nearby the chromium slag pole site. The optimum conditions of growth of the strain and factors affecting reduction efficiency of Cr(VI), such as the temperature, the pH value of solution, the concentration of Cr(VI) and the treatment time, were studied. The results show that the strain is suitable for alkaline solution and reduction capacity for Cr(VI) is strong. After 16 h treatment by microbial, the concentration of Cr(VI) in wastewater is reduced from 1570 to 0.6 mg/L under the aerobic conditions and pH=10.30 and at 32 ℃. The treated sediment contains 21.44% chromium in the form of non-crystal in which the Cr(VI) is hardly detected.
Key words: alkaline solution; reduction bacteria of hexavalent chromium; filter solution of chromium slag; bioreduction
铬盐是重要的化工原料, 广泛应用于电镀、化工、皮革、耐火等行业。 铬盐的生产及其产品应用的各个行业都产生含Cr(VI)废水。 其中Cr(VI)具有致癌性、致突变性及致敏性, 对动植物及人体具有很强的毒性。 Cr(VI)也是美国EPA公认的129种重点污染物之一。 如何降低含Cr(VI)废水的排放对环境造成的危害是世界性难题。
对废水中Cr(VI)的控制, 最常用的方法是先将Cr(VI)还原成Cr(Ⅲ), 随后使Cr(Ⅲ)形成Cr(OH)3沉淀。 传统的方法主要有还原法、离子交换法、电化学还原法、蒸发回收法等[1]。 这些方法有一定的成效, 但存在着产泥渣量大、设备易腐蚀、耗资大以及可能造成二次污染的缺点, 在很大程度上限制了其实际应用。 近年来, 利用微生物处理含Cr(VI)废水的方法十分引人注目。 各种微生物不断地被开发利用[2-5], 但几乎都集中于对中性或偏酸性的电镀废水的处理, 其处理质量浓度比较低(〈200 mg/L)[6-11]; 而有关矿山、冶炼、无机盐及铬盐厂等排放的含铬废水的生物治理研究尚未见报道。 这些废水往往浓度高, 呈碱性, 一般微生物难以适应该体系。 在此, 本文作者在文献[12]的基础上利用从铬渣堆埋场附近分离并经驯化、改良的高效六价铬还原菌C-1, 对碱性的铬渣渗滤液进行还原解毒, 进一步研究细菌对Cr(VI)的还原效果及相关因素对还原率的影响。
1 材料和方法
1.1 主要实验仪器
主要仪器有: 超净工作台(BCM-1300), 手提高压灭菌器(PXQ-SG46), 离心机(LG-2.4A), 恒温气浴振荡器(SHZ-82), 可见光分光光度计(VIS-7220), 隔水式电热恒温培养箱(Gsk-01), LP115 pH计, 显微镜(Nikon E600)。
1.2 六价铬还原菌的选育
从铬渣堆埋场附近的湿泥中取得菌样, 经反复富集培养, 平板纯化, 高浓度Cr(VI)逐级驯化。 同时进行Cr(VI)还原实验, 优化培养基成分及培养条件, 最终获得Cr(VI)的高效还原菌。 经广东微生物研究所鉴定为无色杆菌属(achromobacter sp.), 将之命名为C-1菌。
1.3 碱性含铬废水的来源
研究所用的废水根据细菌处理能力的不同, 将工业铬渣碱性渗滤液按比例稀释。
1.4 Cr(VI)的还原实验
将培养至对数期的细菌按菌废比为1∶10(细菌个数与废水的体积比)取菌液, 经离心后倾去上清液, 将菌体、培养基移入含不同Cr(VI)浓度的废水中进行还原实验。 同时设置空白对照, 研究培养基成分对Cr(VI)的还原性。 在规定的时间取样, 离心后测定上清液中Cr(VI)的浓度。
1.5 分析方法
低浓度的Cr(VI)采用二苯碳酰二肼分光光度法进行分析[13], 波长为540 nm; 高浓度的Cr(VI) 采用硫酸亚铁铵容量法[14]进行滴定分析; 碱性废水、培养液的pH值采用LP115 pH计进行测量。
1.6 细菌计数方法
采用血球计数板计数法对细菌进行计数。
2 结果与讨论
2.1 细菌的生理实验
2.1.1 细菌的生长曲线
接种生长较好的细菌进入含Cr(VI)980 mg/L的新鲜培养液中, 每隔6 h取样计数, 以时间t(h)作为横坐标, 每mL菌液中细菌个数为纵坐标, 绘出细菌的生长曲线, 如图1所示。 从图1可以看出, 当接种长势较好的细菌时, 细菌对Cr(VI)的还原基本上无须经历延迟期, 而直接进入对数期, 对数期大约为16 h, 然后进入稳定期。
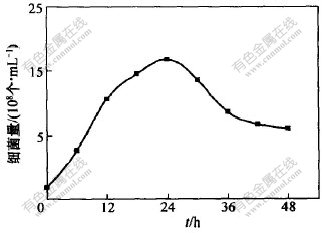
图 1 Cr(VI)还原菌的生长曲线
Fig. 1 Growth curve of reduction Cr(VI) bacteria
2.1.2 细菌的最适温度
对该菌分别在20,25,28,31,34, 37和40 ℃温度下进行培养。 培养16 h后, 该菌在28~34 ℃时生长以及还原能力较好, 超过或低于该温度范围时, 其降解效果受到不同程度的影响。
2.1.3 细菌的最适pH值
对细菌在pH值分别为3.5,4.5,6.5,7.5,8.5,9.5,10.5,11.5及12.5的体系中生长情况进行研究。 研究结果表明, 该菌在pH值低于4.5或高于12.5时不生长, 其最适生长的pH值范围为8.5~10.5。
2.1.4 细菌所需的碳源及氮源
对该菌所需要的碳源进行考察, 发现该菌可利用葡萄糖、乙酸钠、乙醇等作为生长碳源, 但利用效果不同, 可作为其高效生长碳源的有机物较少。 在选取其氮源时同样发现该菌只能利用有机氮源。
2.2 Cr(VI)的还原实验
2.2.1 pH值对细菌还原Cr(VI)的影响
在Cr(VI)质量浓度为920 mg/L时, 研究了pH值分别为6.81,7.46, 8.42, 9.74, 10.38, 11.61及12.60的体系中细菌还原Cr(VI)的情况, 还原16 h后的结果如图2所示。 图2表明, 碱性环境适合细菌还原Cr(VI), 特别是当pH值为10.38时, 溶液中Cr(VI)质量浓度仅为0.4 mg/L; 当pH值高于11.60时, 细菌基本丧失了其还原能力。 研究结果表明, 细菌还原Cr(VI)的最适pH值 范围为8.50~10.50。
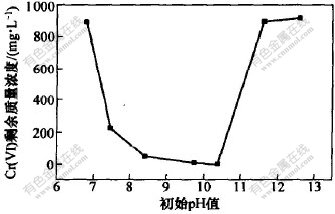
图 2 初始pH值对Cr(VI)还原的影响
Fig. 2 Effect of initial pH value on Cr(VI) reduction
2.2.2 Cr(VI)质量浓度对细菌还原的影响
当Cr(VI)质量浓度为920 mg/L时, 研究该菌在温度为20, 25, 28, 31, 34, 37和40 ℃, 经16 h还原Cr(VI)后的情况, 结果如图3所示。 图3表明, 温度对细菌还原Cr(VI)的影响比较明显。 当温
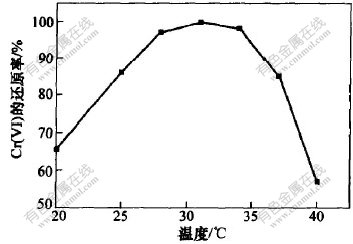
图 3 温度对Cr(VI)还原率的影响
Fig. 3 Effect of temperature on Cr(VI) reduction rate
度为20 ℃时, 其还原率较低, 随着温度的升高, Cr(VI)的还原率快速上升; 在31 ℃时, 其还原率超过99.9%, 继续上升时, 其还原率开始下降; 在40 ℃时, 还原率仅为57%。 表明该菌最适宜的生长温度为28~34 ℃, 超过或低于该温度范围, 其还原效果均受到不同程度的影响。
2.2.3 Cr(VI)质量浓度对细菌还原的影响
将培养至对数期的细菌接种于不同Cr(VI)质量浓度, pH值为10.3的废水中培养, 16 h后取其上清液测定Cr(VI)的质量浓度, 结果如表1所示。 从表1可看出, 当Cr(VI)质量浓度低于1570.0 mg/L时, 其还原效果最为理想, 废水中Cr(VI)质量浓度仅为0.6 mg/L; 取其沉淀物做X射线衍射分析表明其铬以非晶态存在; 化学成分分析结果显示, 总铬含量为21.44%, 其中Cr(VI)为痕量。 说明经该细菌作用后的铬渣碱性渗滤液中的Cr(VI)被彻底还原。 当Cr(VI)质量浓度为2180.0 mg/L时, 其还原能力仍较强, 但处理结果达不到排放标准; 当Cr(VI)质量浓度大于2730.0 mg/L时, 其还原能力急速下降, 但细菌生长仍然较好; 而当质量浓度达4362.0 mg/L时, 微生物基本不具备还原能力, 但仍能生长, 图4中的黑色杆状菌是在该浓度中经16 h培养后的细菌生长情况。 结果表明, 细菌还原Cr(VI)存在一个浓度阀值, 当超过该值时, 其还原能力明显减弱甚至丧失, 但其仍具有耐受高浓度Cr(VI)的能力。
表 1 Cr(VI)的初始浓度对细菌还原Cr(VI)的影响
Table 1 Effect of initial Cr(VI) concentration on reduction ρ/(mg·L-1)


图 4 含高浓度Cr(VI)溶液中细菌生长状况
Fig. 4 Growth situation of bacteria in solution with high concentration of Cr(VI)
2.2.4 细菌繁殖过程与Cr(VI)还原率的关系及还原过程pH值的变化
每隔6 h取样分析细菌的生长、剩余Cr(VI)量(其初始Cr(VI)质量浓度为980.0 mg/L)以及pH值跟踪研究细菌的生长繁殖与Cr(VI)的还原率及pH值变化的关系。 图5所示为时间对细菌生长和Cr(VI)还原的影响曲线, 图6所示为还原过程溶液pH值与Cr(VI)的还原量的关系。 从图5可看出, 在接种对数期微生物进行还原实验时, 基本上无须经历延迟期而直接进入对数期, 随着微生物的不断繁殖, Cr(VI)不断被还原; 当细菌进入稳定期时, Cr(VI)的还原率超过99.9%。 故认为Cr(VI)的还原是在细菌不断繁殖、代谢的过程中完成的。 从图6可知, 随着细菌的不断繁殖, Cr(VI)的质量浓度不断减少, 蓝色胶粘状的Cr(OH)3沉淀不断增多, 溶液的pH值快速下降。 随着稳定期的到来, pH值达最低值, 为8.95; 当进入衰亡期后, 溶液的pH值基本稳定在9.00左右。 pH值的变化从客观上也能反映Cr(VI)的还原情况。
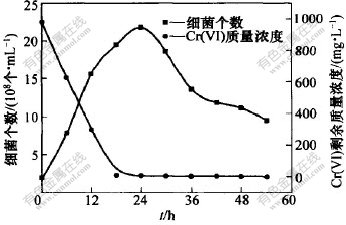
图 5 时间对细菌生长和Cr(VI)还原的影响
Fig. 5 Effect of time on bacteria growth and reduction of Cr(VI)
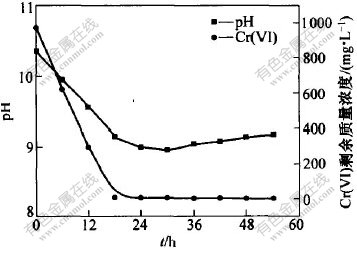
图 6 还原过程溶液pH值与Cr(VI)的还原
Fig. 6 Change curves of pH value and reduction of Cr(VI) during reduction
2.3 含Cr(VI)废水处理工艺模型
在了解细菌的生长、还原条件的基础上进行模拟连续化工业废水处理实验, 结果如图7所示。 结果表明, 处理效果比较理想, 但铬的回收以及水的回收使用仍在研究中。 其中还原池可采用隔热层保证温度条件, pH值可实时监控, 将Cr(VI)浓度调节在细菌有效处理范围内。 经水处理设施后排出的泼水中, 其色度、浊度以及细菌含量达排放标准。 通过各级处理, 含铬废水可达排放标准。
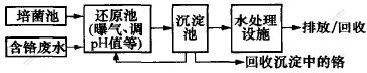
图 7 含废水处理工艺模型
Fig. 7 Model of Cr(VI)-containing wastewater treatment process
3 结 论
a. C-1菌还原工业铬渣碱性渗滤液中Cr(VI)的最适宜温度为28~34 ℃, 最适pH值为8.5~10.5。 在最适环境下该菌具有较强的还原能力, 并可耐受Cr(VI)质量浓度达4362.0 mg·L-1。 当Cr(VI)质量浓度为1570.0 mg/L, pH=10.30, 菌废比为1∶10时, 还原16 h后Cr(VI)质量浓度可降至0.6 mg/L。 其沉淀物中总铬含量为21.44%, Cr(VI)检测不出。
b. C-1细菌的生长对数期短且解毒也在对数期内进行, 这为细菌快速解毒Cr(VI)提供了理论基础。 采用该菌处理碱性含铬废水, 尤其是铬渣渗滤液效果明显, 细菌培养方法简单, 运行费用低廉。
参考文献:
[1]汪大翚, 徐新华, 宋爽. 工业废水中专项污染物处理手册[M]. 北京: 化学工业出版社, 2000.
WANG Da-hui, XU Xin-hua, SONG Shuang. Treatment Manual of Special Pollutant in Industrial Wastewater[M]. Beijing: Chemical Industry Press, 2000.
[2]Laxman R S, More S . Reduction of hexavalent chromium by streptomyces griseus[J].Minerals Engineering, 2002, 15(11): 831–837.
[3]Guha H, Jayachandran K, Maurrasse F. Microbiological reduction of chromium(VI) in presence of pyrolusite-coated sand by Shewanella alga Simidu ATCC 55627 in laboratory column experiments[J]. Chemosphere, 2003, 52(1): 175-183.
[4]WANG Yi-tin, XIAO Chang-song. Factors affecting hexavalent chromium reduction in pure cultures of bacteria[J]. Wat Res, 1995, 29(11): 2467-2474.
[5]Guha H, Jayachandran K, Maurrasse F. Kinetics of chromium (VI) reduction by a type strain Shewanella alga under different growth conditions[J]. Environmental Pollution, 2001, 115(2): 208-218.
[6]WANG Yi-tin, SHEN Hai. Modelling Cr(VI) reduction by pure bacterial cultures[J].Wat Res, 1997, 31(4): 727-732.
[7]Eiji F, Kiyzoshi T, Hisao O. Bacterial reduction of toxic hexavalent chromium using a fed-batch culture of enterobacter cloacaestrain HO1[J].Fermentation and Bioengineering, 1990, 35(9): 365-367.
[8]Komori K. Biological removal of toxic chromium using an enterobacter cloacae strain that reduces chromate under anaerobic conditions[J]. Biotechnology and Bioengineering, 1990, 35(9): 951-954.
[9]周海涛, 白毓谦.一株六价铬还原菌的分离及其用于含铬废水处理的初步研究[J].青岛海洋大学学报, 1991, 21(3): 104-109.
ZHOU Hai-tao, BAI Yu-qian. Isolation of a Cr(VI) reduction bacterium and primary studies on treatment of wastewater containing chromium[J].Journal of Ocean University of Qingdao, 1991, 21(3): 104-109.
[10]申如香, 瞿建国, 张晓旗, 等. 微生物法处理冷轧含铬(Ⅵ)废水的试验研究[J]. 上海化工, 2001(1): 4-7.
SHEN Ru-xiang, QU Jian-guo, ZHANG Xiao-qi, et al. Experimental study on microbial treatment of wastewater containing chromium(VI) from cold rolling[J]. Shanghai Chemical Industry, 2001(1): 4-7.
[11]汪频, 李福德, 刘大江. 硫酸盐还原菌还原铬(Ⅵ)的研究[J]. 环境科学, 1993, 14(6): 1-4.
WANG Pin, LI Fu-de, LIU Da-jiang. The study of hexavalent chromium reduction by sulfate-reducingbacteria[J]. Environmental Science, 1993, 14(6): 1-4.
[12]CHAI Li-yuan, HE De-wen, YU Xia, et al. Technological progress on detoxification and comprehensive utilization of chromium containing slag[J]. Trans Nonferrous Met Soc China, 2002, 12(3): 514-518.
[13]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京: 中国环境科学出版社, 1998.
Editor Group of Monitor Analytic Method of Water and Wastewater of Environmental Protection Bureaus. Monitor Analytic Method of Water and Wastewater[M]. Beijing: China Environmental Science Press, 1998.
[14]工业固体废物有害特性试验与监测分析方法组.工业固体废物有害特性试验与监测分析方法(试行)[M]. 北京: 中国环境科学出版社, 1986.
Group of Characterization Experiment and Monitor Analytic Method of Industrial Solid Waste.Characterization Experiment and Monitor Analytic Method of Industrial Solid Wastes (Trial Implementation)[M]. Beijing: China Environmental Science Press, 1986.
收稿日期:2005-01-10
基金项目: 教育部优秀青年教师基金资助项目(教人司 2001-39号)
作者简介:柴立元(1966-), 男, 江西万年人, 教授, 博士生导师, 从事三废治理资源化及湿法冶金研究
论文联系人: 柴立元, 男, 教授; 电话: 0731-8836921(O); E-mail: Lychai@mail.csu.edu.cn
[1]汪大翚, 徐新华, 宋爽. 工业废水中专项污染物处理手册[M]. 北京: 化学工业出版社, 2000.
[9]周海涛, 白毓谦.一株六价铬还原菌的分离及其用于含铬废水处理的初步研究[J].青岛海洋大学学报, 1991, 21(3): 104-109.
[10]申如香, 瞿建国, 张晓旗, 等. 微生物法处理冷轧含铬(Ⅵ)废水的试验研究[J]. 上海化工, 2001(1): 4-7.
[11]汪频, 李福德, 刘大江. 硫酸盐还原菌还原铬(Ⅵ)的研究[J]. 环境科学, 1993, 14(6): 1-4.
[13]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京: 中国环境科学出版社, 1998.
[14]工业固体废物有害特性试验与监测分析方法组.工业固体废物有害特性试验与监测分析方法(试行)[M]. 北京: 中国环境科学出版社, 1986.


