熔盐电解法制备硼粉的研究
摘 要:
研究了在KCl-KBF4体系和KCl-KBF4-B2O3体系中熔盐电解法制备硼粉的工艺条件。对KCl-KBF4体系采用正交试验法研究了熔盐配比、温度、阴极电流密度和电解时间对硼粉纯度及电流效率的影响,得到的最佳实验条件为:KCl∶KBF4为5∶1,温度750℃,阴极电流密度1.5A.cm-2,电解时间3h。该条件下能得到纯度95%以上的球形非晶态硼粉,电流效率可达到80%以上。KCl-KBF4-B2O3体系熔盐电解得到超细球形硼粉,但电流效率低,产品难以收集,杂质含量较高。
关键词:
熔盐电解;硼粉;KCl-KBF4体系;KCl-KBF4-B2O3体系;
中图分类号: TQ128.1
作者简介:彭程(1986-),男(土家族),湖南保靖人,硕士研究生;研究方向:有色金属冶金;王力军(E-mail:gold@grinm.com);
收稿日期:2009-07-22
基金:军品配套项目(JPPT-115-2-1226)资助;
Preparation of Boron Powder by Molten Salt Electrolysis
Abstract:
The feasibility and optimum process of boron powder preparation was studied in KCl-KBF4 and KCl-KBF4-B2O3 molten salt systems.In KCl-KBF4 molten salt systems,the effects of molten salt composition,temperature,cathode current density and electrolysis time on purity and current efficiency were investigated by orthogonal experimental method.The results showed that the purity of amorphous boron with more than 95% spheres shape was obtained under the condition in that the ratio of KCl∶KBF4 was 5∶1,temperature was 750 ℃,cathode current density was 1.5 A·cm-2,and electrolyze time was 3 h.The current efficiency was more than 80%.In the KCl-KBF4-B2O3 molten salt systems,fine boron powder with spheres shape was obtained.However,the current efficiency was low,the product contained high impurity and was difficult to collect.
Keyword:
molten salt electrolysis;boron powder;KCl-KBF4 system;KCl-KBF4-B2O3 system;
Received: 2009-07-22
硼粉是重要的硼精细化工产品之一, 在冶金、 玻璃、 电子、 军工行业用途广泛。 硼粉主要应用于高能固体燃料、 含硼功能陶瓷、 空间技术、 炸药催化剂、 安全气囊引爆剂、 超导材料及制备多种硼化物和高纯卤化硼的原料
本研究采用熔盐电解法制备纯度大于95%的硼粉, 研究了KCl-KBF4和KCl-KBF4-B2O3体系的电解工艺, 并分析了不同实验条件对产品纯度、 粒度和电解过程的影响。
1 实 验
1.1 实验原料
实验选用的原料NaCl, KBF4, KCl和B2O3均为分析纯试剂, 所有试剂在使用前均在150 ℃下烘干24 h。
1.2 实验设备
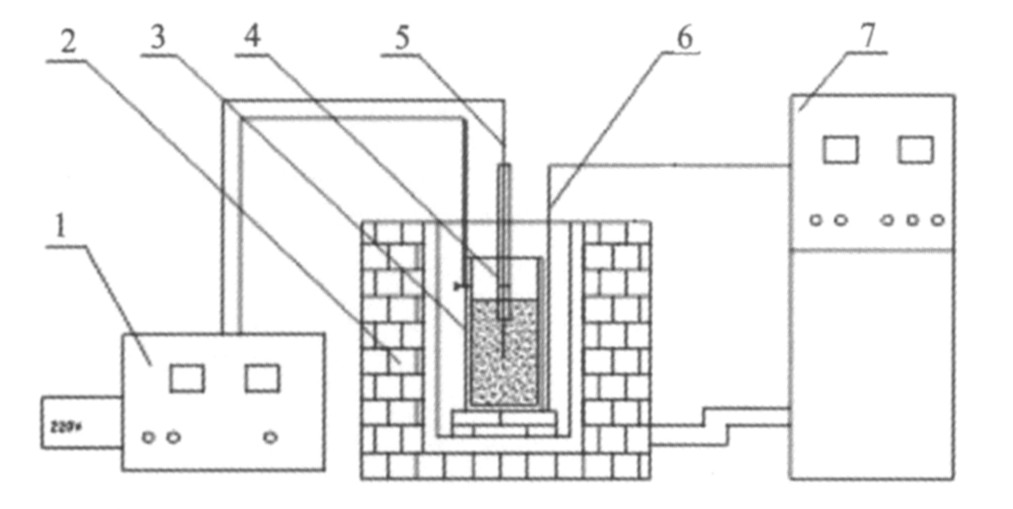
实验的主要设备为电解槽、 电解电源和加热炉。 电解槽为三高石墨坩埚并兼作阳极, 电解槽内径Φ70 mm, 厚10 mm, 高140 mm; 阴极采用Φ6 mm的321不锈钢棒, 加热炉为电阻炉, 电解电源为自制周期换向整流电源。 实验设备见图1。
1.3 实验过程与检测
将熔盐按一定的配比混合均匀后在150 ℃下干燥24 h, 装入石墨坩埚中后加热到反应温度, 保温30 min待熔盐完全熔化后进行30 min预电解。 预电解结束后更换新的阴极, 控制一定的电流强度开始电解。 电解结束后, 将阴极产物取出迅速置于干燥后的NaCl盐中冷却至室温。
将冷却后的阴极产品取下用热水洗涤多次, 除去其中粘附的盐, 然后用浓度约10%的HCl洗涤多次, 除去其中一些酸溶性杂质; 最后用去离子水洗涤至中性, 再用工业酒精洗涤, 在60~70 ℃下干燥4~5 h后包装并送样分析。
图1 电解设备图
Fig.1 Apparatus of electrolysis
1-Electrolysis power; 2-Resistance furnace; 3-Graphite crucible; 4-Ceramic tube; 5-Stainless-steel cathode; 6-Thermocouple; 7-Temperature control equipment
用METTLER DTA/DSC同步热分析仪测定熔盐的熔点; 用红外光谱进行硼粉的化学成分分析; 用X射线衍射仪进行硼粉的物像分析; 用日立S-4800扫描电镜观察产品的形貌。
2 结果与讨论
2.1 熔盐的熔点及电解温度的确定
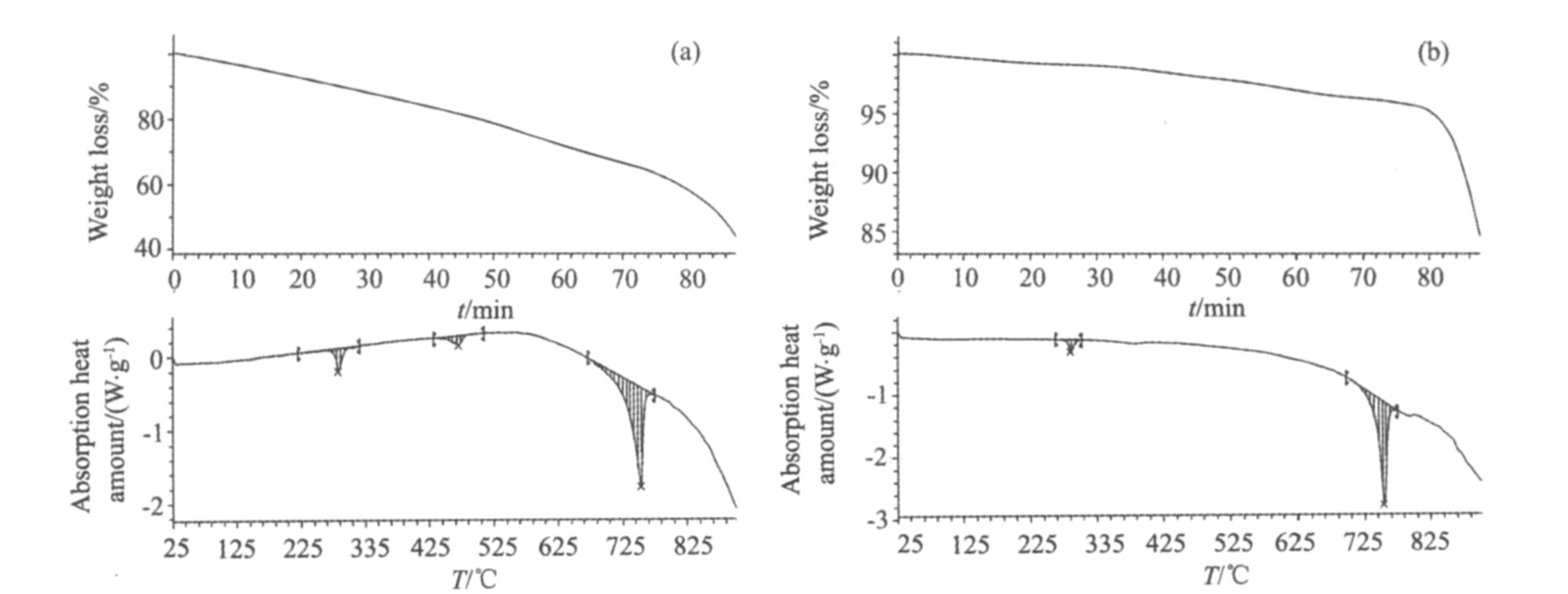
对KCl-KBF4体系和KCl-KBF4-B2O3体系分别进行了熔盐的熔点测定。 分别配制一定比例的KCl-KBF4系和KCl-KBF4-B2O3系混合盐; 均匀混合后在150 ℃下干燥24 h, 随后将混合盐在电阻炉中升温加热至熔融并保持30 min后, 随炉冷却至室温。 将冷却后的融盐研磨, 然后进行热分析, 结果如图2所示。
图2(a)中在286和474 ℃附近出现的吸热峰为吸附水和结晶水的脱除而产生的吸热过程; 在752 ℃附近出现的吸热峰, 为熔盐熔化形成的吸热峰。 与图3的KBF4-KCl相图
图2(b)中在287 ℃附近出现的吸热峰为脱除吸附水的吸热过程; 在753 ℃附近出现的吸热峰, 为熔盐的熔化形成的吸热峰, 因此可得出KCl-KBF4-B2O3体系(KCl∶KBF4∶B2O3=10∶3∶1)的熔化范围为741~759 ℃。
图2 熔盐的DTA/TG曲线
Fig.2 DTA/TG curve of molten salt (a) KCl-KBF4 system(KCl∶KBF4=4∶1); (b) KCl-KBF4-B2O3 system(KCl∶KBF4∶B2O3=10∶3∶1)
图3 KBF4-KCl体系相图
Fig.3 Phase diagram of KBF4-KCl system
根据上述熔盐的热分析结果, 确定熔盐电解温度控制在750~800 ℃之间, 且添加少量B2O3对熔盐的熔化范围影响不大。
2.2 熔盐电解工艺条件
2.2.1 KCl-KBF4熔盐体系电解工艺条件 采用正交实验研究了KCl-KBF4熔盐体系电解法生产硼粉的工艺条件。
KCl-KBF4熔盐体系电解过程阳极反应为:
2Cl-→Cl2↑+2e (1)
阴极反应为: BF-4+3e→B+4F- (2)
总反应为:
熔盐电解实验的主要影响因素有原料配比、 电解温度、 电解时间、 电流密度等, 根据熔盐体系的熔化范围以及前期试验工作, 设计L34正交实验, 结果如表1, 2所示。
根据表2可知, 对于电流效率来说各因素的影响大小顺序为: 时间-电流密度-熔盐配比-温度。 最佳工艺条件为电解温度: 750 ℃, KBF4∶KCl为1∶5, 电解时间为3 h, 阴极电流密度为2 A·cm-2。 对于硼粉纯度而言各因素的影响大小顺序为: 温度-时间-电流密度-熔盐配比。 最佳工艺条件为电解温度: 750 ℃, KBF4∶KCl 为1∶5, 电解时间为3 h, 阴极电流密度为1.5 A·cm-2。 实验中发现阴极电流密度偏高的时候, 容易出现阳极效应, 影响电解的进行, 并且考虑到产品纯度的重要性大于电流效率, 因此确定的最佳实验条件为: 电解温度750 ℃, KBF4∶KCl 为1∶5, 电解时间为3 h, 阴极电流密度为1.5 A·cm-2。
2.2.2 KCl-KBF4-B2O3熔盐体系电解工艺条件 研究了不同的B2O3含量对熔盐电解过程的影响。
该体系电解过程 阳极反应为:
阴极反应为: B3++3e→B (5)
总反应为:
实验条件为: 电解温度为800 ℃, 阴极电流密度2 A·cm-2, 结果如表3所示。 其中KBF4的含量为15%。
KCl-KBF4-B2O3体系相对于KCl-KBF4的优点在于电解过程中B2O3提供硼源, 阳极析出氧气, 并与石墨坩埚反应生成CO2和CO。 电解过程稳定, 设备腐蚀较小。 但该体系电流效率低, 且电解结束后阴极产物容易与阴极棒脱离而掉入熔盐中, 使产品污染并且不利于收集和后续处理。
表1 KCl-KBF4体系熔盐电解正交试验
Table 1 Orthogonal test for KCl-KBF4molten salt system
| No. | Temperature/ ℃ |
Ratio/ (KBF4∶KCl) |
Time/ h |
Current density/ (A·cm-2) |
Results | |
| Purity of B/% | Current efficiency/% | |||||
| 1 | 750 | 1∶3 | 2 | 1 | 94.74 | 70.02 |
| 2 | 750 | 1∶4 | 3 | 1.5 | 97.90 | 81.83 |
| 3 | 750 | 1∶5 | 1 | 2 | 95.96 | 68.50 |
| 4 | 800 | 1∶3 | 1 | 1.5 | 95.97 | 61.34 |
| 5 | 800 | 1∶4 | 2 | 2 | 93.95 | 76.04 |
| 6 | 800 | 1∶5 | 3 | 1 | 95.79 | 82.70 |
| 7 | 850 | 1∶3 | 3 | 2 | 93.81 | 79.62 |
| 8 | 850 | 1∶4 | 1 | 1 | 94.10 | 55.27 |
| 9 | 850 | 1∶5 | 2 | 1.5 | 94.25 | 74.60 |
Note: Purity of boon powder analyzed by titration
表2 正交实验结果分析
Table 2 Analysis of orthogonal test results
| Factors | Temperature | Ratio | Time | Current density |
| Purity/% | ||||
| Average 1 | 96.20 | 94.84 | 94.31 | 94.88 |
| Average 2 | 95.24 | 95.32 | 95.83 | 96.04 |
| Average 3 | 94.05 | 95.33 | 95.34 | 94.57 |
| R | 2.15 | 0.49 | 1.52 | 1.47 |
| Current efficiency/% | ||||
| Average 1 | 73.45 | 70.33 | 73.55 | 69.33 |
| Average 2 | 73.36 | 71.05 | 81.38 | 72.59 |
| Average 3 | 69.83 | 75.27 | 61.70 | 74.72 |
| R | 3.62 | 4.94 | 19.68 | 5.39 |
Note: Average 1: 750 ℃, KBF4∶KCl =1∶3, 2 h, 1 A·cm-2; Average 2: 800 ℃, KBF4∶KCl =1∶4, 3 h, 1.5 A·cm-2; Average 3: 850 ℃, KBF4∶KCl =1∶5, 1 h, 2 A·cm-2; R: the range of the average
表3 B2O3含量和电解时间对电流效率的影响
Table 3Effect of B2O3content and electrolysis time on current efficiency
| Content of B2O3/% | Time/h | Current efficiency/% |
| 1.50 | 2.5 | 20.97 |
| 3.57 | 2.5 | 43.92 |
| 7.15 | 3.0 | Products collected hardly |
| 12.50 | 3.5 | 59.66 |
| 18.00 | 4.0 | 55.93 |
2.3 阴极产物物相分析
电解得到的黑色粉末状阴极产物进行X射线衍射分析, 分析结果如图4所示。
由图4的X射线衍射图谱可知, 两种熔盐体系电解得到的硼粉均为无定形硼粉。 KCl-KBF4-B2O3体系熔盐电解得到的产品的衍射图中出现一些杂质峰, 说明了该体系得到的产品纯度较低。
2.4 阴极产物纯度及主要杂质
对KCl-KBF4-B2O3体系和KBF4-KCl体系阴极产物分别取部分样品进行杂质元素分析, 其中杂质元素含量如表4所示。
根据不同工艺条件得到的产品化学分析结果说明: KCl-KBF4-B2O3体系电解得到的产品比KBF4-KCl体系电解的产品杂质含量略高, 由于实验均采用分析纯的化学试剂为原料, 原料本身和外来的杂质都很少。 初步认为, 不同的熔盐体系电解过程中的电化学过程的差异是造成产品纯度差异的主要原因。 B2O3的分解电压较低, 电解过程中成为产品B的主要来源, 加入B2O3不仅改变了阳极和阴极的电化学反应过程, 而且影响部分杂质元素在阴极的析出电位, 使部分杂质元素在阴极富集。 B2O3加入会使熔盐的粘度增大, 电阻增加, 并且容易造成产品从阴极棒上脱落, 难以收集, 对产品的成分和电解的电流效率有不利的影响。
在KBF4-KCl体系中, 当阴极电流密度均为1.5 A·cm-2时, 电解温度和时间对产品的纯度有较大的影响, 在一定范围内熔盐的配比对产品纯度的影响不大, 这与正交试验得到的结论相符。 在750 ℃下电解得到的产品纯度好于800和850 ℃下的电解产品的纯度, 电解温度高, 反应速率快, 电结晶及晶核生长的速度也加快, 容易造成杂质的包藏影响产品纯度, 因此电解过程中必须控制适当的温度。
图4 阴极产物XRD分析
Fig.4 XRD analysis of cathode productsElectrolysis conditions: (a) KCl∶KBF4=4∶1, T=750 ℃, t=3 h, i=1.5 A·cm-2 ; (b) B2O3 being 12.5%, KBF being 15%, T=800 ℃, t=3.5 h, i=2 A·cm-2
电解时间的影响表现为较长的电解时间得到的产品纯度较好。 尽管在正式电解之前进行了小电流条件下的预电解, 以净化熔盐。 但电解过程中仍然有少量杂质优先在阴极析出, 电解时间过短, 这些杂质会影响产品的纯度, 较长的电解时间使这些杂质被稀释, 产品纯度较好。 但过长的电解时间极易出现阳极效应, 以及由于熔盐成分的变化造成电流效率降低。 可通过适当增加预电解时间, 降低产品中杂质含量。
同时, 产品的洗涤工艺对产品的纯度也有较大的影响, 特别是酸洗的时间、 次数和酸的浓度对产品中部分金属杂质的含量影响较大。
2.5 硼粉的形貌
用扫描电镜观察阴极产物进行形貌, 并于外购的镁热还原法硼粉、 氢还原法硼粉的形貌进行比较, 结果见图5。
表4 阴极产物杂质元素分析结果Table 4 Analysis results of impurity elements in the cathode products 下载原图
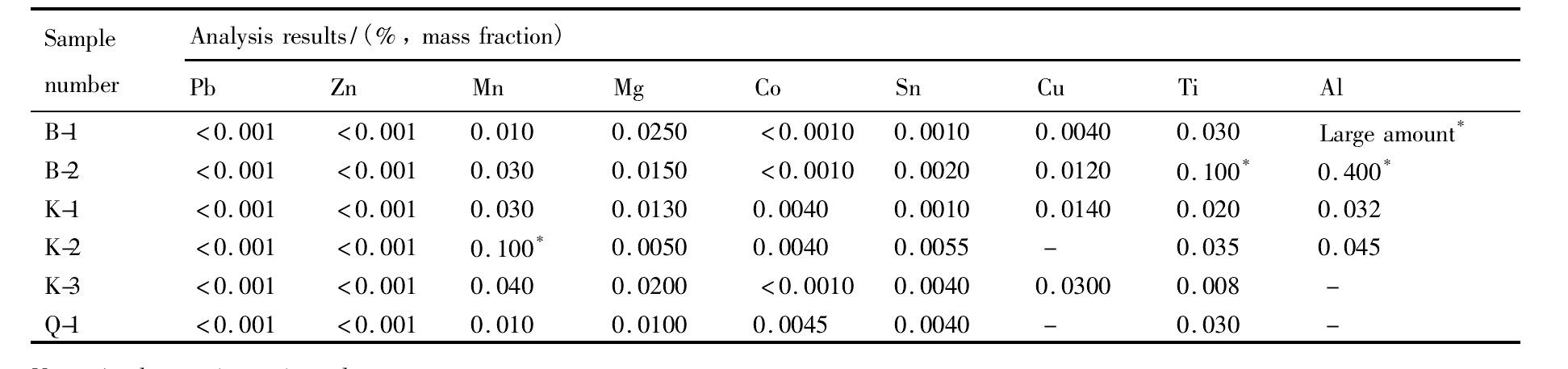
Note:*denotes imprecise value;B-1:KBF4being 15%,B2O3being 12.5%,T=800℃,i=2 A·cm-2,t=3.5 h;B-2:KBF4being 15%,B2O3being 3.57%,T=800℃,i=2 A·cm-2,t=2.5 h;K-1:T=750℃,KCl∶KBF4=4∶1,i=1.5 A·cm-2,t=3 h;K-2:T=800℃,KCl∶KBF4=3∶1,i=1.5 A·cm-2,t=1 h;K-3:T=850℃,KCl∶KBF4=5∶1,i=1.5 A·cm-2,t=2 h;Q-1:The optimal condition:T=750℃,KBF4∶KCl=1∶5,i=1.5 A·cm-2,t=3 h
表4 阴极产物杂质元素分析结果Table 4 Analysis results of impurity elements in the cathode products
图5 不同硼粉样品的SEM照片
Fig.5 SEM pictures of typical samples
The conditions:(a)B2O3being 3.57%,KBF4being 15%,T=800℃,i=2 A·cm-2,t=2.5 h;(b)B2O3being 12.5%,KBF4being 15%,T=800℃,i=2 A·cm-2,t=3.5 h;(c)KCl∶KBF4=3∶1,T=800℃,i=1.5 A·cm-2,t=1 h;(d)KCl∶KBF4=4∶1,T=750℃,i=1.5 A·cm-2,t=3 h;(e)Samples coming from hydrogen reduction process;(f)Samples coming from magnesium reduction process
熔盐电解得到的硼粉颗粒成球形, 产物团聚比较严重。 氢还原法产物颗粒为方形, 分散性好, 粒度小并且分布均匀; 镁热还原法得到的硼粉颗粒粒度不均匀, 形貌不规则, 团聚较严重。
熔盐电解过程中的电结晶
KCl-KBF4体系熔盐电解得到的硼粉为球形, 并且团聚严重, 随着电解时间的增加和温度的降低, 粉末粒度明显增大。 电解温度的降低会降低反应速率, 使颗粒的生长过程占优。 电解时间的增加则促使颗粒长大。
3 结 论
1. 采用KCl-KBF4体系熔盐电解法制备硼粉的最佳条件为KCl∶KBF4为5∶1, 温度750 ℃, 阴极电流密度1.5 A·cm-2, 电解时间3 h; 电解的电流效率大于80%, 产品纯度达到95%以上。 KCl-KBF4-B2O3体系熔盐电解的电流效率低, 产物难于收集且纯度较低, 但该体系电解对设备的腐蚀小。
2. KCl-KBF4体系和KCl-KBF4-B2O3体系熔盐电解得到的硼粉均为无定形。 KCl-KBF4-B2O3体系的产品杂质含量相对较高, 主要是由于电化学过程的差异造成。 KBF4-KCl体系中, 一定范围内熔盐的配比对产品纯度的影响不大, 电解温度较低得到的产品纯度较好, 较长的电解时间得到的产品纯度较好。
3. KCl-KBF4-B2O3体系熔盐电解能得到粒度小的超细球形硼粉, 并随着氧化硼含量的增加, 粉末粒度有变小的趋势。 KCl-KBF4体系熔盐电解得到的球形硼粉团聚严重, 并随着时间的增加, 粉末粒度明显增大。 氢还原法得到的硼粉颗粒为方形, 分散性好, 粒度小并且分布均匀; 镁热还原法得到的硼粉颗粒粒度不均匀, 形貌不规则, 团聚较严重。
参考文献
[12] Cooper Hugh S,Shaker Heights.Electrolytic Method of Making Boron[P].United States:2572248.1951.
[14] Nelson Perry Nies.Electrolytic Production of Elemental Boron[P].United States:2832730.1958.