中国有色金属学报 2004,(02),322-326 DOI:10.19476/j.ysxb.1004.0609.2004.02.031
自蔓延高温合成CaB6的基础研究
东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院,东北大学材料与冶金学院 沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004 ,沈阳110004
摘 要:
估算了CaB6的标准生成熔、恒压热容、标准熵值。通过计算CaO B2O3 Mg反应体系的绝热温度,确定了该体系自蔓延反应进行的可行性。利用自蔓延高温合成的优点,以CaO,B2O3和Mg为原料制备CaB6。对燃烧产物进行X射线衍射分析,从理论上确定了燃烧产物的浸出条件。实验证实了该工艺可行,并得到了理想的CaB6,产品纯度达96.82%。
关键词:
中图分类号: TF123
作者简介:豆志河(1978),男,硕士研究生.;
收稿日期:2002-12-26
Elementary research on CaB6 prepared by SHS
Abstract:
The thermodynamic data of CaB6 were estimated. The adiabatic temperature was calculated. The SHS process was suggested to product CaB6, in which B2O3 and CaO were taken as raw materials and Mg as a reduction agent. The feasibility of the SHS reaction was determined consequently. It is proved that the SHS process is feasible and CaB6 with purity of 96.82% is obtained.
Keyword:
adiabatic temperature; CaB6; SHS;
Received: 2002-12-26
稀土、 碱土金属的六硼化物是一类很重要的物质, 它们具有熔点高、 强度高和化学稳定性高的特点, 其中许多还具有一些特殊的性能, 如电子逸出功低、 挥发性小、 抗中毒能力强、 耐离子轰击能力强、 发射能力强以及中子吸收截面大等, 这些优异的性能决定了其有广泛的应用前景。 许多国家相继开展了对该类材料的研究
1 热力学计算
1.1 CaB6生成焓的估算
对二元化合物生成焓的估算, 以各元素在其标准状态下, 298.15 K时的焓值定为零作基础。 一般情况下, 由于生成焓随温度的变化很小, 只要物质聚集状态不发生变化, 就可以假定其值在所有温度下近似不变。 Kubaschewski等
1) 方法一
如果一个给定的二元系中各个化合物的熔点已知, 则熔点最高的化合物其生成焓数值最大, 倘若其它化合物的熔点相当低, 则其生成焓可以视为具有加和性(按高熔点化合物与一个元素的相对比例)。 又若化合物的熔点不比最高值低很多, 则其生成焓将在加成值与最大值之间
如果金属间系中几种化合物具有几乎相同的熔点, 则可以预期, 最接近等原子组成的化合物的生成焓最高。
由热力学数据手册
2) 方法二
由文献
MgB6具有CaB6型结构, 其中的硼原子以连接的八面体方式排列, 故推测CaB6的生成焓与MgB6的生成焓较为接近。 同时已知MgB4属六方型晶系, 其中硼原子以二维连接形式排列。 由结构知MgB6的晶型较MgB2和MgB4的稳定, 推测其生成焓值大, 熔点应高于后两者, 故估算值应高于-121.283 kJ/mol。 而CaB6的生成焓应高于MgB6的生成焓, 取其近似值-121.283 kJ/mol。
综合方法一、 方法二, CaB6的生成焓值近似为两者的平均值-129.97 kJ/mol。
1.2 CaB6热容的估算
文献
1)方法一
Mezaki等人
最常用的值为0.9左右, 因为CaB6的HT也为估算值, 可粗取其为0.9。 故计算298 K下CaB6的热容为: cp(CaB6)=101.9 J/(mol·K)
2) 方法二
cp=a+b×10-3T+c×105T-2 (2)
根据Kelley给出的∑[H]值计算CaB6的热容cp=109.01+40.17×10-3T-29.26×105T-2(J·mol-1·K-1)。
按此方法计算298 K下cp(CaB6)=91.05 J/(mol·K)。 该值与方法一的差别不大, 故认为由此方法得到的cp—T关系合理。
1.3 CaB6熵值的估算
Latimer
按Latimer方法估算CaB6熵值为:
S=nCaSCa+nBSB (3)
式中 nCa为分子中Ca原子的个数; SCa为Ca在298 K下的熵值。
S298(CaB6)=160.51 J/(K·mol)
文献指出化合物的离子性越弱, 与Latimer法估算的熵值的差值就越大。 强共价键的过渡金属硫化物, 其熵值比估算值低, 故可以认为CaB6的熵值低于160.51 J/(K·mol)。 另由热力学数据手册查得, MgB2的S298为35.98 J/(K·mol), MgB4的S298为51.95 J/(K·mol)。 按Latimer方法计算MgB2的S298为72.732 J/(K·mol), MgB4的S298为113.696 J/(K·mol)。 实际值近似等于上述估算值的1/2, 推测MgB6的S298为77.33 J/(K·mol)。 由热力学数据手册查得Ca、 Mg分别与C、 N、 O、 F所形成的化合物熵值列于表1中, 由表中数据可大致推测MgB6的S298约为107.33 J/(K·mol)。 与Latimer推测法结合, 可认为CaB6的S298约为133.92 J/(K·mol)。
表1 Ca, Mg分别与C, N, O, F形成化合物的熵值(J/(K·mol))
Table 1S298 of compounds between Ca, Mgand C, N, O, F elements(J/(K·mol))
Metal |
MeC2 | Me3M2 | MeO | MeF2 |
Ca |
70.29 | 107.95 | 39.75 | 68.83 |
Mg |
54.39 | 87.86 | 26.94 | 57.24 |
1.4 绝热温度的计算
绝热温度Tad是描述SHS反应特征的重要热力学参数, 即当Tad>1 800 K时, SHS反应才能自我维持完成
ΔH=ΔH298+∫
式中 ΔH298为产物在298 K时的标准生成焓, Δcp为热容。 当体系为绝热体系时, 体系热效应ΔH=0, 则绝热温度Tab可根据式(9)分以下几种情况计算。
当绝热温度低于产物熔点Tmp时,
-ΔH298=∫
如果Tad=Tmp, 则
-ΔH298=∫
式中 γ为产物处于熔融状态的分数, ΔHm为产物的熔化热。
当Tad>Tmp时, 相应的关系式则为
-ΔH298=∫
∫
对于反应
CaO+3B2O3+10Mg=CaB6+10MgO (8)
ΔH298=-1696.79 kJ·mol-1
因 -ΔH298=∫
当T=2 503 K(CaB6 的熔点)时,
∫
1 696.79 kJ/mol
所以, 体系若绝热, 假设反应完全, 六硼化钙可被加热到熔化温度以上。 由于CaB6的熔化热数据无法查到, 因而不再估算CaB6的具体绝热温度值, 其值已高于2 000 K, 由此预计可采用自蔓延方法合成CaB6。
2 CaB6的合成
2.1 点火模式
在自蔓延高温还原过程中会出现中间产物及相互作用, 以及氧化物的还原程度问题。 中间产物的出现及相互作用也将影响火焰的蔓延过程。 本实验中由于会产生中间产物, 同时原料粒度较大, 较难压实, 因而燃烧波停止。 为了点燃这类反应, 一般有两条途径, 其一是预热反应混合物, 以提高绝热温度, 并形成稳定的燃烧前缘; 另一条途径就是利用热爆技术, 将反应混合物在炉内加热, 直至燃烧反应自发进行为止。 在本实验中采用热爆性自蔓延方法合成CaB6。
2.2 反应气氛
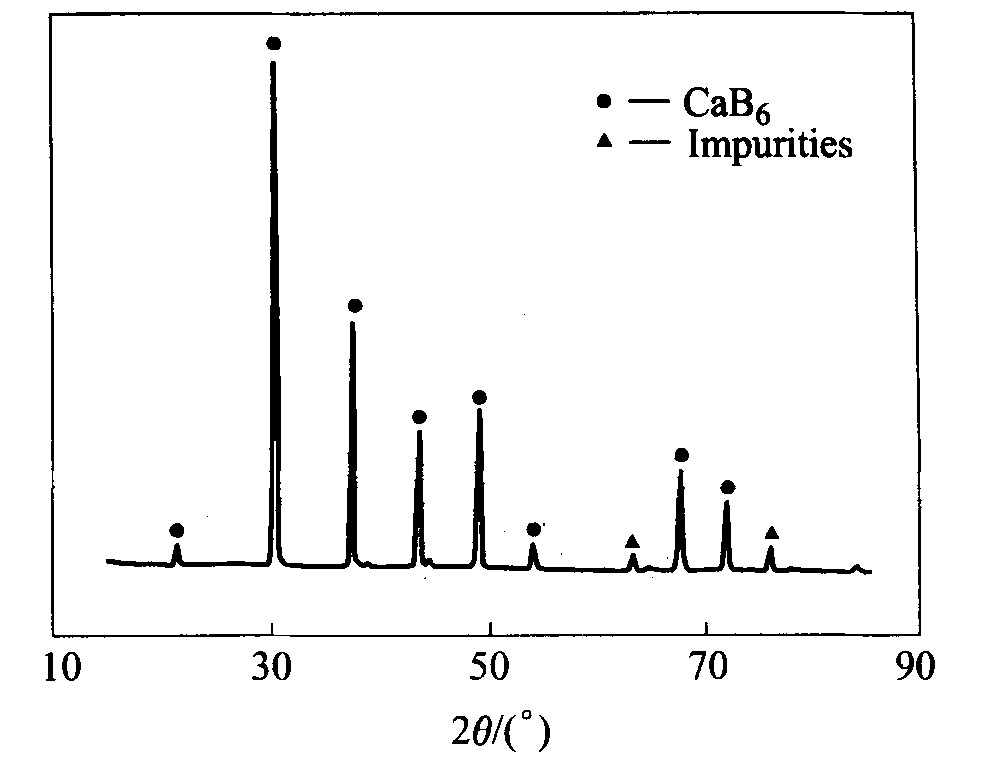
对空气气氛下的燃烧产物进行X射线衍射分析, 分析结果如图1所示。 由图可知在空气中对物料进行自蔓延实验并不生成氮化物, 因此可以采用此方法代替氩气保护条件下的实验。 此反应气氛为该方法实现工业化生产提供了基础。
图1 燃烧产物X射线衍射谱
Fig.1 XRD spectrum of combustion product
2.3 反应机理的推测
由浸出前产物的X射线衍射分析结果可知, 产物中存在CaB6, Mg3B2O6, Ca3(BO3)2和MgO, 推测存在以下反应:
10Mg+CaO+3B2O3=CaB6+10MgO (9)
ΔG?/(J·mol-1)=-1 696 790+124.329T (10)
当T=2 000 K时, ΔG?=-1 448 132 J/mol。
3CaO(s)+B2O3(l)=Ca(BO3)2(l) (11)
ΔG?/(J·mol-1)=-278 200+29.7T (12)
当T=2 000 K时, ΔG?=-218 800 J/mol。
Ca3(BO3)2(l)+8B2O3+30Mg=
3CaB6+30MgO (13)
ΔG?/(J·mol-1)=-4 842 410+384.92T (14)
当T=2 000 K时, ΔG?=-4 072 570 J/mol。
由绝热温度估算值可知, 反应中可能达到的最高温度为2 503 K以上, 故以上反应均能发生。 Mg还原CaO与B2O3的混合物, 在反应过程中由于CaO与B2O3接触面积大, 因而在反应初期加热过程中可能产生大量的Ca3(BO3)2, 但在自蔓延反应发生时, 此相中的一部分又进一步与Mg反应生成CaB6。 而反应中MgO为镁氧化产物, 与B2O3接触面积相对小得多, 因而Mg3B2O6量较小。
2.4 浸出
根据浸出前燃烧产物的X射线衍射分析结果可知, 产物中存在CaB6, Mg3B2O6, Ca3(BO3)2和MgO。 在酸浸过程中, Ca3(BO3)2能全部溶于盐酸而除去, 在pH值较低的情况下, Mg3B2O6不能完全去除。 在浸出过程中可能发生如下反应:
2HCl+MgO=MgCl2+H2O (15)
将大量的MgO除去。 另外还有如下反应:
Mg3B2O6+6HCl=3MgCl2+2HBO3 (16)
Ca3(BO3)2+6HCl=3CaCl2+2HBO3 (17)
盐酸浓度对CaB6含量的影响很大, 盐酸浓度高时, 反应进行更彻底, 杂质脱除得更干净。 图2所示是浸出后产物的X射线衍射分析结果。 由图可见酸浸的杂质脱除效果很理想, 制得的产品纯度达96.82%。
图3所示是浸出产物的SEM照片。 粒度分析表明所制得的CaB6平均粒度为0.5~2 μm。
图2 浸出产物的X射线衍射谱
Fig.2 XRD spectrum of product after lixiviating
图3 浸出产物的SEM照片
Fig.3 SEM photograph of product after lixiviating
3 结论
1) 对CaB6的热力学数据进行了估算, 其标准生成焓、 恒压热容、 标准熵值分别为: -129.97 kJ/mol, cp=109.01+40.17×10-3T-29.26×105T-2 J/(mol·K), 133.92 J/(K·mol)
2) 通过计算得到反应
CaO+3B2O3+10Mg=CaB6+10MgO
的绝热温度高于2 000 K, 采用镁热自蔓延方法制备CaB6在理论上是可行的。
3) 可用空气气氛代替氩气保护进行自蔓延反应。 用一定浓度的盐酸对燃烧产物进行浸出处理可得到纯净的CaB6, 其纯度达96.82%。
参考文献
[1] TakahoT,EisukeB,ShichioK.PreparationofEuB6singlecrystal[J].JCrystGrowth,1977,40:125128.
[11] BurganBR,HallRC,Hele mannRF.Dissociationpressure:Hg Pb[J].JInstMetals,1951,80,41.
[12] EvasMW.ΔH(formation)ofCesulphides[J].NstlNuclearEnergySer,Div,1950,19B:312.
[13] BrooksLS.VapourpressureofPo(438~745℃)[J].JAmerChemSoc,1955,77,3211.
[14] CoughlinJP.ΔH(solutioninHCl·aq):CaO Al2O3;LiAlO2,NaAlO2[J].JAmerChemSoc,1956,78:5479;79:2397
[1] TakahoT,EisukeB,ShichioK.PreparationofEuB6singlecrystal[J].JCrystGrowth,1977,40:125128.
[11] BurganBR,HallRC,Hele mannRF.Dissociationpressure:Hg Pb[J].JInstMetals,1951,80,41.
[12] EvasMW.ΔH(formation)ofCesulphides[J].NstlNuclearEnergySer,Div,1950,19B:312.
[13] BrooksLS.VapourpressureofPo(438~745℃)[J].JAmerChemSoc,1955,77,3211.
[14] CoughlinJP.ΔH(solutioninHCl·aq):CaO Al2O3;LiAlO2,NaAlO2[J].JAmerChemSoc,1956,78:5479;79:2397