文章编号:1004-0609(2017)-02-0406-08
梯级碱溶分步提取废弃电路板中有价金属
郭学益,江晓健,刘静欣,刘 旸,刘子康
(中南大学 冶金与环境学院,长沙 410083)
摘 要:
根据带元器件废弃电路板多金属料成分特点,采用梯级碱溶处理工艺,实现多金属料中有价金属选择性分离。该工艺由低碱浸出和高碱氧化浸出两级组成。第一段主要实现Al的选择性分离,最佳工艺条件:NaOH溶液浓度1.25 mol/L,与多金属料液固比为10:1,浸出温度30 ℃,浸出时间30 min;第二段主要实现Zn、Pb、Sn与Cu的选择性分离,最佳工艺条件:初始NaOH溶液浓度5mol/L,体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比10:1,H2O2溶液滴加速度0.4 mL/min,浸出温度50 ℃,浸出时间60 min。在此优化工艺条件下,金属的浸出率依次为Al 91.25%,Zn 83.65%,Pb 79.26%,Sn 98.24%;此外,98%以上的Cu和100%的贵金属在高碱浸出渣中富集。
关键词:
中图分类号:TF111 文献标志码:A
随着电子产品科技进步日新月异,电子产品生命周期逐渐变短,电子废弃物数量进入一个快速增长阶段,电路板作为其核心部件,产生量也在不断增加[1-2]。电路板主要由玻璃纤维、环氧树脂及多种金属构成,金属成分约占电路板质量分数的40%,其中金属含量最多的是铜,此外还含有大量的铝、铅、锡、锌等常见金属和一定量贵金属,这些金属品位较高,具有较高的经济回收价值。
机械处理一般作为电路板的预处理工序,先将电路板破碎至一定粒径后,再根据不同材料的物理性质差异,如密度、磁性、导电性、色泽等,采用重选、磁选、涡流分选、色选等分选技术将非金属有机组分、铁镍磁性组分及多金属料分离[3-6]。火法处理具有处理规模大,原料适应性广等优点[7-10],但熔炼处理需要有相应的装备系统。近年来,湿法处理成为研究的热点[11-13],但大部分集中于对铜及贵金属的回收,对电路板中的其他金属研究较少。生物湿法冶金技术回收电路板具有环境友好特点,但其对环境要求苛刻,金属浸出率低[14-16]。
本文作者根据废弃电路板多金属料成分含量特点,探索了一种梯级碱溶处理废弃电路板多金属料的新方法,详细探索各段工艺中不同工艺参数对金属浸出率的影响,得到较为适宜的工艺条件,为新方法的实际应用提供依据。
1 实验
1.1 实验原料和设备
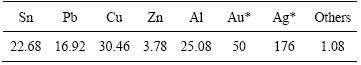
本实验中所用原料为惠州某公司提供的CRT电视带元器件电路板经破碎、粗选、磁选处理后的多金属料,多金属料经过球磨机磨碎混匀后,粒径在74 μm左右,成分如表1所列。多金属料中Cu含量最高,其值为30.46%,两性金属中Al、Pb、Sn的含量较高,金属Al含量达25.08%。
实验所用氢氧化钠、30%过氧化氢均为分析纯,西陇化工股份有限公司生产。
表1 废弃电路板多金属料化学组成
Table 1 Chemical composition of crushed metal enrichment (CME) (mass fraction, %; *, g/t )
主要设备为上海沪西分析仪器厂有限公司生产的HL-2B型恒流泵和金坛市大地自动化仪器厂生产的JHH-S26型双列六孔磁力搅拌水浴锅。
1.2 实验原理
在碱溶液中,当pH大于14时,两性金属Al、Zn、Pb、Sn在溶液主要以AlO2-、ZnO22-、HPbO2-、Sn(OH)62-形式存在[17-18],通过碱溶过程实现两性金属与Cu的分离;而两性金属中Al易与碱发生反应,Zn、Pb、Sn在无氧化剂,低浓度碱溶液中较难浸出,通过低碱浸出,实现Al与Zn、Pb、Sn的分离,同时避免了高浓度碱液中,Al与碱发生剧烈反应。实验流程如图1所示,梯级碱溶工艺由低碱浸出和高碱氧化浸出两级组成,高碱氧化浸出过程中,Cu有少量参与反应,以CuO22-进入溶液中[19],反应式如(1)~(5)所示。
Al+NaOH+H2O=NaAlO2+3/2H2 (1)
Zn+ 2NaOH+H2O2=Na2ZnO2+2H2O (2)
Pb+ NaOH+H2O2=NaHPbO2+H2O (3)
Sn+ 2NaOH+2H2O2=Na2Sn(OH)6 (4)
Cu+ 2NaOH+H2O2=Na2CuO2+2H2O (5)
1.3 实验操作与分析方法
低碱浸出:取10 g多金属料,缓慢加入一定浓度的低碱溶液中,在恒温条件下搅拌浸出,反应一段时间后过滤,取滤液进行检测。
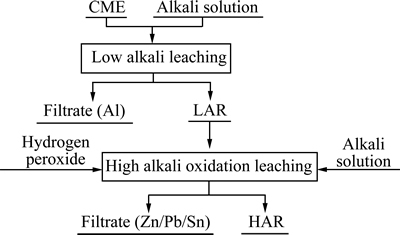
图1 实验流程图
Fig. 1 Schematic diagram of experimental flow sheet
高碱氧化浸出:取10 g低碱浸出渣,用一定浓度的高碱溶液对其浸出,恒流泵控制双氧水的滴加速度,恒温条件下搅拌一定时间,反应一段时间后过滤,取滤液进行检测。
两种滤液的检测原理相同,即通过测定溶液中金属离子浓度判断金属的浸出率(R),计算公式见式(6)。
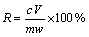 (6)
(6)
式中:R为金属的浸出率,%;c为金属离子浓度,g/L;V为溶液体积,L;m为多金属料或低碱浸出渣质量,g;w为该金属在试样中所占质量分数,%。
滤液采用电感耦合等离子体-原子发射光谱仪(Optimal 5300DV,Perkin-Elmer Instruments)检测Al、Zn、Pb、Sn、Cu浓度。
2 结果与分析
2.1 低碱浸出过程行为
2.1.1 浸出温度对金属浸出率的影响
在NaOH溶液浓度2 mol/L,碱溶液与多金属料液固比为10:1,浸出时间120 min条件下,考察浸出温度对金属浸出率的影响,实验结果如图2所示。
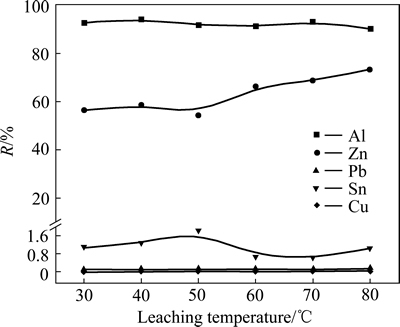
图2 浸出温度对金属浸出率的影响
Fig. 2 Effect of leaching temperature on leaching efficiency of metals
由图2可知,随着浸出温度升高,Al的浸出率变化不大,浸出率均在90%以上;在低温条件下,Zn的浸出率变化不大,当浸出温度超过50 ℃时,随着浸出温度升高,Zn的浸出率呈现上升的趋势。Pb、Sn、Cu浸出率较低,基本不参与反应。Al能直接跟NaOH溶液发生反应,高温条件下,反应较剧烈,过程主要受OH-的传质影响,温度对其影响不占主导地位。Sn在碱溶过程中,氢超电压大,反应进行缓慢,需添加氧化剂促进反应进行[20]。为了使金属达到选择性分离,同时避免反应过程中溶液溢出,选取30 ℃作为低碱浸出的适宜温度。
2.1.2 浸出时间对金属浸出率的影响
在NaOH溶液浓度为2 mol/L,碱溶液与多金属料液固比为10:1,浸出温度为30 ℃条件下,考察浸出时间对金属浸出率的影响,实验结果如图3所示。
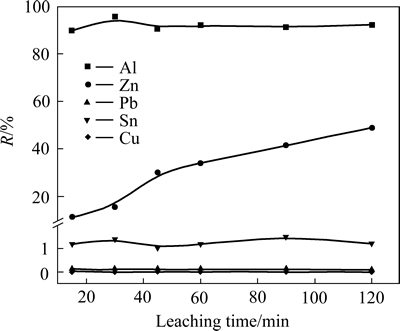
图3 浸出时间对金属浸出率的影响
Fig. 3 Effect of leaching time on leaching efficiency of metals
由图3可以看出,随着浸出时间增加,Al的浸出率变化基本保持不变,浸出率均在90%以上;在考察的时间范围内,Zn的浸出率随着时间延长而不断增加,当浸出时间较短时,Zn的浸出率较低,在浸出时间小于30 min时,其浸出率低于15%,Pb、Sn、Cu浸出率较低,基本不溶解。这说明可以在浸出时间较短的范围内,将Al从电路板中选择性分离出来,如图3所示,在反应时间为30 min时,绝大部分的Al被浸出,同时与其他金属达到了较好分离,所以选择30 min为适宜的浸出时间。
2.1.3 碱浓度对金属浸出率的影响
在碱溶液与多金属料液固比为10:1,浸出温度30 ℃,浸出时间30 min条件下,考察NaOH溶液浓度对金属浸出率的影响,实验结果如图4所示。
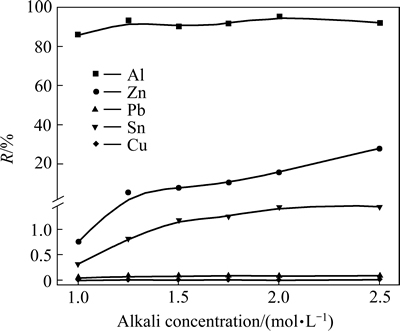
图4 碱浓度对金属浸出率的影响
Fig. 4 Effect of alkali concentration on leaching efficiency of metals
图4表明,在考察的碱浓度范围内,Al的浸出率略有增加,然后维持不变;Zn的浸出率随着碱浓度升高而逐渐增加,但NaOH浓度较低,碱浓度在1.0~1.5 mol/L时,Zn的浸出率较低;Pb、Sn、Cu浸出率很低,基本不参与反应。当碱浓度为1.25 mol/L时,Al得到最大程度的浸出,浸出率为93.02%,而Zn、Pb、Sn、Cu的浸出率依次为5.33%、0.07%、0.83%、0.005%,达到了Al与其他金属选择性分离的目的,选取碱浓度1.25 mol/L较为合适。
2.1.4 液固比对金属浸出率的影响
在NaOH溶液浓度为1.25 mol/L,浸出温度为30 ℃,浸出时间为30 min条件下,考察碱溶液与多金属料液固比对金属浸出率的影响,实验结果如图5所示。
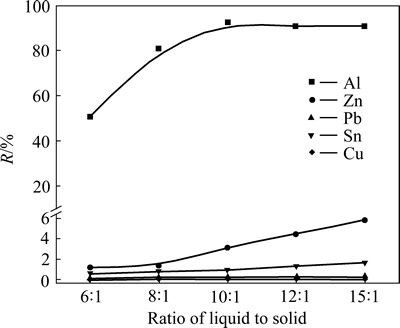
图5 液固比对金属浸出率的影响
Fig. 5 Effect of ratio of liquid to solid on leaching efficiency of metals
由图5可知,液固比对Al的浸出影响较为显著,当液固比从6:1增至10:1时,Al的浸出率从50.73%提高至91.25%,继续增大液固比,Al的浸出率保持不变;Zn的浸出率随着液固比的增加而增加,但增加的幅度较小,当液固比为15: 1时,Zn的浸出率仅有5.83%,Pb、Sn、Cu的浸出率基本不随液固比的改变而变化,溶液中离子含量较少。在液固比为10:1的条件下,其碱耗量与理论量接近,低碱浸出液成分简单,杂质含量少,选择液固比为10:1为较优用量。
2.2 高碱氧化浸出过程行为
在用氧化剂H2O2溶液进行氧化碱浸的试验中,所用试样是低碱浸出最佳工艺条件得到的低碱浸出渣,即NaOH溶液浓度为1.25 mol/L、碱溶液与多金属料液固比为10:1,浸出温度为30 ℃,浸出时间为30 min,低碱浸出渣中Zn、Pb、Sn、Cu含量分别为4.06%、21.4%、27.2%、40.8%;试验每次称取低碱浸出渣10 g,高碱氧化碱浸过程行为研究主要考察浸出过程各因素对金属浸出率的影响,包括浸出温度、碱浓度、H2O2体积分数、液固比、H2O2滴加速度。
2.2.1 浸出温度对氧化浸出过程影响
在初始NaOH溶液浓度为4 mol/L,体系溶液(75%的碱溶液+25%的H2O2溶液)与低碱浸出渣液固比为10:1,H2O2溶液滴加速度为0.4 mL/min,浸出时间为120 min条件下,考察浸出温度对氧化浸出过程金属浸出率的影响,实验结果如图6所示。
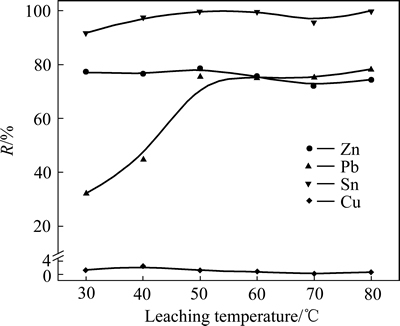
图6 浸出温度对金属浸出率的影响
Fig. 6 Effect of leaching temperature on leaching efficiency of metals
由图6可以看出,在温度低于50 ℃时,随着温度升高,Sn的浸出率逐渐增加,Pb的浸出率呈现快速增长趋势,之后浸出率波动不大,在拐点温度50 ℃时,Pb、Sn的浸出率分别为75.57%、100%;Zn的浸出率随温度变化影响不大,维持在77%左右,Cu有少量参与反应,生成CuO22-[19],但浸出率较低,最高浸出率只有2.61%。Pb在强碱溶液以HPbO2-形式存在,其溶解度随着温度的升高而升高[21],同时升高温度,不仅利于克服反应过程所遇到的能量势垒,也有利于传质过程,从而提高金属的浸出率。为了得到较好的浸出效果,同时减少能量消耗,选择50 ℃为合适的浸出温度。
2.2.2 碱浓度对氧化浸出过程影响
在体系溶液(75%的碱溶液+25%的H2O2溶液)与低碱浸出渣液固比为10:1,H2O2溶液滴加速度为0.4 mL/min,浸出温度为50 ℃,浸出时间为120 min条件下,考察初始NaOH溶液浓度对氧化浸出过程金属浸出率的影响,实验结果如图7所示。
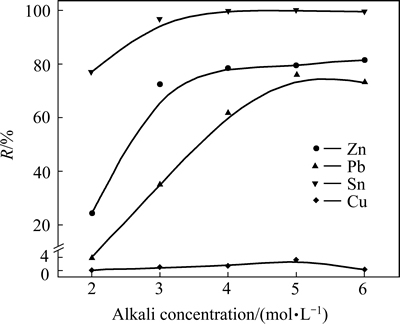
图7 碱浓度对金属浸出率的影响
Fig. 7 Effect of alkali concentration on leaching efficiency of metals
图7表明,随着初始碱浓度升高,金属浸出率均呈现增长的趋势,当碱浓度大于5 mol/L后,提高碱浓度对金属浸出率的变化影响不大,Zn、Pb、Sn浸出率维持在79.34%、76.09%、100%;Cu有少量参与反应。在碱溶液中,Zn、Pb以络合阴离子的形式溶解进入溶液中,其溶解度随着氢氧化钠浓度的增加而逐渐增加[22-23],同时OH-浓度不断增加,增加了金属与活性氢氧根离子的有效接触面积,导致金属的浸出率逐渐增加。但碱浓度的增加,会使溶液黏度增加,减少传质速率,制约了浸出率进一步提升。综合考虑,选择碱浓度为5 mol/L为合适的用量。
2.2.3 H2O2体积分数对氧化浸出过程影响
在初始NaOH溶液浓度为5 mol/L,体系溶液与低碱浸出渣液固比为10:1,H2O2溶液滴加速度为0.4 mL/min,浸出温度为50 ℃,浸出时间为120 min条件下,考察H2O2体积分数对氧化浸出过程金属浸出率的影响,实验结果如图8所示。
从图8可以看出,当H2O2体积分数低于20%时,金属浸出率呈现增长趋势,之后Sn浸出率基本趋于不变,Zn、Pb呈现略微降低的趋势;当体积分数超过30%时,Pb的浸出率有明显的下降趋势,Cu有少量参与反应。当H2O2体积分数为20%时,各金属浸出率取得最高值,分别为Zn 86.72%、Pb 83.48%、Sn 100%、Cu 1.92%;在体系中,金属与碱及氧化剂之间的反应,可认为是H2O2在碱中分解,释放活性氧[O],金属先被氧化生成金属氧化物,氧化物再与碱反应生成钠盐的过程。增加H2O2用量,会产生更多[O]参与金属反应过程,有助于金属在碱中溶解,提高金属浸出率,但当H2O2体积分数较大时,碱溶液体积分数较少,料浆密度增加,减少了传质速率,同时用恒流泵将H2O2不断加入过程中,会降低碱溶液浓度,导致金属浸出率降低。选择H2O2体积分数为20%较为合适。
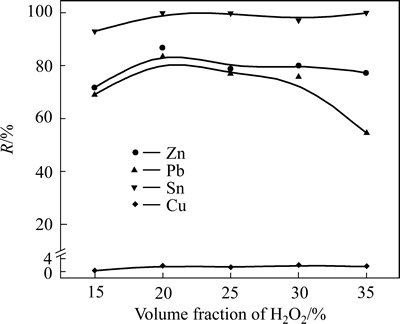
图8 H2O2体积分数对金属浸出率的影响
Fig. 8 Effect of volume fraction of H2O2 on leaching efficiency of metals
2.2.4 液固比对氧化浸出过程影响
在初始NaOH溶液浓度为5 mol/L,H2O2溶液滴加速度为0.4 mL/min,浸出温度为50 ℃,浸出时间为120 min条件下,考察体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比对氧化浸出过程金属浸出率的影响,实验结果如图9所示。
从图9可以看出,随着液固比的增加,各金属的浸出率均逐渐增加,Pb的浸出率增长幅度较大,在液固比为6时,Zn、Pb、Sn、Cu浸出率分别为72.61%、49.95%、81.77%、0.02%,当液固比增大至10时,其值分别为81.10%、79.21%、94.32%、3.52%;继续增大液固比,Zn、Pb、Cu的浸出率基本保持不变,Sn的浸出率先略微增加,然后保持不变。随着液固比的增加,溶液中碱的量逐渐增加,同时双氧水产生的活性氧,在溶液中溶解的量也不断增加,且液固比的增加,降低了料浆密度,使金属粉末在溶液中更加分散,增大了与浸出剂的接触面积,促进各金属元素的浸出。但过高的液固比会增大生产成本投入,综合物料浸出率及反应能耗,选择液固比为10较为合适。
2.2.5 H2O2滴加速度对氧化浸出过程影响
在初始NaOH溶液浓度为5 mol/L,体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比为10:1,浸出温度为50 ℃,浸出时间为120 min条件下,考察H2O2溶液滴加速度对氧化浸出过程金属浸出率的影响,实验结果如图10所示。
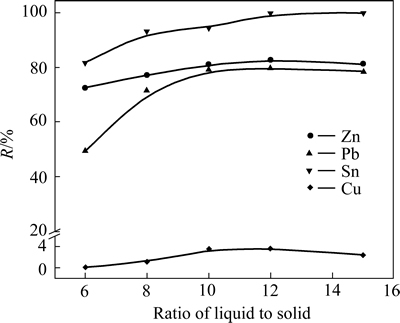
图9 液固比对金属浸出率的影响
Fig. 9 Effect of ratio of liquid to solid on leaching efficiency of metals
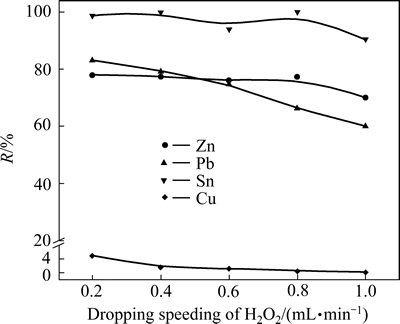
图10 H2O2滴加速度对金属浸出率的影响
Fig. 10 Effect of dropping speed of H2O2 on leaching efficiency of metals
图10表明,在考察的H2O2滴加速度范围内,Zn、Sn的浸出率变化不明显,当滴加速度大于0.8 mL/min时,浸出率略有下降;Pb、Cu的浸出率随H2O2滴加速度增快,浸出率不断降低。H2O2 溶液在碱中分解速度较快,释放活性氧[O],当滴加速度较快时,产生的活性氧远超过了其在溶液中的溶解量,大部分活性氧溢出体系外不参与反应,从而导致金属浸出率降低。但当滴加速度过慢时,反应时间也会延长,综合考虑,选择H2O2滴加速度为0.4 mL/min较为合适。
按0.4 mL/min此H2O2溶液滴加速度计算,双氧水加入时间为50 min,实验发现反应进行60 min后,金属浸出率不再发生变化,为了降低反应能耗,选择反应时间为60 min较为合适。
2.3 优化条件实验
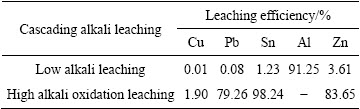
选取以上各个实验得到的最适宜条件进行多次优化条件实验验证,即低碱浸出:NaOH溶液浓度为1.25 mol/L,碱溶液与多金属料液固比为10:1,浸出温度为30 ℃,浸出时间为30 min;高碱氧化浸出:初始NaOH溶液浓度为5 mol/L,体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比为10:1,H2O2溶液滴加速度为0.4 mL/min,浸出温度为50 ℃,浸出时间为60 min。分别对两段碱浸液中金属离子进行检测,结果如表2所列。
表2 优化条件实验金属分布
Table 2 Distribution efficiency of metals in confirmation experiment distribution
对低碱浸出渣和高碱浸出渣进行物相分析,结果如图11所示。

图11 多金属料与浸出渣XRD谱
Fig. 11 XRD pattern of CME and residues
图11表明,多金属料中金属以单质或合金状态存在,图中没有显示Zn衍射特征峰,可能是因为Zn的含量较低,其产生的衍射特征峰强度比较弱。低碱浸出渣中存在的物相有Cu、Pb、Zn,没有Al的物相,说明低碱浸出实现了Al的选择性分离;高碱浸出渣物相中只有Cu,说明高碱氧化浸出实现了Zn、Pb、Sn与Cu的选择性分离,绝大部分Cu和贵金属在高碱渣中富集。从优化条件实验金属分布和物相分析可以得出结论,梯级碱溶能实现金属的选择性分离。
低碱浸出液中成分简单,杂质含量少,主要为NaAlO2,采用补碱循环浸出-析晶工艺,富集回收Al;高碱浸出液先采用Na2S沉淀分离Pb、Zn,滤渣成分主要为PbS和ZnS的混合物,滤液采用蒸发结晶,Sn以Na2SnO3·3H2O形式回收。Cu在渣中以单质形态存在,可通过氧化酸浸溶Cu,浸出液调pH后,可直接用于旋流电积制得阴极铜,不需净化除杂过程,贵金属在氧化酸浸渣中富集。
3 结论
1) 由低碱浸出和高碱氧化浸出两部分组成的梯级碱溶工艺,可将废弃电路板中两性金属在碱中溶解,生成可溶性钠盐与其他金属分离;低碱浸出过程能将Al选择性的分离出来,高碱氧化能将Zn、Pb、Sn与Cu进行选择性分离;同时两段浸出后液成分简单,所含杂质少,容易回收。
2) 低碱浸出最佳工艺条件:NaOH溶液浓度为1.25 mol/L,与多金属料液固比为10:1,浸出温度为30 ℃,浸出时间为30 min;高碱氧化最佳工艺条件:初始NaOH溶液浓度为5 mol/L,体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比为10:1,H2O2溶液滴加速度为0.4 mL/min,浸出温度为50 ℃,浸出时间为60 min。两段浸出过程中,金属的浸出率较高,其值分别为Al 91.25%,Zn 77.34%,Pb 82.53%,Sn 100%;此外,98%以上的Cu和100%的贵金属在高碱渣中富集。
3) 针对两段浸出液,设计采用补碱循环浸出-析晶工艺回收低碱浸出液中的Al和Na2S沉淀-蒸发结晶工艺回收高碱浸出液中Zn、Pb、Sn;针对高碱浸出渣,设计采用氧化酸浸-旋流电积工艺回收其中的Cu。
REFERENCES
[1] 刘小丽, 杨建新, 王如松. 中国主要电子废物产生量估算[J]. 中国人口·资源与环境, 2005, 15(5): 113-117.
LIU Xiao-li, YANG Jian-xin, WANG Ru-song. Estimation of WEEE generation in China[J]. China Population, Resources and Environment, 2005, 15(5): 113-117.
[2] 梁晓辉, 李光明, 贺文智, 黄菊文. 中国电子产品废弃量预测[J]. 环境污染与防治, 2009, 31(7): 82-84.
LIANG Xiao-hui, LI Guang-ming, HE Wen-zhi, HUANG Ju-wen. Estimation of WEEE generation in China[J]. Environmental Pollution & Treatment, 2009, 3(7): 82-84.
[3] 刘志峰, 李 辉, 胡张喜, 潘君齐, 钟海兵. 废旧家电中印刷电路板元器件脱焊技术研究[J]. 家电科技, 2007(1): 32-34.
LIU Zhi-feng, LI Hui, HU Zhang-xi, PAN Jun-qi, ZHONG Hai-bing. Study of disassembly technologies of PCB’s components and soldering tin[J]. China Appliance Technology, 2007(1): 32-34.
[4] DUAN C, WEN X, SHI C, ZHAO Y, WEN B, HE Y. Recovery of metals from waste printed circuit boards by a mechanical method using a water medium[J]. Journal of Hazardous Materials, 2009, 166(1): 478-482.
[5] 徐 敏. 废弃印刷线路板的资源化回收技术研究[D]. 上海: 同济大学, 2008: 12-21.
XU Min. Resources recycling technology for waste printed circuit boards[D]. Shanghai: Tongji University, 2008: 12-21.
[6] 顾帼华, 戚云峰. 废旧印刷电路板的粉碎性能及资源特征[J]. 中国有色金属学报, 2004, 14(6): 1037-1041.
GU Guo-hua, QI Yun-feng. Crushing performance and resource characteristic of printed circuit board scrap [J]. The Chinese Journal of Nonferrous Metals, 2004, 14(6): 1037-1041.
[7] 郭学益, 刘静欣, 田庆华. 废弃电路板多金属粉末低温碱性熔炼过程的元素行为[J]. 中国有色金属学报, 2013, 23(6): 1757-1763.
GUO Xue-yi, LIU Jing-xin, TIAN Qing-hua. Element behavior of low temperature alkaline melting process of waste printed circuit boards[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(6): 1757-1763.
[8] FLANDINET L, TEDJAR F, GHETTA V, FOULETIER J. Metals recovering from waste printed circuit boards (WPCBs) using molten salts[J]. Journal of Hazardous Materials, 2012, 213(7): 485-490.
[9] HAGELUKEN C. Recycling of electronic scrap at Umicore’s integrated metals smelter and refinery[J]. Erzmetall, 2006, 59(3): 152-161.
[10] 刘静欣, 郭学益, 刘 旸. 废弃电路板多金属粉末碱性熔炼产物分形浸出动力学[J]. 中国有色金属学报, 2015, 25(2): 545-552.
LIU Jing-xin, GUO Xue-yi, LIU Yang. Fractal leaching kinetics of alkaline smelting product with metal enrichment from waste printed circuit boards[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(2): 545-552.
[11] SZABOLCS F, FLORICA I, ATTILA E, ARPAD L, PETRU I. Eco-friendly copper recovery process from waste printed circuit boards using Fe3+/Fe2+ redox system[J]. Waste Management, 2015, 40: 136-143.
[12] FICERIOVA J, PETER B, GOCK E. Leaching of gold, silver and accompanying metals from circuit boards (PCBs) waste[J]. Acta Montanistica Slovaca, 2011, 16(2): 128-131.
[13] 张 嘉, 陈 亮, 陈东辉. 废弃电子印刷电路板中Cu和Pb的浸出实验[J]. 环保科技, 2007, 13(2): 25-28.
ZHANG Jia, CHEN Liang, CHEN Dong-fei. Leaching study of copper and lead from waste printed circuit boards[J], Environmental Protection and Technology, 2007, 13(2): 25-28.
[14] CREAMER N J, BAXTER V S, POTTER M, MACASKIE L E. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by desulfovibrio desulfuricans[J]. Biotechnology Letters, 2006, 28(18): 1475-1484.
[15] PANT D, JOSHI D, UPRETI M K, KOTNALA R K. Chemical and biological extraction of metals present in E-waste: A hybrid technology[J]. Waste Management, 2012, 32(5): 979-990.
[16] 吴思芬, 李登新, 姜佩华. 微生物浸取废电路板粉末中的铜[J]. 环境污染与防治, 2008, 30(11): 27-34.
WU Si-fen, LI Deng-xin, JIANG Pei-hua. Bioleaching of copper from wasted printed circuit board by indigenous sulfur-oxidizing bacteria[J]. Environmental Pollution & Control, 2008, 30(11): 27-34.
[17] BROOKINS D G. Eh-pH diagrams for geochemistry[M]. Springer Science & Business Media, 2012: 40-55.
[18] TAKENO N. Atlas of Eh-pH diagrams[R]. Geological Survey of Japan Open File Report, 2005, 419.
[19] 刘伟锋. 碱性氧化法处理铜、铅阳极泥的研究[D]. 长沙: 中南大学, 2011: 68-70.
LIU Wei-feng. Study on copper/lead anode slimes treated by alkaline oxidative leaching[D]. Changsha: Central South University, 2011: 68-70.
[20] 赵由才, 张承龙, 蒋家超. 碱介质湿法冶金技术[M]. 北京: 冶金工业出版社, 2009: 98-100.
ZHAO You-cai, ZHANG Cheng-long, JIANG Jia-chao. Alkali medium hydrometallurgy technology[M]. Beijing: Metallurgical Industry Press, 2009: 98-100.
[21] 刘静欣, 郭学益, 刘 旸, 江晓健. NaOH-Na2SnO3-Na2PbO2- H2O四元水盐体系相平衡研究[J]. 有色金属科学与工程, 2016(1): 13-16.
LIU Jing-xin, GUO Xue-yi, LIU Yang, JIANG Xiao-jian. Study on the phase equilibrium of quaternary saline system NaOH-Na2SnO3-Na2PbO2-H2O[J]. Nonferrous Metals Science and Engineering, 2006(1): 13-16.
[22] KYLE J H, BREUER P L, BUNNEY K G, PLEYSIER R. Review of trace toxic elements (Pb, Cd, Hg, As, Sb, Bi, Se, Te) and their deportment in gold processing. Part 1: Mineralogy, aqueous chemistry and toxicity[J]. Hydrometallurgy, 2011, 107: 91-100.
[23]  M, ERDEM M. Cleaning of high lead-bearing zinc leaching residue by recovery of lead with alkaline leaching[J]. Hydrometallurgy, 2015, 153: 170-178.
M, ERDEM M. Cleaning of high lead-bearing zinc leaching residue by recovery of lead with alkaline leaching[J]. Hydrometallurgy, 2015, 153: 170-178.
Recovery of metal values from waste printed circuit boards using a cascading alkali leaching process
GUO Xue-yi, JIANG Xiao-jian, LIU Jing-xin, LIU Yang, LIU Zi-kang
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: A cascading alkali leaching process was developed to recover metals in crushed metal enrichment (CME) selectively according to metal contents in CME. This process was combined with low alkali leaching and high alkali oxidation leaching. The results show that the optimum conditions for the aluminum selective leaching are as follows: alkali concentration of 1.25 mol/L, liquid to CME of 10:1, leaching temperature of 30 ℃, leaching time of 30 min. And the optimum conditions for selective separation of zinc, lead, tin and copper are as follows: alkali concentration of 5mol/L, liquid (alkali solution of 80% and hydrogen peroxide of 20%) to low alkali leaching residue (LAR) of 10:1, dropping speed of hydrogen peroxide of 0.4 mL/min, leaching temperature of 50 ℃, leaching time of 60 min. By optimizing the experimental conditions, the recoveries of aluminum, zinc, lead, tin reach 91.25%, 83.65%, 79.26%, 98.24%, respectively. In addition, more than 98% of copper and 100% of precious metals are enriched in high alkali leaching residue (HAR).
Key words: waste printed circuit board; cascading alkali leaching; amphoteric metal; leaching efficiency
Foundation item: Project(2014DFA90520) supported by Ministry of Science and Technology, China; Project (2013A090100003) supported by the Teaching and Research Program of Guangdong Province, China
Received date: 2016-03-11; Accepted date: 2016-07-13
Corresponding author: GUO Xue-yi; Tel: +86-731-88876255; E-mail: xyguo@csu.edu.cn
(编辑 何学锋)
基金项目:科技部国际合作专项(2014DFA90520);广东省产学研项目(2013A090100003)
收稿日期:2016-03-11;修订日期:2016-07-13
通信作者:郭学益,教授,博士;电话:0731- 88876255;E-mail: xyguo@csu.edu.cn
摘 要:根据带元器件废弃电路板多金属料成分特点,采用梯级碱溶处理工艺,实现多金属料中有价金属选择性分离。该工艺由低碱浸出和高碱氧化浸出两级组成。第一段主要实现Al的选择性分离,最佳工艺条件:NaOH溶液浓度1.25 mol/L,与多金属料液固比为10:1,浸出温度30 ℃,浸出时间30 min;第二段主要实现Zn、Pb、Sn与Cu的选择性分离,最佳工艺条件:初始NaOH溶液浓度5mol/L,体系溶液(80%的碱溶液+20%的H2O2溶液)与低碱浸出渣液固比10:1,H2O2溶液滴加速度0.4 mL/min,浸出温度50 ℃,浸出时间60 min。在此优化工艺条件下,金属的浸出率依次为Al 91.25%,Zn 83.65%,Pb 79.26%,Sn 98.24%;此外,98%以上的Cu和100%的贵金属在高碱浸出渣中富集。
[1] 刘小丽, 杨建新, 王如松. 中国主要电子废物产生量估算[J]. 中国人口·资源与环境, 2005, 15(5): 113-117.
[2] 梁晓辉, 李光明, 贺文智, 黄菊文. 中国电子产品废弃量预测[J]. 环境污染与防治, 2009, 31(7): 82-84.
[3] 刘志峰, 李 辉, 胡张喜, 潘君齐, 钟海兵. 废旧家电中印刷电路板元器件脱焊技术研究[J]. 家电科技, 2007(1): 32-34.
[5] 徐 敏. 废弃印刷线路板的资源化回收技术研究[D]. 上海: 同济大学, 2008: 12-21.
[6] 顾帼华, 戚云峰. 废旧印刷电路板的粉碎性能及资源特征[J]. 中国有色金属学报, 2004, 14(6): 1037-1041.
[7] 郭学益, 刘静欣, 田庆华. 废弃电路板多金属粉末低温碱性熔炼过程的元素行为[J]. 中国有色金属学报, 2013, 23(6): 1757-1763.
[10] 刘静欣, 郭学益, 刘 旸. 废弃电路板多金属粉末碱性熔炼产物分形浸出动力学[J]. 中国有色金属学报, 2015, 25(2): 545-552.
[13] 张 嘉, 陈 亮, 陈东辉. 废弃电子印刷电路板中Cu和Pb的浸出实验[J]. 环保科技, 2007, 13(2): 25-28.
[16] 吴思芬, 李登新, 姜佩华. 微生物浸取废电路板粉末中的铜[J]. 环境污染与防治, 2008, 30(11): 27-34.
[18] TAKENO N. Atlas of Eh-pH diagrams[R]. Geological Survey of Japan Open File Report, 2005, 419.
[19] 刘伟锋. 碱性氧化法处理铜、铅阳极泥的研究[D]. 长沙: 中南大学, 2011: 68-70.
[20] 赵由才, 张承龙, 蒋家超. 碱介质湿法冶金技术[M]. 北京: 冶金工业出版社, 2009: 98-100.
[21] 刘静欣, 郭学益, 刘 旸, 江晓健. NaOH-Na2SnO3-Na2PbO2- H2O四元水盐体系相平衡研究[J]. 有色金属科学与工程, 2016(1): 13-16.


