高温烧制时间对Pt/YSZ电极性能的影响
王光伟1, 2,李和平1,徐丽萍1,张磊1, 2,张艳清1, 2,窦静1, 2
(1. 中国科学院 地球化学研究所 地球深部物质与流体作用实验室,贵州 贵阳,550002;
2. 中国科学院 研究生院,北京,100039)
摘 要:
摘 要:借助交流阻抗测试技术以及循环伏安、计时电流和扫描电镜方法,研究用Pt浆法制备Pt/YSZ电极过程中高温(850 ℃)烧制时间对其性能的影响。研究结果表明:在Pt/YSZ电极制作时,随着高温烧制时间的增加,电极界面阻抗和氧传感器响应时间均先减小后增大,当烧制时间为10 h时,电极阻抗最小,响应最快,活性最强;Pt/YSZ电极反应激活能受高温烧制时间的影响较小,为200~220 kJ/mol,其速率控制步骤可能为气相O2在PtOx/YSZ界面伴随电荷转移的解离过程。
关键词:
中图分类号:TQ174 文献标志码:A 文章编号:1672-7207(2010)06-2115-07
Effects of sintering time on characteristics of Pt/YSZ electrode
WANG Guang-wei1, 2, LI He-ping1, XU Li-ping1, ZHANG Lei1, 2, ZHANG Yan-qing1, 2, DOU Jing1, 2
(1. Laboratory for Study of the Earth’s Interior and Geofluids, Institute of Geochemistry,
Chinese Academy of Science, Guiyang 550002, China;
2. Graduate School of Chinese Academy of Science, Beijing 100039, China)
Abstract: By means of complex AC impedance, cyclic voltammetry, chronoamperometry and SEM observation, the effects of the Pt/YSZ electrode sintering time at 850 ℃ during the preparing process with the platinum paste method on the characteristics of the electrode were studied. The results show that when the sintering time of the Pt/YSZ electrodes increase, both the interfacial resistances of the electrodes and the response time of the oxygen sensors decrease at first and then increase, the electrode sintered for 10 h has the least resistance, quickest response and best electrode activity; the activation energies of the electrode reactions on the Pt/YSZ electrodes are 200-220 kJ/mol, hardly affected by the sintering time, and the rate determining step (RDS) of the O2/O2- electrode reaction is supposed to be the dissociation of O2 involving a charge-transfer on Pt oxide/YSZ interface.
Key words: Pt/YSZ electrode; sintering time; impedance spectroscopy; cyclic voltammetry; chronoamperometry
YSZ固体电解质是研究和应用最为广泛的高温氧离子导体,由其构成的电化学电池大量用于氧量传感器、氧泵、燃料电池、电化学反应器等领域。虽然混合导体和金属均可用作YSZ固体电解质电池的电极材料,但由于铂具有优良的电催化活性,所以,长期以来一直是进行YSZ电池研究的首选电极材料[1-4]。目前,Pt/YSZ电极制作方法主要有真空喷镀法和Pt浆法[5-6],由于Pt浆法制作成本较低,且所制电极膜附着性能较好,所以,在科研和生产中得到广泛应用。在用Pt浆法制作Pt/YSZ电极过程中,固体电解质YSZ的表面结构、电子浆料的化学组成、电极烧制工艺(烧制温度、烧制时间、升/降温速率)、电极层厚度[7]、电极微观结构形貌[8-9]等都可能影响其电极性能,从而影响器件的氧敏特性和响应速率。鉴于Pt浆法在制作Pt/YSZ电极过程中烧制工艺的重要性,本文作者借助交流阻抗测试技术以及循环伏安、计时电流和扫描电镜方法,研究高温烧制时间对Pt/YSZ电极性能的 影响。
1 实验
1.1 电极制备
YSZ固体电解质为本实验室自制,具体方法为:将(ZrO2)0.92(Y2O3)0.08粉末(上海科技大学提供)制成浆料,用注浆法成型后进行等静压操作,并于1 773 K烧结2 h成瓷,其相对密度达到95%;将制作好的YSZ圆柱体在金刚石切片机上切片即得直径为9 mm、厚度为2 mm的YSZ圆片。YSZ圆片表面经金刚石研磨膏(粒径为20 μm)打磨后,分别用稀盐酸、蒸馏水和丙酮进行超声清洗,然后,采用刷涂工艺在其表面涂覆Pt电极浆料(昆明贵金属研究所提供),在150 ℃烘干后用850 ℃分别烧制1,5,10,15和20 h。电极引线(直径为0.1 mm的铂丝)通过一小滴铂浆与制作好的各电极相连接,烧结温度为700 ℃。制作三电极样品时,工作电极和对电极分别位于YSZ圆片两侧且相互对称,参考电极位于对电极同侧2 mm处,所制两电极和三电极外观如图1所示。图1中:WE为工作电极;CE为对电极,RE为参考电极;SE为YSZ固体电解质。
图1 样品电极示意图
Fig.1 Diagrams of sample electrodes
1.2 测试方法
固定于样品架中的样品电极连同样品架一起被置于与空气连通的管状电阻炉中,测量温度由置于样品电极附近的NiCr-NiAl热电偶提供。采用交流阻抗测试技术测量(两电极法)时,YSZ圆片两表面Pt/YSZ电极分别作为工作电极和参考电极接入Solartron 1260频率响应分析仪,信号电压和频率分别为20 mV和106~10-3 Hz;为了避免电极结构性能在高温条件下发生变化,测试温度从800 ℃降至500 ℃阶段,温度间隔为50 ℃,每次变化温度并保温2 h后开始测试。循环伏安和计时电流实验(三电极法)均通过PAR2263电化学综合测试系统完成,同时,采用JSM-6460LV型扫描电子显微镜,对电化学测试前各样品电极微观形貌进行观察。
2 结果和讨论
2.1 Pt/YSZ电极形貌分析
采用日本JSM-6460LV扫描电镜对各电极样品进行显微形貌观察(850 ℃时烧制时间分别为1,5,10,15和20 h),如图2所示(其中,扫描电镜工作电压为15.0 kV,放大倍数为2 000倍)。由图2可以看出:在Pt/YSZ电极制作过程中,随着高温烧制时间增加,电极中Pt颗粒明显长大并相互聚集,使得电极孔隙率减小,孔径增大,Pt/YSZ两相界与Pt/空气/YSZ三相界长度均减小。
2.2 交流阻抗实验
在不同频率小幅度交流电作用下,“空气,Pt︱YSZ︱Pt,空气”电池表现出一定的阻抗。将该电池阻抗的实部Z′(电阻)和虚部Z″(容抗)分别在复数平面上作图即可获得该电池的阻抗谱。图3所示为600 ℃和700 ℃时各样品电极在空气中的阻抗谱测量结果(其中:Z′和Z″分别为复阻抗的实部和虚部)。由于本实验旨在研究Pt/YSZ电极性能与其高温烧制时间的关系,所以,图中只显示低频(电极)阻抗弧,其左端与实轴的交点代表YSZ固体电解质的本体阻抗。用ZView阻抗谱分析软件对测得的阻抗谱进行拟合,则可得到Pt/YSZ电极的界面电阻。图4所示为各样品电极界面阻抗与其高温烧制时间的关系图。
根据电化学阻抗谱理论,对Pt/YSZ电池施加1个高度为I的恒电流阶跃的电压响应(E),在拉普拉斯平面上E的响应方程式为[10]:
E=IZ=I[R/(1+sRC)]=IR/[(1+sRC)s] (1)
式中:Z为阻抗;s=jω,ω为角频率;R和C分别为阻抗和容抗。将式(1)进行拉普拉斯反变换即得到时间域中E的表达式为:
E=IR[1-e-t/(RC)]=IR(1-e-t/τ) (2)
式中:τ=RC,为过程的弛豫时间,s;IR项是E响应在时间t足够大时的稳态值;IRe-t/τ项则为暂态值。RC愈小,则达到稳态值的时间愈短。由式(2)可推出基于Pt/YSZ电极的氧传感器达到90%响应量时所需的时间为:t=2.303RC=2.303/(2πf) (3)
式中:f为Pt/YSZ电池阻抗谱中电极阻抗弧的特征频率,Hz。

图2 样品电极的扫描电镜照片
Fig.2 SEM photographs of sample electrodes
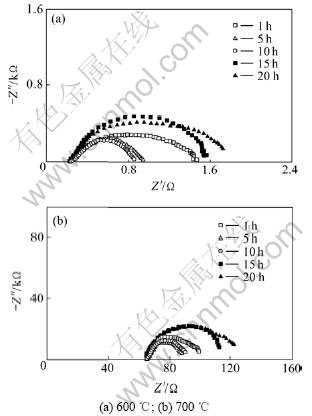
图3 不同温度下YSZ电池的复阻抗谱
Fig.3 Complex impedance plane plots of YSZ cells at different temperatures
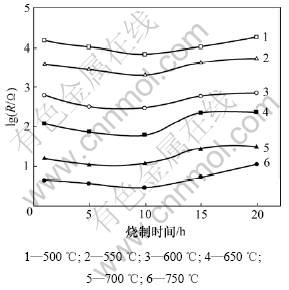
图4 Pt/YSZ电极界面电阻与其高温烧制时间的关系
Fig.4 Relationships between interfacial resistances of Pt/YSZ electrodes and sintering time at different temperatures
将实验所得各电极在不同测试温度点的电极阻抗弧的特征频率代入(3)式,经计算得到氧传感器在各测试温度点达到90%响应量时所需时间t与Pt/YSZ电极高温烧制时间的关系,如图5所示。
由图3~5可知:随着Pt/YSZ电极高温烧制时间增加,电极阻抗和传感器响应时间均先减小后增大,当烧制时间为10 h时,电极阻抗最小,传感器响应最快。这是由于在Pt/YSZ电极系统中,Pt电极本身含有大量的孔洞,具有极大的表面积,处于热力学不稳定状态,当对其进行长时间高温烧结时,不断长大的Pt晶粒聚集成块以降低其结合能,从而使得电极孔隙率减少,孔径增大,电极反应活性区域(Pt/空气/YSZ三相界长度)缩小,电极阻抗增大,响应变慢;但与此同时,Pt和YSZ为了降低其界面能会相互扩散,形成扩散附着,从而提高Pt电极和YSZ之间的界面结合力及其有效结合面积,促进Pt/YSZ界面上的物质与电荷交换,提高电极性能[11]。当Pt/YSZ电极高温烧制时间较短(小于10 h)时,尽管Pt颗粒长大聚集使得Pt/空气/YSZ三相界长度减小,但由于Pt与YSZ界面结合力迅速增强,使其有效结合面积快速增大,导致实验所观察到的电极阻抗和传感器响应时间随烧制时间增加而减小的现象;当Pt/YSZ电极高温烧制时间较长(大于10 h)时,由于Pt与YSZ界面结合力增强的速度减缓,有效结合面积变化较小,电极受三相界长度减小的影响加大,使得电极阻抗和传感器响应时间随高温烧制时间增加而增大。
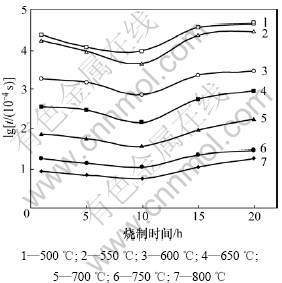
图5 基于Pt/YSZ电极的氧传感器达到90%响应量所需时间t与电极高温烧制时间的关系
Fig.5 Relationships between 90% response time of oxygen sensors based on Pt/YSZ electrodes and sintering time at different temperatures
将各Pt/YSZ样品电极的界面电阻对温度的倒数作图,即得其Arrhenius关系,结果如图6所示。从图6可看出,在实验温度范围内,各电极的Arrhenius关系均表现出较好的线性规律,对各点进行线性拟合所得到的电极过程激活能结果如表1所示。从表1可知,各电极激活能相近,但值较高,为200~220 kJ/mol。根据Gland等[12-15]的研究,在Pt/YSZ电极系统中,当温度低于1 100 ℃时,Pt在作为法拉第电极过程所需电子库的同时,其本身也在进行氧化还原反应而生成铂氧化物。此外,Badwal等[16]在研究Pd/YSZ电极系统时,也发现体系中存在的大量钯氧化物对电极过程具有阻碍作用。依此类推,铂氧化物也应该存在于Pt/YSZ体系中,从而阻碍了吸附氧原子在铂表面的扩散,使电极过程激活能增大,电极反应所需氧量将主要由三相界附近的O2解离吸附所提供。由于本工作所得激活能与O2在非参杂氧化锆界面伴随电荷转移的解离过程活化能(242 kJ/mol)相近[17-18],故认为Pt/YSZ电极反应的速率控制步骤可能为气相O2在PtOx/YSZ界面伴随电荷转移的解离过程。但由于Pt/YSZ电极反应的动力学过程复杂,涉及一系列基元反应步骤和大量的电活性物质,要详细了解体系中电荷转移动力学过程,还需进行深入研究。
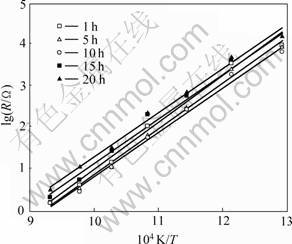
图6 不同高温烧制时间所制Pt/YSZ电极界面电阻的Arrhenius图
Fig.6 Arrhenius plots for interfacial resistances of Pt/YSZ electrodes sintered at 850 ℃ for different time
表1 不同高温烧制时间所制Pt/YSZ电极反应的激活能
Table 1 Activation energies for electrochemical reactions on Pt/YSZ electrodes sintered at 850 ℃ for different time

2.3 循环伏安实验
控制研究电极的电势为连续三角波信号,记录的i-E曲线称为循环伏安曲线,这一测量方法称为循环伏安法。循环伏安法不但是溶液电化学体系最重要的研究手段,而且广泛应用于固体电化学领域,特别是在Pt/YSZ电极系统中,用来研究电极体系可能发生的电化学反应,判断电极过程的可逆性和电极反应物来源,研究电活性物质的吸脱附过程等[19-24]。本工作对各Pt/YSZ样品电极进行了循环伏安实验,电位扫描范围为-400~400 mV。图7所示为600 ℃和空气条件下高温烧制时间为10 h的Pt/YSZ电极循环伏安曲线与电位扫描速度的关系,图8所示为各电极在相同扫描速率(100 mV/s)下的循环伏安曲线。
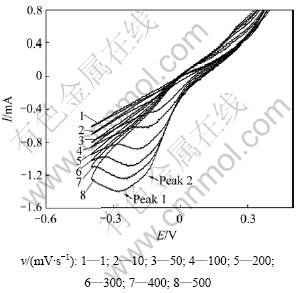
图7 电位扫描速率对高温烧制时间为10 h的Pt/YSZ电极循环伏安曲线的影响
Fig.7 Effect of potential scan rate on voltammogram of Pt/YSZ electrode sintered at 850 ℃ for 10 h
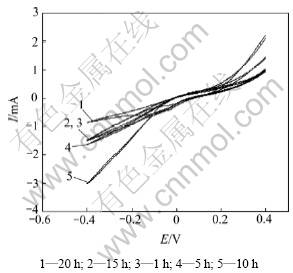
图8 不同高温烧制时间所制Pt/YSZ电极在扫描速率为100 mV/s时的循环伏安曲线
Fig.8 Voltammograms of Pt/YSZ electrodes sintered at 850 ℃ for different times under the same potential scan rate of 100 mV/s
由图7可知:电位扫描速率对Pt/YSZ电极循环伏安曲线有显著影响;当扫描速度小于50 mV/s时,基本看不到电极峰,逐渐增大扫描速度时,开始出现阴极峰;当扫描速度大于200 mV/s时,还可隐约看见第2个阴极峰;进一步增大扫描速度后,第2个阴极峰逐渐明显,但阳极过程无明显变化。Jaccoud等[2, 8]在用循环伏安法研究Pt/YSZ电极时,也观察到2个阴极峰的现象,并认为扫描速率是通过改变三相界而影响循环伏安曲线的。在Pt/YSZ电极体系中,阳极峰是阳极过程(O2-—2e→Oad)的产物Oad在Pt上吸附量(覆盖度)增大而使电极表面活性区域减小所致;阴极峰则是阳极过程所产生并吸附在电极表面的Oad还原(Oad+2e→O2-)的结果。在图7中所观察到的阴极峰峰高随扫描速度增大而增大的现象是由阳极扫描过程中产生并吸附在Pt表面的Oad量增加引起的;峰电位负移表明阴极反应不可逆,也可理解为阳极过程所产生的氧物种热力学性能越稳定,还原电位越负;第2个阴极峰的出现,可能是由于Pt电极表面上形成了2种热力学性能有差异的物种:一种是吸附氧原子Oad,另外一种可能是经过重排的氧或铂氧化物。电极的交流阻抗实验也表明PtOx可能大量存在于电极体系中。Chao等[25]用循环伏安法也得到:在600 ℃时,在Pt/YSZ电极体系中,铂可与氧形成铂氧化物,且该氧化物PtOx在600 ℃时所占比例最大。
由图8可知:当扫描速度为100 mV/s时,各Pt/YSZ电极循环伏安曲线均未出现明显的阴极峰和阳极峰;在电极制备过程中,当高温烧制时间为20 h时,电极活性最低,10 h时电极活性最高,其阴极活性(电位为-0.4 V时)和阳极活性(电位为0.4 V时)分别约为20 h烧制电极的3倍和2倍,其他电极则介于两者之间。这是由于高温烧制时间改变了电极微观形貌结构而导致电极性能发生了变化。
2.4 计时电流实验
由Pt/YSZ电极交流阻抗和循环伏安实验可知,PtOx的存在会阻碍三相界的电荷转移过程,进而影响电极性能。为了研究Pt/YSZ电极表面及体相化学状态的变化,对各样品电极在600 ℃和空气条件下进行计时电流实验,阳极阶跃前于-0.6 V阴极极化1 000 s,使电极体系中可能存在的PtOx全部还原,各电极具有相同的初始状态。图9所示为高温烧制时间为10 h的Pt/YSZ电极在不同阳极阶跃电位下的计时电流曲线,各样品电极在阶跃电位为0.6 V时的计时电流曲线则如图10所示。
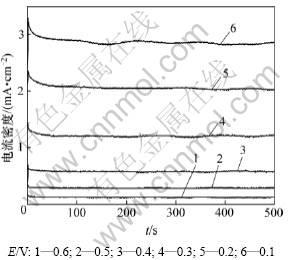
图9 高温烧制时间为10 h所制 Pt/YSZ电极在不同阳极阶跃电位下的计时电流曲线
Fig.9 Chronoamperometric recordings at various anodic potentials of Pt/YSZ electrode sintered at 850 ℃ for 10 h
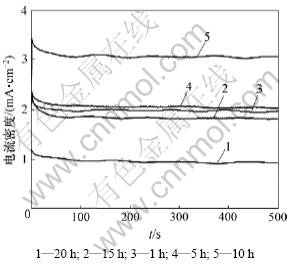
图10 不同高温烧制时间所制Pt/YSZ电极的计时电流曲线
Fig.10 Chronoamperometric recordings of Pt/YSZ electrodes sintered at 850 ℃ for different time
从图9可见:高温烧制时间为10 h时Pt/YSZ电极起始(t=0 s)电流密度随阶跃电位的增大而增大,并且在短时间内(t<10 s)迅速减小至趋于平稳,继续延长极化时间,电流密度无明显变化。这是由于时间增加后,阳极过程产生的O原子大量吸附于电极表面,当其覆盖度达到一定程度后,O原子和Pt原子开始发生位置重排反应,形成更稳定的PtOx以降低表面能,从而阻碍在三相界发生电荷转移,使电流迅速减小;当时间继续增加时,PtOx厚度增加,但对三相界的电荷转移过程影响较小,所以,电流保持平稳。由从图10可以看出:与循环伏安实验和交流阻抗实验结果一致,Pt/YSZ电极烧制过程中,高温烧制时间对电极活性有显著影响,烧制时间为20 h时电极活性最低,10 h时电极活性最高,约为20 h所制电极的3倍,其余电极的活性介于两者之间。
3 结论
(1) 在用Pt浆法制备Pt/YSZ电极过程中,当烧制温度为850 ℃时,随着烧制时间的增加,电极界面阻抗和氧传感器响应时间均先减小后增大;当烧制时间为10 h时,电极阻抗最小,响应最快,活性最高。
(2) 在用Pt浆法制备Pt/YSZ电极过程中,高温(850 ℃)烧制时间对电极界面阻抗激活能无明显影响,为200~220 kJ/mol,与电极体系中Pt原子氧化和重排有关。电极反应速率控制步骤可能为气相O2在PtOx/ YSZ界面伴随电荷转移的解离过程。
参考文献:
[1] Wang T, Novak R F, Soltis R E. A study of factors that influence zirconia/platinum interfacial impedance using equivalent circuit analysis[J]. Sensors and Actuactors B, 2001, 77(1/2): 132-138.
[2] Jaccoud A, Fóti G, Comninellis C. Electrochemical investigation of platinum electrode in solid electrolyte cell[J]. Electrochimica Acta, 2006, 51(7): 1264-1273.
[3] Sridhar S, Stancovski V, Pal U B. Transient and permanent effects of direct current on oxygen transfer across YSZ-electrode interface[J]. J Electrochem Soc, 1997, 144(7): 2479-2485.
[4] Schwandt C, Weppner W. Variation of the oxygen exchange rate of zirconia-based electrodes by electrochemical pretreatment[J]. Solid State Ionics, 1998, 112(3/4): 229-236.
[5] Drevet C, Hénault M, Fulatier J. Oxygen electrode reaction on stabilized zirconia under high oxygen pressure (up to 100 bar)[J]. Solid State Ionics, 2000, 136/137(2): 807-812.
[6] Sridhar S, Stancovski V, Pal U B. Effect of oxygen-containing species on the impedance of the Pt/YSZ interface[J]. Solid State Ionics, 1997, 100(1/2): 17-22.
[7] Badwal S P S, Ciacchi F T. Microstructure of Pt electrodes and its influence on the oxygen transfer kinetics[J]. Solid State Ionics, 1986, 18/19(2): 1054-1060.
[8] Jaccoud A, Fóti G, Wüthrich R, et al. Effect of microstructure on the electrochemical behavior of Pt/YSZ electrodes[J]. Topics in Catalysis, 2007, 44(3): 409-417.
[9] Yoon S P, Nam S W, Han J, et al. Effect of electrode microstructure on gas-phase diffusion in solid oxide fuel cells[J]. Solid State Ionics, 2004, 166(1/2): 1-11.
[10] 曹楚南, 张鉴清. 电化学阻抗谱导论[M]. 北京: 科学出版社, 2002: 76-83.
CAO Chu-nan, ZHANG Jian-qing. Introduction of electrochemical impedance spectroscopy[M]. Beijing: Science Press, 2002: 76-83.
[11] 郭新, 孙尧卿, 崔崑. ZrO2氧传感器的电极、基体及其界面[J]. 传感器技术, 1992(5): 7-12.
GUO Xin, SUN Yao-qing, CUI Kun. The electrode, substrate and their interface[J]. Journal of Sensor and Transducer Technology, 1992(5): 7-12.
[12] Gland J L. Molecular and atomic adsorption of oxygen on the Pt(111) and Pt(s)-12(111)×(111)surfaces[J]. Surface Science, 1980, 93(2/3): 487-514.
[13] Gland J L, Sexton B A, Fisher G B. Oxygen interactions with the Pt(111) surface[J]. Surface Science, 1980, 95(2/3): 587-602.
[14] Somorjai G A. Chemistry in two dimensions-surfaces[M]. London: Cornell University Press, 1981: 500-505.
[15] Kuzin B L, Komarov M A. Adsorption of O2 at Pt and kinetics of the oxygen reaction at a porous Pt electrode in contact with a solid oxide electrolyte[J]. Solid State Ionics, 1990, 39(3/4): 163-172.
[16] Badwal S P S, de Bruin H J. Electrode kinetics at the Palladium/Ceramic oxide electrolyte interface[J]. J Electrochem Soc, 1982, 129(9): 1921-1928.
[17] Smith T. Zirconium dioxide-oxygen reactions Ⅰ. Molecular oxygen adsorption with electron transfer[J]. J Electrochem Soc, 1964, 111(9): 1020-1027.
[18] Smith T. Zirconium dioxide-oxygen reactions Ⅱ. Chemisorption of atomic oxygen[J]. J Electrochem Soc, 1964, 111(9): 1027-1031.
[19] Breiter M W, Leeb K, Fafilek G. Voltammetric studies of electrochemical processes at the interface Pt/YSZ between 300 and 600 ℃[J]. Journal of Electroanalytical Chemistry, 1997, 434(1/2): 129-137.
[20] Breiter M W, Leeb K, Fafilek G. Voltammetric studies of the Au/YSZ interface at temperatures between 300 and 600 ℃[J]. Journal of Electroanalytical Chemistry, 1997, 436(1/2): 155-159.
[21] Jacobsen T, Zachau-Christiansen B, Bay L, et al. Hysteresis in the solid oxide fuel cell cathode reaction[J]. Electrochimica Acta, 2001, 46(7): 1019-1024.
[22] Kenjo T, Yamakoshi Y, Wada K. An estimation of the electrode-electrolyte contact area by linear sweep voltammetry in Pt/ZrO2 oxygen electrodes[J]. J Electrochem Soc, 1993, 140(8): 2151-2157.
[23] Jiang Y, Kaloyannis A, Vayenas C G. High temperature cyclic voltammetry of Pt catalyst-electrodes in solid electrolyte cells[J]. Electrochimica Acta, 1993, 38(17): 2533-2539.
[24] 江义, 李文钊, 曹立新, 等. Pt/YSZ固体电解质界面的电化学动力学研究[J]. 电化学, 1996, 2(1): 32-40.
JIANG Yi, LI Wen-zhao, CAO Li-xin, et al. Kinetic behavior of the Pt/YSZ solid electrolyte interface exposed to O2+He mixture[J]. Electrochemistry, 1996, 2(1): 32-40.
[25] Chao T, Walsh K J, Fedkiw P S. Cyclic voltammetric study of the electrochemical formation of platinum oxide in a Pt/yttria-stabilized zirconia cell[J]. Solid State Ionics, 1991, 47(3/4): 277-285.
(编辑 刘华森)
收稿日期:2009-12-09;修回日期:2010-03-07
基金项目:国家高技术研究发展计划(“863”计划)项目(2006AA09Z205);国家自然科学基金资助项目(40573046);中国科学院重大科研装备研制项目(YZ200720)
通信作者:李和平(1963-),男,湖南长沙人,博士,研究员,从事地球化学研究;电话:13658510565;E-mail: liheping@vip.gyig.ac.cn


