文章编号:1004-0609(2007)09-1536-07
钴氮共掺杂TiO2薄膜的制备及其光电化学性质
施晶莹1, 2, 冷文华2,程小芳2,张 昭2,张鉴清2, 3,曹楚南2, 3
(1. 福建泉州师范学院 化学系,泉州 362000;
2. 浙江大学 化学系,杭州 310027;
3. 中国科学院 金属研究所 金属腐蚀与防护国家重点实验室,沈阳 110016)
摘 要:采用溶胶-凝胶法分别制备未掺杂和钴掺杂TiO2溶胶,室温下将其分别与三乙胺反应制得氮掺杂和(Co, N)共掺杂的TiO2溶胶,然后通过浸渍-提拉法在钛片上成膜,经烧结获得掺杂光电极。采用XRD、SEM、XPS和紫外-可见光谱和光电流作用谱等对电极进行表征,并探讨其光电响应机理。结果表明:TiO2共掺杂后并未引起TiO2能带边缘位置发生明显改变,N主要以NOx形式掺杂;(Co, N)共掺杂TiO2薄膜电极的可见光电响应比单掺杂的高,这主要归因于共掺杂TiO2薄膜电极的比表面积增大、光吸收性能改善、界面电荷转移速率提高以及共掺杂元素的协同作用等。
关键词:
中图分类号:O 643 文献标识码:A
Preparation of cobalt and nitrogen codoped TiO2 thin films and their photoelctrochemical performance
SHI Jing-ying1, 2, LENG Wen-hua2, CHENG Xiao-fang2, ZHANG Zhao2, ZHANG Jian-qing2, 3, CAO Chu-nan2, 3
(1. Department of Chemistry, Quanzhou Normal College, Quanzhou 362000, China;
2. Department of Chemistry, Zhejiang University, Hangzhou 310027, China;
3. State Key Laboratory for Corrosion and Protection, Institute of Metals Research, Chinese Academy of Sciences, Shenyang 110015, China)
Abstract: The undoped and cobalt doped TiO2 sols were prepared using sol-gel method. After addition of triethylamine into the respective sol at room temperature, nitrogen and (Co, N) codoped TiO2 sols were obtained. Various thin film electrodes were prepared from the sols using dip-coating approach. These films were characterized by XRD, SEM, XPS, UV-Vis absorption spectroscopy and photocurrent action spectra, and their photoelectrochemical response mechanisms under visible light were also discussed. The results show that the (Co, N) codoped TiO2 electrode exhibits an enhanced incident photon to current efficiency under visible light in comparison with the Co-doped and N doped TiO2 alone. Codoping dose not shift the position of energy band edges of the electrodes where nitrogen exists in the form of NOx. The enhanced photoresponse observed can be attributed to the increase in surface area, light absorbance, interface charge transfer rate of photogenerated carriers and cooperation effect between the doping species.
Key words: TiO2 thin film; (Co, N) codoping; photoelectrochemistry; visible light
TiO2薄膜作为光催化剂已被广泛研究,然而它只能被紫外光所激发,不利于利用太阳能[1]。过渡金属离子掺杂通常能产生可见光响应[2-3]。但这种掺杂方式通常同时会引起载流子复合中心数目增加,且需要较昂贵的制备设备[2, 4]。非金属例如氮掺杂是近年来的一个研究热点。在宽禁带半导体同时掺入金属和非金属离子,有望同时调控其导带和价带带边位置,窄化带隙,或引入中间能级,提高其可见光响应。
过量掺杂和过多物种掺杂,反而会降低光催化剂的活性[2, 5],故共掺杂的物种数目通常小于2。(Sb, Cr)[6]、 (Cl, Br)[7]、(S, N)[8]、(La, N)[9]等共掺杂光催化剂都显示出比单掺杂催化剂更优的光催化性能。已有报道显示钴[5]和氮元素[4, 10]的单掺杂具有较好的可见光催化活性。为进一步提高薄膜的可见光电响应性能,本文作者采用共掺杂的方法制备(Co, N)共掺杂TiO2电极,对其进行XRD、SEM、XPS等表征,对其光电性质进行较为系统的研究,探讨其光电响应提高的可能机理。迄今为止这种采用金属和非金属共同掺杂的方法来提高电极的可见光电响应的研究未见报道。
1 实验
TiO2溶胶的合成方法详见文献[11]。往其中添加适量Co(NO3)2,可以获得钴掺杂的TiO2溶胶。将适量三乙胺(简记为TEA)分别滴入上述两种溶胶中,搅拌3 h即可在室温下获得淡黄色的氮掺杂溶胶和灰蓝色(Co, N)共掺杂溶胶。
以钛片(纯度大于99.7 %,厚度为15 mm)为基底,采用浸渍-提拉法成膜,详细步骤见以前的报道[12-13]。
薄膜的XRD分析在Rigaku D/max-3B型X射线衍射仪上进行,以Cu Ka(l = 0 .154 nm)为辐射源,石墨单色器滤波,管压40 kV,管流300 mA,扫描速率8 (?)/min,扫描范围10?~90?。XPS分析在PHI公司的PHI 5000C ESCA 系统上进行,采用铝靶,高压为14.0 kV,功率为300 W,通能93.9 eV。以C1s 284.6 eV为基准进行结合能校正。薄膜的形貌观测在SIRION-200型场发射扫描电子显微镜上进行。UV-vis吸收光谱在Analytikjena SPECORD-200紫外-可见分光光度计上进行。以石英玻璃为薄膜基底,扫描波长范围为250~900 nm,扫描速度为5 nm/s,以空白石英玻璃作参比。
光电化学测试如入射光电转换效率(IPCE)、交流阻抗谱(EIS)等测试方法参见文献[3, 12]。以0.1 mol/L Na2SO4和0.1 mol/L C2H5OH混合液为电解液,Na2B4O7浓度为0.01 mol/L,pH 9.0。铂片为对电极,实验中所有电位均相对于饱和甘汞电极(SCE)。光源为250 W氙灯(德国,SVX 1450),以Na2CO3和K2Cr2O7 混合液滤除波长460 nm以下的光线[12]。电化学实验在EG&G 273A恒电位仪上进行。制备的电极在背面点焊导线后,预留0.7 cm×0.7 cm工作面积,其余非工作部位均以环氧树脂密封。
2 结果与讨论
研究表明,在一定外加偏压下,当钴掺杂量从0.5%变化到3%时,掺杂2%钴的TiO2薄膜电极具有最大光电流。当TiO2溶胶和TEA的体积比为1?2时,所得氮掺杂薄膜电极具有较大光电流。因此,以下实验中所研究钴掺杂电极均为2%,氮掺杂电极均由体积比为1?2的未掺杂溶胶和TEA反应制得,而(Co, N)共掺杂溶胶则由以上钴掺杂溶胶和TEA按体积比1?2反应制得。
图1所示为外加电压0.8 V时,电极在暗态和光照下的电流—时间变化。可以看出,(Co, N)共掺杂电极的光电流分别约为钴掺杂电极和氮掺杂电极的1.5和3.5倍,且大于两个单掺杂电极光电流的加和,说明共掺杂提高电极的光电化学响应,两掺杂元素之间还存在一定的协同效应。图1还给出未掺杂电极的电流—时间关系,在相同的光照条件下,其光电流很小,可以忽略。
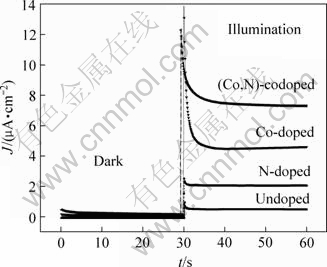
图1 外加电压为0.8 V时暗态和光照下电极电流与时间的关系
Fig.1 Time dependence of current on time for electrodes at 0.8 V in dark and under illumination
X射线衍射分析表明,在未掺杂和氮掺杂TiO2薄膜中锐钛矿相是惟一的TiO2晶相,而钴掺杂和(Co, N)共掺杂薄膜的结晶度略降低。薄膜电极的表面形貌如图2所示。电极表面为纳米多孔结构。同未掺杂电极相比,钴掺杂使表面微孔数目减少;而氮掺杂则使微孔数目明显增多;(Co, N)共掺杂后,其表面微孔数目显然进一步增多,表面粗糙度增加,说明比表面积增大,可有利于增大催化剂和电解液的接触面积,促进光生载流子的传输,从而有利于催化剂的光电转化效率及光催化活性的提高。

图2 TiO2薄膜电极的SEM像
Fig.2 SEM images of undoped and doped TiO2 thin film: (a) Undoped; (b) N-doped; (c) Co-doped; (d) (Co, N)-codoped
XPS结果显示钴掺杂TiO2中钴的含量为0.8 %,氮掺杂TiO2中氮的含量为0.4 %,而(Co, N)共掺杂TiO2中钴含量提高到1.2 %,氮含量却降低至0.1 %。这说明共掺杂元素之间存在相互作用。
图3所示为含氮样品中N 1s的XPS谱。对氮掺杂催化剂中N1s的XPS分析认为[4, 14-15]:结合能396 eV处的峰为Ti—N或b—N(原子态);400 eV处的峰为Ti—O—N或g—N2(化学吸附分子态);402 eV处的峰为g—N2。由图3可见,在N掺杂电极中396 eV处未检测到的峰,说明不存在b—N,即不存在Ti—N键,这同Gole等[14]报道的一致。未掺杂TiO2薄膜的Ti 2p1/2和2p3/2的峰则分别位于464.81和459.27 eV处;而氮掺杂后Ti 2p1/2和2p3/2的峰分别位于464.71和459.17 eV处,两者几乎一样,说明Ti 2p电子的结合能基本不受氮掺杂的影响,进一步证明不存在Ti—N键。这不同于Asahi等[4, 10, 15] 的报道,他们认为氮掺杂催化剂具备可见光响应的原因是由于存在Ti—N键的缘故。在共掺杂样品中,也不存在396 eV的峰,但是Ti 2p的峰位置却有明显位移,这主要归因于金属元素的掺杂。图3示出在N掺杂样品中N1s分别在400.49 eV和402.57 eV处出现两个峰,说明氮的掺杂在催化剂表面上主要是通过分子化学吸附引起的。在(Co, N)共掺杂样品中,N 1s的两个峰分别位于401.27和404.08 eV处,前者可能归因于Co—N—O键的形 成[14],后者可能归因于NOx的形成[16],Sato[17]研究发现NOx掺杂具有光敏化TiO2的作用。
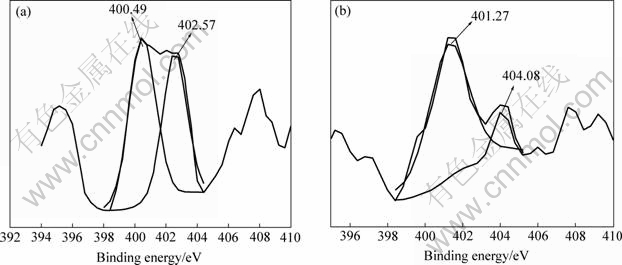
图3 氮掺杂(a)和钴氮共掺杂(b)TiO2薄膜N 1s的XPS谱
Fig.3 N 1s XPS spectra of N-doped(a) and (Co, N)-codoped(b) TiO2 thin film
图4所示为薄膜的UV-Vis 吸收光谱。所有掺杂TiO2薄膜在可见光区间都有光吸收,且共掺杂TiO2薄膜的光吸收性能均优于单掺杂薄膜的,说明(Co, N)共掺杂能够提高TiO2的吸光性能,因而可能提高可见的利用率,这可能是共掺杂电极具有较髙的光电流响应的一个直接原因之一。而氮掺杂样品在400~500 nm间吸收了可测光,这与文献[4, 10, 15]报道的结果一致。
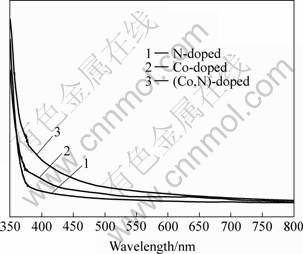
图4 氮掺杂、钴掺杂和钴氮共掺杂TiO2薄膜的紫外-可见吸收光谱
Fig.4 UV-visible absorption spectra for N-doped, Co-doped and (Co, N)-codoped TiO2 thin film coated on suprasil glass
2.3.1 平带电位
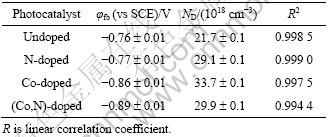
由Mott-Schottky曲线求得的各电极平带电位结果列于表1。与未掺杂样品相比,氮掺杂后平带电位几乎不变,这与Asahi等[4, 10, 15]报道的一致;而Sakthivel等[18]研究表明,氮掺杂后引起平带电位正移,这可能是样品制备方法不同的缘故。另外,钴掺杂使其平带电位负移100 mV,共掺杂氮则使其进一步负移30 mV。已有研究表明,金属元素掺杂往往引起导带带边移动,即引起平带电位移动[3]。XPS分析结果表明,共掺杂使Co 2p的电子结合能从单纯钴掺杂时的798.81 eV正移至799.32 eV处,因此钴氮共掺杂可能通过影响钴的掺杂而使其平带电位进一步负移。
表1还列出样品的施主浓度(ND),该值可通过Mott-Schottky关系曲线的斜率求得。与未掺杂二氧化钛电极相比,所有掺杂电极的ND值都显著提高,特别是钴掺杂电极的ND值约是未掺杂的1.5倍;共掺杂氮后其ND值有所下降,具体原因有待进一步研究。
表1 由Mott-Schottky关系得到的掺杂和未掺杂TiO2薄膜的电极参数
Table 1 Parameters derived from Mott-Schottky plots for doped and undoped TiO2 (pH 9.0, 1 000 Hz, 298.15 K).
2.3.2 光电流作用谱
图5所示为各样品的光电流作用谱。由图可见,氮掺杂并没有显著提高TiO2薄膜光电转换效率(IPCE),这可能是由于氮掺杂量过低(仅0.41%)的缘故。但少量氮共掺杂却能明显提高在波长约400~500 nm区间(以下简称V1区)内电极的IPCE,而对波长约660~800 nm区间(以下简称V2区)的IPCE影响不大。这说明氮的共掺杂总体上有利于提高电极的IPCE。另外,从图5可见,钴掺杂较大地提高了TiO2在V1区的IPCE,而在V2区其IPCE明显低于未掺杂样品的IPCE。
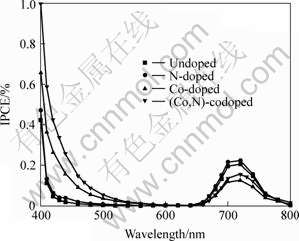
图5 掺杂和未掺杂TiO2薄膜电极光电转化效率
Fig.5 Curves of IPCE vs wavelength for doped and undoped TiO2 thin films at 0.8 V in solutions (pH = 9) containing 0.1 mol/L Na2SO4 , 0.1 mol/L C2H5OH and 0.01 mol/L Na2B4O7
另外,所有被测样品在V2区都有一个峰,中心位置约在710 nm(1.75 eV)处,在未掺杂样品中这个峰也存在,可见这个峰并非由掺杂引起,只是金属离子的掺杂导致这个峰强度急剧减弱。
2.3.3 电化学阻抗谱
图6所示为可见光下掺杂TiO2薄膜电极的电化学阻抗谱。由图可知,采用乙醇作为电子供体,在可见光和外加偏压0.4 V时,电极在Nyquist 图中仅为一段圆弧,Bode图(图6中插图)中仅有一个峰。在此情况下,Nyquist图中圆弧的半径大小与电极反应速率直接相关,圆弧半径越小说明反应越快或载流子复合速率低[19]。显然,共掺杂样品Nyquist图上显示的圆弧具有最小的半径,从而具有较快的反应速率或较低的电子空穴复合速率。圆弧半径由小到大的顺序如下:(Co, N)共掺杂<Co掺杂<N掺杂。这与I—t关系曲线、IPCE和UV-Vis吸收光谱反映的结果一致。
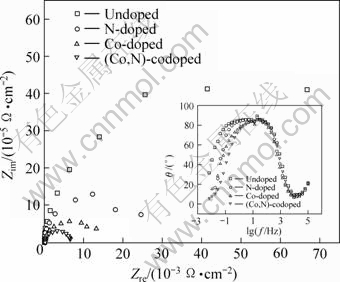
图6 可见光下掺杂TiO2薄膜电极电化学阻抗谱(插图为Bode图)
Fig.6 EIS Nyquist and Bode plots (inset) for electrodes under visible light at 0.4 V
根据光激发TiO2电子在价带和导带之间为间接跃迁,利用光电流作用谱,通过(iphhn/f0)1/2—hn关系曲线,将直线外推即可求得各样品的带隙宽度,具体计算方法详见本文作者以前的报道[3]。图7所示为掺杂和未掺杂TiO2薄膜电极(iphhn/f0)1/2—hn曲线。由图可知,未掺杂、氮掺杂、钴掺杂和(Co, N)共掺杂TiO2薄膜的带隙分别为3.09、3.09、3.06和3.04 eV,可见掺杂并未使带隙明显窄化。
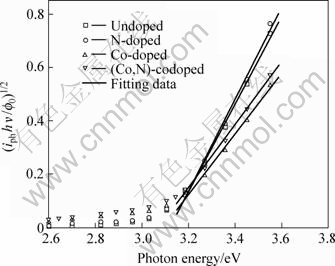
图7 掺杂和未掺杂TiO2薄膜电极的(iphhn/f0)1/2—hn曲线
Fig.7 Curves of (iphhn/f0)1/2 vs hn for doped and undoped TiO2 electrodes at 0.8 V in electrolyte as described in Fig.5
2.4.1 氮掺杂TiO2薄膜光电响应的机理
到目前为止,有关氮掺杂二氧化钛的可见光响应机理大概有如下几种:1) NOx杂质敏化机理[17],即 NOx的掺杂进入TiO2的缘故;2) 氧空位机理[20],认为光响应是由于氧空位能够产生位于导带下的施主能态,而替代氮可以抑制电子-空穴对的复合;3) 带隙窄化机理[4, 10, 15],认为N 2p态和O 2p态混合杂化导致在掺杂催化剂中引入位于O 2p价带之上的N 2p受主,从而引起带隙窄化;4) 填隙式掺杂机理[21],认为N是掺杂在填隙位,而正是这些填隙位上的N原子使催化剂获得可见光响应。根据前面的讨论,本文作者所制备的氮掺杂TiO2薄膜在400~500 nm区间有可测的光吸收,但是与未掺杂TiO2相比,其导带和价带的带边保持不变,因此可以排除带隙窄化机理。并且XPS分析未发现NOx峰,因此该机理也可以排除。这样,氮掺杂样品的可见光响应机理最可能是晶间掺杂和氧空位两者共同作用的结果。
2.4.2 (Co, N)共掺杂电极光电响应提高的可能机理
有关共掺杂TiO2催化剂的研究目前尚不多见,对其光响应提高的可能机理研究也较少,大约有以下几种:1) 电荷平衡原理,如(Sb, Cr)共掺杂[6]。Sb5+和Cr3+离子掺杂进入TiO2后,可有效抑制Cr6+和氧缺陷的生成,因为这两者都是光生电子和空穴的有效非辐射复合中心,减少它们的生成必然引起催化剂活性的提高;2) 带隙变窄,如 (Cl, Br)共掺杂[7]引起TiO2晶相改变而导致吸收带边红移;3) 协同效应,如单独硫掺杂和氮掺杂TiO2的紫外-可见吸收光谱都只有一个吸收带,而(S, N)共掺杂[8]后产生另一个吸收带,这种协同效应促进了催化剂的光吸收和催化活性;(Co, N)共掺杂TiO2光催化剂与单掺杂样品相比,其光电响应提高的主要原因如下:1) 共掺杂元素的协同作用。由图1可见,共掺杂电极在相同条件下产生的光电流略髙于二者的加和。XPS分析结果(未示出)发现氮的共掺杂引起Co 2p电子结合能正移0.51 eV;钴共掺杂引起N 2p电子结合能移动0.78 eV。这说明两种掺杂元素并非独立发挥作用,而是存在一定的协同作用;2) 比表面增大。氮掺杂后导致电极表面更多微孔的形成;3) 光吸收性能提高。吸收光谱显示(Co,N)共掺杂样品的可测起始光吸收延伸至约580 nm处,而钴掺杂和氮掺杂样品的起始光吸收分别约在540 nm和520 nm处;4) NOx杂质掺杂。XPS分析认为,在共掺杂样品中存在NOx,而NOx具有敏化TiO2的功能[17];5) 界面电子转移速度提高。
3 结论
1) 采用溶胶-凝胶法制备了钴掺杂溶胶,将其与TEA反应可以制备(Co, N)共掺杂薄膜光电极。与单元素掺杂的电极相比,共掺杂电极的可见光光电响应更高,吸收光谱进一步向可见光区延伸。
2) 共掺杂后并未引起TiO2能带边缘位置的明显改变,N主要以NOx形式掺杂。
3) 共掺杂电极光电响应高的原因主要归因于电极比表面积增大、光吸收性能改善、界面电荷转移速率提高以及共掺杂元素的协同作用等。金属和非金属元素共掺杂是提高催化剂可见光电响应一种有效 方法。
REFERENCES
[1] Hagfeldt A, Gr?tzel M. Light-induced redox reactions in nanocrystalline systems[J]. Chem Rev, 1995, 95(1): 49-68.
[2] Choi W, Termin A, Hoffmann M R. The role of metal ion dopants in quantum-sized TiO2: correlation between photoreactivity and charge carrier recombination dynamics[J]. J Phys Chem, 1994, 98: 13669-13679.
[3] Shi J Y, Leng W H, Zhu W C, Zhang J Q, Cao C N. Electrochemically assisted photocatalytic oxidation of nitrite over Cr-doped TiO2 under visible light[J]. Chem Eng Technol, 2006, 29: 146-154.
[4] Asahi R, Morikawa T, Ohwaki T, Aoki K, Taga Y. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293: 269-271.
[5] Iwasaki M, Hara M, Kawada H, Tada H, Ito S. Cobalt ion-doped TiO2 photocatalyst response to visible light[J]. J Colloid Interface Sci, 2000, 224: 202-204.
[6] Kato H, Kudo A. Visible-light-response and photocatalytic activities of TiO2 and SrTiO3 photocatalysts codoped with antimony and chromium[J]. J Phys Chem B, 2002, 106: 5029-5034.
[7] Luo H, Takata T, Lee Y, Zhao J, Domen K, Yan Y. Photocatalytic activity enhancing for titanium dioxide by co-doping with bromine and chlorine[J]. Chem Mater, 2004, 16: 846-849.
[8] Liu H Y, Gao L. (Sulfur, nitrogen)-codoped rutile-titanium dioxide as a visible-light-activated photocatalyst[J]. J Am Ceram Soc, 2004, 87(8): 1582-1584.
[9] Miyauchi M, Takashio M, Tobimatsu H. Photocatalytic activity of SrTiO3 codoped with nitrogen and lanthanum under visible light illumination[J]. Langmuir, 2004, 20: 232-236.
[10] Asahi R, Morikawa T, Ohwaki T, Aoki K, Taga Y. Photocatalysts sensitive to visible light-response[J]. Science, 2002, 295: 627-629.
[11] O’Regan B, Gr?tzel M. A low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films[J]. Nature, 1991, 353: 737-739.
[12] 施晶莹, 冷文华, 程小芳, 张鉴清, 曹楚南. TiO2光电化学电池催化氧化甲基红[J]. 物理化学学报, 2005, 21(9): 991-996.
SHI Jing-ying, LENG Wen-hua, CHENG Xiao-fang, ZHANG Jian-qing, CAO Chu-nan. Photocatalytic oxidation of methyl red by TiO2 in a photoelectrochemical cell[J]. Acta Phys Chin Sin, 2005, 21(9): 991-996.
[13] 谌 攀, 曹江林, 冷文华, 王建明. 掺钴氧化钛电极的制备、表征及其光电性能 [J]. 化学物理学报,2003, 16(4): 307-311.
SHEN Pan, CAO Jiang-ling, LENG Wen-hua, WANG Jian-ming. Preparation, microstructure and photoelectrochemical properties of Co doped titanium oxide electrodes[J]. Chin J Chem Phys, 2003, 16(4): 307-311.
[14] Gole J L, Stout J D, Burda C, Lou Y, Chen X. Highly efficient formation of visible light tunable TiO2-xNx photocatalysts and their transformation at the nanoscale [J]. J Phys Chem B, 2004, 108: 1230-1240.
[15] Morikawa T, Asahi R, Ohwaki T, Aoki K, Taga Y. Band-gap narrowing of titanium dioxide by nitrogen by doping[J]. Jpn J Appl Phys, 2001, 40: L561-L563.
[16] Sato S, Nakamura R, Abe S. Visible-light sensitization of TiO2 photocatalysts by wet-method N doping[J]. Appl Catal A, 2005, 284: 131-137.
[17] Sato S. Photocatalytic activity of NOx-doped TiO2 in the visible light region [J]. Chem Phys Lett, 1986, 123(1/2): 126-128.
[18] Sakthivel S, Janczarek M, Kisch H. Visible light activity and photoelectrochemical properties of nitrogen-doped TiO2[J]. J Phys Chem B, 2004, 108: 19384-19387.
[19] Leng W H, Zhang Z, Zhang J Q, Cao C N. Investigation of the kinetics of a TiO2 photoelectrocatalytic reaction involving charge transfer and recombination through surface states by electrochemical impedance spectroscopy[J]. J Phys Chem B, 109: 15008-15023.
[20] Nakamura I, Negishi N, Kutsuna S, Ihara T, Sugihara S, Takeuchi K. Role of oxygen vacancy in the plasma-treated TiO2 photocatalyst with visible light activity for NO removal[J]. J Mol Catal A, 2000, 161: 205-212.
[21] Torres G R, Lindgren T, Lu J, Granqvist C G, Lindquist S E. Photoelectrochemical study of nitrogen-doped titanium dioxide for water oxidation[J]. J Phys Chem B, 2004, 108: 5995-6003.
基金项目:国家自然科学基金资助项目(20373062);福建省泉州市科技局重点资助项目(2003Z10)
收稿日期:2007-01-09;修订日期:2007-07-15
通讯作者:冷文华,副教授,博士;电话:0571-87952318;E-mail: lengwh@css.zju.edu.cn


