基于配位理论的碱性硫脲选择性溶金机理
郑 粟, 王云燕, 柴立元
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要:
采用电化学方法研究了金及常见伴生金属元素银、 铜、 镍、 铁在高稳定性碱性溶液中阳极溶解的电化学行为, 及碱性硫脲浸金的选择性。 结果表明: 在最佳溶金电势0.42V时, 金在碱性硫脲溶液的溶解电流密度分别是银、 铜、 镍和铁的3.4, 5.2, 27.3和42.6倍; 而且碱性硫脲体系进行矿物浸出时金的伴生元素浸出率均小于0.1%, 浸金具有显著的选择性。 采用配合物的化学键理论、 配位理论等分析了碱性硫脲选择性溶金的机理。 碱性硫脲溶液中金、 银、 铜、 镍和铁分别以Au(TU)+2, Ag(TU)+3, Cu(TU)2+4, Ni(TU)2+4和Fe(TU)2+6的形式存在, Au(TU)+2中反馈σ—π配键的形成显著增强了其稳定性。 配合物Ni(TU)2+4和Fe(TU)2+6中, 由于硫脲分子的特殊性, 各配位体间硫原子和氮原子上电子云互相排斥, 使其稳定性有所降低。 而且碱性硫脲溶液中, Ag, Cu, Ni, Fe易于形成致密的硫化物钝化膜, 在一定程度上也阻碍了金属的进一步溶解。
关键词: 碱性硫脲; 选择性溶金; 机理; 配位理论 中图分类号: TF801
文献标识码: A
Mechanism of gold dissolution selectively in alkaline thiourea solutions based on complex theory
ZHENG Su, WANG Yun-yan, CHAI Li-yuan
(School of Metallurgical Science and Engineering,Central South University, Changsha 410083, China)
Abstract: Electrochemical behaviors of gold and the co-existing elements, such as silver, copper, nickel and iron dissolving in alkaline thiourea solution with high stability, and gold leaching selectively in alkaline thiourea solution were studied by the methods of electrochemistry. The results indicate that at the optimal potential of 0.42V, the anodic current density of gold in alkaline thiourea solution is 2.4, 4.2, 26.3 and 41.6 times as big as that of silver, copper, nickel and iron, respectively. Additionally, the leaching rates of the coexisting metals are less than 0.1% when gold ore is leaching in alkaline thiourea system, which indicates that gold leaching in alkaline thiourea solution shows excellent selectivity. The mechanism of gold dissolution selectively in alkaline thiourea solution was anatomied based on chemical bond theory and complex theory. The results indicate that Au, Ag, Cu, Ni and Fe exist in alkaline thiourea solution in the form of Au(TU)+2, Ag(TU)+3, Cu(TU)2+4, Ni(TU)2+4 and Fe(TU)2+6, respectively. σ—π bond is formed in Au(TU)+2, which strengthens its stability markedly. In Ni(TU)2+4 and Fe(TU)2+6, repulsion of electron clouds between S atom and N atom amongst complexes decreases their stabilities owning to the particularity of thiourea molecular. Moreover, the compact sulphides passivation layers of Ag+, Cu2+, Ni2+, Fe2+ with S2-, being prone to form in alkaline thiourea solution, prevent their further dissolution to some extend.
Key words: alkaline thiourea; gold dissolution selectively; mechanism; complex theory
自1941年首次报道硫脲法提金以来, 由于其无毒、 快速、 高效等优点, 很快成为了该研究领域中倍受关注的热点, 世界各国对硫脲提金的理论及工艺开展了广泛的研究[1-5]。 有研究报道硫脲溶金时pH值必须小于1.78, 否则金不能溶解[6]。 因此, 硫脲溶金的研究全都集中在酸性介质, 几乎没有碱性介质中硫脲溶金的研究报道。 但在酸性介质中, 硫脲首先被氧化生成二硫甲脒, 然后又缓慢反应形成高价硫的生成物, 如硫磺。 二硫甲脒的进一步分解增加了硫脲消耗, 而且分解产物易使金钝化, 降低了硫脲的溶金效率。 另外, 酸性介质中硫脲在H+的催化作用下易于分解形成尿素和硫化氢, 酸性越高, 硫脲消耗越大。 而且硫脲易与金矿中其它金属反应致使浸出不具选择性, 造成浸出液的分离、 净化及再生工序复杂等, 这一系列问题都是传统硫脲浸金法未能得到广泛工业应用的重要原因[7-10]。
为克服酸性硫脲提金过程存在的缺点, 本文作者针对硫脲在碱性介质中的稳定性问题, 对碱性硫脲溶金进行了一系列研究[11-21], 发现Na2SO3和Na2SiO3(称为稳定剂)在一定程度上能抑制碱性硫脲的不可逆分解, 提高硫脲的稳定性, 这使得碱性硫脲体系有效溶金这一设想变成了现实。 然而, 矿物中总是存在较多伴生金属, 含金废料中则存在有基体金属或杂质金属, 如银、 铜、 镍、 铁等。 因此, 研究它们对碱性硫脲溶液中金浸出过程的影响及体系浸金是否具有显著的选择性, 对碱性硫脲的工业应用具有十分重要的意义。
本研究借助电化学方法考察金、 银、 铜、 镍和铁电极在高稳定性碱性硫脲溶液中的阳极溶解电化学行为, 并通过比较氰化物体系、 酸性硫脲体系及碱性硫脲体系中实际矿物浸出过程中伴生金属元素对金浸出率的影响, 进一步研究碱性硫脲浸金的选择性。 运用配合物的化学键理论、 配位理论等[22, 23]分析碱性硫脲体系中金、 银、 铜、 镍及铁离子配合物的结构及其性质, 从微观分子结构角度阐明碱性硫脲选择性溶金的本质原因, 旨在为高稳定性碱性硫脲体系浸金过程中基础问题的研究提供参考, 为碱性硫脲浸金的工业应用提供一定的理论依据。
1 实验
采用CHI660A电化学工作站测量金、 银、 铜、 镍及铁在碱性硫脲溶液中的电化学行为。 电极体系为三电极体系, 电解槽为带有砂芯玻璃隔膜的H型电解槽。 研究电极为金、 银、 铜、 镍和铁电极(面积为1cm2), 辅助电极为大面积铂片, 参比电极为1mol/L NaOH的Hg/HgO电极(-0.114V, vs SHE)。 采用带有Luggin毛细管的盐桥以消除不同溶液间的液体接界电势及降低溶液的欧姆电阻。 研究电极在每次使用前用金相砂纸抛光至镜面光亮, 然后依次浸入丙酮、 王水中清洗, 再用二次蒸馏水冲洗。 所研究的溶液用分析纯试剂及二次蒸馏水配制。 实验时将溶液注入H型电解槽中, 温度由DL501型超级恒温器控制, 每次实验前通氮气15min以除去溶液中溶解的氧。 本研究中的电势均相对于标准氢电极(SHE)。 电化学行为测试溶液的组成为: 0.1mol/L CS(NH2)2(TU), 0.5mol/L Na2SO3。 工艺条件为: pH 12.5, 温度25℃, 扫描速度10mV/s。
所选用的矿物为中原黄金冶炼厂的金焙砂, 由难处理含金复杂多金属硫精矿经硫酸化焙烧、 酸浸和盐浸, 使铜、 铅、 锌等转化为水溶和酸溶形态的硫酸盐, 铁转化为氧化物, 从而得到氧化铁焙砂。 金焙砂的成分分析结果列于表1。 Fe, S, Cu的含量较高, 分别为32.64%, 2.38%和1.14%, Pb, Zn, As的含量则较低。 金焙砂物相分析表明(图1), 其主要组成为α-SiO2和Fe2O3。
参照文献[24, 25]的报道, 本研究选择的酸性硫脲和氰化物浸金的工艺条件如下:
表1 金焙砂的化学成分
Table 1 Chemical composition of gold calcine(mass fraction, %)
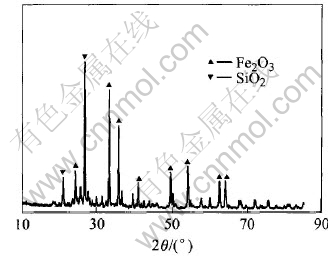
图1 金焙砂的X射线衍射谱
Fig.1 XRD patterns of gold calcine
1)酸性硫脲体系。 硫脲10g/L, H2SO4 0.1mol/L, Fe3+ 3g/L, 用稀硫酸调pH 值为1.5; 浸出时间4h。
2) 氰化物体系。 NaCN 0.5g/L, H2SO4 0.1mol/L, 用氧化钙调整pH值10; 浸出时间12h。
3) 3种浸出体系的其它条件均为: 温度28℃, 液固质量比为10∶1, 固相量为25g, 采用直径为5cm的叶片式搅拌桨进行搅拌, 速度控制为500r/min。
2 高稳定性碱性硫脲溶液溶金的选择性
2.1 金及伴生金属在碱性硫脲溶液中的阳极极化行为
高稳定性碱性硫脲溶液溶解金及常见伴生元素的阳极极化行为如图2所示。 由图2可知, 银在0.12和0.75V分别有一个电流峰, 峰电流密度分别为2.6和2.7mA/cm2, 0.1~0.5V之间银基本处于维钝状态, 阳极电流密度较小。 由金的阳极极化曲线可以看出, 0.2V以后, 金溶解的阳极电流迅速升高, 在0.6V处有一很大的电流峰, 达到4.7mA/cm2。 铜在0.2~0.3V之间有一较小的电流峰。 镍和铁在0.5V之前电流密度很小, 几乎为0。 溶解金具有最佳选择性的电势为0.42V, 此时, 金、 银、 铜、 镍和铁的溶解电流密度依次为 3.83, 1.13, 0.73, 0.14和0.09mA/cm2, 金的溶解电流密度分别为银、 铜、 镍和铁的3.4, 5.2, 27.3和42.6倍。 因此, 高稳定性碱性硫脲溶液溶解金具有明显的选择性。
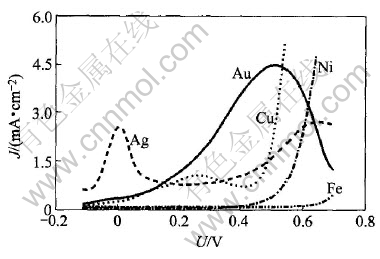
图2 Au, Ag, Cu, Ni和Fe在高稳定碱性硫脲溶液中的阳极极化行为
Fig.2 Anodic polarization of Au,Ag, Cu, Ni and Fe in alkaline thiourea solution with high stability
2.2 金焙砂中金及伴生金属在不同体系中的浸出率
为考察碱性硫脲溶液在对实际矿物的浸出中浸金是否具有选择性, 本研究比较了不同浸金体系中金及伴生金属的浸出率, 结果如表2及图3所示。 由表2和图3可明显看出: 酸性硫脲体系和氰化物
表2 不同浸金体系中金及伴生金属的浸出率
Table 2 Leaching rates of gold and coexisting elements in different systems(%)
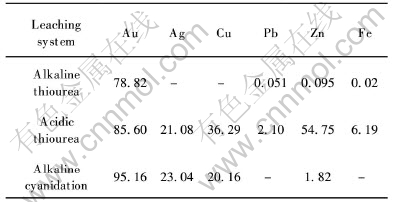
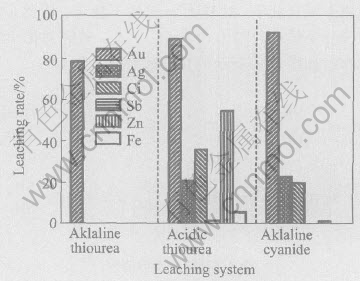
图3 金焙砂中金及伴生金属在不同浸金体系中的浸出率
Fig.3 Leaching rates of gold and coexisting elements of gold calcine leached in different systems
体系受其它伴生金属元素的影响严重, 伴生金属元素的浸出率均较高, 致使浸出液后续净化及再生工序复杂化。 而碱性硫脲体系中伴生金属几乎不被浸出, 浸出率均小于0.1%, 浸金具有显著的选择性。
3 碱性硫脲体系选择性浸金的配位理论分析
3.1 硫脲分子的结构
硫脲的结构如图4所示。 其中碳原子的结构为(2s)1(2px)1(2py)1(2pz)1, 碳原子的1个s轨道和2个p轨道杂化生成3个sp2轨道, 3个轨道在1个平面上, 键角为120°, 碳原子还剩下1个垂直于该平面的2pz轨道。 碳原子的1个杂化轨道与硫原子的3px轨道形成1个δ键, 另外2个杂化轨道与2个氮原子的2px轨道各形成1个σ键。 硫原子的结构为(3s)2(3px)1(3py)2(3pz)1, 硫原子除了用1个3px轨道与碳原子的1个杂化轨道形成1个σ键外, 还用1个3pz轨道与碳原子的2pz轨道形成1个小π键。 硫原子还剩下一对孤对电子(3s)2以及3py轨道上有2个电子(见图4(b))。 另外, 2个氮原子除了各用一个轨道与碳原子的两个杂化轨道形成2个σ键外, 还各用2个轨道与氢原子形成2个σ键, 最后2个氮原子还各剩下1对孤对电子与硫和碳间的小π键(图4(c))共轭形成1个离域分子轨道, 即形成1个大的π键π43。 另外1个氮原子也有1对孤对电子, 但它不能再与硫和碳间的小π键共轭, 由于大π键中再加上1对孤对电子便使大π键中反健轨道上填有电子, 这样大π键便不稳定。 因此, 硫脲的分子结构如图4(d)所示。 因此, 硫脲的化学结构存在如图4(e)所示的共振形式。
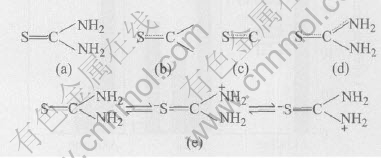
图4 硫脲分子的结构
Fig.4 Structures of thiourea molecular
硫脲分子中硫原子和氮原子上都有孤对电子, 故属于两可配位体, 可以同时通过氮原子的非键电子或硫原子和金属离子选择结合。 但由上面分析的硫脲结构可知, 作为一种强配位体, 在不形成螯合配合物时, 硫脲通常与金属离子通过硫原子配位, 这一点可由硫脲及金硫脲配合物的红外光谱分析得到证实[26]。
3.2 碱性硫脲体系中金属离子稳定存在的价态
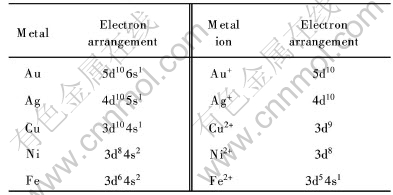
金在化合物中表现为+3和+1两种价态, 但以+3价氧化数为最稳定, Au3+形成配合物的倾向很大。 但在硫脲溶液中, 因为硫脲将Au3+还原为Au+, 故Au以Au+形式存在。 银的特征氧化数为+1, 碱性硫脲溶液中以Ag+的形式存在。 从离子结构来说, Cu+的外层电子排布为3d10, 应该比Cu2+(3d9)稳定, 但在水溶液中, 由于Cu2+具有较高的水合能(-2100kJ/mol), 因此在水溶液中Cu2+的化合物更稳定。 在碱性介质中, 镍的最稳定氧化态是+2, 且比铁的稳定性要高。 Ni2+形成配合物的空间构型是平面正方形, Ni2+离子居中, 采用dsp2杂化轨道容纳配位体的电子。 在碱性介质中, 铁的最稳定氧化态是+3价, 但硫脲具有较强的还原性, 故铁以+2价的形式存在。 因此在碱性硫脲溶液中金、 银、 铜、 镍和铁及相应离子的外层电子排布列于表3。
表3 金、 银、 铜、 镍和铁及相应离子的外层电子排布
Table 3 Arrangement of outer layer electrons in Au, Ag, Cu, Ni, Fe and their ions
3.3 碱性硫脲体系中各金属硫脲配合离子的结构
Au+离子的最外层空轨道为(6s)0(6px)0(6py)0(6pz)0, 金原子以1个6s轨道与一个6p轨道进行杂化形成2个sp杂化轨道, 含有1/2s和1/2p的成分, 夹角为180°, 其空间构型呈直线型, 这2个空的杂化轨道接受S原子的一对孤对电子, 通过σ配键形成配离子Au(TU)+2, 呈直线型, 其结构如图5(a)所示。 另外两个未杂化的空5p轨道与sp杂化轨道互相垂直。
Ag+离子的最外层空轨道为(5s)0(5px)0(5py)0(5pz)0, 银原子的1个5s轨道与2个5p轨道进行杂化形成3个sp2杂化轨道, 每个杂化轨道都含有1/3s和2/3p的成分, 杂化轨道间的夹角为120°, 呈平面三角形。 3个杂化轨道各接受1个硫脲分子中s原子的一对孤对电子, 通过σ配键形成配离子Ag(TU)+3, 其空间构型为平面型, 键角为120°(见图5(b))。 另外, 据报道[11], 溶液中银离子与硫脲还有可能形成Ag2(TU)2+3, Ag(TU)+4, Ag(TU)+2, Ag(TU)+等几种配合物, 相应的稳定常数分别为20.73, 13.72, 11.29和8.77。 但是在本研究中的高稳定性碱性硫脲体系中硫脲的浓度很大, 因此银离子均以配位体Ag(TU)+3的形式存在。
Cu2+离子的最外层空轨道为(3dz)1(4s)0(4px)0(4py)0(4pz)0, 铜原子的1个3d轨道与4s轨道及两个4p轨道进行杂化形成dsp2杂化, 呈平面正方形, 与4个硫脲分子配合(图5(c))。
Ni2+离子的最外层空轨道为(3dz)0(4s)0(4px)0(4py)0(4pz)0, 镍原子的一个空的3d轨道、 与1个4s轨道和2个4p轨道杂化后形成dsp2杂化轨道, 呈平面正方形, 同样与4个硫脲分子配合, 如图5(d)所示。
由于硫脲属于强配体, 给电子能力较强, Fe2+离子的价电子3d54s1被激发为3d6(6个电子成对排列), 空出的2个3d轨道和原来的空4s轨道、 3个4p轨道组合成d2sp3杂化轨道, 空间构型呈八面体型, 与6个硫脲分子配合, 如图5(e)所示。
3.4 碱性硫脲体系浸金选择性的理论剖析
从配离子的结构来看, 由于sp2杂化轨道的成键能力大于sp杂化轨道的成键能力, 银的平面型比金的直线型稳定, 因此Ag+离子与硫脲的结合比Au+离子与硫脲的结合容易, 硫脲浸出银比浸出金容易。 但是对Au+离子来说要接受2对孤对电子, 而Ag+离子则要接受3对孤对电子, 这样便使中心离子Au+, Ag+累积了过多的负电荷, 必然排斥硫脲分子的接近, 即排斥硫原子的孤对电子。 这将使Au(TU)+2, Ag(TU)+3不稳定, 而实际情况下, 2个硫脲分子的硫原子给予金2对孤对电子, 3个硫脲分子的硫原子给予银3对孤对电子, 而Au+、 Ag+离子的d轨道上充满10个电子, 反过来又将d电子给予硫脲分子中的反键轨道π轨道形成π键, 即形成了反馈键(σ—π配键), 这种协同配位键比单独形成一种键强, 因此Au(TU)+2, Ag(TU)+3可以稳定存在。 但Au(TU)+2中反馈键的形成正好相互配合, 相互促进, 而Ag(TU)+3中的反馈键则不如Au(TU)+2中的配合得好, 因此Au(TU)+2比Ag(TU)+3更稳定, 由其稳定常数22.1和13.6也可以说明这一点。
由以上的结构分析可知, Cu(TU)2+4的中心离子中有1个3d电子有可能被激发到能量较高的轨道, 则中心Cu2+离子会强烈排斥硫脲分子, 造成Cu(TU)2+4的稳定性降低, 其稳定常数为15.40。 Ni(TU)2+4和Fe(TU)2+6分别为正方形和八面体, 由于硫脲分子中硫原子和氮原子上电子云之间的排斥, 也会使其稳定性有所降低。
除了以上配合物的结构原因外, 浸金的选择性与碱性硫脲体系中Ag, Cu, Ni, Fe易于形成致密的硫化物钝化膜也有关。 稳定剂的加入在一定程度上提高了碱性体系中硫脲的稳定性[19], 但由于硫脲结构的特殊性, 硫脲分子中的C-S键键能(259.2kJ/mol)比C-N键键能(291.3kJ/mol)小, C-S键易于断裂, 硫原子变为S2-离子, C-N键易离解出2个H+, 与在碱性介质中易与OH-结合成水分子, 溶液中总会有S2-离子存在, Au, Ag, Cu, Ni, Fe失去电子后形成的正离子会与S2-离子结合生成硫化物沉淀。 由各硫化物的标准生
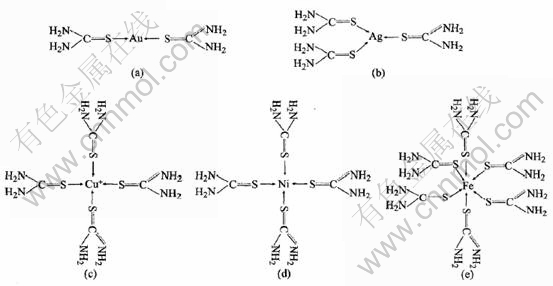
图5 Au, Ag, Cu, Ni和Fe离子与硫脲形成配合物的结构
Fig.5 Structures of complexes of Au, Ag, Cu, Ni and Fe with thiourea
成自由焓(表4)可知, 银、 铜、 镍、 铁相应的硫化物易于形成且非常稳定, 生成的致密硫化物膜阻碍了银、 铜、 镍、 铁的进一步溶解, 致使其浸出率很低。 因此, 高稳定性碱性硫脲体系浸金具有很强的选择性。
表4 各硫化物的标准生成自由焓
Table 4 Standard free formation enthalpy of sulphide(kJ/mol)

4 结论
1) 在碱性硫脲溶液溶金的最佳电势0.42V时, 金、 银、 铜、 镍和铁的溶解电流密度依次为3.83, 1.13, 0.73, 0.14和0.09mA/cm2。 碱性硫脲体系中金的浸出率为78.82%, 伴生金属浸出率均小于0.1%, 浸金具有显著的选择性。
2) 碱性硫脲溶液中金、 银、 铜、 镍和铁分别以Au(TU)+2, Ag(TU)+3, Cu(TU)2+4, Ni(TU)2+4和Fe(TU)2+6的形式存在。 Au(TU)+2中反馈σ—π配键的形成显著增强了其稳定性。 在Ni(TU)2+4, Fe(TU)2+6中, 由于硫脲分子的特殊性, 各配位体间硫原子和氮原子上电子云之间互相排斥, 也会使其稳定性有所降低。 而且碱性硫脲溶液中, Ag, Cu, Ni, Fe易于形成致密的硫化物钝化膜, 也在一定程度上阻碍了金属的进一步溶解。 因此, 高稳定性碱性硫脲体系浸金具有显著的选择性。
REFERENCES
[1]Gaspar V, Mejerovich A S, Meretukov M A, et al. Practical application of potential-pH diagrams for Au-CS(NH2)2-H2O and Ag-CS (NH2)2-H2O systems for leaching gold and silver with acidic thiourea solution[J]. Hydrometallurgy, 1994, 34(3): 369-381.
[2]王清江, 程圭芳, 宗巍. 硫脲法浸取硫化金矿的工艺改进研究[J]. 华东师范大学学报(自然科学版), 1998(1): 61-65.
WANG Qing-jiang, CHENG Gui-feng, ZONG Wei. Study on the improvement process of leaching gold from sulfide ore with thiourea[J]. Journal of East China Normal University, 1998(1): 61-65.
[3]李进善. 浸金体系中影响硫脲消耗因素的研究[J]. 化工冶金, 1994, 15(3): 229-234.
LI Jin-shan. Study on the factors influencing thiourea consumption in the gold-leaching process with acidic thiourea solution[J]. Engineering Chemistry and Metallurgy, 1994, 15(3): 229-234.
[4]van Deventer J S J, Reuter M A, Lorenzen L, et al. Galvanic interactions during the dissolution of gold in cyanide and thiourea solutions[J]. Minerals Engineering, 1990, 3(6): 589-597.
[5]Juarez C M, Dutra A J B. Gold electrowinning from thiourea solutions[J]. Minerals Engineering, 2000, 13(10-11): 1083-1096.
[6]王周谭. 无氰浸金技术在我国的研究应用现状[J]. 黄金科学技术, 1995, 3(6): 9-14.
WANG Zhou-tan. Research and application status of gold leaching by non-cyanidation in china[J]. Gold Science and Technology, 1995, 3(6): 9-14.
[7]赵林治, 杨书廷. 硫脲稳定性研究[J]. 河南师范大学学报, 1992, 20(1): 98-102.
ZHAO Lin-zhi, YANG Shu-ting. Study on thiourea stability[J]. Journal of Henan Normal University, 1992, 20(1): 98-102.
[8]Farinha P A, Correia M J N, Carvalho J R. Leaching of gold from a portuguese concentrate with thiourea[J]. Minerals Engineering, 1992, 5(8): 953-959.
[9]FANG Zhao-heng. Leaching kinetics of a Au-Cu sulfide concentrate with thiourea[J]. Engineering Chemistry & Metallurgy, 1993, 14(4): 319-326.
[10]萨本嘉, 张方宇, 程华. 碱性硫脲溶金的研究[J]. 黄金, 1984, 5(3): 45-47.
SA Ben-jia, ZHANG Fang-yu, CHENG Hua. Study on gold dissolving in alkaline thiourea solution[J]. Gold, 1984, 5(3): 45-47.
[11]柴立元. 碱性硫脲从含金废料中选择性溶金的研究[D]. 长沙: 中南工业大学, 1999.
CHAI Li-yuan. Study on Gold Dissolution Selectively in Alkaline Thiourea Solution from Gold Srcap[D]. Changsha: Central South Unilersity of Technology, 1999.
[12]CHAI Li-yuan, Okido M. Dissolution theory of gold in alkaline thiourea solution (Ⅰ) anodic behavior on gold in alkaline thiourea solution containing Na2SO3[J]. Trans Nonferrous Met Soc China, 1999, 9(1): 145-151.
[13]CHAI Li-yuan, Okido M. Dissolution theory of gold in alkaline thiourea solution (Ⅱ): electrochemical study on Au-Fe mix anode in alkaline thiourea solution containing Na2SO3[J]. Trans Nonferrous Met Soc China, 1999, 9(2): 393-398.
[14]CHAI Li-yuan, Okido M. Dissolution theory of gold in alkaline thiourea solution (Ⅲ): thermodynamics on dissolution of gold in alkaline thiourea solution containing Na2SO3[J]. Trans Nonferrous Met Soc China, 1999, 9(3): 646-650.
[15]Okido M, Ishikawa M, CHAI Li-yuan. Anodic dissolution of gold in alkaline solutions containing thiourea, thiosulfate and sulfite ions[J]. Trans Nonferrous Met Soc China, 2002, 12(3): 519-563.
[16]ZHANG Chuan-fu, CHAI Li-yuan, ZHONG Hai-yun, et al. Selective dissolution of gold in an alkaline thiourea solution by electrolysis[J]. Journal of Central South University of Technology, 1997, 4(2): 73-78.
[17]WEI Da-wei, CHAI Li-yuan, Ryoichi I, et al. Gold leaching in an alkaline thiourea solution[J]. Journal of The Electrochemical Society, 1999, 146(2): 559-563.
[18]柴立元, 闵小波. 亚硫酸钠对碱性硫脲稳定作用的构效关系研究[J]. 中南工业大学学报, 2002, 33(5): 473-476.
CHAI Li-yuan, MIN Xiao-bo. Structure-property relationship between the stability of alkaline thiourea and the structure of thiourea and sulfite ion[J]. Journal of Central South University of Technology, 2002, 33(5): 473-476.
[19]WANG Yun-yan, CHAI Li-yuan, MIN Xiao-bo, et al. Optimization of highly efficient stable reagent of alkaline thiourea solution for gold lixiviation[J]. Journal of Central South University of Technology, 2003, 10(4): 292-296.
[20]CHAI Li-yuan, WANG Yun-yan. Electrochemical behaviors of gold and its associated elements in various complexing agents solutions[J]. Journal of Central South University of Technology, 2003, 10(4): 287-291.
[21]王云燕, 柴立元, 闵小波, 等. Na2SiO3对碱性硫脲溶液选择性溶金的影响[J]. 中南工业大学学报, 2003, 34(6): 611-614.
WANG Yun-yan, CHAI Li-yuan, MIN Xiao-bo, et al. Effect of Na2SiO3 on gold dissolution selectively in alkaline thiourea solutions[J]. Journal of Central South University of Technology, 2003, 34(6): 611-614.
[22]周公度. 结构化学基础[M]. 北京: 北京大学出版社, 1989. 266-284.
ZHOU Gong-du. Foundation on Structure Chemistry[M]. Beijing: Beijing University Press, 1989. 266-284.
[23]张祥麟. 配合物化学[M]. 北京: 高等教育出版社, 1989. 125-158.
HANG Xiang-lin. Complex Chemistry[M]. Beijing: High Education Press, 1989. 125-158.
[24]刘建, 胡小玲, 闫英桃. 含硫金矿的焙烧处理及硫脲浸金研究[J]. 湿法冶金, 1999(3): 13-16.
LIU Jian, HU Xiao-ling, YAN Ying-tao. Study on calcinations treatment and gold leaching in thiourea solution of gold ore with sulfur[J]. Hydrometallurgy of China, 1999(3): 13-16.
[25]姜涛. 提金化学[M]. 长沙: 湖南科学技术出版社, 1998. 120-125.
JIANG Tao. Chemistry of Extractive Metallurgy of Gold[M]. Changsha: Hunan Science and Technology Press, 1998. 120-125.
[26]程瑞学. 硫脲浸出金和银的微观机理[J]. 黄金, 1987, 8(2): 41-46.
CHENG Rui-xue. Micromechanism of leaching gold and silver by thiourea[J]. Gold, 1987, 8(2): 41-46.
基金项目: 国家自然科学基金资助项目(50004009)
收稿日期: 2005-03-24; 修订日期: 2005-07-14
作者简介: 郑 粟(1962-), 男, 博士研究生
通讯作者: 王云燕, 副教授, 博士; 电话: 0731-8830875; 传真: 0731-8710171; E-mail: wyy@mail.csu.edu.cn
[2]王清江, 程圭芳, 宗巍. 硫脲法浸取硫化金矿的工艺改进研究[J]. 华东师范大学学报(自然科学版), 1998(1): 61-65.
[3]李进善. 浸金体系中影响硫脲消耗因素的研究[J]. 化工冶金, 1994, 15(3): 229-234.
[6]王周谭. 无氰浸金技术在我国的研究应用现状[J]. 黄金科学技术, 1995, 3(6): 9-14.
[7]赵林治, 杨书廷. 硫脲稳定性研究[J]. 河南师范大学学报, 1992, 20(1): 98-102.
[10]萨本嘉, 张方宇, 程华. 碱性硫脲溶金的研究[J]. 黄金, 1984, 5(3): 45-47.
[11]柴立元. 碱性硫脲从含金废料中选择性溶金的研究[D]. 长沙: 中南工业大学, 1999.
[18]柴立元, 闵小波. 亚硫酸钠对碱性硫脲稳定作用的构效关系研究[J]. 中南工业大学学报, 2002, 33(5): 473-476.
[21]王云燕, 柴立元, 闵小波, 等. Na2SiO3对碱性硫脲溶液选择性溶金的影响[J]. 中南工业大学学报, 2003, 34(6): 611-614.
[22]周公度. 结构化学基础[M]. 北京: 北京大学出版社, 1989. 266-284.
[23]张祥麟. 配合物化学[M]. 北京: 高等教育出版社, 1989. 125-158.
[24]刘建, 胡小玲, 闫英桃. 含硫金矿的焙烧处理及硫脲浸金研究[J]. 湿法冶金, 1999(3): 13-16.


