生物制剂配合-水解法直接深度处理含锰废水
裴斐,王云燕,柴立元,舒余德
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:在含锰废水特性分析的基础上,开发生物制剂配合-水解法直接深度处理含锰废水新技术。含锰废水生物制剂配合体系中存在pH为8.80~11.18和12.28~13.08的2个缓冲区。废水pH从2.04升高至10.00,氢氧化钠的加入量为2.67~4.00 g/L。研究得到优化工艺条件:生物制剂加入量(即控制生物制剂与废水中锰的质量比)为0.2,配合时间为5 min,水解时间为5 min,温度为25 ℃,pH为10.0,聚丙烯酰胺(PAM)加入量为2.0 mg/L,可将废水中锰离子质量浓度从994 mg/L去除到0.127 mg/L,远低于《污水综合排放标准》(GB 8978—1996)的限值2.000 mg/L;含锰沉渣呈无定型及棒状,主要物相为CaSO4,渣中锰含量达14.16%,可返回生产系统回收锰;生物制剂通过其中的—OH,—COOH,—NH,—C=O,—SO3,—C—O(H)和C—Cl等基团与废水中的含锰离子配合,在水解过程中形成难溶物质沉淀分离。
关键词:
中图分类号:X703.1 文献标志码:A 文章编号:1672-7207(2010)06-2072-07
Direct and deep treatment of manganese-containing wastewater by biologics complexing-hydrolyzation
PEI Fei, WANG Yun-yan, CHAI Li-yuan, SHU Yu-de
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: A novel technology for direct and deep treatment of manganese-containing wastewater by biologics was put forward based on the property analysis of manganese-containing wastewater. There are two pH buffer zones which are from 8.80 to 11.18 and from 12.28 to 13.08 in the complex system of manganese-containing wastewater and biologics. Theoretically, the required amount of sodium hydroxide for increasing pH from 2.04 to 10.00 is 2.67-4.00 g/L. The optimum condition are as follows: the mass ratio of biologics to manganese is 0.2, the cooperation time is 5 min, the hydrolysis time is 5 min, the temperature is 25 ℃, pH is 10.0, polyacrylamide (PAM) is 2 mg/L. Under the above optimum conditions, manganese concentration decreases from 994 to 0.127 mg/L in laboratory scale experiment, which is much less than integrated wastewater discharge standard (GB 8978—1996) (2.000 mg/L). The surface morphology of manganese-containing sludge is amorphous and rod and the main phase is CaSO4. The proportion of manganese in the sludge reaches 14.16%, indicating that the sludge can be reused for manganese recovery. In the hydrolyzation process, manganese ions combine with the functional groups including —OH, —COOH, —NH, —C=O, —SO3, —CO(H) and C—Cl in biologics, to form precipitation.
Key words: biologics; manganese; wastewater; sludge; complexing-hydrolyzation
锰是一种重要的金属元素,在工业上用途很广,需求量很大,如生产1 t钢需13~14 kg锰;此外,锰还用于有色金属、化工、医药、食品、分析和科研等方面。我国是全球最大的电解二氧化锰生产、出口和消费国。但在电解二氧化锰生产过程中排放大量的含锰废水。每生产1 t电解锰,排放含锰废水约130 t,其中主要来源于废电解液、废钝化液、酸解压滤废水以及电解钝化过程的极板清洗水。废水中不仅含有大量的锰,还含有重金属污染物,如镉、铅、锰和硒 等,直接排入水体,将会通过对水体和土壤等生态系统的污染在动植物体内积累,破坏食物链影响人类健康,造成水域污染等日益突出的环境问题[1-5]。处理含锰废水的方法主要有絮凝沉淀法[6-8]、铁屑微电解 法[9-13]、液膜分离法[14]、传统化学沉淀法[15]、过氧化钙沉淀法[16]和电解法[17]等。人们对絮凝沉淀法和铁屑微电解法处理电解锰工业废水的研究较多,技术较成熟,但处理成本高。液膜法是一项治理环境污染的新型技术,关于液膜法处理电解锰工业废水的研究较少。最常见是传统的石灰中和水解法,即向酸性含锰废水中投加碱,使锰发生水解反应,生成难溶的氢氧化物沉淀,从而被分离,但中和水解法难以稳定达到排放标准。基于此,本文作者采用生物制剂配合-水解法直接深度处理含锰废水,研究影响锰去除效果的各因素,以使出水中锰达到或接近《生活饮用水卫生标准》(GB 5749—2006)(0.1 mg/L),以期为含锰沉渣的资源化提供一定的参考。
1 实验
含锰废水:取自湘潭电化集团有限公司电解化合废水调节池。废水pH为2.04,锰离子质量浓度为 994 mg/L。
生物制剂:中南大学冶金学院环境工程研究所开发的生物制剂。
工艺流程:生物制剂配合-水解法直接深度处理含锰废水的工艺流程如图1所示。
工艺过程:根据废水中锰离子浓度,在搅拌状态下按照生物制剂与锰质量比为0~1.0加入生物制剂;配合反应时间为5~25 min,加入碱调节体系pH,搅拌水解反应时间为5~25 min;再按照PAM质量浓度为0~10 mg/L加入絮凝剂PAM,沉淀分离,取上清液分析其中锰离子浓度。
锰离子质量浓度分析方法:废水及出水中锰离子浓度采用火焰原子分光光度法(WFX-120型火焰原子吸收仪)分析。
采用雷磁pHS-25型数显酸度计测试pH。

图1 生物制剂配合-水解法直接深度处理含锰废水的工艺流程
Fig.1 Process of treatment of manganese-containing wastewater by biologics complexing-hydrolyzation
2 含锰废水生物制剂配合体系pH缓冲特性
为了解含锰废水生物制剂配合体系pH随中和剂加入量的变化规律,查明体系缓冲区的分布情况,为中和剂最低消耗找到理论依据,首先采用浓度为 l mol/L的NaOH标准溶液对生物制剂配合后的废水pH做滴定曲线。在25 ℃时,量取含锰废水300 mL置入500 mL烧杯中,生物制剂用量比(生物制剂与锰的质量比)为0.2,配合反应时间为5 min,然后,缓慢滴加NaOH溶液,同时监测体系pH的变化。以NaOH加入量为横坐标,以pH为纵坐标作滴定曲线,如图2
所示。体系中存在2个缓冲区:第1个缓冲区pH为8.80~11.18;第2个缓冲区pH为12.28~13.08。废水pH从2.04升至13.08,共消耗NaOH 100.0 mL,而pH从8.80升到11.18的过程中消耗NaOH 34.9 mL,占总耗NaOH体积的34.9%。可见:若水解pH不超过11.0,则NaOH的最大消耗量为4.68 g/L;若将pH控制在10,则NaOH消耗量仅为2.34 g/L。
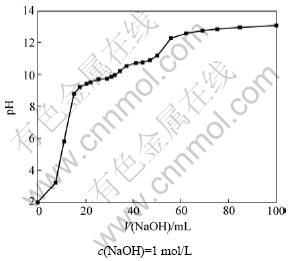
图2 含锰废水生物制剂配合体系NaOH滴定曲线
Fig.2 Titration curve for complexing system of manganese-containing wastewater and biologics
3 含锰废水锰去除效果的影响因素
3.1 生物制剂用量对锰去除效果的影响
取废水300 mL,控制温度为25 ℃,配合反应时间为15 min,水解时间为5 min,pH为10.0,PAM质量浓度为8 mg/L,生物制剂用量比用生物制剂与废水中锰的质量比表示,分别控制为0,0.2,0.4,0.6,0.8和1.0,考察出水中锰离子质量浓度及锰去除率,结果如图3所示。从图3可见:随着生物制剂加入量的增加,出水中锰离子质量浓度逐步减少。生物制剂量(质量比)从0增加到0.2时,残余金属离子质量浓度从0.302 mg/L迅速降到0.136 mg/L;继续增加生物制剂用量,出水中锰离子质量浓度维持在0.100 mg/L左右,远低于《污水综合排放标准》(GB 8978—1996)中的一级排放标准2.000 mg/L,接近《生活饮用水卫生标准》(GB 5749—2006)(0.100 mg/L)。考虑到生产成本,将生物制剂用量比定为0.2。
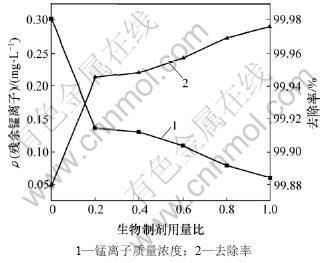
图3 生物制剂用量比对锰去除效果的影响
Fig.3 Effects of dosage of biologics on manganese removal
3.2 水解时间对锰去除效果的影响
取废水300 mL,控制温度为25 ℃,生物制剂用量比为0.2,PAM加入量为8 mg/L,配合反应时间为15 min,水解反应pH为10.0,考察水解时间对出水中锰离子浓度及锰去除率的影响,如图4所示。从图4可见:水解反应时间在5 min和20 min有2个微降,残余锰离子浓度的变化并不大。说明生物制剂与锰离子形成的配合离子在提高pH时发生的水解反应属于均相反应。综合考虑排放标准及成本,水解时间确定为5 min。
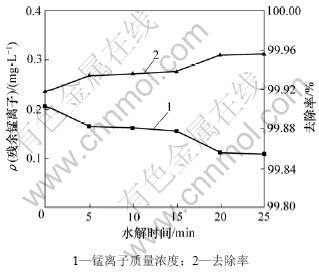
图4 水解时间对锰去除效果的影响
Fig.4 Effects of hydrolysis time on manganese removal
3.3 水解pH对锰去除效果的影响
水解终点pH是工艺关键参数。取废水300 mL,控制温度为25 ℃,生物制剂用量比为0.2,PAM质量浓度为8 mg/L,配合反应时间为15 min,水解时间为5 min,考察水解终点pH对出水中锰离子浓度及锰去除率的影响,结果如图5所示。可见:水解pH为6时,出水锰离子质量浓度为244.50 mg/L,锰离子去除率仅为75.4%;继续提高pH至8,出水中锰离子质量浓度稍有降低;当pH由8.0增加到9.0时,出水中锰离子质量浓度突降至15.826 mg/L,锰去除率为98.41%,但仍无法达到排放标准;继续提高pH,出水中锰离子质量浓度持续下降;当pH增加到10.0时,出水中锰离子质量浓度为0.136 mg/L,远远低于《污水综合排放标准》(GB 8978—1996)中的一级排放标准2.000 mg/L,接近《生活饮用水卫生标准》(GB 5749—2006)的规定0.100 mg/L,锰去除率达到99.97%;继续增加pH,锰离子浓度继续下降,但变化不再明显。考虑处理效果与石灰乳用量,确定最佳水解pH为10.0。

图5 水解pH对锰去除效果的影响
Fig.5 Effects of pH value on manganese removal
3.4 配合反应时间对锰去除效果的影响
取废水300 mL,控制生物制剂用量比为0.2,PAM质量浓度为8 mg/L,温度为25 ℃,水解时间为5 min,加石灰乳调节水解终点pH为10,考察配合反应时间(加入生物制剂后立即加碱调节pH)对出水锰离子质量浓度及锰去除率的影响,结果如图6所示。从图6可见:当配合时间为0~5 min时,出水中锰离子质量浓度迅速下降;当配合反应时间大于5 min之后,出水中锰离子质量浓度略有下降,但变化不再明显。说明5 min之内生物制剂即与含锰离子发生配合反应,故配合反应时间取5 min。
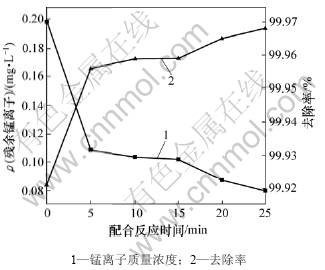
图6 配合反应时间对锰去除效果的影响
Fig.6 Effects of cooperation time on manganese removal
3.5 反应温度对锰脱去除效果的影响
工业生产中废水温度会随季节而变化,因此,需考虑反应温度对锰去除效果的影响。取废水300 mL,生物制剂用量比为0.2,PAM质量浓度为8 mg/L,控制配合反应时间为5 min,水解终点pH为10,水解时间为5 min,考察体系温度对锰去除效果的影响,结果如图7所示。从图7可见:体系温度对锰去除效果有较大影响;温度升高有利于锰的去除,温度为10 ℃时,出水中锰离子质量浓度为1.324 mg/L,当温度升高至15 ℃时,出水锰离子质量浓度迅速降至0.348 mg/L;此后,继续升高温度,出水锰离子质量浓度持续下降,当温度为25 ℃时,出水中锰离子质量浓度降至0.097 mg/L;继续升高温度,锰去除效果不再明显;当温度为40 ℃时,出水锰离子质量浓度仅为0.055 mg/L,低于《生活饮用水卫生标准》(GB 5749—2006)的规定0.100 mg/L。另外,升高温度亦有利于配合反应的进行。在一般工业生产过程中,排放的废水温度为20~40 ℃,因而有利于除锰。
1—锰离子质量浓度;2—去除率
图7 反应温度对锰去除效果的影响
Fig.7 Effects of temperature on manganese removal
3.6 PAM加入量对锰去除效果及沉降速度的影响
取废水300 mL,生物制剂用量比为0.2,控制温度为25 ℃,配合反应时间为5 min,水解时间为5 min,水解终点pH为10.0,考察PAM质量浓度对锰去除效果及沉降速度的影响,结果如图8所示。从图8可见:PAM对锰去除影响不大;不添加PAM时,出水锰离子质量浓度为0.207 6 mg/L;当PAM质量浓度为10 mg/L时,出水锰离子质量浓度为0.126 9 mg/L;不添加PAM时,生成的沉淀颗粒靠自身质量沉降,速度为0.015 7 cm/s,与PAM质量浓度为8和10 mg/L时大致相等,但是,沉淀后水质不清澈明亮;当PAM质量浓度为2 mg/L时,沉降速度最快,达到0.035 cm/s。由于生物制剂与锰形成的配合离子,在水解过程中形成的胶团具有促进沉降的作用,因此,加入少量的PAM (ρ(PAM)=2 mg/L)即可起到很好的效果。
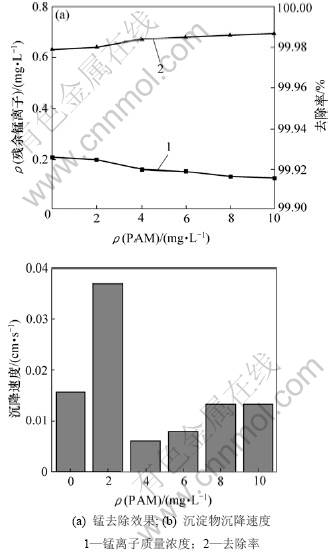
图8 PAM加入量对锰去除效果及沉降速度的影响
Fig.8 Effects of dosage of PAM on manganese removal and precipitation velocity of sludge
3.7 最佳条件综合实验效果
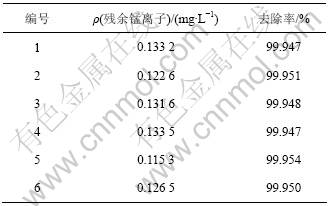
根据上述单因素实验研究结果,取废水300 mL,生物制剂用量比为0.2,控制温度为25 ℃,配合反应时间为5 min,水解时间为5 min,水解终点pH为10.0,PAM质量浓度为2 mg/L,对含锰废水进行处理,并做了6个平行实验,结果如表1所示。从表1可见:出水锰离子平均浓度为0.127 mg/L,且波动不大,远远低于《污水综合排放标准》(GB 8978—1996)中的一级排放标准2.000 mg/L,接近《生活饮用水卫生标准》(GB 5749—2006)的规定0.100 mg/L。说明生物制剂配合-水解法处理含锰废水中对锰去除效果稳定可靠,重现性好。
表1 最优条件下综合实验结果
Table 1 Experimental results under optimized conditions
4 含锰沉渣的物化特性分析
4.1 含锰沉渣的表面形貌及成分分析
采用扫描电子显微镜(SEM)及能量散射光谱(EDS)对优化条件下所得含锰沉渣进行表面分析及定性的成分分析。结果如表2所示。由图9可看出:含锰废水生物制剂配合-水解法直接深度处理后沉渣呈无定型及棒状。EDS分析结果表明(见表2),渣中主要含有O,S,Ca,Mn,Mg和Fe及少量的Cu和Zn,因此,主要物质为CaSO4。

图9 含锰渣的SEM像及EDS谱
Fig.9 SEM image and EDS pattern of manganese-containing sludge
表2 含锰沉渣EDS分析结果
Table 2 Analytic results of manganese-containing sludge

4.2 含锰沉渣的物相分析
采用X线衍射技术分析了含锰沉渣的物相,结果如图10所示。沉渣中的主要物相为石膏CaSO4·2H2O。
4.3 含锰沉渣的红外光谱分析
采用红外光谱(IR)分析了含锰沉渣中的基团,结果如图11所示。由图11可看出:在3 548.38,3 404.54,1 685.80,1 620.72,1 443.12,1 140和668 cm-1处出现吸收峰,故沉渣中有—OH,—NH,C=O,—COOH,N—H,C=O,—SO3,C—O(H)和C—Cl等基团。说明生物制剂通过其中的—OH,—COOH,—NH, —C=O,—SO3,—C—O(H)和C—Cl等基团与废水中的含锰离子配合,在水解的过程中形成难溶物质沉淀分离。

图10 含锰沉渣的XRD谱
Fig.10 XRD patterns of manganese-containing sludge

图11 含锰沉渣的红外谱
Fig.11 IR patterns of manganese-containing sludge
5 结论
(1) 含锰废水生物制剂配合体系的NaOH滴定曲线表明其存在2个缓冲区:第1个缓冲区pH为8.80~11.18,第2个缓冲区pH为12.28~13.08。废水pH从2.04上升至10.00左右,NaOH质量浓度为2.67~ 4.00 g/L。
(2) 单因素实验研究结果得到了优化的工艺条件:生物制剂用量比为0.2,配合反应时间为5 min,水解时间为5 min,温度为25 ℃,pH为10.0,PAM质量浓度为2 mg/L。在优化条件下可将废水中锰离子浓度从994.000 mg/L去除到0.127 mg/L,远远低于《污水综合排放标准》(GB 8978—1996)的一级标准2.000 mg/L。
(3) 含锰沉渣的SEM,EDS,XRD和IR分析结果表明:含锰沉渣呈无定型及棒状,主要物相为CaSO4,渣中锰含量达14.16%,可返回生产系统回收锰。生物制剂通过其中的—OH,—COOH,—NH,—C=O,—SO3,—C—O(H)和C—Cl等基团与废水中的含锰离子配合,在水解的过程中形成难溶物质沉淀分离。
参考文献:
[1] 姚俊, 周方钦, 麻明友, 等. 电解锰生产过程中的环境污染问题及对策的研究[J]. 吉首大学学报: 自然科学版, 1997, 18(4): 60-62.
YAO Jun, ZHOU Fang-qin, MA Ming-you, et al. Study and countermeasure of the environmental from electrolytic manganese production precession[J]. Journal of Jishou University: Natural Science Edition, 1997, 18(4): 60-62.
[2] 谭柱中. 发展中的中国电解金属锰工业[J]. 中国锰业, 2003, 21(4): 1-5.
TAN Zhu-zhong. How to develop China’s electrolytic manganese industry[J]. China’s Manganese Industry, 2003, 21(4): 1-5.
[3] 谭柱中, 梅光贵, 李维健, 等. 锰冶金学[M]. 长沙: 中南大学出版社, 2004: 322-324.
TAN Zhu-zhong, MEI Guang-gui, LI Wei-jian, et al. Metallurgy of manganese[M]. Changsha: Central South University Press, 2004: 322-324.
[4] 曾赳雄. 打造绿色锰业的新途径[J]. 中国锰业, 2005, 23(1): 41-43.
ZENG Jiu-xiong. A new road of green manganese industry will be opened[J]. China’s Manganese Industry, 2005, 23(1): 41-43.
[5] 熊素玉, 张在峰. 我国电解金属锰工业存在的问题与对策[J]. 中国锰业, 2005, 23(1): 10-12.
XIONG Su-yu, ZHANG Zai-feng. Existing problems and countermeasure of Chinese market of EMM[J]. China’s Manganese Industry, 2005, 23(1): 10-12.
[6] 谌永红, 李伟明, 刘航. 含铬、锰酸性废水处理技术探讨[J]. 环境科学动态, 2004, 14(1): 26-28.
SHEN Yong-hong, LI Wei-ming, LIU Hang. Discuss of technology for treatment of containing chrome and manganese acid wastewater[J]. Environmental Science Trends, 2004, 14(1): 26-28.
[7] 姚俊, 田宗平, 姚祖风, 等. 电解金属锰废水处理的研究[J]. 中国锰业, 2000, 18(3): 25-27.
YAO Jun, TIAN Zong-ping, YAO Zhu-feng, et al. Study of treatment of wastewater from electrolying manganese[J]. China’s Manganese Industry, 2000, 18(3): 25-27.
[8] 樊玉川. 含锰废水处理研究[J]. 湖南有色金属, 1995, 14(3): 36-38.
FAN Yu-chuan. Study on the treatment of wastewater with manganese[J]. Hunan Nonferrous Metals, 1995, 14(3): 36-38.
[9] 张子间. 微电解法在废水处理中的研究及应用[J]. 工业安全与环保, 2004, 30(4): 8-10.
ZHANG Zi-jian. Application and research of micro-electrolysis technology in wastewater treatment[J]. Industrial Safety and Environmental Protection, 2004, 30(4): 8-10.
[10] 周培国, 傅大放. 微电解工艺研究进展[J]. 环境污染治理技术与设备, 2001, 2(4): 18-24.
ZHOU Pei-guo, FU Da-fang. Application and development for microelectrolysis technology[J]. Techniques and Equipment for Environmental Pollution Control, 2001, 2(4): 18-24.
[11] 王永广, 杨剑锋. 微电解技术在工业废水处理中的研究与应用[J]. 环境污染治理技术与设备, 2002, 3(4): 69-73.
WANG Yong-guang, YANG Jian-feng. Research and application of micro-electrolysis technology to industrial wastewater treatment[J]. Techniques and Equipment for Environmental Pollution Control, 2002, 3(4): 69-73.
[12] 喻旗, 沈杨, 张光辉. 铁/炭微电解床处理电解锰生产钝化废水[J]. 中国锰业, 2002, 20(1): 11-12.
YU Qi, SHEN Yang, ZHANG Guang-hui. Treatment of purified water from Mn electrolysis using Fe/C micro electrolying bed[J]. China’s Manganese Industry, 2002, 20(1): 11-12.
[13] 欧阳玉祝. 铁屑微电解法处理电解锰生产废水[J]. 吉首大学学报: 自然科学版, 2002, 23(2): 34-37.
OUYANG Yu-zhu. Treatment of the electrolytic manganese wastewater by iron chipping microelectrolysis[J]. Journal of Jishou University: Natural Science Edition, 2002, 23(2): 34-37.
[14] 潘碌亭, 肖锦. 乳状液膜法处理含金属离子废水的研究现状和进展[J]. 上海环境科学, 2000, 19(12): 562-564.
PAN Lu-ting, XIAO Jin. Study progress and development of emulsion liquid membrane separation technique in treatment of wastewater containing metal ion[J]. Shanghai Environmental Sciences, 2000, 19(12): 562-564.
[15] 汪大翬, 徐新华, 宋爽. 工业废水中专项污染物处理手册[M]. 北京: 化学工业出版社, 2001: 264-265.
WANG Da-hui, XU Xin-hua, SONG Shuang. Handbook of treatment special pollutant in industrial waste[M]. Beijing: Chemical Industry Press, 2001: 264-265.
[16] 张嫦, 吴莉莉. 过氧化钙的制备及其在废水处理中的应用[J]. 化工环保, 2004, 24(1): 62-65.
ZHANG Chang, WU Li-li. Preparation of calcium peroxide and its application in wastewater treatment[J]. Environmental Protection of Chemical Industry, 2004, 24(1): 62-65.
[17] Stuck S, Kots R, Carcer B, et al. Electrochemical waste water treatment using high over-voltage anodes. Part Ⅱ: Anode performance and applications[J]. Applied Electrochemistry, 1991, 21: 99-104.
(编辑 陈爱华)
收稿日期:2009-09-10;修回日期:2009-12-03
基金项目:国家水体污染控制与治理科技重大专项项目(20092X07212-001-01);国家自然科学基金重点资助项目(50830301);教育部科技重大项目(308019);湖南省自然科学基金资助项目(08JJ3020);湖南省科技计划项目(2008SK4031);湖南省节能减排科技重大专项项目(08SK1005,08SK1002)
通信作者:柴立元(1966-),男,江西万年人,教授,博士生导师,从事重金属废水、废渣处理与资源化领域的研究;电话:0731-88836921;E-mail: lychai@mail.csu.edu.cn


